一种基于cHS4元件的哺乳动物细胞附着体表达载体、表达系统、制备方法和应用与流程
本发明涉及一种基于cHS4元件的哺乳动物细胞附着体表达载体,同时还涉及包含该附着体表达载体的表达系统、制备方法和应用,属于基因工程与基因治疗技术领域。
背景技术:
随着分子生物学和生物技术的不断发展,人们对遗传性疾病的发病机制有了更深入的了解,并在此基础上发现了大量的致病基因。通过取代受损细胞中的错误基因来治疗疾病将有更广阔的发展空间。基因治疗是指通过基因转移技术将外源正常基因直接导入患者病变部位的靶细胞,通过控制目的基因的表达,抑制、校正、替代或补偿存在缺陷或者异常的基因,治疗基因缺陷的一种方法。在基因治疗中,外源基因的导入效率直接影响体内基因的表达水平,因此基因载体的选择视基因治疗的关键之一。
附着体表达载体是一种新型的非病毒表达载体,能够使外源基因以附着体的形式复制并分离到子代细胞中,使基因高效、持续表达,从而避免整合载体的插入突变等问题。第一个完全由哺乳动物序列构建的非病毒附着体表达载体是1999年Piechaczek等研究人员基于人类β-干扰素上的核基质结合区(matrix attachment region,MAR)构建的pEPI载体。自第一代MAR介导的附着体表达载体pEPI被证实作用后,后续又开展了多项改进型研究,比如通过插入调控元件或减少细菌序列来弥补载体的不足,但是研究中常出现转基因沉默现象。尽管载体在转染宿主细胞后能在细胞中保持附着状态,但是载体的稳定性较差、拷贝数也较低,研究表明约90%的载体分子在传代中逐渐丢失。
技术实现要素:
本发明的目的是提供一种基于cHS4元件的哺乳动物细胞附着体表达载体,该载体能驱动外源基因高效、持续、稳定表达。
同时,本发明还提供一种上述附着体表达载体的制备方法。
最后,本发明再提供一种包含上述附着体表达载体的哺乳动物细胞表达系统、制备方法和应用。
为了实现以上目的,本发明所采用的技术方案是:
附着体表达载体,其上插入有如SEQ ID NO:1所示的cHS4序列,或者与该序列95%以上同源的核苷酸序列。
所述附着体表达载体的出发载体为哺乳动物细胞表达载体,如pEGFP-N1、pEGFP-N3、pEGFP-C1、pEGFP-C2、pEGFP-1、pEYFP-N1、pEYFP-C1、pDsRedN1、pDsRedC1、pDsRed2N1、pCDNA3.1(+)、pCDNA3.1(-)、pCDNA3.1(neo+)或pCDNA3.1(zeo+)等。
上述附着体表达载体可采用常规方法制备,将序列SEQ ID NO:1插入出发载体即可。当出发载体采用pEGFP-C1时,附着体表达载体pES4的制备步骤如下:
1)合成cHS4序列
在序列SEQ ID NO:1的两端分别引入BspE I、BsrG I酶切位点,同时在序列两端分别加上15bp以上载体的同源序列,得到cHS4序列(如SEQ ID NO:2所示);
2)pES4质粒载体的构建
将pEGFP-C1质粒用BspE I单酶切,凝胶回收酶切后的pEGFP-C1线性质粒DNA,与上述cHS4序列连接,转化、鉴定,得到载体pES4。
所述单酶切的酶切体系为:1μg/μL pEGFP-C1质粒10μL,10×NEBuffer 2μL,BspE I酶0.5μL,补三蒸水至20μL。体系充分混匀后,37℃水浴酶切8h。
所述连接的体系为(10μL In-Fusion Cloning):5×In-Fusion HD Enzyme Premix 2μL,pEGFP-C1线性质粒2μL,cHS4 4μL,ddH2O 2μL。体系充分混匀后,50℃水浴15min。
所述转化、鉴定均可采用常规操作。
哺乳动物细胞表达系统,包含上述附着体表达载体。可采用常规方法制备,步骤如下:
1)将外源目的基因插入附着体表达载体的cHS4上游、启动子下游,构建得到重组表达载体;
2)将重组表达载体转入宿主细胞中,经筛选得到哺乳动物细胞表达系统。
步骤1)中外源基因可采用人β干扰素IFN-β(IFN-β)等。
步骤2)中宿主细胞选自中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞、人张氏肝(Change liver)细胞等。
上述附着体表达载体、哺乳动物细胞表达系统在制备包含目的蛋白的药物中的应用。
本发明的有益效果:
鸡超敏感位点4(Chicken hypersensitive site 4,cHS4)是一种经典绝缘子元件,具有増强子阻断与异染色质屏障的功能,能将转基因沉默的主要原因-位置效应降到最低,还能降低外源启动子及增强子造成邻近基因异常表达的概率。本发明将cHS4序列引入载体的多克隆位点即eGFP下游处,一方面能克服转基因沉默,另一方面还能介导外源基因在无选择压力的情况下在哺乳动物细胞中稳定、高效、持久的表达,且安全性较好。
本发明引入的cHS4序列较短,所得载体拥有较大的容纳外源基因的能力。
附图说明
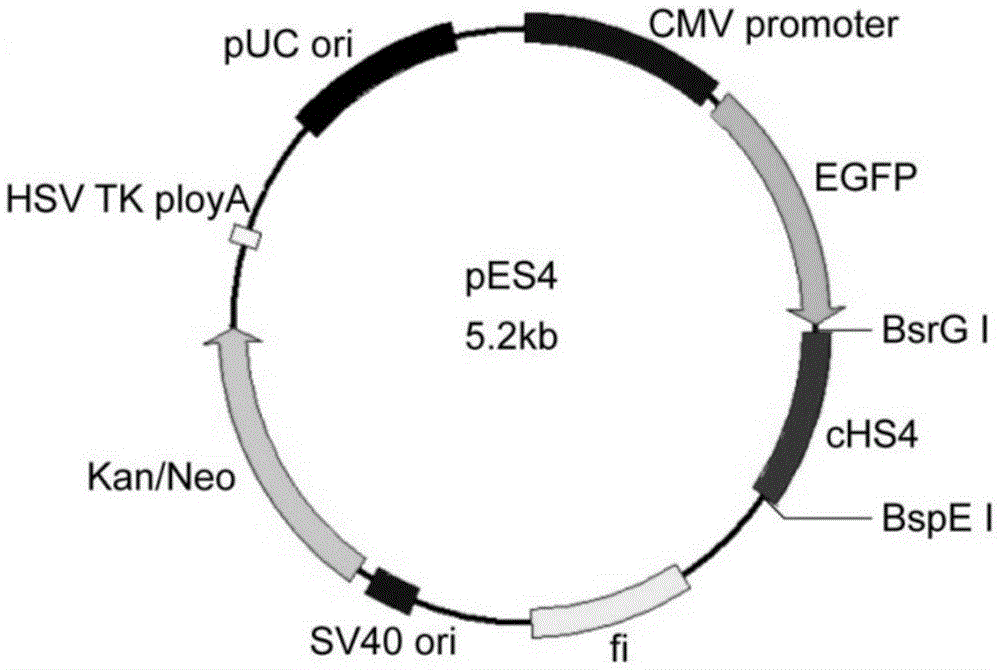
图1为附着体表达载体pES4的结构示意图;
图2为pES4转染CHO和Chang liver细胞的转染率;
图3为pES4转染CHO和Chang liver细胞报告基因eGFP的表达水平;
图4为pES4转染CHO和Chang liver细胞eGFP长期保持率;
图5为质粒还原酶切电泳图;
图6为pES4转染CHO和Chang liver细胞还原质粒的Southern Blot图;
图7为pES4转染CHO和Chang liver细胞的荧光原位杂交图;
图8为pES4-IFN-β转染CHO细胞IFN-β的表达水平。
具体实施方式
下述实施例仅对本发明作进一步详细说明,但不构成对本发明的任何限制。
实施例1
附着体表达载体pES4的构建,步骤如下:
1)cHS4序列的合成
根据文献(Saunders F,Sweeney B,Antoniou,et al.Chromatin function modifying elements in an industrial antibody production platform-comparison of UCOE,MAR,STAR and cHS4elements.2015,PLoS One 10:e0120096.)合成cHS4序列,为实现定向克隆及后续载体的鉴定,在序列的5′端分别引入BspE I、BsrG I酶切位点。由于采用无缝克隆技术构建pES4载体,公司合成cHS4序列时在序列的两端分别加上15个bp载体的同源序列。合成cHS4序列如下所示:
其中,斜体部分代表同源序列,下划线处为酶切位点。
2)pES4质粒载体的构建
a.酶切反应
将pEGFP-C1质粒用BspE I单酶切,酶切体系为:1μg/μL pEGFP-C1质粒10μL,10×NEBuffer 2μL,BspE I酶0.5μL,补三蒸水至20μL;充分混匀后,37℃水浴酶切8h。
b.琼脂糖凝胶电泳鉴定及目的片段回收
酶切结束后,1.5%琼脂糖凝胶电泳鉴定酶切情况,确定酶切开后,凝胶回收酶切的pEGFP-C1线性大片段质粒。
c.cHS4片段与pEGFP-C1线性质粒的连接、转化与鉴定
10μL In-Fusion Cloning连接体系:5×In-Fusion HD Enzyme Premix 2μL,pEGFP-C1线性质粒2μL,cHS4 4μL,ddH2O 2μL;充分混匀后,50℃水浴15min。取出,冰上放置片刻,取2.5μL上述混合物转化细胞。
无菌状态下取新鲜制备的E.coli JM109菌株感受态细菌200μL,转移至灭菌的1.5mL Ep管中,加入2.5μL上述连接好的反应溶液进行转化,并接种在含卡那霉素的琼脂平板表面,置于37℃培养箱中过夜。从培养的平板上挑取阳性转化子于盛有3mL LK液体培养基的试管中,37℃摇床培养过夜。提取重组质粒,对重组质粒进行酶切验证,选取酶切验证正确的质粒进行测序验证,将序列完全正确的载体命名为pES4(质粒图谱见图1)。
实施例2
哺乳动物细胞表达系统的构建,步骤如下:
1)IFN-β序列的合成
根据NCBI公布的IFN-β序列(GenBank:BC096151.2,第1~564位碱基),公司合成IFN-β(如SEQ ID NO:3所示,序列两端分别加上15个bp载体的同源序列,另外IFN-β插入在eGFP下游),经测序分析与GenBank登录的序列完全一致。
2)构建含IFN-β序列的附着体表达载体pES4-IFN-β
将pES4质粒用BsrG I单酶切,酶切体系为:1μg/μL pES4质粒10μL,10×NE buffer 2μL,BsrG I酶0.5μL,补三蒸水至20μL;充分混匀后,37℃水浴酶切8h。酶切结束后,1.5%琼脂糖凝胶电泳,回收酶切后的pES4线性质粒DNA。
10μL In-Fusion Cloning连接体系:5×In-Fusion HD Enzyme Premix 2μL,pES4线性质粒2μL,IFN-β4μL,ddH2O 2μL;充分混匀后,50℃水浴15min。取出,冰上放置片刻,取2.5μL上述混合物转化细胞。
无菌状态下取新鲜制备的E.coli JM109菌株感受态细菌200μL,转移至灭菌的1.5mL Ep管中,加入2.5μL上述连接好的反应溶液进行转化,并接种在含卡那霉素的琼脂平板表面,置于37℃培养箱中过夜。从培养的平板上挑取阳性转化子于盛有3mL LK液体培养基的试管中,37℃摇床培养过夜。提取重组质粒,对重组质粒进行酶切验证,选取酶切验证正确的质粒进行测序验证,将序列完全正确的载体命名为pES4-IFN-β。
3)构建哺乳动物细胞表达系统
CHO于37℃、5%CO2条件下,在含10%灭活胎牛血清的DMEM培养基中培养。细胞转染按照脂质体2000转染试剂盒说明书进行。转染24h后,用终浓度为500μg/mL的G418培养液加压筛选2周,每3d更换一次培养液,形成稳定转化的细胞集落。
对比例1
参照实施例2中方法构建表达载体pEPI-IFN-β,pEPI质粒单酶切、连接及转化操作基本同实施例2。
试验例1
1、附着体表达载体pES4转染中国仓鼠卵巢细胞和人张氏肝细胞表达系统的建立
CHO细胞于37℃、5%CO2条件下,在含10%灭活胎牛血清的DMEM培养基中培养,Chang liver细胞在RPMI培养基中培养。转染前1d细胞进行传代,吸去旧培养基,加2.5mL(2~3mL均可)0.25%胰酶消化液,显微镜下观察细胞形态,80%左右细胞由多角形变为圆形时,吸去消化液,加3mL完全培养基,接种于24孔培养板,使每孔约2×105细胞,37℃、5%CO2饱和湿度下培养细胞,待细胞融合达70%~80%时进行转染。
细胞转染按照脂质体2000转染试剂盒说明书进行,具体为:取实施例1中载体0.6μg加入到50μL不含血清和抗生素的DMEM培养基中,轻轻混匀。2μL脂质体2000试剂稀释于50μL不含血清和抗生素的DMEM培养基中,轻轻混匀,室温放置5min。50μL脂质体2000稀释液滴加到质粒DNA稀释液中,一边滴加一边混匀。室温孵育15min(15~20min均可),接着将约100μL脂质体2000/DNA复合物加到每个孔中并轻轻摇动使其混合。转染48h后,流式细胞术检测转染后48h的转染率,并用终浓度为500μg/mL的G418培养液加压筛选,每2d(2~3d均可)更换一次培养液,一周后G418培养液改为维持浓度250μg/mL持续筛选2周,同样每2d(2~3d均可)更换一次培养液,大约14d待稳定转化的细胞集落形成后,用0.25%胰酶消化,对每组转染细胞有限稀释并单克隆化,最后分至96孔培养板继续培养,培养7d后,转入培养瓶内继续培养,待细胞密度达80%~90%时,将细胞一分为二,一组加250μg/mL G418持续传代培养50代,一组不加G418传代培养50代。每间隔30d收集细胞,采用流式细胞术检测不同时间eGFP的表达量。
转染后48h,流式细胞仪检测转染阳性率,结果显示:pES4转染CHO细胞的转染率是78.2%,转染Chang liver细胞的转染率是87.9%,说明附着体表达载体pES4转染哺乳动物细胞的转染率均较高(见图2)。流式检测eGFP的表达量,结果显示:在单克隆形成时,CHO细胞中平均荧光强度为2.3×106,Chang liver细胞中平均荧光强度为5.4×106。经G418抗性稳定筛选或不加G418培养50代发现,在传代过程中,eGFP的表达量逐渐降低,但在50代后,不管有无选择压力,eGFP的表达量仍较高(见图3,图中A~C分别表示CHO细胞转染后48h、G418筛选50代、无G418筛选50代eGFP的表达水平,D~F分别表示Chang live细胞转染后48h、G418筛选50代、无G418筛选50代eGFP的表达水平)。eGFP的维持率在CHO细胞有筛选压力为58.2%,无筛选压力为48.5%,Chang liver细胞有筛选压力为67.3%,无筛选压力为53.6%(见图4)。
2、质粒还原试验
采用Hirt裂解法从CHO和Change liver细胞中提取转染pES4载体的附着体质粒,具体为:向收集的细胞中加入2mL Hirt裂解缓冲液,室温静置20min,使充分裂解;加入1/4体积(0.5mL)的5mol/L NaCl,放入4℃过夜(8~20h均可);次日,15000rpm离心40min;取上清,加RNase A(2g/L)125μL,于37℃水浴60min;用25:24:1的酚氯仿异戊醇抽提2次,再次用氯仿抽提1次;取上清,加入5mL-20℃预冷的异丙醇于10mL离心管中,置于-20℃过夜;次日,12000rpm离心30min;加入1mL无水乙醇吹打白色沉淀使其悬浮于1.5mL EP管内,无水乙醇洗涤2次,空气中干燥,再加入20μLElution Buffer缓冲液溶解附着体质粒。
无菌状态下取新鲜制备的感受态细胞250μL,转移至灭菌的4mL离心管中,加入10μL提取的附着体质粒进行转化,将转化的菌液均匀涂布于含卡那霉素的琼脂平板表面,37℃培养箱中过夜培养,直至阳性转化子长出。从培养的平板上挑取阳性转化子,置于装有3mL LK液体培养基的试管中,37℃摇床过夜培养。常规方法提取质粒,进行酶切鉴定。从转染pES4的CHO和Change liver细胞中还原出的质粒经BspE I单酶切和BspE I/BsrG I双酶切均能切出大小为5200bp的线性片段和478bp的cHS4片段(见图5,图中M:DL5000,1:转染CHO细胞的还原质粒未酶切,2:转染CHO细胞的还原质粒BspE I单酶切,3:转染CHO细胞的还原质粒BspE I/BsrG I双酶切,4:转染Chang liver细胞的还原质粒未酶切,5:转染Chang liver细胞的还原质粒BspE I单酶切,6:转染Chang liver细胞的还原质粒BspE I/BsrG I双酶切)。
3、Southern Blot
转染CHO和Chang liver细胞的还原质粒经BspE I单酶切后电泳胶回收质粒,回收的质粒样品进行0.7%琼脂糖凝胶电泳,25V恒压低温过夜。将胶置于平皿中,用蒸馏水冲洗后,加入3倍体积变性液室温振荡45min;用蒸馏水冲洗2次,加入中和液室温振荡2×15min;用蒸馏水冲洗2次,加入2×SSC以平衡凝胶和带正电荷的尼龙膜5min,向上毛细管法转膜20h,取下膜作好标记,在2×SSC中漂洗一次,80℃烘烤固定2h。取10.0mL Hyb-100,加入杂交管中,37℃预杂交2h;针对eGFP序列设计的地高辛标记的探针在PCR仪中100℃变性10min,立即放冰水浴冷却5min;排尽预杂交液,在10.0mLHyb-100中加入20μL新变性好的探针,混匀,37℃杂交过夜。杂交后于室温下,20mL 2×SSC/0.1%SDS洗膜2×5min。65℃,20mL 1×SSC/0.1%SDS洗涤2×15min;再将膜置于20mL洗涤缓冲液中平衡3min(2~5min均可);将膜在10mL封闭液中封闭30min(在摇床上轻轻摇动);Anti-Dig-AP在10000rpm下离心5min。离心后将Anti-Dig-AP用封闭液稀释(1:5000),2.0μL Anti-Dig-AP加入10mL封闭液混匀;封闭完成后倒出封闭液,加入稀释好的10mL抗体溶液,浸膜至少30min;去除抗体溶液,用20mL洗涤缓冲液缓慢洗膜2次,每次15min;在膜的正面(核酸面)滴加1mL CSPD,隔绝空气20℃(15~25℃)反应5min,去除多余的液体,37℃孵育10min;在暗房用X-ray film曝光,显影,定影,洗片,曝光。结果发现:从转染pES4的CHO和Change liver细胞中还原出的质粒BspE I单酶切后经杂交均显示有一条5200bp的杂交带(见图6,图中M:DL5000,1:转染CHO细胞的还原质粒经BspE I单酶的杂交条带,2:转染Chang liver细胞的还原质粒BspE I单酶切的杂交条带)。
4、荧光原位杂交
培养细胞中期染色体制备:当细胞系的融合达到约85%(75~90%均可)时,于每5mL培养基细胞中加入40μL秋水仙素,继续培养2h,收集细胞;加入10mL 37℃水浴预热的0.075mol/L KCl溶液于15mL离心管中,用力吹打散开,37℃水浴低渗30min,约每8min用吸管吹打一次,使细胞充分分散悬浮于溶液中;向离心管中加1.5mL固定液并用吸管轻轻吹匀,预固定10min;2000rpm离心5min,弃上清液;固定I:沿管壁慢慢加入固定液6mL,用吸管吹打成细胞悬液后,37℃水浴20min;1000rpm离心10min,弃上清液;固定II:操作步骤同固定I;1000rpm离心10min,弃大部分上清液,留下上清液的量使得细胞保持在牛奶状细胞团(一般是0.5~1mL),用吸管吹打成细胞悬液;滴片:用吸管吸取少量细胞悬液,高度35cm(30~40cm均可),垂直滴在预冷的载玻片上,室温晾干;老化:染色体片子,37℃老化4d(1~7d均可)。使用前玻片置于60℃温箱孵育3.5h(3~4h均可)。
将4mL(3~5mL均可)变性液置于74±1℃水浴或杂交仪平衡至少30min(注意:平衡温度为容器内的实际温度)。将玻片浸入杂交液中4min(2~5min均可),依据玻片的制备时间每增加一周,时间增加2min。梯度脱水:立即放入冰冷70%酒精3min,再依次置于85%、100%酒精缸中脱水,各1min。使用前置40℃(37~45℃均可)温箱中备用。将探针置于PCR仪内变性,程序设为:77℃5min,37℃2min;将变性后的探针加在完全干燥的玻片上(注意避光),Rubber胶封片,杂交过夜(12~18h均可)。准备2缸洗液,1缸置于72℃,另一缸置于室温。将玻片置于72℃缸内至少30min,轻轻揭去玻片上的胶(如果不好揭开或者为避免干燥,可以先放在常温洗液里)。将玻片放入72℃缸内洗涤2min;常温缸洗涤2min。将玻片依次放入75%、85%、100%酒精缸中,脱水各1min,脱水后空气中干燥。复染并观察结果:加二氨基苯基吲哚(DAPI)20μL复染,加盖玻片。置于暗处20min,荧光显微镜观察结果并采集图像。结果表明:pES4载体在CHO和Change liver细胞中的有丝分裂期以附着于染色体外的形式存在,拷贝数为3~5个/细胞(见图7,图中A为CHO细胞,B为Chang liver细胞)。
试验例2
Western blot法检测CHO细胞中IFN-β蛋白的表达,具体操作为:
1)取实施例2及对比例1中细胞集落,分别用0.25%胰酶消化,消化后细胞有限稀释并单克隆化,分至96孔培养板继续培养,培养7d后,转入培养瓶内继续培养,待细胞密度达85%时,收集细胞上清液待测。
2)从上清液定量取100μg蛋白上样,在120g/L的SDS-PAGE上电泳,蛋白充分分离后,转移到PVDF膜上,于含50g/L脱脂奶粉的封闭液中4℃过夜。IFN-β一抗1:300稀释,室温孵育2h,二抗1:2000稀释,室温孵育1h;ECL发光试剂对PVDF膜进行显色反应,X线下曝光、拍照。采用Western Blot分析IFN-β蛋白的表达水平。
Western blot结果显示:转染pES4-IFN-β组呈现较亮的特异条带,未转染组在相应位置出现非常弱条带,转染pEPI-IFN-β组也呈现较弱的特异条带,表明pES4-IFN-β能介导IFN-β基因在CHO细胞中高表达目的蛋白IFN-β(见图8,图中1为未转染组,2为转染pEPI-IFN-β组,3为转染pES4-IFN-β组)。
实施例及试验例中所用质粒载体、细胞系、试剂、工具酶等均为市售商品。pEGFP-C1质粒载体购自美国Clontech公司,中国仓鼠卵巢细胞和人张氏肝细胞购自中国科学院上海细胞库。
需要说明的是,说明书中所列实施例仅用于理解发明技术方案,不具有任何限制作用。除了上述实施例外,还可以有其他的实施方式。凡是采用等同替换或等效变换形成的任何技术方案,均落在本发明要求的保护范围内。
序列表
SEQUENCE LISTING
<110> 新乡医学院
<120> 一种基于cHS4元件的哺乳动物细胞附着体表达载体、表达系统、制备方法和应用
<170> PatentIn version 3.5
<211> 478
<212> DNA
<213> 序列
<221> cHS4序列(不含酶切位点以及载体的同源序列)
<222> (1)..( 478)
<400> 1
GGGGAGCTCA CGGGGACAGC CCCCCCCCAA AGCCCCCAGG GATGTAATTA CGTCCCTCCC 60
CCGCTAGGGG GCAGCAGCGA CCGCCCGGGG CTCCGCTCCG GTCCGGCGCT CCCCCCGCAT 120
CCCGAGCCGG CAGCGTGCGG GGACAGCCCG GGCACGGGGA AGGTGGCACG GGATCGCTTT 180
CCTCTGAACG CTTCTCGCTG CTCTTTGAGC CTGCAGACAC CTGGGGGATA CGGGGAAAAG 240
GGGAGCTCAC GGGGACAGCC CCCCCCCAAA GCCCCCAGGG ATGTAATTAC GTCCCTCCCC 300
CGCTAGGGGG CAGCAGCGAC CGCCCGGGGC TCCGCTCCGG TCCGGCGCTC CCCCCGCATC 360
CCGAGCCGGC AGCGTGCGGG GACAGCCCGG GCACGGGGAA GGTGGCACGG GATCGCTTTC 420
CTCTGAACGC TTCTCGCTGC TCTTTGAGCC TGCAGACACC TGGGGGATAC GGGGAAAA 478
<211> 520
<212> DNA
<213> 序列
<221> 合成cHS4序列
<222> (1)..(520)
<400> 2
ACGAGCTGTA CAAGTTGTAC AGGGGAGCTC ACGGGGACAG CCCCCCCCCA AAGCCCCCAG 60
GGATGTAATT ACGTCCCTCC CCCGCTAGGG GGCAGCAGCG ACCGCCCGGG GCTCCGCTCC 120
GGTCCGGCGC TCCCCCCGCA TCCCGAGCCG GCAGCGTGCG GGGACAGCCC GGGCACGGGG 180
AAGGTGGCAC GGGATCGCTT TCCTCTGAAC GCTTCTCGCT GCTCTTTGAG CCTGCAGACA 240
CCTGGGGGAT ACGGGGAAAA GGGGAGCTCA CGGGGACAGC CCCCCCCCAA AGCCCCCAGG 300
GATGTAATTA CGTCCCTCCC CCGCTAGGGG GCAGCAGCGA CCGCCCGGGG CTCCGCTCCG 360
GTCCGGCGCT CCCCCCGCAT CCCGAGCCGG CAGCGTGCGG GGACAGCCCG GGCACGGGGA 420
AGGTGGCACG GGATCGCTTT CCTCTGAACG CTTCTCGCTG CTCTTTGAGC CTGCAGACAC 480
CTGGGGGATA CGGGGAAAAT CCGGACCGGA CTCAGATCTC 520
<211> 594
<212> DNA
<213> 序列
<221> IFN-β序列
<222> (1)..(594)
<400> 3
CGGCATGGAC GAGCTATGAC CAACAAGTGT CTCCTCCAAA TTGCTCTCCT GTTGTGCTTC 60
TCCACTACAG CTCTTTCCAT GAGCTACAAC TTGCTTGGAT TCCTACAAAG AAGCAGCAAT 120
TTTCAGAGTC AGAAGCTCCT GTGGCAATTG GATGGGAGGC TTGAATATTG CCTCAAGGAC 180
AGGATGAACT TTGACATCCC TGAGGAGATT AAGCAGCTGC AGCAGTTCCA GAAGGAGGAC 240
GCCGCATTGA CCATCTATGA GATGCTCCAG AACATCTTTG CTATTTTCAG ACAAGATTCA 300
TCTAGCACTG GCTGGAATGA GACTATTGTT GAGAACCTCC TGGCTAATGT CTATCATCAG 360
ATAAACCATC TGAAGACAGT CCTGGAAGAA AAACTGGAGA AAGAAGATTT CACCAGGGGA 420
AAACTCATGA GCAGTCTGCA CCTGAAAAGA TATTATGGGA GGATTCTGCA TTACCTGAAG 480
GCCAAGGAGT ACAGTCACTG TGCCTGGACC ATAGTCAGAG TGGAAATCCT AAGGAACTTT 540
TACTTCATTA ACAGACTTAC AGGTTACCTC CGAAACTGAG TACAAGTTGT ACAG 594
- 还没有人留言评论。精彩留言会获得点赞!
- 用于抑制在哺乳动物细胞中和在人中的hiv复制的方法
- 在哺乳动物细胞中将非天然氨基酸遗传掺入蛋白质的制作方法
- 通过电磁刺激哺乳动物活细胞生产的天然糖基化哺乳动物生物分子的制作方法
- 在哺乳动物宿主细胞中高水平表达重组抗体的制作方法
- 调控由哺乳动物细胞培养物产生的蛋白质唾液酸化的方法
- 通过细菌性来源的完整小细胞向哺乳动物细胞递送功能性核酸的制作方法
- 一种用于哺乳动物细胞培养用的凹凸棒土制备方法
- 将治疗性细胞给予哺乳动物中枢神经系统的方法、药物组合物和制品的制作方法
- 适用于治疗哺乳动物异常细胞生长的6-[2-(甲基-氨甲酰基)苯基硫基]-3-e-[2-(吡啶-2 ...的制作方法
- 电穿孔装置及用其进行哺乳动物细胞电穿孔的方法