一种基因同源重组修复报告系统及建立方法与流程
本发明涉及细胞工程与病毒学领域,涉及一种基因同源重组修复报告系统及建立方法。
背景技术:
细胞基因组在染色体自我复制的过程中由于受到各种内源性或者外源性因素的影响,存在多种形式的损伤,并由此引发一系列细胞学反应。DNA的损伤类型很多,其中以DNA双链断裂(double strand break,DSB)最为严重。且DNADSB的修复比其他类型的DNA损伤更加困难,不修复则可能导致染色体断裂和细胞死亡,而错误修复则可能导致染色体缺失、重排、转位和倒置等。DNA损伤的不完全修复可导致基因组不稳定,机体细胞为了对抗损伤,进化出多个修复系统来确保基因组的完整性,其中同源重组修复(homologous recombination repair,HRR)是DNA DSB损伤修复的主要方式。HRR主要发生在有丝分裂的S期和G2监测点,因DNADSB而导致断裂DNA末端与姊妹染色单体进行结合并进行修复。
肿瘤是严重危害人类生命和健康的一类疾病,其发生发展是个复杂过程。基因组的修复对于肿瘤细胞的生长特别重要,而基因HRR对于保持基因组稳定性的必不可少。有研究表明HRR修复缺陷的细胞对于药物,如顺-二氯二氨络铂(Cisplatin),卡波铂(Carboplatin)和亚硝基脲(Nitrosoureas)超敏感。这提示着,与HRR相关的分子理论上很可能可以成为临床肿瘤治疗的靶标。因此,如何从大量小分子中筛选出靶向HRR相关的分子显得十分有意义,而限制该研究重要的难点是需要建立能在体外快速、有效、高通量的HRR报告系统来达到靶向筛选的目的。
技术实现要素:
本发明的目的是建立一种基因同源重组修复报告系统,以解决不能在体外有效、快速、高通量筛选出靶向HRR相关分子的瓶颈,有助于临床肿瘤治疗靶标的筛选,药物开发,HRR机制进行深入研究。
具体地,根据本发明的一个方面,提供了一种基因同源重组修复报告系统,包括报告细胞系,报告细胞系为整合有GFP(510_513delAAC)基因的单克隆HEK-293或HT-1080-GFP(510_513delAAC)细胞系,GFP(510_513delAAC)基因的序列如SEQ ID NO.1。GFP(510_513delAAC)基因为GFP(绿色荧光蛋白)基因510bp位置缺失AAC碱基序列而绿色荧光失活的GFP突变体,所述GFP突变体基因由申请人筛选获得。
所述报告系统还包括基因同源重组修复模板AAV,其为腺相关病毒(AAV)包装的同源重组修复模板质粒pA2-GFP-pMC1TK,pA2-GFP-pMC1TK载体包含不含启动子的GFP(绿色荧光蛋白)和Puro基因。
一种基因同源重组修复报告系统的建立方法,包括报告细胞系的建立:
1)构建重组载体pSin-GFP(510_513delAAC),重组载体pSin-GFP(510_513delAAC)包含GFP(510_513delAAC)基因,IRES基因和嘌呤霉素(Puromycin)抗性基因:
2)将重组pSin-GFP(510_513delAAC)载体和辅助质粒共转入HEK-293T细胞,获得慢病毒pSin-GFP(510_513delAAC);
3)用慢病毒pSin-GFP(510_513delAAC)感染HEK-293或HT-1080细胞,获得整合有GFP(510_513delAAC)基因的单克隆HEK-293/HT-1080-GFP(510_513delAAC)细胞系。
重组载体pSin-GFP(510_513delAAC)的构建方法为:
1)筛选出GFP(510_513delAAC)基因;
2)用PCR扩增GFP(510_513delAAC)基因,克隆到pSin-EF2-LIN28-Pur载体上,得到重组pSin-GFP(510_513delAAC)载体。pSin-EF2-LIN28-Pur载体的制备方法见http://www.addgene.org/16580,为已知技术。
筛选GFP(510_513delAAC)基因的方法为:
1)CRISPR/Cas9-GFP-sgRNA载体设计:根据AAV打靶载体同源臂长度要求,在GFP基因530bp处设计sgRNA,sgRNA序列为:CAAGATCCGCCACAACATCG;
2)HEK-293-GFP细胞(申请人实验室保存)计数后接种于6孔板,每孔的细胞密度为5.0×105细胞/孔;
3)将CRISPR/Cas9-GFP-sgRNA载体转入HEK-293-GFP细胞中,在荧光显微镜下挑选GFP失活的单克隆细胞(即不绿的细胞)培养;
4)上述单克隆细胞培养大约15天后消化细胞,提基因组PCR后测序,筛选目标突变基因,即GFP(510_513delAAC)基因。
辅助质粒为pVSVg和psPAX2(申请人实验室保存)。
慢病毒pSin-GFP(510_513delAAC),保存于-80℃。
获得整合有GFP(510_513delAAC)基因的单克隆HEK-293/HT-1080-GFP(510_513delAAC)细胞系的方法为:
1)HEK-293或HT-1080细胞计数后接种于6孔板,每孔的细胞密度为3.0×105细胞/孔;
2)细胞生长24h后,在6孔板中加入适量的慢病毒pSin-GFP(510_513delAAC),同时加终浓度为4ug/ml的聚凝胺(polybrene);
3)HEK-293或HT-1080细胞感染慢病毒pSin-GFP(510_513delAAC)12h后换液,48h后传代,稀释后接种到10cm皿,用1ug/ml浓度的抗生素嘌呤霉素(Puromycin)筛选;
4)10天后,在显微镜下挑选单克隆细胞,获得整合有GFP(510_513delAAC)基因的单克隆HEK-293或HT-1080-GFP(510_513delAAC)细胞系。
基因同源重组修复报告系统的建立方法还包括基因同源重组修复模板AAV的制备方法为:
1)构建同源重组修复模板AAV质粒pA2-pMC1TK-GFP-Ires-Puro,其包含不含启动子的GFP(绿色荧光蛋白)和Puro基因;
2)将质粒pA2-pMC1TK-GFP-Ires-Puro和辅助质粒共转HEK-293T细胞,获得基因同源重组修复模板AAV。
构建同源重组修复模板AAV质粒pA2-pMC1TK-GFP-Ires-Puro的方法为:
从pSin-GFP-Puro载体(申请人实验室保存)上扩增GFP-Ires-Puro序列(序列如SEQ ID NO.2所示)和从PL253载体(制备方法见https://ncifrederick.cancer.gov/Research/Brb/productDataSheets/recombineering/plasmid.aspx)上扩增pMC1-TK序列(序列如SEQ ID NO.3所示),克隆到AAV载体(制备方法见http://www.addgene.org/67634)的ITR序列中间,得到重组pA2-GFP-pMC1TK载体。
辅助质粒为pDG(申请人实验室保存)。
基因同源重组修复报告系统的建立方法还包括如下步骤:
1)用基因同源重组修复模板AAV感染报告细胞系(HEK-293/HT-1080-EGFP(delAAC)细胞系)的细胞;
2)2d后观察报告细胞系是否出现恢复绿色荧光的细胞;出现表示基因修复了;
3)第7d收集细胞,流式细胞术检测绿色荧光细胞的比率。此比率反映了AAV介导的基因同源重组修复的效率。基因修复效率在0.4%左右表示修复效率高。
基因同源重组修复报告系统的建立方法还包括如下步骤:
1)HEK-293/HT-1080-GFP(510_513delAAC)细胞计数后接种于12孔板,调整细胞密度为0.5×105细胞/孔,37℃,5%CO2培养箱内培养;
2)24h后,吸掉培养基,加0.5ml含不同MOI(感染复数)基因同源重组修复模板AAV的完全培养基,轻轻摇晃;培养箱内培养1h后,再加0.5ml完全培养基,轻轻摇晃;
3)24h后换液,2d后可观察细胞GFP(510_513delAAC)基因修复后恢复绿色荧光的细胞(HEK-293/HT-1080-GFP细胞)的情况;
4)第7d收集细胞,流式细胞术检测绿色荧光细胞的比率。此比率反映AAV介导的基因同源重组修复的效率。
本发明还提供基因同源重组修复报告系统在HEK-293和HT-1080细胞中修复效率的研究。
进一步的在HEK-293细胞中的研究,具体如下:
1)HEK-293-GFP(510_513delAAC)细胞计数后接种于12孔板,调整细胞密度为0.5×105细胞/孔,37℃,5%CO2培养箱内培养;
2)24h后吸掉培养基,加0.5ml含不同MOI AAV的完全培养基,MOI分别为1000/2500/5000/7500/10000,轻轻摇晃;培养箱内培养1h后,再加0.5ml完全培养基,轻轻摇晃;
3)24h后换液;2d后可观察到细胞GFP基因修复后恢复绿色荧光的细胞(HEK-293-GFP细胞);
4)第7d收集细胞,流式细胞术检测AAV修复效率。数据统计后可以看到MOI在7500/10000时,基因修复效率都在0.4%左右,达到饱和。
进一步的在HT-1080细胞中的研究,具体如下:
1)HT-1080-GFP(510_513delAAC)细胞计数后接种于12孔板,调整细胞密度为0.5×105细胞/孔,37℃,5%CO2培养箱内培养;
2)24h后吸掉培养基,加0.5ml含不同MOI AAV的完全培养基,MOI分别为1000/2500/5000/7500/10000/30000,轻轻摇晃;培养箱内培养1h后,再加0.5ml完全培养基,轻轻摇晃;
3)24h后换液;2d后可观察到细胞GFP基因修复后恢复绿色荧光的细胞(HT-1080-GFP细胞);
4)第7d收集细胞,流式细胞术检测AAV修复效率。数据统计后可以看到MOI在10000/30000时,基因修复效率都在0.4%左右,达到饱和。
利用基因同源重组修复报告系统可以在体外快速、有效、高通量筛选靶向HRR相关的分子,有助于临床肿瘤治疗靶标的筛选,药物开发,HRR机制进行深入研究
附图说明
图1 GFP(510_513delAAC)测序图
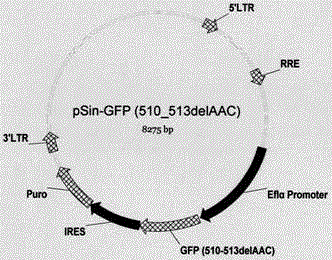
图2 pSin-GFP(510_513delAAC)质粒模式图
图3 pA2-GFP-pMC1TK质粒模式图
图4 AAV介导的基因同源重组修复报告系统技术流程
图5 AAV介导的HEK-293-GFP(510_513delAAC)基因同源重组修复修复结果
A.流式细胞术检测结果 B.细胞荧光结果
图6 AAV介导的HT-1080-GFP(510_513delAAC)基因同源重组修复修复结果
A.流式细胞术检测结果 B.细胞荧光结果
具体实施方式
现结合实施例和附图,对本发明做进一步描述。
下列实施例如无特殊说明所用方法均为常规方法。
实施例1:HEK-293-GFP(510_513delAAC)细胞系建立
1)构建pSin-GFP(510_513delAAC)慢病毒载体(见图2),其包含GFP(510_513delAAC)基因(如SEQ ID NO.1所示),IRES和嘌呤霉素(Puromycin)抗性基因。pSin-GFP(510_513delAAC)和辅助质粒共转HEK-293T细胞,收集病毒上清,0.45um滤膜过滤,分装后-80℃保存备用。
2)HEK-293细胞复苏:把冻存HEK-293细胞的管从液氮中取出来,立即投入37℃水浴锅中,轻微摇动。等液体都融化后(大概1~1.5min),拿出来喷点酒精放到超净工作台里;把上述细胞悬液吸到装有5ml培养基的15ml的离心管中,1500rmp,离心5min;倒掉上清液,加1ml培养基把细胞悬浮起来。吸到装有10ml培养基的10em培养皿中前后左右轻轻摇动,使细胞均匀分布在培养皿中;
标好细胞种类和日期、培养人姓名等,放到5%的CO2培养箱中培养,细胞贴壁后换培养基。完全培养基的配制:DMEM(高糖)+10%FBS(胎牛血清)+1%Pen./Strep.(青霉素100U/ml,链霉素100ug/ml)
3)用胰蛋白酶消化对数生长期的HEK-293细胞,细胞计数后接种于6孔板,调整细胞密度为3.0×105细胞/孔;根据慢病毒滴度测定结果,感染适量的慢病毒pSin-GFP(510_513delAAC),同时加终浓度为4ug/ml的polybrene;感染慢病毒12h后换液,48h后传代到10cm皿,用1ug/ml浓度的抗生素Puromycin筛选;10天后,在显微镜下挑单克隆细胞,获得整合有GFP(510_513delAAC)基因的单克隆HEK-293-GFP(510_513delAAC)细胞系。
4)单克隆HEK-293-GFP(510_513delAAC)细胞扩大培养,该克隆中GFP(510_513delAAC)基因的拷贝数经过qPCR检测,确定为单拷贝。
实施例2:HT-1080-GFP(510_513delAAC)细胞系建立
1)构建pSin-GFP(510_513delAAC)慢病毒载体(见图2),其包含GFP(510_513delAAC)失活基因,IRES和嘌呤霉素(Puromycin)抗性基因。pSin-GFP(510_513delAAC)和辅助质粒共转HEK-293T细胞,收集病毒上清,0.45um滤膜过滤,分装后-80℃保存备用。
2)HT-1080细胞复苏:把冻存HT-1080细胞的管从液氮中取出来,立即投入37℃水浴锅中,轻微摇动。等液体都融化后(大概1~1.5min),拿出来喷点酒精放到超净工作台里;把上述细胞悬液吸到装有5ml培养基的15ml的离心管中,1500rmp,离心5min;倒掉上清液,加1ml培养基把细胞悬浮起来。吸到装有10ml培养基的10cm培养皿中前后左右轻轻摇动,使细胞均匀分布在培养皿中;
标好细胞种类和日期、培养人姓名等,放到5%的CO2培养箱中培养,细胞贴壁后换培养基。
3)用胰蛋白酶消化对数生长期的HT-1080细胞,细胞计数后接种于6孔板,调整细胞密度为3.0×105细胞/孔;根据慢病毒滴度测定结果,感染适量的慢病毒pSin-GFP(510_513delAAC),同时加终浓度为4ug/ml的polybrene;感染慢病毒12h后换液,48h后传代到10cm皿,用1ug/ml浓度的抗生素Puromycin筛选;10天后,在显微镜下挑单克隆细胞,获得整合有EGFP GFP(510_513delAAC)基因的单克隆HT-1080-GFP(510_513delAAC)细胞系。
4)单克隆HT-1080-GFP(510_513delAAC)细胞扩大培养,该克隆中GFP(510_513delAAC)基因的拷贝数经过qPCR检测,确定为单拷贝。
5)用0.25%胰蛋白酶消化细胞,加合适的完全培养基中和,1500rmp,离心5min;。用配好的冻存液把细胞悬浮起来,分装到灭菌的冻存管中,静置几分钟,写明细胞种类,冻存日期和冻存者姓名。装在梯度冻存盒里-80℃过夜,然后放到液氮灌中保存。(冻存液的配制:70%的完全培养基+20%FBS+10%DMSO,DMSO要慢慢滴加,边滴边摇。)
实施例3:HEK-293-GFP(510_513delAAC)细胞系中GFP(510_513delAAC)基因同源重组修复
1)构建同源重组修复模板质粒pA2-GFP-pMC1TK(见图3),其包含不含启动子的GFP(绿色荧光蛋白)和Puro基因以及由pMC1启动子启动的自杀基因胸苷激酶HSV-TK基因。制备病毒。
2)用胰蛋白酶消化对数生长期的HEK-293-GFP(510_513delAAC)细胞计数后接种于12孔板,调整细胞密度为0.5×105细胞/孔,37℃,5%CO2培养箱内培养;24h后吸掉培养基,加0.5ml含不同MOIAAV的完全培养基,MOI分别为1000/2500/5000/7500/10000,轻轻摇晃;培养箱内培养1h后,再加0.5ml完全培养基,轻轻摇晃;24h后换液;2d后可观察到细胞EGFP基因修复后恢复绿色荧光的细胞(HEK-293-GFP细胞);第7d收集细胞,流式细胞术检测AAV修复效率。数据统计后可以看到MOI在7500/10000时,基因修复效率都在0.4%左右,达到饱和(见图5)。
实施例4:HT-1080-GFP(510_513delAAC)细胞系中GFP(510_513delAAC)基因同源重组修复
1)构建同源重组修复模板质粒pA2-GFP-pMC1TK(见图3),其包含不含启动子的GFP(绿色荧光蛋白)和Puro基因以及由pMC1启动子启动的自杀基因胸苷激酶HSV-TK基因。制备病毒。
2)用胰蛋白酶消化对数生长期的HT-1080-GFP(510_513delAAC)细胞计数后接种于12孔板,调整细胞密度为0.5×105细胞/孔,37℃,5%CO2培养箱内培养;24h后吸掉培养基,加0.5ml含不同MOI AAV的完全培养基,MOI分别为1000/2500/5000/7500/10000,轻轻摇晃;培养箱内培养1h后,再加0.5ml完全培养基,轻轻摇晃;24h后换液;2d后可观察到细胞GFP基因修复后恢复绿色荧光的细胞(HT-1080-GFP细胞);第7d收集细胞,流式细胞术检测AAV修复效率。数据统计后可以看到MOI在10000/30000时,基因修复效率都在0.4%左右,达到饱和(见图6)。
- 还没有人留言评论。精彩留言会获得点赞!