蔗糖合成酶在调控植物果实发育中的应用的制作方法
本发明涉及一种蔗糖合成酶在调控植物果实发育中的应用。
背景技术:
黄瓜是世界各国普遍栽培的重要蔬菜之一,也是我国五大蔬菜作物之一。与大多数高等植物相同,黄瓜的光合作用主要发生在成熟的叶片、果实和茎等绿色组织中,我们称之为“源”。而对于根、花和种子等不具有光合能力的非绿色组织,我们称之为“库”。蔗糖是绿色植物进行光合作用的主要产物,也是光合产物主要运输形式,蔗糖经过韧皮部向库器官运输,为细胞的生长发育供应碳源和能源;蔗糖代谢在植物发育、逆境响应和产量形成过程中发挥着重要的作用,它主要通过生成一系列糖作为燃料的代谢物和合成化合物(包括蛋白质、纤维素和淀粉)和作为信号分子调节microRNA的表达、转录因子和其他基因以及激素、氧化应激和防御信号的交互作用。从源器官合成的碳水化合物以多糖的形式通过韧皮部运输到各个库器官中贮存或吸收利用。到达库器官,少部分的二糖或多糖可以被库器官直接吸收利用,大部分多糖水解为单糖被植物所吸收。在植物体内与蔗糖代谢相关的主要有三种酶:1、蔗糖磷酸合成酶(Sucrose Phosphate Synthase;SPS,EC 2.3.1.14),催化反应:果糖-6-P+UDPG→蔗糖-6-P+UDP,是催化蔗糖合成的关键酶。2、蔗糖转化酶(Invertase;Inv,EC2.1.1.26),催化反应:蔗糖+H2O→葡萄糖+果糖,是蔗糖分解过程的中的关键酶。3、蔗糖合成酶(Sucrose Synthase;SUS,E.C.2.4.1.13),催化的是一个可逆反应:蔗糖+UDP←→UDPG+果糖。蔗糖转化酶和蔗糖合成酶在植物糖代谢都是分解蔗糖,在调节源库关系过程中发挥着重要的作用。蔗糖合成酶分解蔗糖的产物为UDPG,为纤维素合成提供底物。蔗糖合成酶是蔗糖代谢过程中的一个关键酶,该酶已经在很多植物中被研究,并且被认为在植物体内的能量代谢过程中起到重要作用,在植物细胞内直接参与蔗糖的调动,细胞结构的形成以及碳水化合物的积累。但蔗糖合成酶在黄瓜果实发育的过程的功能还不清楚。
技术实现要素:
本发明的目的是提供一种蔗糖合成酶在调控植物果实发育中的应用。
本发明提供了一种培育转基因植物的方法(方法甲),是将蔗糖合成酶的编码基因导入目的植物中,得到转基因植物;所述转基因植物满足如下(a1)-(a5)中至少一种性状:
(a1)果实产量大于所述目的植物;
(a2)果实长度大于所述目的植物;
(a3)果实粗度(直径)大于所述目的植物;
(a4)果实重量大于所述目的植物;
(a5)雄花大于所述目的植物。
所述方法甲中,所述蔗糖合成酶的编码基因可以通过重组表达载体导入目的植物。所述重组表达载体可通过Ti质粒、Ri质粒、植物病毒载体、直接DNA转化、显微注射、电导、农杆菌介导等常规生物学方法转化到目的植物中。
可用现有的植物表达载体构建含有所述基因的重组表达载体。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等。使用所述基因构建重组表达载体时,可在其转录起始核苷酸前加上任何一种增强型、组成型、组织特异型或诱导型启动子,它们可单独使用或与其它的植物启动子结合使用;此外,使用所述基因构建重组表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是ATG起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入在植物中表达可产生颜色变化的酶或发光化合物的基因、具有抗性的抗生素标记物或是抗化学试剂标记基因等。
所述重组表达载体具体可为在载体pBI 121的多克隆位点中插入了序列表的序列2所示的双链DNA分子得到的重组质粒。
所述重组表达载体具体可为将载体pBI 121的XbaI和SmaI酶切位点之间的小片段取代为了序列表的序列2所示的DNA分子得到的重组质粒。
本发明还保护所述方法甲在植物育种中的应用。
所述植物育种是为了选育果实产量高和/或果实长度大和/或果实粗度(直径)大和/或雄花大的植物。
本发明还保护一种培育转基因植物的方法(方法乙),是抑制目的植物中蔗糖合成酶的编码基因的表达,得到转基因植物;所述转基因植物满足如下(b1)-(b5)中至少一种性状:
(b1)果实产量小于所述目的植物;
(b2)果实长度小于所述目的植物;
(b3)果实粗度(直径)小于所述目的植物;
(b4)果实重量小于所述目的植物;
(b5)雄花小于所述目的植物。
所述方法乙中,所述“抑制目的植物中蔗糖合成酶的编码基因的表达”是通过干扰载体实现的。
所述干扰载体可通过Ti质粒、Ri质粒、植物病毒载体、直接DNA转化、显微注射、电导、农杆菌介导等常规生物学方法转化到目的植物中。
所述干扰载体具体可为含有干扰片段的重组表达载体。
所述干扰片段包括区段甲和区段乙。所述区段甲和所述区段乙为反向互补序列。所述区段甲的序列如序列表的序列3所示。所述干扰片段具体可为序列表的序列4所示。
所述干扰载体具体可为在载体pFGC1008的多克隆位点中插入了序列表的序列4所示的双链DNA分子得到的重组表达载体。
所述干扰载体具体可为将载体pFGC1008的AscI和SpeI酶切位点之间的小片段取代为了序列表的序列4所示的DNA分子得到的重组表达载体。
本发明还保护所述方法乙在植物育种中的应用。
所述植物育种是为了选育果实产量低和/或果实长度小和/或果实粗度(直径)小和/或雄花小的植物。
以上任一所述方法中,所述目的植物具体可为双子叶植物。所述双子叶植物可为葫芦科植物。所述葫芦科植物可为黄瓜属植物。所述黄瓜属植物具体可为黄瓜,例如新泰密刺黄瓜。
本发明还保护蔗糖合成酶的应用,为如下(e1)-(e16)中的至少一种:
(e1)调控植物果实发育;
(e2)调控植物库强;
(e3)调控植物器官中蔗糖合成酶活性;
(e4)调控植物果实中蔗糖合成酶活性;
(e5)调控植物雄花中蔗糖合成酶活性;
(e6)调控植物器官中蔗糖合成酶催化蔗糖转化为果糖的活性;
(e7)调控植物果实中蔗糖合成酶催化蔗糖转化为果糖的活性;
(e8)调控植物雄花中蔗糖合成酶催化蔗糖转化为果糖的活性;
(e9)促进植物果实发育;
(e10)提高植物库强;
(e11)促进植物器官中蔗糖合成酶活性;
(e12)促进植物果实中蔗糖合成酶活性;
(e13)促进植物雄花中蔗糖合成酶活性;
(e14)促进植物器官中蔗糖合成酶催化蔗糖转化为果糖的活性;
(e15)促进植物果实中蔗糖合成酶催化蔗糖转化为果糖的活性;
(e16)促进植物雄花中蔗糖合成酶催化蔗糖转化为果糖的活性。
所述植物具体可为双子叶植物。所述双子叶植物可为葫芦科植物。所述葫芦科植物可为黄瓜属植物。所述黄瓜属植物具体可为黄瓜,例如新泰密刺黄瓜。
本发明还保护一种特异DNA分子,包括区段甲和区段乙。所述区段甲和所述区段乙为反向互补序列。所述区段甲的序列如序列表的序列3所示。所述特异DNA分子如序列表的序列4所示。
本发明还保护一种干扰载体,是将所述特异DNA分子导入表达载体得到的。
所述干扰载体具体可为在载体pFGC1008的多克隆位点中插入了序列表的序列4所示的双链DNA分子得到的重组表达载体。
所述干扰载体具体可为将载体pFGC1008的AscI和SpeI酶切位点之间的小片段取代为了序列表的序列4所示的DNA分子得到的重组表达载体。
本发明还保护所述特异DNA分子或所述干扰载体在培育转基因植物中的应用;所述转基因植物满足如下(f1)-(f5)中至少一种性状:
(f1)果实产量小于出发植物;
(f2)果实长度小于出发植物;
(f3)果实粗度(直径)小于出发植物;
(f4)果实重量小于出发植物;
(f5)雄花小于出发植物。
所述出发植物具体可为双子叶植物。所述双子叶植物可为葫芦科植物。所述葫芦科植物可为黄瓜属植物。所述黄瓜属植物具体可为黄瓜,例如新泰密刺黄瓜。
以上任一所述蔗糖合成酶具体可为蔗糖合成酶CsSUS4。
所述蔗糖合成酶CsSUS4,获自黄瓜,是如下(c1)或(c2):
(c1)由序列表中序列1所示的氨基酸序列组成的蛋白质;
(c2)将序列1的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的由序列1衍生的蛋白质。
为了使(c1)中的蔗糖合成酶CsSUS4便于纯化和检测,可在由序列表中序列1所示的氨基酸序列组成的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。
表1标签的序列
上述(c2)中的蔗糖合成酶CsSUS4可人工合成,也可先合成其编码基因,再进行生物表达得到。上述(c2)中的蔗糖合成酶CsSUS4的编码基因可通过将序列表中序列2所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上表1所示的标签的编码序列得到。
以上任一所述蔗糖合成酶的编码基因具体可为CsSUS4基因。
所述CsSUS4基因为如下(d1)-(d3)中任一所述的DNA分子:
(d1)编码区如序列表中序列2所示的DNA分子;
(d2)在严格条件下与(d1)限定的DNA序列杂交且编码蔗糖合成酶的DNA分子;
(d3)与(d1)或(d2)限定的DNA序列具有90%以上同源性且编码蔗糖合成酶的DNA分子。
上述严格条件可为用0.1×SSPE(或0.1×SSC),0.1%SDS的溶液,在DNA或者RNA杂交实验中65℃下杂交并洗膜。
本发明发现了蔗糖合成酶基因CsSUS4在黄瓜果实发育过程中发挥着的关键性作用,可以调节库强从而促进果实的发育。这一优良的功能对于改良黄瓜的高效增产具有指导意义。
附图说明
图1为过表达转基因株系PCR鉴定结果。
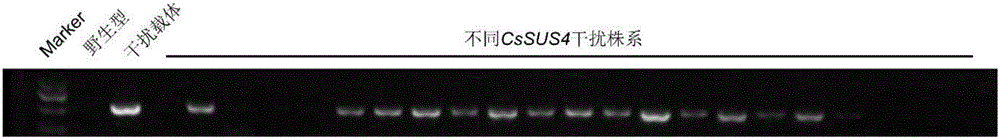
图2为干扰转基因株系PCR鉴定结果。
图3为黄瓜不同组织部位及不同时期CsSUS4基因表达量及酶活性分析结果。
图4为转基因植株果实表型及果实中酶活性分析结果。
图5为转基因植株雄花表型及雄花中酶活性分析结果。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
新泰密刺黄瓜:参考文献:Cheng J,Wang Z,Yao F,et al.Down-Regulating CsHT1,a Cucumber Pollen-Specific Hexose Transporter,Inhibits Pollen Germination,Tube Growth,and Seed Development.[J].Plant Physiology,2015,168(2):635-47.;公众可以从中国农业大学获得。
载体pBI 121:Cheng J,Wang Z,Yao F,et al.Down-Regulating CsHT1,a Cucumber Pollen-Specific Hexose Transporter,Inhibits Pollen Germination,Tube Growth,and Seed Development.[J].Plant Physiology,2015,168(2):635-47.;公众可以从中国农业大学获得。
载体pFGC1008:Cheng J,Wang Z,Yao F,et al.Down-Regulating CsHT1,a Cucumber Pollen-Specific Hexose Transporter,Inhibits Pollen Germination,Tube Growth,and Seed Development.[J].Plant Physiology,2015,168(2):635-47.;公众可以从中国农业大学获得。
农杆菌LBA4404:Cheng J,Wang Z,Yao F,et al.Down-Regulating CsHT1,a Cucumber Pollen-Specific Hexose Transporter,Inhibits Pollen Germination,Tube Growth,and Seed Development.[J].Plant Physiology,2015,168(2):635-47.;公众可以从中国农业大学获得。
MS固体培养基:MS培养基4.43g,蔗糖30g,植物凝胶2.5g,补水至1L,调pH 5.7-5.8。
MS分化培养基:MS培养基4.43g,蔗糖30g,植物凝胶2.5g,6-BA 0.5mg,ABA 1mg,补水至1L,pH 5.7-5.8。
MS培养基:北京西美杰科技有限公司,货号:M519。
3,5-二硝基水杨酸溶液:向262mL 2M NaOH水溶液中加入6.3g 3,5-二硝基水杨酸粉末,然后与500mL含185g酒石酸钾钠的热水溶液混和,再加入5g结晶酚和5g亚硫酸钠后搅拌溶解,冷却后加双蒸水定容至1000mL,棕色瓶保存一星期后使用。
以下实施例中粗酶液的制备方法为:取1g待测样品于冰浴的研钵中,加入4mL酶提取液(溶剂为pH7.5、50mM HEPES-NaOH缓冲液;含10mM MgCl2、1mM EDTA、2.5mM DTT、0.1g/100mlBSA和体积百分含量为0.05%的TritonX-100)研磨成匀浆,13000rpm离心20min,取上清。将上清装入透析袋中,在透析液(不含有TritonX-100,其余各个溶质的浓度为酶提取液中浓度的十分之一)中透析16h,取透析液中的液体,即为粗酶液,用于酶活性测定。
以下实施例中蔗糖合成酶活性的检测方法为:配制700μL反应体系,30℃反应30min;向反应体系中加入1500μL 3,5-二硝基水杨酸溶液终止反应;将反应体系沸水浴10min,冷却后测定OD540nm值。酶活力以单位果实鲜重中的粗酶液在单位时间内催化蔗糖分解产生果糖的μmol数表示。单位为:μmol·h-1·g-1FW(FW指样品鲜重)。
反应体系(700μL):溶剂为80mM Mes缓冲液(pH 5.5);含5mM氟化钠,100mM蔗糖,5mM UDP,500μL粗酶液。
对照反应体系(700μL):溶剂为80mM Mes缓冲液(pH 5.5);含5mM氟化钠,100mM蔗糖,500μL粗酶液。
以下实施例中酸性转化酶活性或碱性转化酶活性的检测方法为:配制反应体系,将反应体系37℃,水浴60min;向反应体系中加入1mL 3,5-二硝基水杨酸溶液终止反应;将反应体系100℃煮沸5min后流水迅速冷却(若有沉淀则4000rpm离心10min取上清),测定OD520nm值。
酸性转化酶反应体系:0.6ml0.1mol/L乙酸乙-酸钠(pH4.8),0.2ml0.1mol/L蔗糖,0.2ml粗酶液。
酸性转化酶对照反应体系:0.6ml0.1mol/L乙酸乙-酸钠(pH4.8),0.2ml蒸馏水,0.2ml粗酶液。
碱性转化酶反应体系:0.6ml0.1mol/L KH2PO4-0.1mol/L柠檬酸钠(pH 7.2),0.2ml0.1mol/L蔗糖,0.2ml粗酶液。
碱性转化酶对照反应体系:0.6ml0.1mol/L KH2PO4-0.1mol/L柠檬酸钠(pH 7.2),0.2ml蒸馏水,0.2ml粗酶液。
根据还原糖(葡萄糖)标准曲线计算其生成还原糖的量和酶活性。酶活力单位为:μmol·h-1·g-1FW(FW指样品鲜重)。
实施例1、蔗糖合成酶蛋白及其编码基因的获得
对各品种黄瓜基因组进行序列分析、区段截取和功能验证,从新泰密刺黄瓜中发现一种蔗糖合成酶蛋白,将其命名为CsSUS4蛋白,如序列表的序列1所示。将编码CsSUS4蛋白的基因命名CsSUS4基因,如序列表的序列2所示。
实施例2、黄瓜不同组织部位不同时期CsSUS4基因表达量及酶活性分析
1、分别取新泰密刺黄瓜如下时期的如下材料:
空间表达取样:同一黄瓜植株上的根(R)、茎(S)、成熟叶(ML)、幼叶(YL)、雄花(FF)和雌花(MF)。
时间表达取样:花前两天果实(-2DAF)、开花当天果实(0DAF)、花后三天果实(3DAF)、花后六天果实(6DAF)和花后九天果实(商品成熟果,9DAF)。
以上每份样品均取3个生物学重复。
提取上述材料的总RNA,并合成第一链cDNA,采用qRT-PCR的方法检测CsSUS4基因的表达情况(以TUA基因为内参基因),采用引物FP1和引物RP1组成的引物对检测CsSUS4基因的表达,采用引物FP2和引物RP2组成的引物对检测TUA基因的表达。
FP1:5’-CATTTTTCTTGTCAATTTACTGCTG-3’;
RP1:5’-GCCCGACACGAAACGAC-3’;
FP2:5’-ACGCTGTTGGTGGTGGTAC-3’;
RP2:5’-GAGAGGGGTAAACAGTGAATC-3’。
2、分别取新泰密刺黄瓜如下时期的如下材料:花前两天果实(-2DAF)、开花当天果实(0DAF)、花后三天果实(3DAF)、花后六天果实(6DAF)和花后九天果实(商品成熟果,9DAF)。分别检测上述材料中蔗糖合成酶活性、酸性转化酶活性和碱性转化酶活性。
以上每份样品均取3个生物学重复。
结果如图3所示。结果表明,CsSUS4基因在黄瓜的不同组织部位均有表达,其中在库器官中表达较高,包括雄花、雌花、根和果实。而且CsSUS4基因的表达量随着果实的发育逐渐升高,蔗糖合成酶活性和碱性转化酶活性也随果实发育不断升高,酸性转化酶的活性保持不变。
实施例3、转基因植株的获得
一、过表达载体的构建
1、提取新泰密刺黄瓜的总RNA,并反转录为cDNA,以cDNA为模板,采用SS4F和SA4R组成的引物对进行PCR扩增,回收PCR扩增产物。
SS4F:5’-GCTCTAGAATGGCTTCTTTGGTGGTAAATCATCATAACGGT-3’;
SA4R:5’-TCCCCCGGGTTACTTTTGAATCCGAGATTGGGTGCGCTT-3’。
SS4F和SA4R中,下划线分别标注XbaI和SmaI酶切位点。
2、用限制性内切酶XbaI和SmaI双酶切步骤1的PCR扩增产物,回收酶切产物。
3、用限制性内切酶XbaI和SmaI双酶切载体pBI 121,回收约14750bp的载体骨架。
4、将步骤2的酶切产物和步骤3的载体骨架连接,得到过表达载体pBI 121-CsSUS4。根据测序结果,对过表达载体pBI 121-CsSUS4进行结构描述如下:将载体pBI 121的XbaI和SmaI酶切位点之间的小片段取代为了序列表的序列2所示的DNA分子。过表达载体pBI 121-CsSUS4部分原件示意图如图4A所示。
二、干扰载体的构建
1、提取新泰密刺黄瓜的总RNA,并反转录为cDNA,以cDNA为模板,采用+S4iF和+S4iR组成的引物对进行PCR扩增,回收PCR扩增产物。
+S4iF:5’-AGGCGCGCCTCTTTGGTGGTAAATCATCATAACG-3’;
+S4iR:5’-GCATTTAAATATATTCCCAACATCCTGGTTCTG-3’。
+S4iF和+S4iF中,下划线分别标注AscI和SwaI酶切位点。
2、用限制性内切酶AscI和SwaI双酶切步骤1的PCR扩增产物,回收酶切产物。
3、用限制性内切酶AscI和SwaI双酶切载体pFGC1008,回收约10907bp的载体骨架。
4、将步骤2的酶切产物和步骤3的载体骨架连接,得到重组载体pFGC1008-RNAi-1。根据测序结果,对重组载体pFGC1008-RNAi-1进行结构描述如下:将载体pFGC1008的AscI和SwaI酶切位点之间的小片段取代为了序列表的序列3所示的DNA分子。
5、提取新泰密刺黄瓜的总RNA,并反转录为cDNA,以cDNA为模板,采用-S4iF和-S4iR组成的引物对进行PCR扩增,回收PCR扩增产物。
-S4iF:5’-GACTAGTTCTTTGGTGGTAAATCATCATAACG-3’;
-S4iR:5’-CGGGATCCATATTCCCAACATCCTGGTTCTG-3’。
-S4iF和-S4iF中,下划线分别标注SpeI和BamHI酶切位点。
6、用限制性内切酶SpeI和BamHI双酶切步骤5的PCR扩增产物,回收酶切产物。
7、用限制性内切酶SpeI和BamHI步骤4得到的重组载体pFGC1008-RNAi-1,回收约11190bp的载体骨架。
8、将步骤6的酶切产物和步骤7的载体骨架连接,得到干扰载体pFGC1008-RNAi-CsSUS4。根据测序结果,对干扰载体pFGC1008-RNAi-CsSUS4进行结构描述如下:将重组载体pFGC1008的AscI和SpeI酶切位点之间的小片段取代为了序列表的序列4所示的DNA分子。干扰载体pFGC1008-RNAi-CsSUS4部分原件示意图如图4A所示。
三、过表达转基因植株的获得
1、将步骤一得到的过表达载体pBI 121-CsSUS4导入农杆菌LBA4404,得到重组农杆菌。
2、取步骤1得到的重组农杆菌,接种至含有25μg/ml利福平和100μg/ml卡那霉素的YEB液体培养基中,120rpm、28℃培养至菌液OD600nm达到0.6-0.8;将菌液5000rpm离心5min收集菌体沉淀,将菌体沉淀用1/2MS液体培养基洗涤2次后,重新悬浮于1/2MS液体培养基中,调整菌液OD600nm为0.2。
3、取新泰密刺黄瓜种子,播种于MS固体培养基中28℃恒温暗培养至种子萌发2天后进行后续实验。
4、取步骤3萌发2天后的黄瓜幼嫩子叶,去除生长点后将每片子叶均匀分成2块,只保留靠近生长点一半的部分。
5、将步骤4处理后的黄瓜子叶浸没在步骤2得到的农杆菌菌液中侵染15分钟,然后用灭菌的滤纸吸干多余菌液,将黄瓜子叶接种至MS分化培养基中,黑暗条件28℃培养2天后收获外植体。
6、将步骤5得到的外植体接种至含有50mg/L卡那霉素和500mg/L羧苄青霉素的MS分化培养基上,25℃、2000LX光照强度(14h光照/10h黑暗)培养,待抗性芽长至1cm时,将其切下移入含有100mg/L卡那霉素和200mg/L羧苄青霉素的MS固体培养基中诱导生根,获得T0代过表达转基因植株,待植株根系发育好后,移入盛有无菌土的花盆中,温室常规管理。T0代植株自交,得到T1代植株。T1代植株自交,得到T2代植株。
7、取步骤6得到的若干转基因株系的T2代植株进行鉴定。取待测植株苗期叶片的总RNA并反转录为cDNA,以cDNA为模板,采用引物35S2-F和35S2-R进行PCR鉴定。
35S2-F:5’-TGGTTAGAGAGGCTTACGCAGCAGGTC-3’;
35S2-R:5’-CCATCTTTGGGACCACTGTCGGCA-3’。
如果对于某一T0代植株,其抽样检测的T2代植株的PCR鉴定结果均为阳性,该T0代植株及其自交后代为一个纯合的过表达转基因株系。
设置采用新泰密刺黄瓜(野生型)cDNA为模板的阴性对照。
设置采用过表达载体pBI 121-CsSUS4 DNA为模板的阳性对照。
鉴定结果如图1所示。
四、干扰转基因植株的获得
采用步骤二得到干扰载体pFGC 1008-RNAi-CsSUS4代替过表达载体pBI 121-CsSUS4,按照步骤三进行操作,得到T0代干扰转基因植株,待植株根系发育好后,移入盛有无菌土的花盆中,温室常规管理。T0代植株自交,得到T1代植株。T1代植株自交,得到T2代植株。采用步骤三中的方法对干扰转基因株系的T2代植株进行鉴定。
设置采用新泰密刺黄瓜(野生型)cDNA为模板的阴性对照。
设置采用干扰载体pFGC1008-RNAi-CsSUS4 DNA为模板的阳性对照。
鉴定结果如图2所示。
五、转空载体植株的获得
1、采用载体pBI 121代替过表达载体pBI 121-CsSUS4,按照步骤三进行操作,得到过表达转基因对照植株,待植株根系发育好后,移入盛有无菌土的花盆中,温室常规管理。
2、采用载体pFGC1008代替过表达载体pBI 121-CsSUS4,按照步骤三进行操作,得到干扰转基因对照植株,待植株根系发育好后,移入盛有无菌土的花盆中,温室常规管理。
实施例4、转基因植株的表型观察
待测植株为:新泰密刺黄瓜(WT)、实施例3构建的过表达转基因株系(OE6-10和OE17-2)的T2代植株、干扰转基因株系(Ri54-12和Ri37-5)的T2代植株、过表达转基因对照株系的T2代植株和干扰转基因对照株系的T2代植株。
1、取待测植株统一进行日常田间管理。去掉根瓜,在第二个瓜开花当天进行挂牌,取开花后生长到9天的瓜,进行单果重、单果长度及单果粗度的统计,并采用实施例2中的方法检测果实中的CsSUS4基因的表达情况,并检测果实蔗糖合成酶活性。
结果如图4所示。结果表明,与野生型新泰密刺黄瓜(WT)相比,CsSUS4基因的相对表达量在过表达转基因株系(OE6-10和OE17-2)果实中上调、在干扰转基因株系(Ri54-12和Ri37-5)果实中下调(图4B);与野生型新泰密刺黄瓜相比,蔗糖合成酶的活性在干扰转基因株系(Ri54-12和Ri37-5)果实中上调、在干扰转基因株系(Ri54-12和Ri37-5)果实中下调(图4C);干扰转基因株系(CsSUS4-Ri)的果实明显小于野生型;而过表达转基因株系(CsSUS4-OE)果实明显大于野生型(图4D);过表达转基因株系(OE6-10和OE17-2)果实与野生型相比,无论果实长度、粗度和重量显著增加,干扰转基因株系(Ri54-12和Ri37-5)果实与野生型株系相比,无论果实长度、粗度和重量显著减小(图4E、F、G)。过表达转基因对照植株和干扰转基因对照植株的统计结果与野生型无显著差异。
2、取待测植株统一进行日常田间管理。在雄花盛花期统计雄花的表型,每个株系至少统计50朵雄花的重量,分别统计各株系5瓣花、6瓣花、7瓣花和8瓣花的平均单花重量,分别统计各株系5瓣花、6瓣花、7瓣花和8瓣花所占的数量比例,检测雄花中蔗糖合成酶活性。
结果如图5所示。结果表明,过表达转基因株系(OE6-10和OE17-2)雄花中蔗糖合成酶活性比野生型(WT)高;干扰转基因株系(Ri54-12和Ri37-5)雄花中蔗糖合成酶活性比野生型低(图5A);与野生型雄花相比,过表达转基因株系(OE6-10和OE17-2)雄花明显大而干扰转基因株系(Ri54-12和Ri37-5)雄花明显小(图5B);过表达转基因株系(OE6-10和OE17-2)、干扰转基因株系(Ri54-12和Ri37-5)和野生型中5瓣花、6瓣花、7瓣花和8瓣花的平均单花重量有显著差异(图5C);过表达转基因株系(OE6-10和OE17-2)中出现7瓣花和8瓣花的比例比野生型的高,干扰转基因株系(Ri54-12和Ri37-5)中出现7瓣花和8瓣花的比例与野生型相当(图5D)。过表达转基因对照植株和干扰转基因对照植株的统计结果与野生型无显著差异。
<110> 中国农业大学
<120> 蔗糖合成酶在调控植物果实发育中的应用
<160> 4
<210> 1
<211> 834
<212> PRT
<213> 黄瓜(Cucumis sativus L.)
<400> 1
Met Ala Ser Leu Val Val Asn His His Asn Gly Glu Ser Ile Gly Asp
1 5 10 15
Gly Ile Val Glu Ala Leu Lys Gln Asn His Asn Tyr Met Lys Arg Cys
20 25 30
Phe Gly Lys Phe Val Glu Lys Gly Asn Arg Ser Leu Lys Lys Lys Glu
35 40 45
Leu Met Glu Glu Met Glu Leu Val Ile Asp Asp Lys Ile Glu Arg Asn
50 55 60
Arg Val Met Glu Gly Val Leu Gly His Met Leu Thr Ser Thr Gln Val
65 70 75 80
Ala Ile Val Ile Pro Pro Tyr Val Ala Phe Ala Ile Arg Pro Glu Pro
85 90 95
Gly Cys Trp Glu Tyr Val Lys Val Ser Ser Leu Asp Leu Ser Leu Gln
100 105 110
Ser Leu Thr Ser Thr Glu Phe Leu Lys Leu Lys Glu Met Ile Tyr Asp
115 120 125
Glu Glu Trp Ala Asn Asp Glu Asn Ala Leu Glu Val Asp Phe Gly Ala
130 135 140
Ile Glu Phe Thr Thr Pro Arg Leu Ser Leu Pro Ser Ser Ile Gly Asp
145 150 155 160
Gly Leu Ser Tyr Thr Thr Lys Phe Leu Thr Ser Lys Leu Ser Gly Lys
165 170 175
Ser Glu Asn Leu Gln Pro Leu Val Asp Tyr Leu Leu Ser Leu Asp Tyr
180 185 190
Gln Gly Glu Lys Leu Met Ile Asn Glu Thr Leu Ser Thr Ala Ser Lys
195 200 205
Leu Gln Met Thr Leu Ile Leu Ala Asp Ile Phe Leu Ser Val Leu Pro
210 215 220
Pro Asp Thr Pro Tyr Asp Asp Phe His Leu Lys Phe Lys Gln Trp Gly
225 230 235 240
Phe Glu Arg Gly Trp Gly Asp Cys Ala Gly Arg Val Lys Glu Thr Ile
245 250 255
Arg Cys Leu Ser Glu Ile Phe Gln Ala Tyr Asp Pro Ile Gln Met Glu
260 265 270
Lys Phe Phe Ser Arg Leu Pro Thr Ile Phe Asn Val Val Ile Leu Ser
275 280 285
Pro His Gly Tyr Phe Gly Gln Ala Gly Val Leu Gly Leu Pro Asp Thr
290 295 300
Gly Gly Gln Val Val Tyr Ile Leu Asp Gln Val Lys Ala Met Glu Glu
305 310 315 320
Glu Leu Leu Leu Arg Ile Lys Gln Gln Gly Leu Asn Phe Lys Pro Gln
325 330 335
Ile Ile Ile Ile Thr Arg Leu Ile Pro Asp Ala Lys Gly Thr Lys Cys
340 345 350
Asn Gln Glu Ile Glu Pro Val Ile Gly Thr Thr Tyr Ser Lys Ile Val
355 360 365
Arg Val Pro Phe Lys Thr Glu Asn Gly Thr Leu His Arg Trp Val Ser
370 375 380
Arg Phe Asp Ile Tyr Pro Tyr Leu Glu Lys Phe Ala Gln Asp Ala Ser
385 390 395 400
Asp Lys Ile Leu Glu Leu Met Glu Ala Lys Pro Asp Leu Ile Ile Gly
405 410 415
Asn Tyr Thr Asp Gly Asn Leu Val Ala Ser Leu Met Ala Ser Arg Leu
420 425 430
Gly Val Thr Gln Gly Thr Ile Ala His Ala Leu Glu Lys Thr Lys Tyr
435 440 445
Glu Asp Ser Asp Leu Lys Trp Lys Glu Leu Asp Ser Lys Tyr His Phe
450 455 460
Ser Cys Gln Phe Thr Ala Asp Ile Leu Ala Met Asn Ala Thr Asp Phe
465 470 475 480
Val Ile Ala Ser Thr Phe Gln Glu Ile Ala Gly Ser Lys Glu Lys Pro
485 490 495
Gly Gln Tyr Glu Ser His Glu Ala Phe Thr Leu Pro Gly Leu Cys Arg
500 505 510
Phe Val Ser Gly Ile Asn Val Phe Asp Pro Lys Phe Asn Ile Ala Ala
515 520 525
Pro Gly Ala Asp Gln Ser Val Tyr Phe Pro Tyr Thr Thr Lys Glu Leu
530 535 540
Arg Phe Ala Ser Phe Gln Pro Ala Ile Glu Glu Leu Leu Phe Ser Lys
545 550 555 560
Val Glu Asn Asp Glu His Ile Gly Tyr Leu Ala Asp Arg Lys Lys Pro
565 570 575
Ile Ile Phe Ser Met Ala Arg Leu Asp Val Val Lys Asn Ile Thr Gly
580 585 590
Leu Val Glu Trp Phe Gly Lys Asn Glu Lys Leu Arg Asn Leu Val Asn
595 600 605
Leu Val Val Val Gly Gly Phe Phe Asp Pro Ser Lys Ser Lys Asp Arg
610 615 620
Glu Glu Met Ala Glu Ile Arg Lys Met His Glu Leu Ile Asp Lys Tyr
625 630 635 640
Gln Leu Lys Gly Gln Ile Arg Trp Ile Ala Ala Gln Thr Asp Arg Arg
645 650 655
Arg Asn Gly Glu Leu Tyr Arg Cys Ile Ala Asp Thr Lys Gly Ala Phe
660 665 670
Val Gln Pro Ala Leu Tyr Glu Ala Phe Gly Leu Thr Val Ile Glu Ala
675 680 685
Met Asn Cys Gly Leu Pro Thr Phe Ala Thr Asn Gln Gly Gly Pro Ala
690 695 700
Glu Ile Ile Val Asp Gly Val Ser Gly Phe Gln Ile Asp Pro Asn Asn
705 710 715 720
Gly Thr Glu Ser Ser Gln Lys Ile Ala Asn Phe Phe Glu Lys Cys Lys
725 730 735
Asn Asp Pro Thr Tyr Trp Asn Glu Ile Ser Asn His Gly Leu Gln Arg
740 745 750
Ile Asn Glu Cys Tyr Thr Trp Lys Ile Tyr Ala Lys Lys Val Leu Asn
755 760 765
Met Gly Ser Thr Tyr Ser Phe Trp Lys Gln Val Asn Lys Asn Gln Lys
770 775 780
Gln Ala Lys Asp Arg Tyr Ile Gln Met Phe Tyr Asn Leu Leu Phe Lys
785 790 795 800
Asn Leu Val Lys Asn Val Pro Ile Val Val His Glu Asp Ser His Pro
805 810 815
Glu Asn Pro Arg Leu Pro Gln Val Ser Lys Arg Thr Gln Ser Arg Ile
820 825 830
Gln Lys
<210> 2
<211> 2505
<212> DNA
<213> 黄瓜(Cucumis sativus L.)
<400> 2
atggcttctt tggtggtaaa tcatcataac ggtgagtcga ttggtgatgg aattgtagag 60
gcattgaagc aaaaccataa ttatatgaag agatgctttg gtaagtttgt agagaaaggg 120
aataggagct tgaagaagaa ggaattaatg gaggaaatgg agcttgttat agatgataag 180
atagaaagga atagggttat ggagggtgtc cttggtcata tgttgacttc aactcaggtg 240
gcgattgtga ttccaccata tgttgcattt gcaataagac cagaaccagg atgttgggaa 300
tatgttaaag ttagttctct tgatctttca ctccaatctc tcacttcaac tgaatttctc 360
aaattgaagg agatgattta cgacgaagaa tgggcaaatg atgaaaatgc tttggaagtg 420
gatttcggag caattgaatt tacaactcct cggttaagcc ttccatcttc aattggagat 480
ggacttagtt atactacaaa gtttctcacc tcaaagctga gtgggaagtc ggagaattta 540
caacctcttg tagattactt gttgtccctt gattatcaag gagagaaact tatgatcaat 600
gaaactctaa gcacagcttc caaactccaa atgacattaa ttcttgctga tattttcctc 660
tctgttcttc ctccagacac cccatatgat gacttccatc tcaaattcaa gcaatgggga 720
tttgagagag gatggggaga ttgtgctgga agagtaaagg aaacaataag atgtttatct 780
gaaatattcc aagcctatga tccaatccaa atggagaagt tcttcagcag gcttcctact 840
attttcaatg ttgtcatttt gtctcctcat ggatactttg gccaagctgg tgttcttggt 900
ttgcccgaca ccggaggtca ggttgtgtac atactcgatc aagttaaagc tatggaagaa 960
gaacttctgc tcagaattaa gcaacaaggc ctcaatttca agcctcaaat tattattatt 1020
acaagactta ttccagatgc gaaggggact aagtgcaacc aagaaataga acctgtcatt 1080
gggactactt actccaagat tgttagggtg cccttcaaga ctgaaaatgg cacccttcat 1140
cgttgggttt ctcgtttcga catttatcct tatctcgaga aatttgcaca agatgcgagc 1200
gacaaaatat tagagctcat ggaagcaaag ccagatctaa tcattggaaa ctacacagat 1260
ggaaatcttg tggcatctct catggccagc agattaggag taacccaagg aactattgca 1320
catgccttgg agaagacaaa gtatgaagat tcagatctta aatggaagga attggactcc 1380
aagtaccatt tttcttgtca atttactgct gatattcttg ctatgaatgc gactgatttt 1440
gtcatcgcaa gcactttcca agagattgca ggaagcaaag aaaagccagg ccaatatgaa 1500
agccacgagg catttacgct tccaggactg tgtcgtttcg tgtcgggcat caatgtgttt 1560
gatcctaagt tcaacattgc agcaccaggg gctgatcagt ctgtctattt tccttacacg 1620
accaaagaac ttcgatttgc atcgtttcaa cctgccattg aagaacttct ttttagcaaa 1680
gttgagaacg atgagcatat aggatatctg gccgatagga aaaagccgat catcttttca 1740
atggcacggc ttgatgttgt caagaacatt accgggttgg tcgaatggtt tgggaagaat 1800
gagaagctga gaaatttggt gaatcttgtt gtggttggag gattttttga tccttccaaa 1860
tcaaaggaca gagaagaaat ggcagagata agaaagatgc atgaattaat tgacaaatac 1920
caactcaaag gtcagatcag gtggatagca gcacagactg atcgccgtcg taatggagaa 1980
ctctaccgct gcattgctga cacaaaagga gcctttgtgc agcctgctct ctatgaagct 2040
tttggtctca cagtcattga ggcaatgaat tgtggtctac caacctttgc tacgaaccaa 2100
gggggtccag ctgagatcat tgttgatggg gtctctggct tccaaattga tcccaacaat 2160
ggcactgaat caagccaaaa gattgctaac ttttttgaga aatgcaagaa tgatccaacc 2220
tactggaacg aaatttcgaa tcacggtctt caacgtatca atgaatgtta cacatggaaa 2280
atctatgcaa aaaaggtgct aaatatggga agcacttaca gtttttggaa gcaagtgaac 2340
aaaaaccaaa agcaggcaaa ggacagatac atccaaatgt tctacaatct actttttaag 2400
aacttggtga aaaacgtgcc aatcgtggtc cacgaagatt cacatccaga aaatccacgg 2460
ttaccacaag tctcgaagcg cacccaatct cggattcaaa agtaa 2505
<210> 3
<211> 297
<212> DNA
<213> 黄瓜(Cucumis sativus L.)
<400> 3
tctttggtgg taaatcatca taacggtgag tcgattggtg atggaattgt agaggcattg 60
aagcaaaacc ataattatat gaagagatgc tttggtaagt ttgtagagaa agggaatagg 120
agcttgaaga agaaggaatt aatggaggaa atggagcttg ttatagatga taagatagaa 180
aggaataggg ttatggaggg tgtccttggt catatgttga cttcaactca ggtggcgatt 240
gtgattccac catatgttgc atttgcaata agaccagaac caggatgttg ggaatat 297
<210> 4
<211> 975
<212> DNA
<213> 人工序列
<220>
<223>
<400> 4
tctttggtgg taaatcatca taacggtgag tcgattggtg atggaattgt agaggcattg 60
aagcaaaacc ataattatat gaagagatgc tttggtaagt ttgtagagaa agggaatagg 120
agcttgaaga agaaggaatt aatggaggaa atggagcttg ttatagatga taagatagaa 180
aggaataggg ttatggaggg tgtccttggt catatgttga cttcaactca ggtggcgatt 240
gtgattccac catatgttgc atttgcaata agaccagaac caggatgttg ggaatatatt 300
taaatcccca gatgaacatg gcatcgtggt gattgatgaa actgctgctg tcggctttaa 360
cctctcttta ggcattggtt tcgaagcggg caacaagccg aaagaactgt acagcgaaga 420
ggcagtcaac ggggaaactc agcaagcgca cttacaggcg attaaagagc tgatagcgcg 480
tgacaaaaac cacccaagcg tggtgatgtg gagtattgcc aacgaaccgg atacccgtcc 540
gcaaggtgca cgggaatatt tcgcgccact ggcggaagca acgcgtaaac tcgacccgac 600
gcgtccgatc acctgcgtca atgtaatgtt ctgcgacgct cacaccgata ccatcagcga 660
tctctttgat ggggatccat attcccaaca tcctggttct ggtcttattg caaatgcaac 720
atatggtgga atcacaatcg ccacctgagt tgaagtcaac atatgaccaa ggacaccctc 780
cataacccta ttcctttcta tcttatcatc tataacaagc tccatttcct ccattaattc 840
cttcttcttc aagctcctat tccctttctc tacaaactta ccaaagcatc tcttcatata 900
attatggttt tgcttcaatg cctctacaat tccatcacca atcgactcac cgttatgatg 960
atttaccacc aaaga 975
- 还没有人留言评论。精彩留言会获得点赞!