一种哈茨木霉酸性蛋白酶P6281的异源表达及纯化方法与流程
本发明属于生物工程技术领域,特别涉及一种哈茨木霉酸性蛋白酶P6281的异源表达及纯化方法。
背景技术:
哈茨木霉是一种存在于几乎所有土壤中的木霉属真菌,它们易于定殖植物根,一些菌株具有根际活性,即能够在根发育时在根上生长。同时哈茨木霉也会通过攻击,寄生其他真菌等方式来获得营养。经过多年的进化,它们已经发展出用于其它真菌的攻击和用于增强植物和根生长的许多机制。作为一种经济有效、安全可持续的菌剂,哈茨木霉也用作杀真菌剂,是目前广泛应用于植物真菌病生物防治的一个最重要生防菌,其抑菌的作用机制和应用研究已经备受关注。它用于叶面施用、种子处理和土壤处理以抑制各种引起疾病的真菌病原体的生长。目前市场上商业生物技术产品如3Tac、T-22、G-41等已经用于治疗葡萄孢属、镰孢属和青霉属引起的真菌性土传病害。目前研究推测哈茨木霉的抑菌机制有竞争、重寄生、抗生素和刺激宿主免疫等,其中又以重寄生作用最具研究意义。目前其重寄生的机制的研究并不十分清晰,大多数科学家推测其分泌的几丁质酶、葡聚糖酶及蛋白酶等能破坏病原真菌细胞壁,而使其根植在真菌上重寄生。
在研究哈茨木霉重寄生作用的机制研究中,2005年Suarez等的研究发现,在培养基中添加灰葡萄孢提取的细胞壁组分后,在哈茨木霉分泌蛋白2D电泳中,可见多种蛋白的表达明显上调,蛋白酶P6281就是其中之一。随后他们通过质谱获得这个蛋白酶部分序列,再通过PCR获得该基因的全长,然后根据蛋白质序列分析获得P6281的理论分子量、等电点、糖基化位点或活性中心等信息。2007年Suarez对哈茨木霉EST序列中发现了61种蛋白酶,其中也包含了P6281。2009年Samolski通过microarray芯片也发现在添加几丁质的培养基中,哈茨木霉也有大量基因表达上调,其中也有p6281。2013年Szabo也报道了在线虫卵上寄生的哈茨木霉中该基因的表达。由此可见P6281可能是哈茨木霉寄生其他真菌和线虫卵过程中的一个重要蛋白酶。然而到目前为止,尚未有人分离纯化过哈茨木霉的P6281蛋白酶,对其性质并没有清楚的研究。
而在目前已有报道中,异源表达纯化得到的木霉属酸性蛋白酶酶活普遍不高,例如,2007年Liu在酿酒酵母表达的哈茨木霉SA76酸性蛋白酶发酵液酶活为10.5U/mL,2010年Guo在酿酒酵母表达的粗糙链孢菌酸性蛋白酶发酵液酶活为6.8U/mL,2013年Yang在毕赤酵母表达的棘孢木霉酸性蛋白酶发酵液酶活为18.5U/mL,2014年Dou在大肠杆菌表达的棘孢木霉ASP55酸性蛋白酶纯酶液酶活为9.52U/mL。
技术实现要素:
本发明的首要目的在于克服现有技术的缺点与不足,提供一种哈茨木霉酸性蛋白酶P6281的异源表达及纯化方法。本发明以哈茨木霉为来源,采用了基因工程的技术方法,从木霉中获得酸性蛋白酶基因p6281,构建重组质粒,然后在毕赤酵母中重组表达,通过亲和层析和分子筛层析对发酵液中的酸性蛋白酶组分进行纯化,首次成功表达纯化了哈茨木霉酸性蛋白酶P6281。
本发明的另一目的在于提供所述方法制得的酸性蛋白酶。
本发明的目的通过下述技术方案实现:
一种哈茨木霉酸性蛋白酶P6281的异源表达及纯化方法,包括如下步骤:
(1)培养哈茨木霉;
(2)提取哈茨木霉总RNA;
(3)RT-PCR克隆p6281编码序列;
(4)TA克隆与重组质粒的筛选鉴定;
(5)基因p6281转化毕赤酵母GS115;
(6)P6281的发酵诱导及纯化;
(7)重组蛋白的SDS-PAGE检测。
步骤(1)中所述的培养哈茨木霉是将哈茨木霉GIM 3.442接种至PDA固体培养基中,30℃培养2天。
步骤(3)中所述的RT-PCR克隆p6281编码序列的具体步骤如下:先获取哈茨木霉cDNA,然后进行PCR反应获得目的DNA片段,所使用的引物如下:正向引物F(5’-CTGCGAATTCTCGCCGGTAAAGCCAAGT-3’)和反向引物R(5’-ACTTACGCGTAGCGGCGGTAGCAAAGC-3’),下划线序列分别表示EcoR I酶切位点和MluI酶切位点。
步骤(4)中所述的TA克隆与重组质粒的筛选鉴定的具体步骤优选如下:高保真酶产物经切胶回收后,将基因片段与pMD18-T载体连接,T载体连接体系如下:pMD18-T为0.5μL、p6281为4.5μL、Solution I为5μL。
步骤(5)中所述的基因p6281转化毕赤酵母GS115的具体步骤优选为:提取表达质粒载体,然后对表达质粒载体用BglII内切酶酶切,将表达质粒载体线性化;制备毕赤酵母GS115感受态;使用电转化法把线性化质粒转入毕赤酵母中。
步骤(5)中所述的基因p6281转化毕赤酵母GS115的具体步骤进一步优选为:
①提取pMD18-T-p6281克隆载体质粒,以之为模板进行PCR扩增,鉴定产物后用纯化回收,得到回收产物;
②把表达载体pPIC9K多酶切位点改造,依次为BamHI,EcoRI,ApaI和MluI,构建得到表达载体pPIC9BM;
③使用EcoRI和MluI对步骤①的回收产物和步骤②得到的pPIC9BM载体进行双酶切后,分别纯化回收,得到双酶切后的蛋白酶基因片段和pPIC9BM载体;
④将步骤③中得到的蛋白酶基因片段和pPIC9BM载体进行体外连接,构建得到表达质粒pPIC9BM-p6281;
⑤对表达质粒pPIC9BM-p6281,用BglII内切酶酶切,将表达质粒载体线性化;
⑥制备毕赤酵母GS115感受态;使用电转化法把步骤⑤得到的线性化质粒转入毕赤酵母中。
步骤①中所述的鉴定优选为通过琼脂糖凝胶电泳进行鉴定。
步骤④中所述的蛋白酶基因片段和pPIC9BM载体优选按摩尔比为1:5配比进行体外连接。
步骤(6)中所述的纯化优选为使用镍柱亲和层析和Sephadex G-75柱层析纯化目的蛋白。
所述的镍柱亲和层析所用洗脱液优选为0.01M咪唑、0.5M NaCl、0.02M磷酸缓冲液(pH7.4);所述的Sephadex G-75柱层析冲洗液优选为0.05M NaCl、0.02M磷酸缓冲液(pH6.0)。
一种酸性蛋白酶,由上述方法制备得到。
本发明相对于现有技术具有如下的优点及效果:
1.本发明首次成功表达纯化了哈茨木霉酸性蛋白酶P6281。
2.本发明得到的P6281蛋白酶酶活远高于现有的酸性蛋白酶。
采用国标法测定P6281的蛋白酶活,测得发酵液蛋白酶活为321.8U/mL,比酶活为4373.1U/mg,高于同类报道的酸性蛋白酶酶活,如2007年Liu在酿酒酵母表达的哈茨木霉SA76酸性蛋白酶发酵液酶活为10.5U/mL,2010年Guo在酿酒酵母表达的粗糙链孢菌酸性蛋白酶发酵液酶活为6.8U/mL,2013年Yang在毕赤酵母表达的棘孢木霉酸性蛋白酶发酵液酶活为18.5U/mL,2014年Dou在大肠杆菌表达的棘孢木霉ASP55酸性蛋白酶纯酶液酶活为9.52U/mL。
3.本发明的方法大幅度提高了P6281蛋白酶的产量。
附图说明
图1是重组表达载体pPIC9BM-p6281的质粒图谱图。
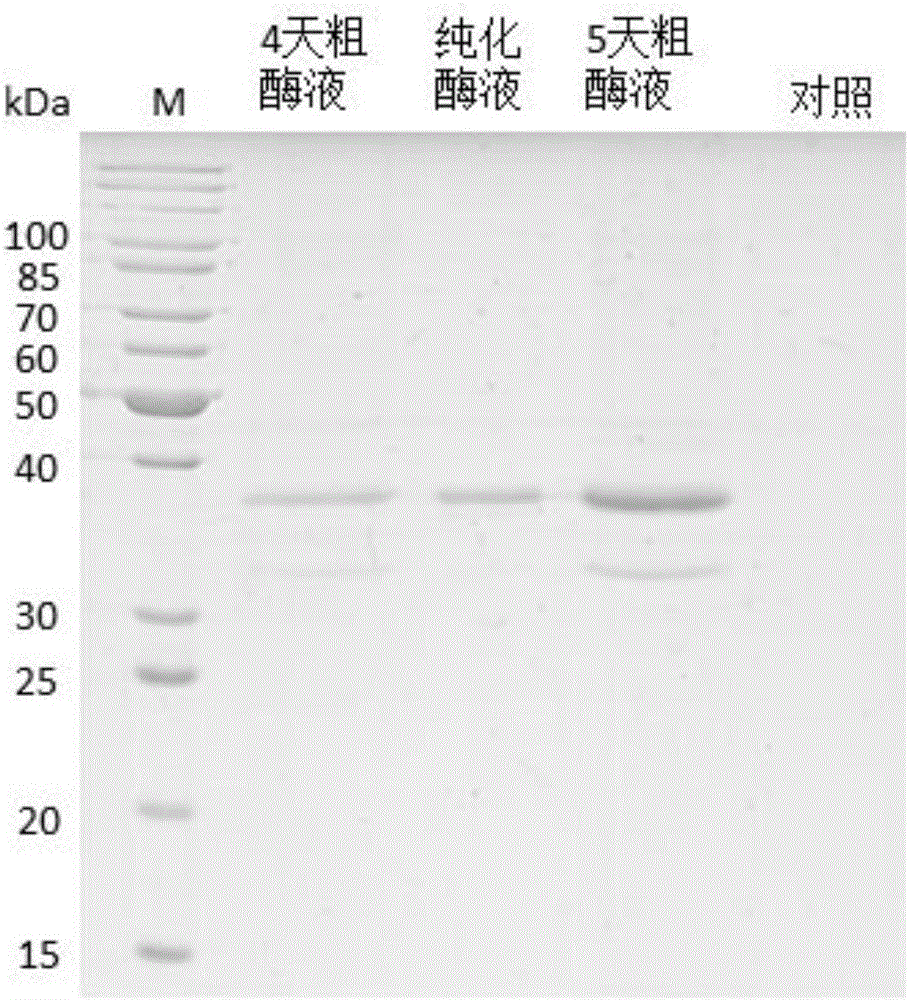
图2是重组蛋白的SDS-PAGE凝胶电泳图,其中,M表示标准分子量蛋白,泳道1是经过4天发酵诱导后得到的粗酶液,泳道2是经过5天发酵诱导后纯化后的样品,泳道3是经过5天发酵诱导的粗酶液,泳道4是经过5天诱导的转化空载体的毕赤酵母上清液。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例
(一)哈茨木霉培养:
将哈茨木霉GIM3.442(购于广东省微生物菌种保藏中心)接种至PDA固体培养基(马铃薯粉滤过液200mL,葡萄糖4g,硫酸镁0.75g,磷酸二氢钾0.75g,琼脂粉4g)中,30℃培养2天。
(二)哈茨木霉总RNA提取:
(1)用高压蒸汽灭菌后的镊子摄取约100mg的菌丝体放入液氮预冷的研钵中,加入少量液氮,用研钵快速研磨,再加入少量液氮,继续研磨,反复3次,直至全部菌丝体彻底变成白色粉末。
(2)向研钵中加入2mL RNAiso Plus(购于大连宝生物工程有限公司),尽量将粉末完全覆盖,然后室温静置,直至RNAiso Plus完全融化,用研钵继续研磨至裂解液呈透明状。将所得的裂解液等量转移至1.5mL离心管中,室温静置5分钟。12000rpm,4℃离心5分钟,小心吸取上清液,移入新的离心管中(切勿吸取沉淀)。
(3)向步骤(2)中得到的上清液加入400μL氯仿,盖紧离心管盖,剧烈振荡15秒。待溶液充分乳化后,再室温静置数分钟后12000rpm,4℃离心15分钟。
(4)从离心机中小心取出离心管,此时匀浆液分为三层,无色的上清液、中间的白色蛋白层和带有颜色的下层有机相。吸取上清液转移至另一新的离心管中;
(5)向步骤(4)得到的上清液中加入等体积的异丙醇,上下颠倒离心管充分混匀后,在室温下静置10分钟后,12000rpm,4℃离心10分钟。
(6)离心之后,试管底部有沉淀。小心弃去上清,缓慢地沿离心管壁加入1mL 75%的乙醇(切勿触及沉淀),轻轻上下颠倒,洗涤离心管管壁,12000rpm,4℃离心5分钟后小心弃去乙醇。
(7)打开离心管盖子,倒置管子,室温干燥沉淀5分钟,加入20μL的RNase-free水溶解沉淀,待沉淀完全溶解后,将溶解液转移至RNase-free离心管中,置于-80℃保存。
(三)RT-PCR克隆p6281编码序列:
(1)把下列组分加入到一个无核酶的PCR管中:
表1RT-PCR体系
(2)65℃保温上述混合物5分钟后迅速置于冰上,再加入4μL5×First-Strand buffer,2μL 0.1M DTT,1μL 40U/mL RNase抑制剂于上述混合物中,轻轻混合并在37℃培养2分钟;
(3)加入1μL反转录酶,轻轻混合后在37℃培养50分钟;
(4)70℃培养15分钟灭活反转录酶,置于-20℃保存;
(5)设计正向引物F(5’-CTGCGAATTCTCGCCGGTAAAGCCAAGT-3’)和反向引物R(5’-ACTTACGCGTAGCGGCGGTAGCAAAGC-3’)。以上一步获得的哈茨木霉cDNA为模板,按照以下PCR体系及程序,进行PCR反应获得目的DNA片段;
表2PCR体系
PCR反应条件为:94℃预变性3min;94℃变性30秒;51℃退火30秒;72℃延伸2分钟;32个循环;最后72℃延伸10分钟;然后将产物通过琼脂糖凝胶电泳鉴定,琼脂糖浓度为1.5%,电泳条件为120V,25min,琼脂糖凝胶电泳的操作过程参见《分子克隆实验指南》。得到酸性蛋白酶基因条带大小约为1100bp,使用凝胶回收试剂盒回收目的基因。
(四)TA克隆与重组质粒的筛选鉴定
(1)高保真酶产物经切胶回收后,利用Ex-taq酶进行加A反应,按以下体系将步骤(三)得到的目的基因片段(p6281)与pMD18-T载体(购于大连宝生物工程有限公司)连接,连接条件16℃,2h;
表3T载体连接体系
然后42℃热击70秒转化大肠杆菌DH5α感受态细胞(购买于大连宝生物工程有限公司),涂布含有氨苄青霉素抗性的LB液体培养基(胰蛋白胨10g,酵母提取物5g,氯化钠10g,蒸馏水定容至1000mL)中,37℃培养过夜。然后使用2×Taq PCR Mix进行菌落PCR筛选阳性菌落,反应体系及程序如下:
表4菌落PCR体系
菌落PCR反应条件为:94℃预变性3min;94℃变性30秒;51℃退火30秒;72℃延伸1分钟;32个循环;最后72℃延伸10分钟;然后将产物通过琼脂糖凝胶电泳鉴定,琼脂糖浓度为1%,电泳条件为120V,25min,得到酸性蛋白酶基因条带大小约为1100bp;
(2)挑取阳性克隆加入到含氨苄抗性的LB液体培养基于37℃,220rpm摇床上扩大培养12h。取扩大培养的菌液于离心管中,送至生工生物工程(上海)股份有限公司进行测序,经过测序测得克隆基因长度为1107bp,测序结果如下:其核苷酸序列如SEQ ID No:3所示;
(五)基因p6281转化毕赤酵母GS115:
(1)提取克隆有酸性蛋白酶基因的pMD18-T-p6281克隆载体质粒,以之为模板进行PCR扩增,PCR体系参照前文表2,然后将产物进行琼脂糖凝胶电泳鉴定,用试剂盒纯化回收。把表达载体pPIC9K(购买于Invitrogen公司)多酶切位点改造,依次为BamHI,EcoRI,ApaI和MluI,并命名为pPIC9BM(图1)。构建载体使用RF克隆,引物为5’-GAAGCTGGATCCGAATTCCCGCTCGAGGGGCCCACGCGTCATCATCATCATC-3’(下划线的序列分别表示EcoRI酶切位点和MluI酶切位点),反应体系为:
表5RF克隆体系
反应条件为:98℃预变性3min;98℃变性10秒;58℃退火15秒;72℃延伸8分钟;32个循环;最后72℃延伸10分钟;产物测序鉴定;
使用EcoRI和MluI对回收产物和pPIC9BM载体按照说明书进行双酶切(双酶切体系如表6),用普通DNA回收试剂盒对酶切后的DNA分别进行纯化回收,然后用核酸浓度检测仪检测DNA浓度;
表6双酶切体系
酶切条件37℃,4h;
(2)将纯化回收的蛋白酶基因片段p6281和pPIC9BM载体片断按摩尔比为1:5的比例利用T4连接酶进行体外连接,连接条件22℃,8h,连接体系如下表。
表7T4连接酶连接体系
将连接后的重组质粒42℃热击70秒转化至大肠杆菌DH5α菌株中。在含有的平板上挑选阳性单菌落,提取其质粒进行双酶切鉴定,并且对该菌株也进行菌液和质粒测序鉴定;对构建成功的表达质粒命名为pPIC9BM-p6281。
(3)采用质粒小提试剂盒从阳性克隆菌株的菌悬液中提取表达质粒载体,然后对表达质粒载体用BglII内切酶酶切,将表达质粒载体线性化,酶切体系如下:
表8单酶切体系
酶切之后,用回收试剂盒回收质粒并测定浓度;
(4)制备毕赤酵母GS115感受态,具体步骤如下:
a.将-80℃冻存的毕赤酵母GS115菌株于YPD平板(胰蛋白胨20g,酵母提取物10g,葡萄糖20g,琼脂粉20g,蒸馏水定容至1000mL)上划线接种,30℃培养3天;
b.挑取毕赤酵母GS115菌株的单菌落接种至含有25mLYPD培养液(胰蛋白胨20g,酵母提取物10g,葡萄糖20g,蒸馏水定容至1000mL)的250mL三角瓶中,30℃、220rpm振荡培养2天;
c.取1mL步骤b最终得到的菌悬液接种至另一瓶含有50mLYPD培养液三角瓶中,30℃、220rpm振荡培养数小时,至菌悬液的OD600达到2.0;
d.将菌悬液转移已灭菌的50mL离心管中,5000rpm,4℃离心5分钟,去上清,用预冷的无菌水10mL将菌体重悬,然后转移至15mL离心管中;
e.5000rpm,4℃离心5分钟,去上清,用预冷的1M山梨醇10mL将菌体重悬,重复一次;
f.5000rpm,4℃离心5分钟,去上清,用1mL 1M山梨醇重悬菌体,置于冰上用于电转化;
(5)使用电转化法把步骤(3)得到的线性化质粒转入毕赤酵母中,电击条件为1.5kV,2mm电转杯,10ng线性化质粒。把电转化后的菌液涂布MD平板,30℃培养2天,挑选5个单菌落分别接种YPD液体培养基,然后低温裂解毕赤酵母转化子细胞,
裂解方法如下:
a.从MD平板(葡萄糖20g,YNB 13.4g,琼脂粉20g,蒸馏水定容至1000mL)上,挑取10个毕赤酵母转化子单菌落分别接种至2mLYPD培养液中,30℃,220rpm振荡培养2天;
b.分别将1mL菌液转移至离心管中,8000rpm离心2min,弃上清;
c.加入1mL TE buffer重悬菌体,8000rpm离心2min,弃上清,重复一次;
d.沸水浴30min后转移至-80℃冰箱放置一个小时,然后沸水浴10min;
e.8000rpm离心2min,所得上清置于-20℃保存;
使用2×Taq PCR Mix进行菌落PCR鉴定,反应体系及程序参照表4;
(六)P6281的发酵诱导及纯化:
挑选阳性重组毕赤酵母菌株划线MD平板,30℃培养2天,挑取单菌落接种于装有50mL BMGY培养液(酵母提取物10g,胰蛋白胨20g,YNB 13.4g,甘油10mL,1M磷酸钾(pH6.0)100mL,蒸馏水定容至1000mL)的三角瓶中,30℃,220rpm振荡培养至OD600≈5.0。然后离心收集菌体,等量转移菌体沉淀至装有100mL BMMY培养液的三角瓶中28℃,220rpm振荡培养,每24小时添加1.5%的甲醇溶液进行诱导表达,诱导4~5天。发酵液5000rpm,4℃离心10min取得上清测定酶活;采用《SB/T 10317-1999蛋白酶活力测定法》中的“福林法”测定P6281的蛋白酶活。然后使用镍柱亲和层析和Sephadex G-75柱层析纯化目的蛋白,其中镍柱亲和层析上样量为150mL,所用洗脱液为0.01M咪唑、0.5M NaCl、0.02M磷酸缓冲液(pH7.4);Sephadex G-75柱层析上样量为95mL,冲洗液为0.05M NaCl、0.02M磷酸缓冲液(pH6.0)。以转化空载体pPIC9BM的GS115菌株作为实验对照。
通过前述方法,测得本发明所得的发酵液蛋白酶活为321.8U/mL,比酶活为4373.1U/mg。通过生工生物工程(上海)股份有限公司的BCA蛋白浓度试剂盒测得纯化后的蛋白酶的产量为116.5mg/1000mL发酵液。
Suarez等曾分别添加1%的P.ultimum,B.cinerea,R.solani细胞壁和几丁质作为碳源对哈茨木霉的蛋白表达进行研究,哈茨木霉在其中添加B.cinerea细胞壁的条件下表达P6281表达量最大,但其表达的总蛋白量仅为18μg/300mL(包含P6281,未纯化)。由此可见,本发明不仅首次成功异源表达纯化得到P6281,且产量实现了明显提高。
(七)重组蛋白的SDS-PAGE检测:
利用SDS-PAGE凝胶电泳来确认重组蛋白酶的表达情况、纯度和分子质量的大小。采用的浓缩胶浓度为12%以及分离胶浓度为5%,上样量为20μL,以标准分子量的标准蛋白作为Marker。SDS-PAGE凝胶电泳的操作过程参见《蛋白质电泳实验技术》。对于发酵液样品的制备,诱导表达产生的重组蛋白酶的量较高,可以直接将发酵液稀释1倍后与上样缓冲液混匀,沸水煮沸10min后,12000rpm离心1min,上样后进行电泳。
粗酶液(指未经过镍柱亲和层析和Sephadex G-75柱层析的发酵液)与纯化后酶液的SDS-PAGE电泳图如图2所示,M表示标准分子量蛋白,泳道1是经过4天发酵诱导后得到的粗酶液,泳道2是经过5天发酵诱导后通过亲和层析和分子筛层析纯化的样品,泳道3是经过5天发酵诱导的粗酶液,泳道4是经过5天诱导的转化空载体的毕赤酵母上清液。由图中可以看出,转化空载体的毕赤酵母并无蛋白表达,而未经纯化的阳性诱导(即泳道1和泳道3)的上清液中均有一深一浅两个蛋白条带,其中深色条带大小接近40kDa,与预期结果相符;而诱导5天的蛋白表达量比4天要大,由泳道2可看出,经过纯化处理后只剩下单一的预期蛋白条带,表明已经成功获得电泳纯级别的酸性蛋白酶P6281。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 华南理工大学
<120> 一种哈茨木霉酸性蛋白酶的异源表达及纯化方法
<130> 1
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> RT-PCR正向引物F
<400> 1
ctgcgaattc tcgccggtaa agccaagt 28
<210> 2
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> RT-PCR反向引物R
<400> 2
acttacgcgt agcggcggta gcaaagc 27
<210> 3
<211> 1107
<212> DNA
<213> 哈茨木霉
<220>
<223> 哈茨木霉蛋白酶p6281目的基因
<400> 3
tcgccggtaa agccaagtgc caagactgcc gcgctatcag tgaagcgtgt ctcgaacgtc 60
aaatcattga agaatattgt ccaaaagggc caggcacgca tcaacaagat caacggcgtc 120
aaagacatcg aggccagagc tagcggccca gccaccaacg aggatgttag ctatgttgcc 180
tcggtcacta ttggtggtaa atcctgggac ctcatcgtcg acactggatc ttcaaacacg 240
tggtgtggtg ctcaaagctc atgcgagcct tcatctactg gcaagtccac gggcggttcc 300
gtccaggtca gctatggttc cggctccttc tccggcaccg agtacaagga cacagttagc 360
ttcggtggtt tgactgtcac atcacagtcg gttggagctg cccgttcatc ctctggcttt 420
tcaggtgtcg atggaattat tggctttggt ccggtggatc tcactgagga caccgtctcc 480
aacgccaaca cggttccaac cttcttggat aatctctaca gccaaggttc catctcgact 540
gaggtgctgg gcgtttcttt caagccagag tctggcagtg acagtgatga caccaacggc 600
gagttgaccc tcggcggtac tgatagctcc aagtacacgg gctctctcac ctacttctca 660
actctcaaga gtggctctgc tgctccctac tggggcatct ctattgctag tttcacctac 720
ggctcgacga ccctcgcatc gtctgcgacc ggcattgtcg acactggtac tacgctcatc 780
tacatcccca ccaaggctta caatgcattc ctgtctgccg ctggtggcaa gactgacagc 840
tcttctggcc tcgccgtctt ctcaaaagcg ccaacatcca actttgctat caagtttggc 900
tcaacgacct acaccctcac accttctcaa tacttggttc ccacctctca gtacagcttc 960
tacggactca gctctggaaa gtactacgct tggattaacg acggtggcag ctcgggtgtc 1020
aacaccatta ttggccagaa gttcctggaa aactactact ccgtttttga tactaccaac 1080
ggccgcatcg gctttgctac cgccgct 1107
<210> 4
<211> 52
<212> DNA
<213> Artificial Sequence
<220>
<223> RF克隆引物
<400> 4
gaagctggat ccgaattccc gctcgagggg cccacgcgtc atcatcatca tc 52
- 还没有人留言评论。精彩留言会获得点赞!