顺式还原酮加双氧酶基因在提高水稻抗旱能力方面的应用的制作方法
技术领域
本发明属于水稻整体生长发育情况改进的技术领域,涉及提高水稻抗旱能力方面的应用。
背景技术:
农作物的产量会受到生长环境的影响,目前全球作物产量由于土地缺水受到严重的制约,随着全球气候变暖,世界各国旱灾发生的频率和范围也在加大。水稻是我国重要粮食作物之一,我国是世界上最大的稻米生产国和消费国,但在水稻的种植和生产中,需要耗费大量的淡水资源,因此干旱已成为制约我国水稻生产的重要因素。
当植物受到干旱胁迫环境时,植物会对胁迫产生应答,诱导抗旱相关基因的表达从而影响植物的生长发育来起到保护作用,所以研究和挖掘植物抗旱基因,利用转基因策略来提高作物的抗旱能力,培育抗旱作物品种,提高作物产量、确保粮食生产安全具有重要的意义。
研究表明植物激素在逆境胁迫中起到十分关键的作用,如ABA及乙烯。植物激素ABA在逆境胁迫中的功能已有较为明确的分析,但乙烯在胁迫中的调控通路还不清楚,目前有研究发现,胁迫会增加植物体内乙烯的含量,如在干旱、高盐、寒冷、水淹,机械损伤、寒冷等胁迫下都能诱导植物体内乙烯含量的增加。
顺式还原酮加双氧酶(Acireductone Dioxygenase,ARD)是乙烯合成途径中的一个重要的酶,首先,顺式还原酮加双氧酶催化顺式还原酮生成2-Keto-4-methylthiobutyrate (KMTB),KMTB进而被催化形成甲硫氨酸(Met)。Met是乙烯合成途中的重要物质,植物中乙烯的合成是首先通过Met催化形成S-腺苷甲硫氨酸,S-腺苷甲硫氨酸由ACC合成酶催化形成乙烯前体1-aminocyclopropane-1-carboxylic acid (ACC),ACC被氧化后形成乙烯[1],所以ARD位于乙烯合成的上游。在细菌里,Dai等[2]发现在肺炎克雷伯菌(Klebsiela pneumoniae)中有两种ARD酶,这两种酶的蛋白质构成完全相同,由同一个基因编码,但由于结合的金属离子不同,却行使了完全相反的功能。很多研究表明真核生物中参与甲硫氨酸循环的两个ARD蛋白同样行使着完全不同的功能,Fe-ARD催化顺式还原酮形成KMTB进而促进甲硫氨酸(Met)的合成,而Ni-ARD参与催化顺式还原酮生成甲基丙酸乙酯,顺式还原酮的消耗使甲硫氨酸的合成减少[3]。目前OsARD1具体的生物学功能仍然未知,我们实验结果表明干旱可以诱导OsARD1的表达。我们进一步构建了OsARD1的过表达载体获得了其过表达植株,发现过量表达OsARD1能够增强水稻的抗旱能力。
技术实现要素:
本发明公开了一种水稻抗旱基因OsARD1核苷酸序列,其特征在于OsARD1基因的核苷酸序列为SEQ ID No.1, OsARD1所编码的氨基酸序列为SEQ ID No.2。
本发明进一步公开了OsARD1基因在提高水稻抗旱能力方面的应用。
本发明公开的水稻抗旱基因OsARD1核苷酸序列如下:
ATGGAGAACGAATTCCAGGATGGTAAGACGGAGGTGATAGAAGCATGGTACATGGATGATAGCGAAGAGGACCAGAGGCTTCCTCATCACCGCGAACCCAAAGAATTCATTCATGTTGATAAGCTTACAGAACTAGGAGTAATCAGCTGGCGCCTAAATCCTGATAACTGGGAGAATTGCGAGAACCTGAAGAGAATCCGCGAAGCCAGAGGTTACTCTTATGTGGACATTTGTGATGTGTGCCCAGAGAAGCTGCCAAATTATGAAACTAAGATCAAGAGTTTCTTTGAAGAACACCTGCATACCGATGAAGAAATACGCTATTGTCTTGAAGGGAGTGGATACTTTGATGTGAGAGACCAAAATGATCAGTGGATTCGTATAGCACTGAAGAAAGGAGGCATGATTGTTCTGCCTGCAGGGATGTACCACCGCTTTACGTTGGACACCGACAACTATATCAAGGCAATGCGACTGTTTGTTGGCGATCCTGTTTGGACACCCTACAACCGTCCCCATGACCATCTTCCTGCAAGAAAGGAGTTTTTGGCTAAACTTCTCAAGTCAGAAGGTGAAAATCAAGCAGTTGAAGGCTTCTGA
OsARD1所编码的氨基酸序列为:
MENEFQDGKTEVIEAWYMDDSEEDQRLPHHREPKEFIHVDKLTELGVISWRLNPDNWENCENLKRIREARGYSYVDICDVCPEKLPNYETKIKSFFEEHLHTDEEIRYCLEGSGYFDVRDQNDQWIRIALKKGGMIVLPAGMYHRFTLDTDNYIKAMRLFVGDPVWTPYNRPHDHLPARKEFLAKLLKSEGENQAVEGF。
附图说明
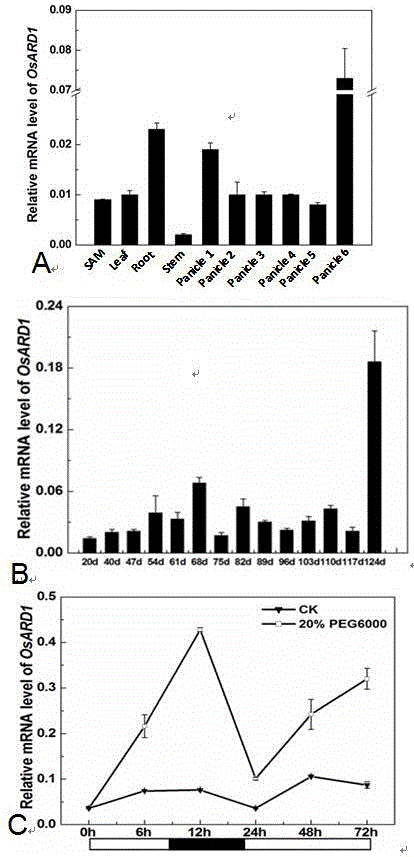
图1为 OsARD1的表达模式分析;其中A. OsARD1的组织特异性分析;M:茎顶端分生组织;Root:根;Leaf:叶片;LS:叶鞘;Stem:茎;Panicle1:0.5-1 cm长幼穗; Panicle1:1-2cm长幼穗;Panicle3:3-4cm长幼穗;Panicle4:5-6cm长幼穗;Panicle5:10cm长幼穗;Panicle6:抽穗开花期的幼穗;C. OsARD1在模拟干旱渗透胁迫处理条件下的表达分析,空心框表示光期,实心框表示暗期;
图2为OsARD1过表达载体的构建;其中A.过表达载体的结构;LB:T-DNA的左边界;NPTⅡ:新霉素磷酸转移酶抗性标记基因;2×35S:两个串联排列的花椰菜病毒(CaMV)35S启动子;OsARD1:OsARD1的全长ORF片段;RB:T-DNA的右边界;B.目的基因OsARD1全长ORF片段的PCR扩增;C.过表达重组载体酶切鉴定,1-3为3个不同的单克隆;M为Marker标记;
图3为 OsARD1过表达转基因植株的表型及表达分析;其中A. T0代过表达转基因植株中NPTⅡ基因的PCR检测。1-22为获得的40株中的22个转基因单株,P: pCAMBIA2300空载体质粒; WT: 转入pCAMBIA2300空载体对照;CK: 正常未转化的野生型中花11;所用引物为载体中NPTⅡ基因特异引物;B. 部分T0代过表达转基因植株的表达分析;WT为空载体对照转基因植株;1-18为1-6号株系的18株过表达转基因植株; C. T1代转基因植株表达分析。WT为空载对照体转基因植株,#2~#6为4个独立的过表达转基因植株; D. 过表达转基因植株表型。WT为空载对照体转基因植株;OsARD1-OV为过表达转基因植株;
图4为干旱及PEG处理情况下表型分析;其中A. 脱水处理前的表型;B. 脱水处理2h后的表型;C. 5% PEG6000渗透胁迫处理6天后表型;对照组为未加PEG6000的Arga培养基,处理组为加入5% PEG6000的Arga培养基中;WT为转入空载体的转基因植株,OsARD1-OV为过表达转基因植株。
具体实施方式
下面通过具体的实施方案叙述本发明。除非特别说明,本发明中所用的技术手段均为本领域技术人员所公知的方法。另外,实施方案应理解为说明性的,而非限制本发明的范围,本发明的实质和范围仅由权利要求书所限定。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对这些实施方案中的物料成分和用量进行的各种改变或改动也属于本发明的保护范围。本发明所用原料及试剂均有市售。粳稻品种中花11有市售。
实施例1
1 材料和方法
1.1 材料
粳稻品种中花11(Oryza sativa L. ssp. Japonica cv. Zhonghua 11)及其转基因植株用于本研究,田间材料均种植于天津市天津师范大学试验田,田间保持日常管理。用于处理的材料均种植于人工气候箱中(Climacell MMM,德国)。
1.2 OsARD1过表达载体的构建
OsARD1目的基因用RT-PCR方法获得,总RNA从60天的成熟水稻叶片中提取,用M-MLV反转录酶(Vazyme,南京)反转录合成cDNA,以其为模板,用OsARD1特异性引物
OsARD1-F: 5’-TTAggtaccTTCCACCCCGCAATCCACAT-3’
和OsARD1-R: 5’-GTTgtcgacGTGCAGGAGCCCAACAAAAC-3’(小写字母部分为酶切位点序列)进行PCR扩增获得 OsARD1完整的ORF(Open Reading Frame)。
PCR扩增程序为:95℃ 1 min;94℃ 30s,62℃ 30s,72℃ 30s,运行35个循环,所用DNA聚合酶为高保真特性的酶(Vazyme,南京)。目的片段凝胶检测正确后进行纯化回收,然后与pCAMBIA2300空载体进行连接,获得重组载体。对重组载体进行酶切及测序验证正确后转入农杆菌(EHA105)中,通过农杆菌的遗传转化法获得OsARD1 过表达转基因植株,同时转入pCAMBIA2300空载体作为对照,转化方法参照Hiei等的转化方法(Hiei et al., 1994)。
1.3 转基因植株的分子检测
待T0代过表达转基因植株在田间长到约60天后,我们对其进行了转基因分子检测。用CTAB法(张凤娟等, 2004)提取叶片基因组DNA,然后用pCAMBIA2300载体中独有的新霉素磷酸转移酶基因(NPTⅡ)对获得的过表达转基因植株进行检测。
所用引物为NPTⅡ-F: 5’-TTCTCACTGAAGCGGGAAGGG-3’
和NPTⅡ-R: 5’-GCGATACCGTAAAGCACCAGG-3’,
PCR扩增程序为:94℃ 4 min;94℃ 30s,57℃ 30s,72℃ 30s,运行30个循环。
1.4 缺水处理及PEG渗透胁迫处理
缺水处理实验,将催芽后的野生型和OsARD1-OV过表达转基因种子种植在营养液里生长,14天的水稻幼苗撤去营养液进行缺水处理,观察记录表型。
对于渗透胁迫实验是将催芽后的种子种在琼脂(Arga)培养基中,将催芽后的野生型和OsARD1-OV过表达转基因种子分别种在含有5% PEG6000(渗透势为-0.05 Mpa)(Michel and Kaufmann et al.,1973)及无PEG6000的Arga培养基中生长,并进行表型观察记录。
渗透胁迫处理及表达分析
渗透胁迫:将营养液中培养的14天大小的野生型幼苗,转入含有20% PEG6000营养液(渗透势为-0.49 Mpa) (Michel and Kaufmann et al.,1973)中进行处理,以在正常营养液中生长的幼苗作为对照,分别提取处理0、6、12、24、48、72小时后处理组和对照组幼苗的总RNA进行表达分析。
非生物胁迫处理后提取总RNA, 经DNaseⅠ进行处理,反转录合成cDNA,利用RT-PCR方法分析不同非生物胁迫处理下目的基因的表达规律。
2 结果与分析
2.1 OsARD1的表达模式分析
为了研究OsARD1在水稻不同器官中的表达,我们分别提取了水稻野生型中花11的茎顶端分生组织(SAM)、根、茎、叶片、叶鞘和不同时期的穗的总 RNA,通过RT-PCR方法分析目的基因的表达。结果显示OsARD1 在各个组织器官中均有表达,但在不同器官中的表达量有明显差异,OsARD1在根和已经成熟开花的幼穗(Panicle 6)中高表达(图1-A),但在其它组织器官中表达量低(图1-A)。我们进一步分析了OsARD1在不同时期水稻叶片中表达情况,结果显示,OsARD1在幼嫩的叶片中表达量较低,在成熟的叶片中表达量稍高,而在124天水稻衰老的叶片中表达量最高(图1-B),表明OsARD1在植株成熟的组织高表达,在植株的衰老期被明显的诱导。
上述时空特异性表达结果表明,OsARD1在衰老的叶片中表达明显提高,这提示我们OsARD1的表达可能受某些环境因素的诱导,因此我们用2周大小的野生型中花11幼苗进行模拟干旱PEG渗透胁迫处理,结果表明OsARD1的表达受到强烈的诱导,在处理6h后OsARD1的表达明显升高,处理12h后达到峰值(图1-C)。上述结果表明 OsARD1的表达明显受PEG渗透胁迫诱导,预示OsARD1可能与水稻的耐旱密切相关。
2.2 OsARD1 过表达载体的构建
从水稻成熟叶片中提取总RNA,反转录获得cDNA后利用RT-PCR的方法获得OsARD1的全长ORF,经琼脂糖凝胶检测后发现目的片段大小与预期相符(图2-B)。将凝胶纯化回收后的目的片段与含有2×35S启动子的空载体pCAMBIA2300经限制性内切酶KpnⅠ 和SalⅠ进行双酶切,利用T4 DNA连接酶16 ℃过夜连接获得重组载体。重组载体经酶切检测,酶切出预期的目的条带(图2-C),表明OsARD1的全长ORF片段已成功的连入过表达空载体中,获得最终的过表达载体(图2-A)。为了进一步确保载体的正确性,我们将构建好的过表达载体进行测序验证后,转入农杆菌中以备后续转基因实验。
2.3 过表达转基因植株的获得及表达分析
利用农杆菌介导的遗传转化方法,将重组载体转入野生型中花11中获得 OsARD1 过表达转基因植株。通过转化获得了6个独立株系共40株T0代转基因植株,经转基因分子检测后发现有37株为转基因阳性植株(图3-A),田间观察过表达转基因植株与空载体对照表型,二者没有明显差异。我们进一步提取了过表达转基因植株的总RNA,用RT-PCR方法分析了6个独立株系的18个转基因植株中目的基因OsARD1的表达,结果表明,OsARD1的表达在不同株系过表达转基因植株中的表达明显提高(图3-B),说明过表达载体在转基因植株中起到了过量表达的作用,正常工作。收获T0代转基因植株种子后,来年我们选取了4个过表达株系在大田里进行种植获得T1代转基因株系,并检测了T1代植株中目的基因的表达情况,发现OsARD1在4个过表达株系中表达量均明显提高(图3-C),进一步表明构建的过表达载体能够正常工作,而且可以稳定的遗传到后代。进一步观察T1代转基因植株的表型,与对照相比,仍未见明显差异(图3-D)。由于OsARD1干旱渗透胁迫的诱导,我们推测OsARD1可能与干旱胁迫相关,因此我们接下来用干旱缺水和PEG模拟干旱处理观察转基因植株的表型。
2.4 过表达OsARD1增强了水稻的抗旱能力
由于OsARD1受机械损伤、干旱及渗透胁迫的诱导,我们推测OsARD1可能与非生物胁迫相关,因此我们用干旱缺水和PEG模拟干旱处理过表达转基因植株及空载体对照转基因植株,观察过表达转基因植株及对照的表型,以揭示OsARD1的可能功能。首先将水培生长的14天的水稻幼苗进行缺水处理,处理1h后,对照植株叶片开始卷曲,而过表达转基因植株没有明显变化,处于正常状态。处理2h后,对照植株叶片已经完全下垂并且皱缩卷曲呈针状,表现出了严重的缺水症状。但是过表达转基因植株生长正常,叶片不仅没有下垂,而且仍处于舒展状态(图4-A),这一结果表明过量表达OsARD1明显增强了水稻抗旱耐缺水能力。此外,我们将催芽后的对照和 OsARD1 过表达转基因种子分别种在含有5% PEG6000及不含PEG6000的琼脂培养基中。处理6天后发现,不含PEG的Arga培养基中对照和过表达的幼苗生长情况没有明显的差别(图4-B),但在PEG处理组中,对照幼苗根的生长受到严重抑制,而过表达植株幼苗根的生长受到的抑制较小,根长明显长于对照植株(图4-B),说明过表达植株对PEG处理的耐受力更强,表明过量表达OsARD1明显提高了水稻对渗透胁迫的耐受能力。
参考文献
以上是本发明所引用的参考文献。
SEQUENCE LISTING
<110> 天津师范大学
<120> 顺式还原酮加双氧酶基因在提高水稻抗旱能力方面的应用
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 600
<212> DNA
<213> 人工序列
<400> 1
atggagaacg aattccagga tggtaagacg gaggtgatag aagcatggta catggatgat 60
agcgaagagg accagaggct tcctcatcac cgcgaaccca aagaattcat tcatgttgat 120
aagcttacag aactaggagt aatcagctgg cgcctaaatc ctgataactg ggagaattgc 180
gagaacctga agagaatccg cgaagccaga ggttactctt atgtggacat ttgtgatgtg 240
tgcccagaga agctgccaaa ttatgaaact aagatcaaga gtttctttga agaacacctg 300
cataccgatg aagaaatacg ctattgtctt gaagggagtg gatactttga tgtgagagac 360
caaaatgatc agtggattcg tatagcactg aagaaaggag gcatgattgt tctgcctgca 420
gggatgtacc accgctttac gttggacacc gacaactata tcaaggcaat gcgactgttt 480
gttggcgatc ctgtttggac accctacaac cgtccccatg accatcttcc tgcaagaaag 540
gagtttttgg ctaaacttct caagtcagaa ggtgaaaatc aagcagttga aggcttctga 600
<210> 2
<211> 199
<212> PRT
<213> 顺式还原酮加双氧酶
<400> 2
Met Glu Asn Glu Phe Gln Asp Gly Lys Thr Glu Val Ile Glu Ala Trp
1 5 10 15
Tyr Met Asp Asp Ser Glu Glu Asp Gln Arg Leu Pro His His Arg Glu
20 25 30
Pro Lys Glu Phe Ile His Val Asp Lys Leu Thr Glu Leu Gly Val Ile
35 40 45
Ser Trp Arg Leu Asn Pro Asp Asn Trp Glu Asn Cys Glu Asn Leu Lys
50 55 60
Arg Ile Arg Glu Ala Arg Gly Tyr Ser Tyr Val Asp Ile Cys Asp Val
65 70 75 80
Cys Pro Glu Lys Leu Pro Asn Tyr Glu Thr Lys Ile Lys Ser Phe Phe
85 90 95
Glu Glu His Leu His Thr Asp Glu Glu Ile Arg Tyr Cys Leu Glu Gly
100 105 110
Ser Gly Tyr Phe Asp Val Arg Asp Gln Asn Asp Gln Trp Ile Arg Ile
115 120 125
Ala Leu Lys Lys Gly Gly Met Ile Val Leu Pro Ala Gly Met Tyr His
130 135 140
Arg Phe Thr Leu Asp Thr Asp Asn Tyr Ile Lys Ala Met Arg Leu Phe
145 150 155 160
Val Gly Asp Pro Val Trp Thr Pro Tyr Asn Arg Pro His Asp His Leu
165 170 175
Pro Ala Arg Lys Glu Phe Leu Ala Lys Leu Leu Lys Ser Glu Gly Glu
180 185 190
Asn Gln Ala Val Glu Gly Phe
195
- 还没有人留言评论。精彩留言会获得点赞!