一种回收片段化降解DNA的方法与流程
本发明涉及一种回收片段化降解DNA的方法,属于分子生物学
技术领域:
。
背景技术:
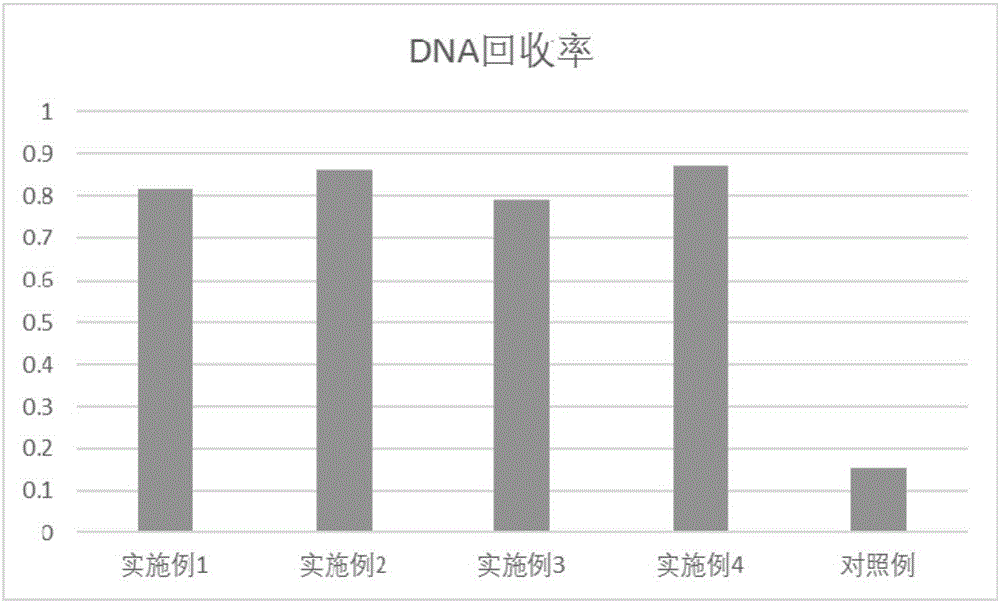
:DNA是人类遗传的物质基础,为了弄清DNA在人类遗传和发育过程中的功能和结构,DNA序列的检测成为了研究DNA最重要的手段。随着对DNA信息的海量需求,二代测序诞生了,该技术基于一项边合成边测序技术,代表公司有Roche(454),Illumina(Solexa),ABI(SOLID)。二代测序技术最基本的技术就是二代测序文库的构建,文库构建起始首先将待测样本的基因组DNA进行破碎和片段化,主要手段有剪切力,超声波,氮气,酶切等。影响DNA片段化最关键的因素在于基因组DNA的完整度,完整度高的DNA会获得较好的效果。然而很多临床样本大多为石蜡包埋样本,近年来也出现了很多穿刺及激光微切割样本,这些样本的DNA量少,降解程度高。使用常规DNA片段化及回收手段处理这类样本时,往往因为降解DNA被片段化后,片段过小导致纯化过程中大幅损失,因此降解DNA的片段化回收率低成为了科研人员对这类样本研究中的瓶颈问题。如何提高降解DNA片段化回收率及尽可能保证DNA片段均一成为亟待解决的问题。技术实现要素:本发明的主要目的在于提供一种回收片段化降解DNA方法,以克服现有技术中的不足。为实现前述发明目的,本发明采用的技术方案包括:本发明实施例提供一种回收片段化降解DNA的方法,其包括以下步骤:在降解DNA的溶液中加入羧基磁珠,使大片段DNA与羧基磁珠结合,而使小片段DNA保留于溶液中,所述大片段DNA的尺寸大于2000bp,所述小片段DNA的尺寸为200bp~2000bp;将结合有大片段DNA的羧基磁珠与包含小片段DNA的溶液分离;使大片段DNA与羧基磁珠分离,再对大片段DNA进行片段化处理,直至形成小片段DNA;回收所述包含小片段DNA的溶液中的小片段DNA以及由大片段DNA经片段化处理形成的小片段DNA。在一些实施方案中,所述一种回收片段化降解DNA的方法包括以下步骤:(1)取降解DNA溶于水,形成降解DNA溶液;(2)向降解DNA溶液中加入羧基磁珠,混合均匀后,在室温下孵育,使羧基磁珠与大片段DNA充分结合;(3)利用磁场作用使羧基磁珠沉降,直至混合液澄清,再分离出羧基磁珠,并收集包含小片段DNA的澄清液;(4)对羧基磁珠进行清洗;(5)将羧基磁珠室温干燥后,以洗脱液进行洗脱,并在室温下放置;(6)利用磁场作用使步骤(5)所获洗脱混合液达到澄清,再将澄清溶液分离出;(7)将步骤(6)分离出的澄清溶液转移至片段化仪中进行片段化处理,使其中的大片段DNA被打断为小片段DNA;(8)将步骤(7)所获的含小片段DNA的溶液与步骤(3)所获的包含小片段DNA的澄清液合并;(9)从步骤(8)最终所获的含小片段DNA的溶液中分离出小片段DNA。在一些实施方案中,所述降解DNA的溶液中降解DNA的浓度为1ug/30uL~1ug/150uL。在一些实施方案中,将羧基磁珠加入降解DNA的溶液中,步骤(2)包括:将羧基磁珠加入降解DNA的溶液中,混合均匀后在室温下孵育5min-20min,使羧基磁珠与其中的大片段DNA充分结合。其中,所述羧基磁珠为5mg/mL,用量为20uL-100uL。在一些实施方案中,步骤(4)包括:以浓度为80v/v%的乙醇溶液对羧基磁珠进行清洗。在一些实施方案中,步骤(5)包括:将羧基磁珠在室温下干燥1min-10min,之后加入洗脱液进行洗脱。在一些实施方案中,将与降解DNA的大片段结合的羧基磁珠置于Covaris片段化仪中进行片段化处理至降解DNA的小片段。在一些实施方案中,所述的回收片段化降解DNA的方法,其特征在于,步骤(9)包括:将步骤(8)最终所获的含小片段DNA的溶液与磷酸盐缓冲液均匀混合后加入离心柱;向所述离心柱中加入PE缓冲液,清洗离心柱;将空的离心柱放置入离心机中全速离心2min,,并室温晾干;向离心柱中加入洗脱液,洗脱小片段DNA。所述洗脱液为浓度为3mM-15mM的Tris缓冲盐溶液,其pH值为7.3-8.5。在一些实施方案中,所述试剂I的配置方法为:取3mM-15mMTris缓冲液溶于超纯水中,之后用HCl溶液调节溶液的pH值为7.3-8.5。在一些实施方案中,将与降解DNA的大片段结合的羧基磁珠中进行清洗处理后,在室温下干燥1min-10min,之后加入30uL-80uL的试剂I。在一些实施方案中,待小片段DNA全部从离心柱中分离后,向离心柱中加入体积为15uL-80uL的试剂I,在20℃-70℃条件下洗脱所述离心柱。在一些实施方案中,步骤(9)中采用的洗脱温度为20℃-70℃。在一些实施方案中,步骤(9)中采用的洗脱缓冲液用量为100uL。在一些实施方案中,所述缓冲液包括缓冲液PB(德国凯杰),所述缓冲液的用量为0.5mL-3mL。与现有技术相比,本发明的优点包括:本发明提供的回收片段化降解DNA方法大大提高了片段化降解DNA纯化回收率,较现有的DNA片段化回收方法而言,设计了针对降解DNA的片段化回收方法,为该类样本用于下游分子生物学研究提供了有效保障,且该方法所用试剂成分简单,操作方便,成本低廉,不需特殊设备,并能提高片段化降解DNA回收率。附图说明图1是本发明实施例1~实施例4以及对比例中DNA用量对比图。图2是本发明实施例1~实施例4以及对比例中DNA回收率对比图。具体实施方式鉴于现有技术中的不足,本案发明人经长期研究和大量实践,得以提出本发明的技术方案。如下将对该技术方案、其实施过程及原理等作进一步的解释说明。本发明实施例提供一种回收片段化降解DNA的方法,其包括以下步骤:在降解DNA的溶液中加入羧基磁珠,使大片段DNA与羧基磁珠结合,而使小片段DNA保留于溶液中,所述大片段DNA的尺寸大于2000bp,所述小片段DNA的尺寸为200bp~2000bp;将结合有大片段DNA的羧基磁珠与包含小片段DNA的溶液分离;使大片段DNA与羧基磁珠分离,再对大片段DNA进行片段化处理,直至形成小片段DNA;回收所述包含小片段DNA的溶液中的小片段DNA以及由大片段DNA经片段化处理形成的小片段DNA。在一些实施方案中,所述一种回收片段化降解DNA的方法包括以下步骤:(1)取降解DNA溶于水,形成降解DNA溶液;(2)向降解DNA溶液中加入羧基磁珠,混合均匀后,在室温下孵育,使羧基磁珠与大片段DNA充分结合;(3)利用磁场作用使羧基磁珠沉降,直至混合液澄清,再分离出羧基磁珠,并收集包含小片段DNA的澄清液;(4)对羧基磁珠进行清洗;(5)将羧基磁珠室温干燥后,以洗脱液进行洗脱,并在室温下放置;(6)利用磁场作用使步骤(5)所获洗脱混合液达到澄清,再将澄清溶液分离出;(7)将步骤(6)分离出的澄清溶液转移至片段化仪中进行片段化处理,使其中的大片段DNA被打断为小片段DNA;(8)将步骤(7)所获的含小片段DNA的溶液与步骤(3)所获的包含小片段DNA的澄清液合并;(9)从步骤(8)最终所获的含小片段DNA的溶液中分离出小片段DNA。在一些实施方案中,所述降解DNA的溶液中降解DNA的浓度为1ug/30uL~1ug/150uL。在一些实施方案中,将羧基磁珠加入降解DNA的溶液中,步骤(2)包括:将羧基磁珠加入降解DNA的溶液中,混合均匀后在室温下孵育5min-20min,使羧基磁珠与其中的大片段DNA充分结合。其中,所述羧基磁珠的用量为20uL-100uL。在一些实施方案中,步骤(4)包括:以浓度为80v/v%的乙醇溶液对羧基磁珠进行清洗。在一些实施方案中,步骤(5)包括:将羧基磁珠在室温下干燥1min-10min,之后加入洗脱液进行洗脱。在一些实施方案中,所述的回收片段化降解DNA的方法,其特征在于,步骤(9)包括:将步骤(8)最终所获的含小片段DNA的溶液与磷酸盐缓冲液均匀混合后加入离心柱;向所述离心柱中加入PE缓冲液,清洗离心柱;将空的离心柱放置入离心机中全速离心2min,并室温晾干;向离心柱中加入洗脱液,洗脱小片段DNA。所述洗脱液为浓度为3mM-15mM的Tris缓冲盐溶液,其pH值为7.3-8.5。在一些实施方案中,所述试剂I的配置方法为:取3mM-15mMTris缓冲液溶于超出水中,之后用HCl溶液调节溶液的pH值为7.3-8.5。在一些实施方案中,将与降解DNA的大片段结合的羧基磁珠中进行清洗处理后,在室温下干燥1min-10min,之后加入30uL-80uL的试剂I。在一些实施方案中,步骤(9)中采用的洗脱温度为20℃-70℃。在一些实施方案中,步骤(9)中采用的蛋白酶K用量为100uL。在一些实施方案中,所述缓冲液包括缓冲液PB,所述缓冲液的用量为0.5mL-3mL。在一些实施方案中,将与降解DNA的大片段结合的羧基磁珠置于Covaris片段化仪中进行片段化处理至降解DNA的小片段。在一些实施方案中,待小片段DNA全部从离心柱中分离后,向离心柱中加入体积为15uL-80uL的试剂I,在20℃-70℃条件下洗脱所述离心柱。在一些实施方案中,所述回收片段化降解DNA的方法具体包括以下步骤:(1)取1ug降解DNA补水至合适体积。(2)向DNA中加入一定体积的羧基磁珠,混匀后室温放置合适时间。(3)混合液放置磁力架上至澄清,转移上清至新的1.5mL离心管中。(4)向羧基磁珠中加入新鲜配置的80%乙醇,清洗2次。(5)室温干燥一段时间后,加入适当体积的溶液I进行洗脱,并放置室温适当时间。(6)洗脱混合液放置磁力架上至澄清,转移上清至新的1.5mL离心管中。(7)将上一步中的离心管转移至Covaris片段化仪中进行片段化。(8)将打断后的DNA转移至步骤(3)中的离心管中,充分混匀。(9)向混合后的DNA液中加入适当体积的缓冲液PB,充分混匀后,加入MinEluteColumn中。(10)向MinEluteColumn中加入缓冲液PE,清洗离心柱。(11)空离离心柱,并室温晾干。(12)向离心柱中加入溶液I,洗脱DNA。所述步骤(1)中加水至适合体积为30uL-150uL。所述步骤(2)中羧基磁珠用量为20uL-100uL,孵育时间为5min-20min。所述步骤(5)中室温干燥时间为1min-10min。所述步骤(5)中试剂I的pH为7.3-8.5,溶剂是超纯水,溶质为如下终浓度物质:Tris3mM-15mM,加HCl调节pH值。所述步骤(5)中试剂I的加入体积为30uL-80uL。所述步骤(9)中加入的缓冲液PB体积为0.5mL-3mL。所述步骤(12)中试剂I的加入体积为15uL-80uL,洗脱温度为20℃-70℃。更适宜的是,所述步骤(12)中,蛋白酶K用量为100uL。优选的,所述步骤(1)中加水至体积为100uL。优选的,所述步骤(2)中羧基磁珠用量为60uL,孵育时间为10min。优选的,所述步骤(5)中室温干燥时间为3min。优选的,所述步骤(5)中试剂I的pH为8.0,溶剂是超纯水,溶质为如下终浓度物质:Tris10mM,加HCl调节pH值。优选的,其中所述步骤(5)中试剂I的加入体积为50uL。优选的,其中所述步骤(9)中加入的缓冲液PB体积为1.1mL。优选的,其中所述步骤(12)中试剂I的加入体积为30uL,洗脱温度为55℃。本发明提供的回收片段化降解DNA方法大大提高了片段化降解DNA纯化回收率,为该类样本用于下游分子生物学研究提供了有效保障。本发明的一种高效回收片段化降解DNA方法,只需使用市面现有羧基磁珠试剂和PCR纯化试剂,材料来源简单,操作难度低,无需专门技术培训及特殊仪器设备。以下结合附图和若干实施例及对比例对本发明的技术方案作进一步的解释说明。本发明将根据具体事例做进一步的描述,但其仅为例证性的目的,并非用以限制本发明。在对实例描述前,有必要提供一些备注说明:采用不同厂家、不同批次的试剂会造成实验结果的差异,属于正常现象。在进行小规模实验室,为保证平行实验间的重复性,建议配置试剂后,充分混匀并分装,以保证每次实验试剂的均一性。实施例1试剂准备:羧基磁珠AmpureXPBeads(Beckman),分离柱QiaAmpMinEluteColumn(Qiagen),缓冲液PB(Qiagen),缓冲液PE(Qiagen),无水乙醇(国药),QubitdsDNAHSAssay(LifeTechnologies)。试剂I:pH为8.0,溶剂为超纯水,溶质包含以下终浓度物质,Tris缓冲液10mM(国药),HCl溶液调节pH用。实验操作过程:(1)取1ug降解DNA补水至100uL;(2)向步骤(1)降解DNA中加入60uLAmpureXPBeads,混匀后室温放置10min;(3)混合液放置磁力架上至澄清,转移上层清液至1.5mL离心管中;(4)向步骤(3)中下层混合液中加入新鲜配置的80wt%乙醇溶液,清洗2次;(5)室温3min,加入50uL试剂I进行洗脱,并放置室温3min;(6)洗脱混合液放置磁力架上至澄清,转移上清至新的1.5mL离心管中。(7)将步骤(6)中的离心管转移至Covaris片段化仪中进行片段化,片段化条件如下:Intensity4DutyCycle10%CycleperBurst200TreatmentTime(s)30(8)将步骤(7)打断后的DNA转移至步骤(3)中的离心管中,并充分混匀。(9)向步骤(8)中混合后的DNA液中加入1.1mL缓冲液PB,充分混匀后,加入MinEluteColumn中,放入离心机中8000rpm离心30s,反复该步骤至全部DNA液全部通过MinEluteColumn。(10)向MinEluteColumn中加入700uL缓冲液PE,清洗离心柱2次。(11)空离离心柱,并室温晾干3min。(12)向MinEluteColumn中心加入试剂I30uL,55℃孵育5min,离心得到终产物。最后测得终产物浓度为:27.2ng/ul。实施例2试剂准备:羧基磁珠AmpureXPBeads(Beckman),分离柱QiaAmpMinEluteColumn(Qiagen),缓冲液PB(Qiagen),缓冲液PE(Qiagen),无水乙醇(国药),QubitdsDNAHSAssay(LifeTechnologies)。试剂I:pH为8.0,溶剂为超纯水,溶质包含以下终浓度物质,Tris缓冲液10mM(国药),HCl溶液调节pH用。实验操作过程:(1)取1ug降解DNA补水至100uL;(2)向步骤(1)降解DNA中加入60uLAmpureXPBeads,混匀后室温放置10min;(3)混合液放置磁力架上至澄清,转移上层清液至1.5mL离心管中;(4)向步骤(3)中下层混合液中加入新鲜配置的80wt%乙醇溶液,清洗2次;(5)室温3min,加入50uL试剂I进行洗脱,并放置室温3min;(6)洗脱混合液放置磁力架上至澄清,转移上清至新的1.5mL离心管中。(7)将步骤(6)中的离心管转移至Covaris片段化仪中进行片段化,片段化条件如下:Intensity4DutyCycle10%CycleperBurst200TreatmentTime(s)30(8)将步骤(7)打断后的DNA转移至步骤(3)中的离心管中,并充分混匀。(9)向步骤(8)中混合后的DNA液中加入1.1mL缓冲液PB,充分混匀后,加入MinEluteColumn中,放入离心机中8000rpm离心30s,反复该步骤至全部DNA液全部通过MinEluteColumn。(10)向MinEluteColumn中加入700uL缓冲液PE,清洗离心柱2次。(11)空离离心柱,并室温晾干3min。(12)向MinEluteColumn中心加入试剂I30uL,55℃孵育5min,离心得到终产物。最后测得终产物浓度为:28.8ng/ul。实施例3试剂准备:羧基磁珠AmpureXPBeads(Beckman),分离柱QiaAmpMinEluteColumn(Qiagen),缓冲液PB(Qiagen),缓冲液PE(Qiagen),无水乙醇(国药),QubitdsDNAHSAssay(LifeTechnologies)。试剂I:pH为8.0,溶剂为超纯水,溶质包含以下终浓度物质,Tris缓冲液10mM(国药),HCl溶液调节pH用。实验操作过程:(1)取1ug降解DNA补水至100uL;(2)向步骤(1)降解DNA中加入60uLAmpureXPBeads,混匀后室温放置10min;(3)混合液放置磁力架上至澄清,转移上层清液至1.5mL离心管中;(4)向步骤(3)中下层混合液中加入新鲜配置的80wt%乙醇溶液,清洗2次;(5)室温3min,加入50uL试剂I进行洗脱,并放置室温3min;(6)洗脱混合液放置磁力架上至澄清,转移上清至新的1.5mL离心管中。(7)将步骤(6)中的离心管转移至Covaris片段化仪中进行片段化,片段化条件如下:Intensity4DutyCycle10%CycleperBurst200TreatmentTime(s)30(8)将步骤(7)打断后的DNA转移至步骤(3)中的离心管中,并充分混匀。(9)向步骤(8)中混合后的DNA液中加入1.1mL缓冲液PB,充分混匀后,加入MinEluteColumn中,放入离心机中8000rpm离心30s,反复该步骤至全部DNA液全部通过MinEluteColumn。(10)向MinEluteColumn中加入700uL缓冲液PE,清洗离心柱2次。(11)空离离心柱,并室温晾干3min。(12)向MinEluteColumn中心加入试剂I30uL,55℃孵育5min,离心得到终产物。最后测得终产物浓度为:26.3ng/ul。实施例4试剂准备:羧基磁珠AmpureXPBeads(Beckman),分离柱QiaAmpMinEluteColumn(Qiagen),缓冲液PB(Qiagen),缓冲液PE(Qiagen),无水乙醇(国药),QubitdsDNAHSAssay(LifeTechnologies)。试剂I:pH为8.0,溶剂为超纯水,溶质包含以下终浓度物质,Tris缓冲液10mM(国药),HCl溶液调节pH用。实验操作过程:(1)取1ug降解DNA补水至100uL;(2)向步骤(1)降解DNA中加入60uLAmpureXPBeads,混匀后室温放置10min;(3)混合液放置磁力架上至澄清,转移上层清液至1.5mL离心管中;(4)向步骤(3)中下层混合液中加入新鲜配置的80wt%乙醇溶液,清洗2次;(5)室温3min,加入50uL试剂I进行洗脱,并放置室温3min;(6)洗脱混合液放置磁力架上至澄清,转移上清至新的1.5mL离心管中。(7)将步骤(6)中的离心管转移至Covaris片段化仪中进行片段化,片段化条件如下:Intensity4DutyCycle10%CycleperBurst200TreatmentTime(s)30(8)将步骤(7)打断后的DNA转移至步骤(3)中的离心管中,并充分混匀。(9)向步骤(8)中混合后的DNA液中加入1.1mL缓冲液PB,充分混匀后,加入MinEluteColumn中,放入离心机中8000rpm离心30s,反复该步骤至全部DNA液全部通过MinEluteColumn。(10)向MinEluteColumn中加入700uL缓冲液PE,清洗离心柱2次。(11)空离离心柱,并室温晾干3min。(12)向MinEluteColumn中心加入试剂I30uL,55℃孵育5min,离心得到终产物。最后测得终产物浓度为:29.1ng/ul。对比例试剂准备:羧基磁珠QiaAmpMinEluteColumn(Qiagen),缓冲液PB(Qiagen),缓冲液PE(Qiagen),缓冲液EB(Qiagen),QubitdsDNAHSAssay(LifeTechnologies)。实验操作过程:(1)取1ug降解DNA补水至50uL,并转移至Covaris片段化仪中进行片段化,片段化条件如下:Intensity4DutyCycle10%CycleperBurst200TreatmentTime(s)30(2)向打断后的DNA液中加入250uL缓冲液PB,充分混匀后,加入MinEluteColumn中,放入离心机中8000rpm离心30s,反复该步骤至全部DNA液全部通过MinEluteColumn。(3)向MinEluteColumn中加入700uL缓冲液PE,清洗离心柱2次。(4)空离离心柱,并室温晾干3min。(5)向MinEluteColumn中心加入缓冲液EB30uL,55℃孵育5min,离心得到终产物。最后测得终产物浓度为:5.2ng/ul。从图1和图2的附图可以看出,本发明使用的一种高效回收片段化降解DNA的方法所用试剂成分简单,操作方便,成本低廉,不需特殊设备,可针对降解DNA提高片段化回收率,回收率远远高于现有的DNA片段化回收率。因此,本发明可有效提高降解DNA提高片段化回收率,大大改善科研人员在处理降解DNA进行下游分子生物研究时所遭遇的问题。应当理解,上述实施例仅为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1