制备主要组织相容性复合物基因修饰小鼠的方法与流程
相关申请的交叉引用
本申请为申请日为2012年10月26日,申请号为201280060540.8的中国申请的分案申请。原申请要求申请日为2011年10月28日的美国临时专利申请号61/552,582和61/552,587以及申请日为2012年9月14日的美国临时专利申请号61/700,908的优先权,其全部内容通过引用并入本申请。
本发明涉及基因修饰的非人动物例如啮齿动物(例如小鼠或大鼠),其表达人源或人源化的主要组织相容性复合物(mhc)i类分子。本发明还涉及基因修饰的非人动物,例如小鼠或大鼠,其表达人源或人源化的mhci蛋白(例如mhciα链)和/或人源或人源化的β2微球蛋白;及表达人源或人源化的mhci蛋白(例如mhciα链)和/或人源或人源化的β2微球蛋白的胚胎、组织和细胞。本发明进一步提供了一种制备基因修饰的非人动物的方法,所述动物表达人源或人源化的mhci类蛋白(例如mhciα链)和/或β2微球蛋白。本发明还提供了一种在体外人源化细胞免疫系统或基因修饰的非人动物中鉴定和评估肽的方法,以及修饰非人动物例如小鼠或大鼠的mhci和/或β2微球蛋白基因座以表达人源或人源化的mhci和/或β2微球蛋白的方法。
背景技术:
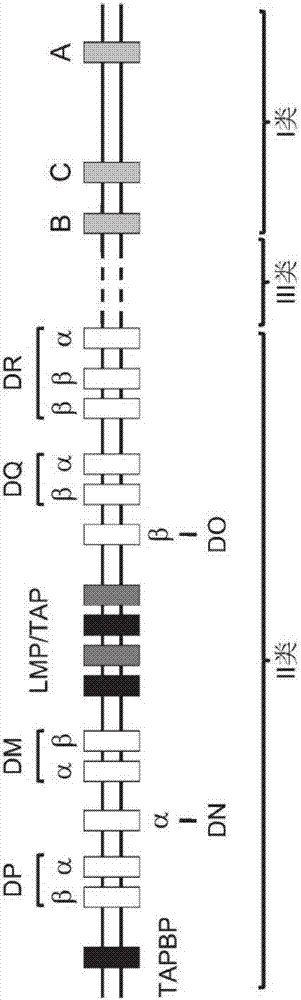
在适应性免疫应答中,通过b淋巴细胞(例如免疫球蛋白)和t淋巴细胞(例如t细胞受体或tcr)上的受体分子识别外来抗原。这些外来抗原在细胞表面上以特定蛋白的肽片段递呈,通常将其称为主要组织相容性复合物(mhc)分子。mhc分子由多个基因座编码,已发现其为跨距约4mb的连锁的基因簇。在小鼠中,mhc基因位于17号染色体上,并且由于历史原因被称为组织相容性2(h-2)基因。在人中,该基因位于6号染色体上,被称为人白细胞抗原(hla)基因。在小鼠和人中,所述基因座是多基因的,其包括三个在人和小鼠基因组中具有相似构造的高多态性类型的mhc基因(i、ii和iii类)(分别参见图2和图3)。
mhc基因座在基因组中显示出最高的多态性;一些基因通过>300个等位基因代表(例如人hla-drβ和人hla-b)。全部i类和ii类mhc基因均能递呈为肽片段,但是各基因表达具有不同结合特性的蛋白,这反映了多态性和等位基因变体。在免疫应答过程中任何具有独特肽片段范围的给定个体均能够递呈被递呈至b和t细胞的细胞表面。
人与小鼠均具有i类mhc基因(参见图2和图3)。在人中,经典的i源基因被称为hla-a、hla-b和hla-c,而在小鼠中被称为h-2k、h-2d和h-2l。i类分子由两条链组成:多态性的α-链(有时被称为重链)和被称为β2-微球蛋白的较小的链(也被称为轻链),其通常不具有多态性(图1)。这两条链在细胞表面上形成非共价的异源二聚体。所述α-链包含三个结构域(α1、α2和α3)。α链基因的外显子1编码先导序列,外显子2和3编码α1和α2结构域,外显子4编码α3结构域,外显子5编码跨膜结构域,而外显子6和7编码胞质尾区。α-链形成含有α1和α2结构域的肽结合缝隙(类似于ig-样结构域)接着为类似于β2-微球蛋白的α3结构域。
β2微球蛋白是一种非糖基化的12kda蛋白;其功能之一在于稳定mhci类α-链。与α-链不同,所述β2微球蛋白不跨膜。所述人源β2微球蛋白的基因座在15号染色体上,而鼠源的基因座在2号染色体上。β2微球蛋白的基因由4个外显子和3个内含子组成。循环形式的β2微球蛋白存在于血清、尿液和其他体液中;因此,非共价mhci结合的β2微球蛋白在生理条件下能够与循环β2微球蛋白进行交换。
i类mhc分子在所有有核细胞中表达,包括肿瘤细胞。其特异性地在t和b淋巴细胞、巨噬细胞、树突状细胞和中性粒细胞以及其他细胞上表达并且其功能为在cd8+细胞毒性t淋巴细胞(ctl)表面展示肽片段(长度通常为8-10个氨基酸)。ctl通过其自身的膜结合tcr特异性地杀伤携带mhci结合肽的任意细胞。当细胞展示非正常存在的细胞蛋白来源的肽(例如病毒、肿瘤或其他非自身来源)时,这种肽被ctl所识别,ctl被激活并杀伤展示该肽的细胞。
通常,由于存在耐受机制,递呈正常(即自身)蛋白在mhci分子环境下的递呈不会引发ctl的激活。然而,在一些疾病(例如癌症、自身免疫性疾病)中来源于自身蛋白的肽成为免疫系统的靶细胞成分,结果导致递递呈这种肽的细胞受到破坏。尽管在识别一些激发细胞免疫应答的自身来源抗原(例如与多种癌症相关的抗原)的方面已有进展,但是为了改进通过mhci类分子被人ctl所识别的肽的鉴定,仍需要体内和体外系统来模拟人源细胞免疫系统的各个方面。模拟人源细胞免疫系统的系统可用于鉴定与疾病相关的抗原从而开发人体治疗产品例如疫苗和其他生物制品。在人源免疫系统中评估抗原识别的系统能够辅助鉴定对治疗有用的ctl群(例如对研究和防治人类疾病是有用的)。这种系统还能够辅助增强人ctl群的活性以便更有效地对抗感染和携带外来抗原的实体。因此,需要一种能够产生免疫系统的生物系统(例如基因改造的动物),所述免疫系统展示模拟人免疫系统功能的组分。
发明概述
本申请提供了一种用于产生或鉴定肽的生物系统,所述的肽与mhci类蛋白及其嵌合体相联,并且与cd8+t细胞结合。本申请提供了一种非人动物,其包含表达在细胞免疫应答中具有功能的人源或人源化的分子的非人细胞。本申请还提供了编码人源或人源化的mhci和β2微球蛋白的人源化的啮齿动物基因座。本申请还提供了表达人源或人源化的mhci和β2微球蛋白的人源化的啮齿动物细胞。本申请提供了包含人源化的啮齿动物细胞的体内和体外系统,其中所述啮齿动物细胞表达一个或多个人源或人源化的免疫系统分子。
本申请提供了一种非人动物例如啮齿动物(例如小鼠或大鼠),在其基因组中包含编码人源/非人源(例如人/啮齿动物,例如人/小鼠或人/大鼠)嵌合mhci多肽的核苷酸序列,其中所述嵌合多肽的人源部分包含人mhci多肽的胞外结构域。具体的说,本发明提供了一种非人动物,其在内源性mhci基因座包含编码人源/非人源嵌合mhci多肽的核苷酸序列,其中所述嵌合多肽的人源部分包含人mhci多肽的胞外结构域,并且其中所述动物表达人源/非人源嵌合mhci多肽。在一个方面,所述动物在内源性非人源mhci基因座不表达内源性非人源mhci多肽的胞外结构域。在本发明的一个方面,所述非人动物(例如啮齿动物,例如小鼠或大鼠)包含两个拷贝的mhci基因座,其中包含编码人源/非人源(例如人/啮齿动物,例如人/小鼠或人/大鼠)嵌合mhci多肽的核苷酸序列。在本发明的另一个方面,所述动物包含一个拷贝的mhci基因座,其中包含编码人源/非人源嵌合mhci多肽的核苷酸序列。因此,所述动物针对包含编码人源/非人源嵌合mhci多肽的核苷酸序列的mhci基因座可以是纯合子或杂合子。在不同的实施方式中,编码人源/非人源嵌合mhci多肽的核苷酸序列被包含在非人动物(例如啮齿动物,例如大鼠或小鼠)的生殖细胞中。
在一个方面,所述编码人源/非人源嵌合mhci的核苷酸序列可操作地与内源性非人源调控元件连接,例如启动子、增强子、沉默子等。在一个实施方式中,所述嵌合多肽的人源部分包含人先导序列。在另一个实施方式中,所述嵌合多肽的人源部分包含人mhci多肽的α1、α2和α3结构域。所述人mhci多肽可以选自以下组:hla-a、hla-b和hla-c。在一个实施方式中,所述人mhci多肽是hla-a2多肽,例如hla-a2.1多肽。
在一个方面,所述基因改造的非人动物是啮齿动物。在一个实施方式中,所述啮齿动物是小鼠。因此,在一个实施方式中,所述内源性非人源的基因座是小鼠基因座,例如小鼠h-2k、h-2d或h-2l基因座。在一个实施方式中,所述人源/非人源嵌合mhci多肽的非人源部分包含内源性非人源mhci多肽的跨膜和胞质结构域。因此,在一个实施方式中,其中所述非人动物是小鼠,所述内源性非人源mhci基因座可以是h-2k基因座(例如h-2kb基因座)以及所述内源性非人源hmci多肽可以是h-2k多肽;因此,所述人源/非人源嵌合mhci多肽可以包含h-2k多肽的跨膜和胞质结构域。在另一个实施方式中,其中所述非人动物是小鼠,所述内源性非人源mhci基因座可以是h-2d基因座以及所述内源性非人源mhci多肽可以是h-2d多肽;因此,所述人源/非人源嵌合mhci多肽可以包含h-2d多肽的跨膜和胞质结构域。类似地,在另一个实施方式中,所述内源性非-mhci基因座可以是h-2l基因座且所述内源性非人源mhci多肽可以是h-2l多肽;因此,人源/非人源嵌合mhci多肽可以包含h-2l多肽的跨膜和胞质结构域。
本申请还提供了在内源性h-2k基因座包含编码人源/小鼠嵌合mhci多肽的核苷酸序列的小鼠,其中所述嵌合多肽的人源部分包含人hla-a(例如hla-a2)多肽的胞外结构域和小鼠部分包含小鼠h-2k多肽的跨膜和胞质结构域,并且其中所述小鼠表达人源/小鼠嵌合mhci多肽。在一些实施方式中,所述小鼠不表达来自内源性h-2k基因座的小鼠h-2k多肽胞外结构域。在一个方面,编码人源/小鼠嵌合mhci多肽的核苷酸序列可操作地与内源性小鼠调控元件连接。所述嵌合多肽的人源部分可以包含人先导序列。其还可以包含人mhci多肽的α1、α2和α3结构域。所述人mhci多肽可以是hla-a多肽,例如hla-a2.1多肽。在一个方面,所述小鼠h-2k基因座是h-2kb基因座。
本发明的另一个方面涉及一种非人动物例如啮齿动物(例如小鼠或大鼠),在所述动物的基因组中包含编码人源或人源化β2微球蛋白多肽的核苷酸序列。因此,本申请提供了一种非人动物,所述动物在内源性非人源β2微球蛋白基因座包含编码人源或人源化β2微球蛋白多肽的核苷酸序列,其中所述动物表达人源或人源化β2微球蛋白多肽。在一个方面,所述动物不表达来自内源性非人源β2微球蛋白基因座的功能性内源性非人源β2微球蛋白多肽。在一个方面,所述动物包含两个拷贝的编码人源或人源化β2微球蛋白多肽的β2微球蛋白基因座;在另一个实施方式中,所述动物包含一个拷贝的编码人源或人源化β2微球蛋白多肽的β2微球蛋白基因座。因此,所述动物针对编码人源或人源化β2微球蛋白多肽的β2微球蛋白基因座可以是纯合子或杂合子。在多种实施方式中,编码人源或人源化β2微球蛋白多肽的核苷酸序列被包含在所述非人动物(例如啮齿动物,例如大鼠或小鼠)的生殖细胞中。在一个实施方式中,编码人源或人源化β2微球蛋白多肽的核苷酸序列包含编码含有人β2微球蛋白氨基酸序列的多肽的核苷酸序列。在一个实施方式中,所述多肽能够与mhci蛋白结合。
在一些实施方式中,编码所述人源或人源化β2微球蛋白多肽的核苷酸序列可操作地与内源性非人源β2微球蛋白调控元件连接。在一个方面,编码所述人源或人源化β2微球蛋白多肽的核苷酸序列包含人源β2微球蛋白基因外显子2至外显子4中所示的核苷酸序列。在另一个方面,编码所述人源或人源化β2微球蛋白多肽的核苷酸序列包含人β2微球蛋白基因外显子2、3和4中所示的核苷酸序列。在进一步的实施方式中,所述核苷酸序列还包括非人源β2微球蛋白基因外显子1中所示的核苷酸序列。在一些实施方式中,所述非人动物是啮齿动物(例如小鼠或大鼠);因此,所述非人源β2免疫球蛋白基因座是啮齿动物(例如小鼠或大鼠)β2免疫球蛋白基因座。
本申请还提供了一种小鼠,所述小鼠在内源性β2微球蛋白基因座包含编码人源或人源化β2微球蛋白多肽的核苷酸序列,其中所述小鼠表达所述人源或人源化的β2微球蛋白多肽。在一些实施方式中,所述小鼠不表达来自内源性β2微球蛋白基因座的功能性内源性小鼠β2微球蛋白。所述核苷酸序列可以与内源性小鼠调控元件连接。在一个方面,所述核苷酸序列包含人β2微球蛋白基因外显子2至外显子4中所示的核苷酸序列。或者,编码所述人源或人源化β2微球蛋白多肽的核苷酸序列可以包含人β2微球蛋白基因外显子2、3和4中所示的核苷酸序列。编码人源或人源化β2微球蛋白多肽的核苷酸序列可以进一步包含小鼠β2微球蛋白基因外显子1的核苷酸序列。在一个实施方式中,编码人源或人源化β2微球蛋白多肽的核苷酸序列可以包含编码含有人源β2微球蛋白氨基酸序列的多肽的核苷酸序列。在一个实施方式中,所述多肽能够与mhci蛋白结合。
本发明进一步包含一种非人动物(例如啮齿动物,例如小鼠或大鼠),所述动物在其基因组中包含编码人源/非人源嵌合mhci多肽的核苷酸序列以及编码人源或人源化β2微球蛋白多肽的核苷酸序列。在一个实施方式中,本发明提供了一种非人动物,所述动物在其基因组中包含编码人源/非人源mhci多肽的第一核苷酸序列,其中所述嵌合多肽的人源部分包含人mhci多肽的胞外结构域;以及编码人源或人源化β2微球蛋白多肽的第二核苷酸序列,其中所述第一核苷酸序列位于内源性非人源mhci基因座,和所述第二核苷酸序列位于内源性非人源β2微球蛋白基因座,并且其中所述动物表达人源/非人源嵌合mhci多肽和人源或人源化β2微球蛋白多肽。在一个方面,所述动物是小鼠。因此,所述内源性mhci基因座可以选自下组:h-2k、h-2d和h-2l基因座。在一个实施方式中,所述内源性小鼠基因座是h-2k基因座(例如h-2kb基因座)。在一个实施方式中,所述人mhci多肽选自以下组:hla-a、hla-b和hla-c多肽。在一个方面,所述人mhci多肽是hla-a,例如hla-a2(例如hla-a2.1)。在多种实施方式中,所述第一和第二核苷酸序列被包含在所述非人动物(例如啮齿动物,例如小鼠或大鼠)的生殖细胞中。
因此,本发明提供了一种小鼠,所述小鼠在其基因组中包含编码人源/小鼠嵌合mhci多肽的第一核苷酸序列,其中所述嵌合多肽的人源部分包含人hla-a(例如hla-a2)的胞外结构域和小鼠部分包含小鼠h-2k的跨膜和胞质结构域;以及编码人源或人源化β2微球蛋白多肽的第二核苷酸序列,其中所述第一核苷酸序列位于内源性h-2k基因座和所述第二核苷酸序列位于内源性小鼠β2免疫球蛋白基因座,以及其中所述小鼠表达人源/小鼠嵌合mhci多肽和人源或人源化β2微球蛋白多肽。在一个实施方式中,包含嵌合mhci多肽和人源或人源化β2微球蛋白多肽的所述非人动物(例如所述小鼠)在其各自的内源性基因座不表达内源性非人源mhci多肽(例如小鼠h-2k多肽)的胞外结构域和/或功能性内源性非人源(例如小鼠)β2微球蛋白多肽。在一个方面,所述动物(例如所述小鼠)分别包含两个拷贝的第一和第二核苷酸序列。在另一个方面,所述动物(例如所述小鼠)包含一个拷贝的第一和一个拷贝的第二核苷酸序列。因此,所述动物针对第一和第二核苷酸序列都可以是纯合子或杂合子。
在一个方面,所述第一核苷酸序列可操作地与内源性非人源(例如小鼠)mhci调控元件连接,并且所述第二核苷酸序列可操作地与内源性非人源(例如小鼠)β2微球蛋白元件连接。所述嵌合多肽的人源部分可以包含人源mhci多肽的1、2和3结构域。所述第二核苷酸序列可以包含人β2微球蛋白基因外显子2至外显子4中所示的核苷酸序列。或者,所述第二核苷酸序列可以包含人β2微球蛋白基因外显子2、3和4中所示的核苷酸序列。在一个方面,包含嵌合mhci多肽和人源或人源化β2微球蛋白多肽的所述小鼠可以是这样的,与不表达人源或人源化β2微球蛋白多肽时人源/小鼠嵌合mhci多肽的表达情况相比,人源或人源化β2微球蛋白的表达使得人源/小鼠嵌合mhci多肽的表达量增加。
本发明还提供了一种制备本申请所述的基因改造的非人动物(例如啮齿动物,例如小鼠或大鼠)的方法。因此,在一个实施方式中,本发明提供了一种修饰啮齿动物(例如小鼠或大鼠)的mhci基因座以表达人源/啮齿动物嵌合(例如人/小鼠或人/大鼠)mhci多肽的方法,其中所述方法包括在所述内源性mhci基因座用编码人源mhci多肽胞外结构域的核苷酸序列取代编码啮齿动物mhci多肽胞外结构域的核苷酸序列。在另一个实施方式中,本发明提供了一种修饰啮齿动物(例如小鼠或大鼠)的β2微球蛋白基因座以表达人源或人源化β2微球蛋白多肽的方法,其中所述方法包括在内源性啮齿动物(例如小鼠或大鼠)β2微球蛋白基因座用编码人源或人源化β2微球蛋白多肽的核苷酸序列取代编码啮齿动物(例如小鼠或大鼠)β2微球蛋白多肽的核苷酸序列。在这种方法中,所述取代可以在单个es细胞中进行,并且可以将所述单个es细胞引入啮齿动物(例如小鼠或大鼠)以制备胚胎。可以将所得到的啮齿动物(例如小鼠或大鼠)进行交配以产生双人源化动物。
因此,本发明还提供了一种制备双人源化动物例如啮齿动物(例如小鼠或大鼠)的方法。在一个实施方式中,本申请还提供了一种制备基因修饰的小鼠的方法,所述方法包括(a)修饰第一小鼠的mhci基因座以表达人源/小鼠嵌合mhci多肽,其在内源性小鼠mhci基因座包含编码小鼠mhci多肽胞外结构域的核苷酸序列被编码人mhci多肽胞外结构域的核苷酸序列所取代,(b)修饰第二小鼠的β2微球蛋白基因座以表达人源或人源化β2微球蛋白多肽,其在内源性小鼠β2微球蛋白基因座包含编码小鼠β2微球蛋白多肽的核苷酸序列被编码人源或人源化β2微球蛋白多肽的核苷酸序列取代;以及(c)将所述第一和第二小鼠交配以生成经修饰的小鼠,所述小鼠在其基因组中包含编码人源/小鼠嵌合mhci多肽的第一核苷酸序列和编码人源或人源化β2微球蛋白多肽的第二核苷酸序列,其中所述基因修饰的小鼠表达人源/小鼠嵌合mhci多肽和人源或人源化β2微球蛋白多肽。在一些实施方式中,所述mhci基因座选自h-2k、h-2d和h-2l;;在一些实施方式中,所述人mhci多肽选自hla-a、hla-b和hla-c。在一个实施方式中,所述mhci基因座是h-2k基因座,所述人mhci多肽是hla-a(例如hla-a2),并且所述小鼠表达嵌合hla-a/h-2k多肽(例如hla-a2/h-2k多肽)。在一个方面,所述嵌合hla-a2/h-2k多肽包含hla-a2多肽的胞外结构域和h-2k多肽的胞质和跨膜结构域。在一个方面,所述第二核苷酸序列包含人β2微球蛋白基因外显子2、3和4(例如外显子2至外显子4)中所示的核苷酸序列,以及小鼠β2微球蛋白基因外显子1中所示的核苷酸序列。
本发明还提供了一种来源于本申请所述的非人动物(例如啮齿动物,例如小鼠或大鼠)的细胞例如分离的抗原递呈细胞。本发明还提供了来源于本申请所述的非人动物的组织和胚胎。
在又一个实施方式中,本发明提供了鉴定激发免疫应答的抗原或抗原表位的方法,评估候选疫苗的方法,鉴定对人病原体或癌症抗原具有高亲和性的t细胞的方法。
本发明所述的任何实施方式和方面均可以彼此结合使用,除非另有说明或从上下文是显而易见的。通过随后的详细描述,对本领域技术人员而言其他实施方式将是显而易见的。下文的详细描述包括对本发明不同实施方式的示例性描述,其对所主张的发明不具有限制性。附图构成了本说明书的一部分,其与说明书一起仅用于说明书实施方式,而不是用于限制本发明。
附图简述
图1是i类mhc分子四个结构域的示意图:含有α1、α2和α3结构域的α-链以及非共价结合的第四个结构域β2-微球蛋白(β2m)。灰色的圆圈表示在肽结合缝隙中结合的肽。
图2是人hla相对基因组结构示意图(未按照比例),显示了i、ii和iii类基因。
图3是小鼠mhc相对基因组结构的示意图(未按照比例),显示了i、ii和iii类基因。
图4显示了含有编码嵌合hla-a/h-2k多肽的cdna以及ires-gfp报告基因的病毒载体构建体(a);以及对单独转导(左图)hla-a2(虚线)、hla-a2/h-2k(点线)或未转导(实线),或与人源化β2微球蛋白共转导(右图)的mg87细胞中人hla-a2表达情况进行比较的直方图(b)。与(b)图平行对应的数据在表(c)中以表达构建体的细胞所占百分率表示。
图5是用于制备表达人hla-a2蛋白胞外区域的嵌合h-2k基因座的定位策略的示意图(未按照比例)。小鼠序列以黑色表示,人序列以白色表示。l=先导序列,utr=非翻译区,tm=跨膜结构域,cyt=胞质结构域,hyg=潮霉素。
图6a显示了从野生型(wt)小鼠或携带嵌合hla-a2/h-2k基因座的杂合子小鼠(hla-a/h-2khet)分离的细胞中hla-a2(左图)和h-2k(右图)的表达情况(占总细胞%)。
图6b为在携带嵌合hla-a2/h-2k基因座的杂合子小鼠中嵌合hla-a2/h-2k蛋白体内表达情况的点图。
图7显示了在小鼠β2微球蛋白基因座将β2微球蛋白基因人源化的定向策略(未按照比例)。小鼠序列以黑色表示,人序列以白色表示。neo=新霉素。
图8显示了从野生型(wt)小鼠、嵌合hla-a2/h-2k杂合子小鼠、嵌合hla-a2/h-2k杂合子和人源化β2微球蛋白杂合子小鼠(双杂合子;i类/β2mhet)的血液分离的细胞中hlai类和人β2微球蛋白的表达情况的代表性点图。
图9显示了从野生型(wt)、嵌合hla-a2/h-2k杂合子(i类het)和嵌合hla-a2/h2k/人源化β2微球蛋白双杂合子(i类/β2mhet)小鼠血液分离的细胞中人hlai类表达情况(x-轴)的代表性直方图。
图10显示了在流感(左图)或ebv(右图)肽存在的条件下,对接触来源于野生型小鼠的抗原递呈细胞(apc)(wtapc)或针对嵌合hla-a2/h-2k和人源化β2微球蛋白是杂合子的小鼠的抗原递呈细胞(apc)(双hetapc)递呈的人t细胞进行ifnγelispot检测的结果。使用单因素方差检验anova结合tukey的检验后多重比较测试进行统计学分析。
发明详述
定义
本发明提供了表达人源或人源化mhci和/或β2微球蛋白的基因修饰的非人动物(例如小鼠、大鼠、家兔等);以及包含该基因修饰的胚胎、细胞和组织;制备该基因修饰动物以及使用其的方法。除非另有定义,否则本申请使用的所有术语和短语包括所述术语和短语在本领域中所具有的含义,除非有明确的相反说明或在使用所述术语或短语的上下文中是显而易见的。
当用于描述保守的氨基酸取代时,术语“保守的”包括氨基酸残基被另一个具有带有相似化学性质(例如电荷或疏水性)的侧链r基的氨基酸残基取代。保守的氨基酸取代可以通过修饰核苷酸序列以引入编码保守取代的核苷酸的改变来实现。在通常情况下,保守的氨基酸取代将不会从基本上改变目标蛋白的功能性性质,例如mhci递呈目标肽的能力。具有带有相似化学性质的侧链的氨基酸基团的例子包括脂肪族侧链如甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;脂肪族-羟基侧链如丝氨酸和苏氨酸;含有酰胺的侧链如天冬酰胺和谷胺酰胺;芳香侧链如苯丙氨酸、酪氨酸和色氨酸;碱性侧链如赖氨酸、精氨酸和组氨酸;酸性侧链如天冬氨酸和谷氨酸;和含硫侧链如半胱氨酸和甲硫氨酸。保守的氨基酸取代基团包括例如缬氨酸/亮氨酸/异亮氨酸、苯丙氨酸/酪氨酸、赖氨酸/精氨酸、丙氨酸/缬氨酸、谷氨酸/天冬氨酸和天冬酰胺/谷氨酰胺。在一些实施方式中,保守的氨基酸取代可以是蛋白中的任意天然残基被丙氨酸取代,用于例如丙氨酸扫描诱变。在一些实施方式中,所采用的保守取代在pam250对数概似矩阵中具有正值的,如gonnet等,(1992)exhaustivematchingoftheentireproteinsequencedatabase,science256:1443-45所公开的,其通过引用并入本申请。在一些实施方式中,所述取代是适度的保守取代,其中所述取代在pam250对数概似矩阵中具有非负值。
因此,本发明还包括一种基因修饰的非人动物,所述动物的基因组包含编码人源或人源化mhci多肽和/或β2微球蛋白多肽的核苷酸序列,其中所述多肽包含本申请所述的氨基酸序列的保守氨基酸取代。
本领域技术人员可以理解,除了本申请所述的编码人源或人源化mhci多肽和/或β2微球蛋白的核酸残基以外,由于遗传密码的简并性,其他核酸也可以编码本发明的多肽。因此,除了在其基因组中包含编码具有保守氨基酸取代的mhci和/或β2微球蛋白多肽的核苷酸序列的基因修饰的非人动物以外,本申请还提供了由于遗传密码的简并性使得在其基因组包含不同于本申请所述的核酸序列的非人动物。
当与序列一起使用时,术语“同一性”包括通过本领域公知的能够用于测定核苷酸和/或氨基酸序列同一性的多种不同算法确定的同一性。在本申请所述的一些实施方式中,使用开放间隙罚分为10.0和延伸间隙罚分为0.1的clustalwv.1.83(slow)算法和gonnet相似性矩阵(macvectortm10.0.2,macvectorinc.,2008)确定同一性。用于序列同一性比较的序列的长度取决于特定的序列。在多种实施方式中,通过从成熟蛋白的n末端至c末端进行序列比较确定其同一性。在不同实施方式中,当将人源/非人源嵌合序列与人序列进行比较时,将所述人源/非人源嵌合序列的人源部分(而不是非人源部分)用于比较,以确定人源序列和人源/非人源嵌合序列的人部分之间的同一性水平(例如将人源/小鼠嵌合蛋白的人胞外结构域与人蛋白的人胞外结构域进行比较)。
关于序列例如核苷酸或氨基酸序列的术语“同源性”或“同源的”是指两条序列经最佳比对和比较具有至少约75%的核苷酸或氨基酸、至少约80%的核苷酸或氨基酸、至少约90-95%的核苷酸或氨基酸,例如超过97%的核苷酸或氨基酸是相同的。本领域技术人员可以理解,对于最佳基因靶向而言,靶向构建体应含有与内源性dna序列同源的臂(即“同源臂”);因此,能够在靶向构建体与被靶向的内源性序列之间发生同源重组。
术语“可操作地连接”指并列,其中被这样描述的组分处于允许其以预计方式发挥功能的关系中。因此,编码蛋白的核酸序列可以可操作地与调控序列(例如启动子、增强子、沉默子序列等)连接,以保持适宜的转录调控。此外,在细胞中本发明的嵌合或人源化蛋白的多个部分可以可操作地相连以保持其折叠、加工、靶向、表达和其他细胞中的蛋白功能。除非另有明示,本发明的嵌合或人源化蛋白的多种结构域彼此之间可操作地连接。
如本申请所使用的,术语“mhci复合物”或类似表述包括mhciα链多肽与β2-微球蛋白多肽之间的复合物。如本申请所使用的,术语“mhci多肽”或类似表述包括单独的mhciα链多肽。通常,术语“人mhc”和“hla”可以互换使用。
关于基因取代中的术语“取代”,是指在内源性基因座加入外源性遗传物质,从而用直系同源的或同源的核酸序列取代全部或部分内源性基因。如下述实施例中所示,编码部分小鼠mhci和β2微球蛋白多肽的内源性基因座的核酸序列分别被编码部分人源mhci和β2微球蛋白多肽的核酸序列取代。
如本申请所使用的“功能性”,就功能性多肽而言,是指保留至少一个通常与天然蛋白相关的生物活性的多肽。例如,在本发明的一些实施方式中,在内源性基因座的取代(例如在内源性非人源mhci和/或β2微球蛋白基因座的取代)使得基因座无法表达功能性内源性多肽。
本申请下文描述的基因修饰的mhci非人动物的若干方面,例如动物类型、动物品系、细胞类型、筛选、检测和其他方法、使用方法等将适用于基因改造β2微球蛋白和mhci/β2微球蛋白的动物。
基因修饰的mhci动物
在多种实施方式中,本发明基本提供了基因修饰的非人动物,所述动物在其基因组中包含编码人源或人源化mhci多肽的核苷酸序列;因此,所述动物表达人源或人源化的mhci多肽。
mhc基因分为三类:i类、ii类和iii类,其均在人6号染色体或小鼠17号染色体上编码。人和小鼠的mhc类型相对结构的示意图分别见图2和图3。mhc基因是小鼠和人基因组中最具多态性的基因。mhc多态性被推定为在提供进化优势方面是重要的;序列的改变能够导致肽结合的差异,以便更好地将病原体递呈至细胞毒性t细胞。
mhci类蛋白包含胞外结构域(其含有三个结构域:α1、α2和α3)、跨膜结构域和胞质尾。α1和α2结构域形成肽结合裂隙,而α3与β2-微球蛋白相互作用。
除了与β2-微球蛋白的相互作用之外,α3结构域还与tcr共受体cd8之间相互作用,以促进抗原特异性活化。尽管mhci类与cd8的结合比tcr与mhci类的结合弱约100倍,但是cd8结合增强了tcr结合的亲和性。wooldridge等,(2010)mhcclassimoleculeswithsuperenhancedcd8bindingpropertiesbypasstherequirementforcognatetcrrecognitionandnonspecificallyactivatectls,j.immunol.184:3357-3366。有趣的是,增强mhci类与cd8的结合消除了ctl活化中的抗原特异性。同上。
cd8与mhci类分子的结合具有种属特异性;已发现cd8的小鼠同源物lyt-2在α3结构域与h-2dd分子结合,但其不与hla-a分子结合。connolly等,(1988)thelyt-2moleculerecognizesresiduesintheclassiα3domaininallogeneiccytotoxictcellresponses,j.exp.med.168:325-341。这种差异性结合可能是由cd8上的cdr样决定簇(cdr1-和cdr2-样)在人和小鼠之间不保守所导致的。sanders等,(1991)mutationsincd8thataffectinteractionswithhlaclassiandmonoclonalanti-cd8antibodies,j.exp.med.174:371-379;vitiello等,(1991)analysisofthehla-restrictedinfluenza-specificcytotoxictlymphocyteresponseintransgenicmicecarryingachimerichuman-mouseclassimajorhistocompatibilitycomplex,j.exp.med.173:1007-1015;以及gao等,(1997)crystalstructureofthecomplexbetweenhumancd8ααandhla-a2,nature387:630-634。已报道cd8在α3结构域的保守区(在位点223-229)结合hla-a2。在hla-a中的单一取代(v245a)导致cd8与hla-a的结合降低,同时伴随着t细胞介导的裂解大大减少。salter等,(1989),polymorphismintheα3domainofhla-amoleculesaffectsbindingtocd8,nature338:345-348。在通常情况下,hla-a分子在α3结构域的多态性也会影响其与cd8的结合。同上。在小鼠中,在h-2dd中残基227的氨基酸取代影响小鼠lyt-2与h-2dd的结合,并且使用突变的h-2dd转染的细胞不会被cd8+t细胞裂解。potter等,(1989)substitutionatresidue227ofh-2classimoleculesabrogatesrecognitionbycd8-dependent,butnotcd8-independent,cytotoxictlymphocytes,nature337:73-75。
因此,由于mhci类α3结构域与cd8之间的相互作用具有种属特异性,因此包含h-2kα3结构域被人hla-a2α3结构域取代的mhci复合物在缺乏人cd8的小鼠中(即在体内)无功能。在hla-a2的转基因动物中,使用人α3结构域取代小鼠α3结构域使得t细胞应答恢复。irwin等,(1989)species-restrictedinteractionsbetweencd8andtheα3domainofclassiinfluencethemagnitudeofthexenogeneicresponse,j.exp.med.170:1091-1101;vitiello等,(1991),见前。
小鼠mhci类蛋白的跨膜结构域和胞质尾也具有重要功能。mhci跨膜结构域的一个功能是促进hla-a2同型细胞粘附的调控(增强或抑制粘附),这可能是表面mhc分子交联(或连接)的结果。wagner等,(1994)ligationofmhcclassiandclassiimoleculescanleadtoheterologousdesensitizationofsignaltransductionpathwaysthatregulatehomotypicadhesioninhumanlymphocytes,j.immunol.152:5275-5287。细胞粘附能够受到与hla-a2分子不同表位结合的mab的影响,这表明hla-a2上的多个位点参与了调节同型细胞的粘附;依据所结合表位的不同,该影响可能会增强或抑制hla-a2依赖性粘附。同上。
据报道由mhci基因的外显子6和7编码的胞质尾对细胞表面上的适宜表达和lir1介导的nk细胞毒性的抑制是必要的。gruda等,(2007)intracellularcysteineresiduesinthetailofmhcclassiproteinsarecrucialforextracellularrecognitionbyleukocyteig-likereceptor1,j.immunol.179:3655-3661。胞质尾对于至少通过在其半胱氨酸残基上形成二硫键的mhci分子的多聚化是必需的,因此其可能在成簇和被nk细胞识别中具有重要作用。lynch等,(2009)novelmhcclassistructuresonexosomes,j.immunol.183:1884-1891。
尽管hla-a2的胞质结构域含有一个组成型的磷酸化丝氨酸残基和一个可磷酸化的酪氨酸,但是在jurkat细胞中缺乏胞质结构域的突变hla-a2分子在表达、细胞骨架结合、聚合和内吞内化方面表现正常。gur等,(1997)structuralanalysisofclassimhcmolecules:thecytoplasmicdomainisnotrequiredforcytoskeletalassociation,aggregation,andinternalization,mol.immunol.34(2):125-132。缺乏胞质结构域的截短的hla-a2分子显示出正常的表达且与β2微球蛋白的结合,同上。
然而,一些研究已表明胞质尾在细胞内转运、树突状细胞(dc)介导的抗原递呈和ctl引发中具有重要作用。已证明外显子6编码的酪氨酸残基是通过内涵体小室的mhci转运、外源性抗原的递呈和ctl引发所必需的;而外显子7的缺失导致抗病毒ctl应答的增强。lizee等,(2003)controlofdendriticcross-presentationbythemajorhistocompatibilitycomplexclassicytoplasmicdomain,natureimmunol.4:1065-73;basha等,(2008)mhcclassiendosomalandlysosomaltraffickingcoincideswithexogenousantigenloadingindendriticcells,plosone3:e3247;和rodriguez-cruz等,(2011)naturalsplicevariantofmhcclassicytoplasmictailenhancesdendriticcell-inducedcd8+t-cellresponsesandboostsanti-tumorimmunity,plosone6:e22939。
在多种实施方式中,本发明提供了一种基因修饰的非人动物(例如小鼠、大鼠、家兔等),在所述动物的基因组中包含编码人源或人源化mhci类多肽的核苷酸序列。所述非人动物可以在其基因组中包含编码mhci多肽的核苷酸序列,所述mhci多肽部分是人源的和部分是非人源的,例如表达人源/非人源嵌合mhci多肽的非人动物。在一个方面,所述非人动物仅表达人源或人源化mhci多肽,例如人源/非人源嵌合mhci多肽,并且不表达来自内源性mhci基因座的内源性非人源mhci蛋白。
在一个实施方式中,所述人源/非人源嵌合mhci多肽在其人源部分包含一个人mhci多肽的肽结合结构域。在一个方面,所述嵌合多肽的人源部分包含人mhci的胞外结构域。在这个实施方式中,所述嵌合多肽的人源部分包含人mhciα链的胞外结构域。在一个实施方式中,所述嵌合多肽的人源部分包含人mhci的α1和α2结构域。在另一个实施方式中,所述嵌合多肽的人源部分包含人mhci的α1、α2和α3结构域。
所述人源或人源化mhci多肽可以来源于由任意hla-a、hla-b、hla-c、hla-e、hla-f或hla-g基因座编码的功能性人hla分子。常用的hla抗原列表可参见shankarkumar等((2004)thehumanleukocyteantigen(hla)system,int.j.hum.genet.4(2):91-103),其通过引用并入本申请。shankarkumar等还提供了对本领域使用的hla命名法的简要说明。hla命名法和不同hla等位基因的其他信息可以参见holdsworth等,(2009)thehladictionary2008:asummaryofhla-a,-b,-c,-drb1/3/4/5,anddqb1allelesandtheirassociationwithserologicallydefinedhla-a,-b,-c,-dr,and–dqantigens,tissueantigens73:95-170,以及最新的marsh等,(2010)nomenclatureforfactorsofthehlasystem,2010,tissueantigens75:291-455,其均通过引用并入本申请。因此,所述人源或人源化mhci多肽可以来源于本申请所述的任意功能性人hlai类分子。
在一个特定方面,所述人源或人源化mhci多肽来源于人hla-a。在一个特定实施方式中,所述hla-a多肽是hla-a2多肽(例如hla-a2.1多肽)。在一个实施方式中,所述hla-a多肽是由hla-a*0201等位基因(例如hla-a*02:01:01:01等位基因)编码的多肽。hla-a*0201等位基因通常用于北美人群中。尽管本实施例中描述了这一特定的hla序列,但是任意适宜的hla-a序列均包含在本申请中,例如hla-a2在人群中的多态性变体、具有一个或多个保守的或非保守的氨基酸修饰的序列、由于遗传密码的简并性而不同于本申请所述序列的核酸序列等。
在一个方面,本申请提供了表达人hla-a2序列的非人动物,其中所述人hla-a2序列包含一个或多个保守的或非保守的修饰。
在一个方面,本申请提供了表达人源hla-a2序列的非人动物,其中所述人源hla-a2序列与人hla-a2序列具有至少约85%、90%、95%、96%、97%、98%或99%的同一性。在一个特定实施方式中,所述人源hla-a2序列与实施例中所述的人hla-a2序列具有至少约90%、95%、96%、97%、98%或99%的同一性。在一个实施方式中,所述人hla-a2序列包含一个或多个保守取代。在一个实施方式中,所述人hla-a2序列包含一个或多个非保守取代。
在另一个特定的方面,所述人源或人源化mhci多肽来源于选自hla-b和hla-c的人mhci。在一个方面,所述人源或人源化mhci来源于hla-b例如hla-b27。
在一个方面,所述人源/非人源嵌合mhci多肽的非人源部分包含非人源mhci多肽的跨膜和/或胞质结构域。在一个实施方式中,所述非人动物是小鼠,并且所述非人源mhci多肽选自h-2k、h-2d和h-2l。在一个实施方式中,所述非人源mhci多肽是h-2k例如h-2kb。尽管在实施例中描述了特定的h-2k序列,但是在本申请中包含任意适宜的h-2k序列例如多态性变体、保守/非保守的氨基酸取代等。
本申请所述的非人动物可以在其基因组中包含编码人源或人源化mhci多肽的核苷酸序列,例如人源/或非人源嵌合mhci多肽,其中所述编码这种多肽的核苷酸序列位于内源性非人源mhci基因座(例如h-2k基因座)。在一个方面,其为内源性mhci基因或其部分被编码人源或人源化mhci多肽的核苷酸序列取代的结果,例如编码本申请所述的人源/非人源嵌合mhci多肽的嵌合基因。在一个实施方式中,所述取代包含编码非人源mhci多肽结合结构域或非人源mhci胞外结构域的内源性核苷酸序列被编码其的人核苷酸序列(例如hla-a2核苷酸序列)取代。在这个实施方式中,所述取代不包含编码非人源mhci多肽(例如h-2k多肽)的跨膜和/或胞质结构域的mhci序列的取代。因此,所述非人动物在内源性非人源mhci基因座包含人源/非人源嵌合序列,并且从内源性非人源mhci基因座表达人源/非人源嵌合mhc多肽。
人源/非人源嵌合多肽可以是包含人源或非人源的先导(信号)序列的。在一个实施方式中,所述嵌合多肽包含非人源内源性mhci蛋白的先导序列。在另一个实施方式中,所述嵌合多肽包含人源mhci蛋白例如hla-a2蛋白(例如hla-a2.1先导序列)的先导序列。因此,编码所述嵌合mhci多肽的核苷酸序列可以可操作地与编码人源mhci先导序列的核苷酸序列连接。
人源/或非人源嵌合mhci多肽可以在其人部分中包含完整的或基本上完整的人源mhci多肽胞外结构域。因此,所述人部分可以包含编码人源mhci多肽(例如hla-a2多肽)胞外结构域的氨基酸的至少80%、优选地至少85%、更优选地至少90%,例如95%或以上。在一个例子中,基本上完整的人源mhci多肽的胞外结构域缺乏人源mhci先导序列。在另一个例子中,所述人源/非人源嵌合mhci多肽包含人源mhci先导序列。
而且,所述嵌合mhci多肽可以在内源性非人源调控元件例如啮齿动物mhci调控元件的调控下表达。这种重排将有利于在非人动物中例如在非人动物的免疫应答中适宜地表达嵌合mhci多肽。
基因修饰的非人动物可以选自以下组:小鼠、大鼠、家兔、猪、牛(例如奶牛、公牛、水牛)、鹿、绵羊、山羊、鸡、猫、狗、雪貂、灵长类动物(例如狨猴、猕猴)。对于不易于获得适宜基因修饰的es细胞的非人动物而言,可以使用其他方法制备包含基因修饰的非人动物。这种方法包括例如修饰非es细胞基因组(例如成纤维细胞或诱导的多能干细胞)以及引入核转移以便将经修饰的基因组转移至适宜细胞例如卵母细胞,并且在适宜条件下在非人动物中使经修饰的细胞(例如经修饰的卵细胞)妊娠以形成胚胎。
在一个方面,所述非人动物是哺乳动物。在一个方面,所述非人动物是小型哺乳动物,例如跳鼠科或鼠科超家族。在一个实施方式中,所述基因修饰的动物是啮齿动物。在一个实施方式中,所述啮齿动物选自小鼠、大鼠和仓鼠。在一个实施方式中,所述啮齿动物选自鼠科超家族。在一个实施方式中,所述基因修饰的动物来自选自丽仓鼠科(例如小鼠样仓鼠)、仓鼠科(例如仓鼠、新世界大鼠和小鼠、田鼠)、鼠科(真小鼠和大鼠、沙鼠、刺毛鼠、冠毛大鼠)、马岛鼠科(登山小鼠、岩小鼠、有尾大鼠、马达加斯加大鼠和小鼠)、刺山鼠科(例如多刺睡鼠)和鼹形鼠科(例如摩尔大鼠、竹大鼠和鼢鼠)家族。在一个特定实施方式中,所述基因修饰的啮齿动物选自真小鼠或大鼠(鼠科)、沙鼠、刺毛鼠和黄冠鼠。在一个实施方式中,所述基因修饰的小鼠是鼠科家族成员。在一个实施方式中,所述动物是啮齿动物。在一个特定实施方式中,所述啮齿动物选自小鼠和大鼠。在一个实施方式中,所述非人动物是小鼠。
在一个特定实施方式中,所述非人动物是啮齿动物,其是c57bl品系的小鼠,选自c57bl/a、c57bl/an、c57bl/grfa、c57bl/kalwn、c57bl/6、c57bl/6j、c57bl/6byj、c57bl/6nj、c57bl/10、c57bl/10scsn、c57bl/10cr和c57bl/ola。在另一个实施方式中,所述小鼠是选自以下组的129品系:129p1、129p2、129p3、129x1、129s1(例如129s1/sv、129s1/svim)、129s2、129s4、129s5、129s9/svevh、129s6(129/svevtac)、129s7、129s8、129t1、129t2(参见例如festing等(1999)revisednomenclatureforstrain129mice,mammaliangenome10:836,亦参见auerbach等(2000)establishmentandchimeraanalysisof129/svev-andc57bl/6-derivedmouseembryonicstemcelllines)。在一个特定实施方式中,所述基因修饰的小鼠是前述129品系和前述c57bl/6品系的混合品系。在另一个特定实施方式中,所述小鼠是前述129品系的混合品系或前述bl/6品系的混合品系。在一个特定实施方式中,所述129品系的混合品系是129s6(129/svevtac)品系。在另一个实施方式中,所述小鼠是balb品系,例如balb/c品系。在又一个实施方式中,所述小鼠是balb品系和另一个前述品系的混合品系。
在一个实施方式中,所述非人动物是大鼠。在一个实施方式中,所述大鼠选自wistar大鼠、lea品系、spraguedawley品系、fischer品系、f344、f6和darkagouti。在一个实施方式中,所述大鼠品系是两种或多种选自以下组的品系的混合品系:wistar、lea、spraguedawley、fischer、f344、f6和darkagouti。
因此,在一个实施方式中,本发明涉及一种基因修饰的小鼠,所述小鼠在其基因组中包含编码人源/小鼠嵌合mhci多肽的核苷酸序列,其中所述嵌合多肽的人源部分包含人源mhci(例如人hla-a,例如人hla-a2,例如人hla-a2.1)的肽结合结构域或胞外结构域。在一些实施方式中,所述小鼠不表达来自其内源性小鼠基因座的内源性小鼠多肽的肽结合或胞外结构域。所述人源mhci的肽结合结构域可以包含α1和α2结构域。或者,所述人mhci的肽结合结构域可以包含α1、α2和α3结构域。在一个方面,所述人源mhci的胞外结构域包含人mhciα链的胞外结构域。在一个实施方式中,所述内源性小鼠基因座是h-2k(例如h-2kb)基因座,并且所述嵌合多肽的小鼠部分包含小鼠h-2k(例如h-2kb)多肽的跨膜和胞质结构域。
因此,在一个实施方式中,提供了一种基因修饰的小鼠,其中所述小鼠在内源性h-2k(例如h-2kb)基因座包含编码人源/小鼠嵌合mhci多肽的核苷酸序列,其中所述嵌合多肽的人源部分包含人hla-a2(例如hla-a2.1)多肽的胞外结构域和小鼠部分包含小鼠h-2k(例如h-2kb)多肽的跨膜和胞质结构域。在一个方面,所述小鼠不表达来自内源性mhci基因座的小鼠h-2k(例如h-2kb)多肽的胞外结构域。在一个实施方式中,所述小鼠表达来自内源性h-2k(例如h-2kb)基因座的嵌合hla-a2/h-2k(例如嵌合hla-a2.1/h-2kb)多肽。在多种实施方式中,嵌合基因的表达在内源性小鼠mhci类调控元件的调控下进行。在一些方面,所述小鼠包含两个拷贝的嵌合mhci基因座,其含有编码嵌合hla-a2/h-2k多肽的核苷酸序列;而在其他方面,所述小鼠包含一个拷贝的嵌合mhci基因座,其含有编码嵌合hla-a2/h-2k多肽的核苷酸序列。因此,所述小鼠针对编码嵌合hla-a2/h-2k多肽的核苷酸序列可以是纯合子或杂合子。
在本申请所述的一些实施方式中,提供了一种小鼠,所述小鼠在内源性小鼠h-2k基因座包含嵌合mhci基因座。所述嵌合基因座包含编码人hla-a2蛋白胞外结构域例如人hla-a2基因的α1、α2和α3结构域的核苷酸序列。所述嵌合基因座缺乏编码小鼠h-2k蛋白胞外结构域(例如小鼠h-2k的α1、α2和α3结构域)的核苷酸序列。在一个方面,所述嵌合基因座缺乏编码小鼠h-2k的先导肽,α1、α2和α3结构域的核苷酸序列;并且包含人hla-a2的先导肽,α1、α2和α3结构域以及小鼠h-2k的跨膜和胞质结构域。所述嵌合基因座的不同结构域可操作地彼此连接,以使得所述嵌合基因座表达功能性人源/小鼠嵌合mhci蛋白。
在多种实施方式中,非人动物例如啮齿动物(例如小鼠或大鼠),其表达来自如本申请所述的嵌合mhci基因座的功能性嵌合mhci蛋白,在细胞表面展示嵌合蛋白。在一个实施方式中,所述非人动物在细胞表面表达的嵌合mhci蛋白在细胞中的分布与在人中所观察到的结果相同。在一个方面,所述细胞展示的肽片段(抗原片段)与所述嵌合mhci蛋白的胞外部分(例如人hla-a2的胞外部分)结合。在一个实施方式中,这种嵌合蛋白的胞外部分与所述细胞表面的其他蛋白例如β2-微球蛋白相互作用。
在多种实施方式中,展示嵌合mhci蛋白的例如hla-a2/h-2k蛋白的细胞是有核细胞。在多种方面,所述细胞是抗原递呈细胞(apc)。但是机体内的大部分细胞在mhci存在条件下能够递呈抗原,抗原递呈细胞的一些非限制性例子包括巨噬细胞、树突状细胞和b细胞。其他抗原递呈细胞包括专职的和非专职的apc是本领域公知的,其均包含在本申请中。在一些实施方式中,展示所述嵌合mhci蛋白的细胞是肿瘤细胞,并且通过嵌合蛋白递呈的肽片段来自肿瘤。在其他实施方式中,通过所述嵌合mhci蛋白递呈的肽片段来自病原体,例如细菌或病毒。
本申请所述的嵌合mhci蛋白可以与相同细胞或另一个细胞表面的其他蛋白相互作用。在一些实施方式中,所述嵌合mhci蛋白与所述细胞表面的内源性非人蛋白相互作用。所述嵌合mhci蛋白还可以与相同细胞或另一个细胞表面的人源或人源化蛋白相互作用。
在同一细胞上,hlai类分子可以在功能上与非人源(例如啮齿动物,例如小鼠或大鼠)和人源β2-微球蛋白相互作用。因此,在一个实施方式中,所述嵌合mhci蛋白例如hla-a2/h-2k蛋白与小鼠β2-微球蛋白相互作用。尽管一些人hlai类分子与小鼠β2-微球蛋白之间的相互作用是可能的,但是其与人hlai类和人β2-微球蛋白之间的相互作用相比大大减少。因此,在缺乏人β2-微球蛋白的条件下,人mhci在细胞表面的表达可能降低。perarnau等,(1988)humanβ2-microglobulinspecificallyenhancescell-surfaceexpressionofhlaclassimoleculesintransfectedmurinecells,j.immunol.141:1383-89。其他hla分子例如hla-b27不与小鼠β2-微球蛋白相互作用;参见例如tishon等,(2000)transgenicmiceexpressinghumanhlaandcd8moleculesgeneratehla-restrictedmeaslesviruscytotoxictlymphocytesofthesamespecificityashumanswithnaturalmeaslesvirusinfection,virology275:286-293,其报道了在转基因小鼠中hla-b27的功能需要人β2-微球蛋白和人cd8。因此,在另一个实施方式中,所述嵌合mhci蛋白与人源或人源化β2-微球蛋白相互作用。在一些这种实施方式中,如本申请的下文所述,所述非人动物例如啮齿动物(例如小鼠或大鼠)在其基因组中包含人源或人源化β2-微球蛋白基因,并且所述动物表达功能性人源或人源化β2-微球蛋白多肽;因此,所述嵌合mhci蛋白与人源或人源化β2-微球蛋白多肽相互作用。
在多种方面,所述嵌合蛋白(例如hla-a2/h-2k蛋白)还与另一个细胞表面的蛋白相互作用(通过其细胞外部分)。所述另一个细胞可以是非人的例如小鼠的或人源的细胞。所述另一个细胞可以来源于与表达所述嵌合mhci多肽的细胞相同的非人动物或相同的非人动物种属。与嵌合蛋白(例如hla-a2/h-2k)的胞外部分相互作用的蛋白的非限制性例子包括t细胞受体(tcr)及其共受体cd8。因此,另一个细胞可以是t细胞。此外,所述嵌合mhci蛋白的胞外部分可以与自然杀伤(nk)细胞表面的蛋白结合,例如nk细胞表面上的杀伤免疫球蛋白受体(kir)。
t细胞或nk细胞可以与嵌合mhci多肽及其展示的肽片段之间形成的复合物结合。这种结合可以分别导致t细胞的活化或nk介导的细胞杀伤的抑制。一种假设是nk细胞已经进化为通过下调其mhci复合物杀伤已逃逸t细胞介导的细胞毒性的受感染的或肿瘤细胞。然而,当mhci复合物在细胞表面表达时,可以被nk细胞受体识别,并且抑制nk介导的细胞杀伤。因此,在一些方面,当nk细胞与所述嵌合mhci多肽(例如hla-a2/h-2k多肽)和在受感染的或肿瘤细胞表面所展示的肽片段之间形成的复合物结合时,nk介导的细胞杀伤被抑制。
在一个例子中,本申请所述的嵌合mhci多肽例如嵌合hla-a2/h-2k多肽与另一个细胞表面的cd8蛋白相互作用。在一个实施方式中,所述嵌合hla-a2/h-2k多肽与另一个细胞表面的内源性啮齿动物(例如小鼠或大鼠)cd8蛋白相互作用。在一个实施方式中,所述另一个细胞是t细胞。在另一个实施方式中,所述另一个细胞被改造以表达cd8。在某些方面,所述嵌合hla-a2/h-2k多肽与另一个细胞(例如人细胞或啮齿动物细胞)表面的人cd8相互作用。在一些这种实施方式中,所述非人动物例如小鼠或大鼠包含人cd8转基因,并且所述小鼠或大鼠表达功能性人cd8蛋白。
本申请所述的嵌合mhci多肽还可以与另一个细胞上的非人(例如小鼠或大鼠)tcr、人源tcr或人源化的tcr相互作用。所述嵌合mhci多肽可以与另一个细胞表面的内源性tcr(例如小鼠或大鼠tcr)相互作用。所述嵌合mhci多肽还可以与另一个细胞表面表达的人源或人源化tcr相互作用,其中所述细胞来源于与表达所述嵌合mhci多肽的细胞相同的动物或动物种属(例如小鼠或大鼠)。所述嵌合mhci多肽可以与人细胞表面表达的人tcr相互作用。
除了基因修饰的非人动物以外,本申请还提供了非人胚胎(例如啮齿动物胚胎,例如小鼠或大鼠胚胎),其中所述胚胎包含供体es细胞,其来源于如本申请所述的非人动物(例如啮齿动物,例如小鼠或大鼠)。在一个方面,所述胚胎包含包括所述嵌合mhci基因的es供体细胞和宿主胚胎细胞。
本申请还提供了一种组织,其中所述组织来源于如本申请所述的非人动物(例如小鼠或大鼠),并且表达所述嵌合mhci多肽(例如hla-a2/h-2k多肽)。
此外,本申请提供了分离自如本申请所述的非人动物的非人细胞。在一个实施方式中,所述细胞是es细胞。在一个实施方式中,所述细胞是抗原递呈细胞,例如树突状细胞、巨噬细胞、b细胞。在一个实施方式中,所述细胞是免疫细胞。在一个实施方式中,所述免疫细胞是淋巴细胞。
本申请还提供了一种非人细胞,所述细胞包含如本申请所述的非人动物的染色体或其片段。在一个实施方式中,所述非人细胞包含如本申请所述的非人动物的细胞核。在一个实施方式中,所述非人细胞包含核转移得到的染色体或其片段。
在一个方面,本申请提供了一种非人诱导的多能干细胞,所述细胞包含编码如本申请所述的嵌合mhci多肽(例如hla-a2/h-2k多肽)的基因。在一个实施方式中,所述诱导的多能干细胞来源于如本申请所述的非人动物。
在一个方面,本申请提供了一种杂交瘤或四价体瘤,其来源于如本申请所述的非人动物细胞。在一个实施方式中,所述非人动物是小鼠或大鼠。
本申请还提供了一种制备如本申请所述的基因改造的非人动物(例如基因改造的啮齿动物,例如小鼠或大鼠)的方法。制备基因改造的非人动物的方法使得在所述动物的基因组中包含编码嵌合mhci多肽的核苷酸序列。在一个实施方式中,所述方法生成的基因改造的小鼠,其基因组在内源性mhci基因座例如h-2k基因座包含编码人源/小鼠嵌合mhci多肽的核苷酸序列,其中所述嵌合mhci多肽的人源部分包含人hla-a2胞外结构域且小鼠部分包含小鼠h-2k的跨膜和胞质结构域。在一些实施方式中,如实施例中所描述的,所述方法利用使用
因此,本申请还提供了用于生成本申请所述的基因改造的非人动物的核苷酸构建体。在一个方面,所述核苷酸构建体包含:5’和3’非人同源臂、包含人hla-a基因序列的人dna片段和筛选基因表达盒两侧的重组位点。在一个实施方式中,所述人dna片段是包含人hla-a基因的内含子和外显子的基因组片段。在一个实施方式中,所述非人同源臂与非人mhci类基因座(例如小鼠h-2k基因座)具有同源性。
在一个实施方式中,所述基因组片段包含人hla-a先导、α1结构域、α2结构域和α3结构域的编码序列。在一个实施方式中,所述人dna片段包含,从5’至3’:hla-a先导序列、hla-a先导/α1内含子、hla-aα1外显子、hla-aα1-α2内含子、hla-aα2外显子、hla-aα2-α3内含子和hla-aα3外显子。
筛选基因表达盒是插入靶向构建体的一段核苷酸序列,其有助于筛选已插入目的构建体的细胞(例如es细胞)。若干适宜的筛选基因表达盒是本领域公知的。通常,在存在特定抗生素(例如neo、hyg、pur、cm、spec等)的条件下筛选基因表达盒能够得到阳性筛选。此外,筛选基因表达盒可能在两侧具有重组位点,这使得在使用重组酶处理后可以将筛选基因表达盒去除。常用的重组位点是loxp和frt,其分别由cre和flp酶识别,但其他的也是本领域公知的。
在一个实施方式中,所述筛选基因表达盒位于人dna片段的5’端。在另一个实施方式中,所述筛选基因表达盒位于人dna片段的3’端。在另一个实施方式中,所述筛选基因表达盒位于人dna片段中。在另一个实施方式中,所述筛选基因表达盒位于人dna片段的内含子中。在另一个实施方式中,所述筛选基因表达盒位于α2-α3内含子中。
在一个实施方式中,5’和3’非人同源臂包含分别位于内源性非人源(例如鼠源)mhci类基因座的5’和3’位置的基因组序列(例如非人源mhci基因第一先导序列的5’和α3外显子的3’端)。在一个实施方式中,所述内源性mhci类基因座选自小鼠h-2k、h-2d和h-2l。在一个特定实施方式中,所述内源性mhci类基因座是小鼠h-2k。
在一个方面,本申请提供了一种核苷酸构建体,其从5’至3’包含:含有内源性小鼠h-2k基因座的小鼠基因组序列5’端的5’同源臂、含有hla-a基因第一基因组序列的第一人dna片段、5’重组序列位点(例如loxp)、筛选基因表达盒、3’重组序列位点(例如loxp)、含有hla-a基因第二基因组序列的第二人dna片段和含有内源性h-2kα3外显子的小鼠基因组序列3’端的3’同源臂。在一个实施方式中,所述核苷酸构建体,从5’至3’包含:含有内源性小鼠h-2k基因座的小鼠基因组序列5’端的5’同源臂、包括hla-a前导的人基因组序列、hla-a前导/α1内含子序列、hla-aα1外显子、hla-aα1-α2内含子、hla-aα2外显子、α2-α3内含子的第一5’部分、两侧有重组位点的筛选基因表达盒、α2-α3内含子的第二3’部分、hla-aα3外显子和含有内源性小鼠h-2kα3外显子非小鼠基因组序列3’端的3’同源臂。在一个实施方式中,5’同源臂序列如seqidno:1所示和3’同源臂序列如seqidno:2所示。
在基因靶向完成后,对es细胞或基因修饰的非人动物进行筛选以确证成功插入了目的外源性核苷酸序列或表达了外源性多肽。多种技术是本领域技术人员公知的,包括(但不限于)southern印迹、长pcr、定量pct(例如使用
本公开还提供了一种修饰非人动物的mhci基因座以表达本申请所述的人源/非人源嵌合mhci多肽的方法。在一个实施方式中,本申请提供了一种修饰小鼠的mhci基因座以表达人源/小鼠嵌合mhci多肽的方法,其中所述方法包括在内源性mhci基因座编码小鼠mhc多肽肽结合结构域的核苷酸序列被编码人mhci多肽肽结合结构域的核苷酸序列取代。在一些方面,小鼠mhci胞外结构域的核苷酸序列被人mhci胞外结构域的核苷酸序列取代。所述小鼠可能无法表达来自内源性mhci基因座的小鼠mhci的肽结合或胞外结构域。在一些实施方式中,小鼠h-2k胞外结构域的核苷酸序列被人hla-a2胞外结构域的核苷酸序列取代,以使得经修饰的小鼠mhci基因座表达嵌合hla-a2/h-2k多肽。
在一个方面,本申请提供了一种用于制备人源hlai类/非人源mhci类嵌合分子的方法,所述方法包含在单个细胞中表达来自核苷酸构建体的嵌合hla-a/h-2k蛋白,其中所述核苷酸构建体包含编码hla-a蛋白α1、α2和α3结构域以及非人h-2k蛋白例如小鼠h-2k蛋白的跨膜和胞质结构域的cdna序列。在一个实施方式中,所述核苷酸构建体是病毒载体;在一个特定实施方式中,所述病毒载体是慢病毒载体。在一个实施方式中,所述细胞选自cho、cos、293、hela和表达病毒核酸序列的视网膜细胞(例如perc.6tm细胞)。
在一个方面,本申请提供了一种表达人源hlai类/非人源mhci嵌合蛋白(例如hla-a/h-2k蛋白)的细胞。在一个实施方式中,所述细胞包含含有嵌合mhci类基因的表达载体,其中所述嵌合mhci类基因包含可操作地与非人h-2k基因序列例如小鼠h-2k基因连接的人hla-a基因序列。在一个实施方式中,所述人hla-a基因序列包含编码hla-a蛋白α1、α2和α3结构域的外显子。在一个实施方式中,所述非人h-2k基因序列包含编码h-2k蛋白跨膜和胞质结构域的外显子。在一个实施方式中,所述细胞选自cho、cos、293、hela和表达病毒核酸序列的视网膜细胞(例如perc.6tm细胞)。
本申请还提供了使用本申请所述的非人动物制备的嵌合mhci类分子,其中所述嵌合mhci类分子包含来自人hla-a蛋白的α1、α2和α3结构域以及来自非人例如小鼠h-2k蛋白的跨膜和胞质结构域。可以通过抗-hla-a抗体检测本申请所述的嵌合mhci多肽。因此,可以使用抗-hla-a抗体分子检测和/或选择展示人源/非人源嵌合mhci多肽的细胞。在一些例子中,可以使用抗-hla-a2抗体检测本申请所述的嵌合mhci多肽。
尽管下述实施例描述了一种基因改造的动物,其基因组在内源性小鼠h-2k基因座包含编码小鼠h-2k多肽胞外结构域的核苷酸序列被编码人hla-a胞外结构域的序列取代,本领域技术人员将理解可以使用类似的策略用相应的人hla基因座(hla-b、hla-c等)取代其他的小鼠mhci基因座(h-2d、h-2l等)。因此,本申请还提供了一种非人动物,所述动物在其基因组中包含编码人源/非人源嵌合mhci多肽的核苷酸序列,其中所述多肽的人部分来源于另一种hlai类蛋白。还涉及多个mhci基因座的取代。
基因修饰β2微球蛋白的动物
本发明通常涉及基因修饰的非人动物,所述动物在其基因组中包含编码人源或人源化β2微球蛋白多肽的核苷酸序列;因此,所述动物表达人源或人源化β2微球蛋白多肽。
β2微球蛋白或mhci类复合物的轻链(也简称为“β2m”)是较小的(12kda)非糖基化蛋白,其功能主要是稳定mhcα链。人β2微球蛋白基因编码119个氨基酸的蛋白,其具有编码先导序列的20个n末端氨基酸。其成熟蛋白包含99个氨基酸。其基因含有4个外显子,第一个外显子含有5’非翻译区、整个前导序列和成熟多肽的前两个氨基酸;第二个外显子编码大部分成熟蛋白;第三个外显子编码成熟蛋白的最后四个氨基酸和终止密码子;以及第四个外显子含有3’非翻译区。gussow等,(1987)theβ2-microglobulingene.primarystructureanddefinitionofthetranscriptionalunit,j.immunol.139:3131-38。β2微球蛋白与mhci非共价结合。未结合的β2微球蛋白存在于体液中,如血浆,并且其通过肾排泄。肾功能障碍导致β2微球蛋白的蓄积,其可能是致病性的(例如透析相关淀粉样变);蓄积的蛋白在关节和结缔组织中形成丝状纤维样的淀粉样蛋白斑块。
除了透析相关淀粉样变以外,β2微球蛋白还参与多种其他疾病。在淋巴系统恶性肿瘤中例如非霍奇金氏淋巴瘤和多发性骨髓瘤检测到β2微球蛋白水平升高。参见例如shi等,(2009)β2microglobulin:emergingasapromisingcancertherapeutictarget,drugdiscoverytoday14:25-30。伴随β2微球蛋白水平升高的一些其他恶性肿瘤包括乳腺癌、前列腺癌、肺癌、肾癌、胃肠道和鼻咽癌。β2微球蛋白过表达已显示出具有肿瘤生长促进作用,同上。最近还发现了β2微球蛋白驱动上皮向间质的转变,其在乳腺、前列腺、肺和肾癌中促进癌向骨和软组织转移。josson等,(2011)β2microglobulininducesepitelialtomesenchymaltransitionandconferscancerlethalityandbonemetastasisinhumancancercells.cancerres.71(7):1-11。β2微球蛋白与非经典mhci成员血色素沉着病蛋白(hfe)以及与转铁蛋白受体相互作用,并且调节铁稳态,同上。在现有技术中广泛记载了β2微球蛋白参与恶性肿瘤的其他特征(自我更新、血管生成增强、治疗抗性)。
β2微球蛋白缺陷小鼠已被报道。参见koller等,(1990)normaldevelopmentofmicedeficientinβ2m,mhcclassiproteins,andcd8+tcells,science248:1227-1230。如koller等所报道的,这些小鼠外观健康,但是检测不到mhci类的表达。而且,在一些组织中大部分t细胞群是正常的,而在其他组织中观察到cd8+t细胞显著减少。这种所谓的mhci表达的缺乏,与此前allen等((1986)β2microglobulinisnotrequiredforcellsurfaceexpressionofthemurineclassihistocompatibilityantigenh-2dborofatruncatedh-2db,proc.natl.acad.sci.usa83:7447-7451)得到的结果不同。allen等报道了β2微球蛋白不是所有mhci复合物在细胞表面表达所必需的,因为缺乏β2微球蛋白的细胞能够表达h-2db。然而,据推测在这些细胞中h-2db的功能是受损的,并且h-2db的构象不同于天然蛋白,这解释了为何koller和他的同事使用针对天然h-2db的抗体无法检测到这种蛋白。然而,据报道缺乏β2微球蛋白的细胞可能递呈针对cd8+t细胞的内源性抗原(包括来自正常小鼠的内源性cd8+t细胞),并且据报道小鼠对抗原的攻击进行应答时不需要β2微球蛋白就能生成高水平的h-2dmhci类-限制性的cd8+ctl,尽管其是维持有效的免疫应答所需要的。quinn等,(1997)virus-specific,cd8+majorhistocompatibilitycomplexclassi-restrictedcytotoxictlymphocytesinlymphocyticchoriomeningitisvirus-infectedβ2-microglobulin-deficientmice,j.virol.71:8392-8396。值得注意的是,据报道在缺乏β2微球蛋白时产生高水平这种t细胞的能力限于h-2dmhci类-限制性的应答。已报道β2微球蛋白缺陷小鼠具有多种显著特征,例如对一些寄生虫病的敏感性增加、对肝炎感染的敏感性增加、在铁代谢中存在缺陷和繁殖表型受损。cooper等(2007)animpairedbreedingphenotypeinmicewithageneticdeletionofbeta-2microglobulinanddiminishedmhcclassiexpression:roleinreproductivefitness,biol.reprod.77:274-279。
在随机插入的转基因上同时表达人β2微球蛋白和人hlai类分子(即hla-b7)的小鼠已被报道。chamberlain等,(1988)tissue-specificandcellsurfaceexpressionofhumanmajorhistocompatibilitycomplexclassiheavy(hla-b7)andlight(β2-microglobulin)chaingenesintransgenicmice,proc.natl.acad.sci.usa85:7690-7694。人hlai类的表达与肝脏中内源性i类的显著减少一致,同上。人β2微球蛋白的表达还与内源性β2微球蛋白一致,而在双转基因小鼠中人hlai类分子的表达增加10-至17-倍,同上。然而,作者并没有试图用人β2微球蛋白基因座取代内源性β2微球蛋白基因座。
因此,本申请所公开的是一种基因改造的非人动物(例如啮齿动物,例如小鼠或大鼠),在其基因组中包含编码人源或人源化β2微球蛋白多肽的核苷酸序列。在一个方面,所述动物不表达来自内源性非人源β2微球蛋白基因座的内源性非人源β2微球蛋白。在一些实施方式中,编码β2微球蛋白多肽的所述核苷酸序列部分是人源的且部分是非人源的,例如其含有一些对应于人的氨基酸和一些对应于非人β2微球蛋白的氨基酸。在一个方面,所述非人动物不表达来自于内源性非人源基因座的内源性非人β2微球蛋白多肽,并且仅表达人源或人源化的β2微球蛋白多肽。在一个例子中,所述非人动物不表达来自于内源性β2微球蛋白基因座的完整的内源性非人源β2微球蛋白多肽,仅表达部分非人源内源性β2微球蛋白多肽。因此,在多种实施方式中,所述动物不表达来自于内源性非人源β2微球蛋白基因座的功能性非人源β2微球蛋白多肽。在一个特定方面,编码人源或人源化β2微球蛋白的所述核苷酸序列位于内源性非人源β2微球蛋白基因座。在一个方面,所述动物包含两个拷贝的β2微球蛋白基因座,其中包含编码人源或人源化β2微球蛋白多肽的核苷酸序列。在另一个方面,所述动物包含一个拷贝的β2微球蛋白基因座,其中包含编码人源或人源化β2微球蛋白多肽的核苷酸序列。因此,所述动物针对包含编码人源或人源化β2微球蛋白多肽的核苷酸序列的β2微球蛋白基因座可以是纯合子或杂合子。所述人源或人源化β2微球蛋白的核苷酸序列可以来源于在人群中天然存在的β2微球蛋白序列的集合。在不同实施方式中,本发明的基因修饰的非人动物在其生殖细胞中包含编码人源或人源化β2微球蛋白的核苷酸序列。在一个实施方式中,编码人源或人源化β2微球蛋白多肽的核苷酸序列包含编码包括人源β2微球蛋白氨基酸序列的多肽的核苷酸序列。在一个实施方式中,所述多肽能够与mhci蛋白结合。
编码人源或人源化β2微球蛋白多肽的核苷酸序列可以包含与整个人β2微球蛋白基因对应的核酸残基。或者,所述核苷酸序列可以包含编码人β2微球蛋白的氨基酸21-119中所示的氨基酸序列的核酸残基(即与成熟人β2微球蛋白对应的氨基酸残基)。在一个替代实施方式中,所述核苷酸序列可以包含编码人β2微球蛋白的氨基酸23-115中所示的氨基酸序列的核酸残基,例如人β2微球蛋白的氨基酸23-119中所示的氨基酸序列。人β2微球蛋白的核酸和氨基酸序列如gussow等所述,同上,其通过引用并入本申请。
因此,所述人源或人源化β2微球蛋白可以包含人β2微球蛋白多肽的氨基酸23-115中所示的氨基酸序列,例如人β2微球蛋白多肽的氨基酸23-119中所示的氨基酸序列,例如人β2微球蛋白多肽的氨基酸21-119中所示的氨基酸序列。或者,人β2微球蛋白可以包含人β2微球蛋白多肽的氨基酸1-119。
在一些实施方式中,编码人源或人源化β2微球蛋白的核苷酸序列包含人β2微球蛋白基因的外显子2至外显子4中所示的核苷酸序列。或者,所述核苷酸序列包含人β2微球蛋白基因的外显子2、3和4中所示的核苷酸序列。在这个实施方式中,外显子2、3和4中所示的核苷酸序列可操作地连接以使得所述基因正常转录和翻译。因此,在一个实施方式中,所述人源序列包含与人β2微球蛋白基因的外显子2至外显子4对应的核苷酸序列。在一个特定实施方式中,所述人序列包含与人β2微球蛋白基因的外显子2至外显子4之后约267bp对应的核苷酸序列。在一个特定实施方式中,所述人序列包含约2.8kb的人β2微球蛋白基因。
因此,所述人源或人源化β2微球蛋白多肽可以由包含人β2微球蛋白的外显子2至外显子4中所示的核苷酸序列例如与人β2微球蛋白基因的外显子2至外显子4对应的核苷酸序列的核苷酸序列所编码。或者,所述多肽可以由包含人β2微球蛋白基因的外显子2、3和4中所示的核苷酸序列的核苷酸序列所编码。在一个特定实施方式中,所述人源或人源化β2微球蛋白多肽由与人β2微球蛋白基因的外显子2至外显子4之后约267bp对应的核苷酸序列所编码。在另一个特定实施方式中,所述人源或人源化多肽由包含约2.8kb人源β2微球蛋白基因的核苷酸序列所编码。因为所述β2微球蛋白基因的外显子4含有5’非翻译区,因而所述人源或人源化多肽可以由包含β2微球蛋白基因的外显子2和3的核苷酸序列所编码。
本领域的普通技术人员将理解,尽管本实施例中描述了生成基因改造的动物的特定核酸和氨基酸序列,但是本申请中还提供了一种或多种保守或非保守氨基酸取代的序列或者由于遗传密码的简并性导致的与本申请所述的那些不同的序列。
因此,本申请提供了一种表达人β2微球蛋白序列的非人动物,其中所述β2微球蛋白序列与人β2微球蛋白序列具有至少约85%、90%、95%、96%、97%、98%或99%的同一性。在一个特定实施方式中,所述β2微球蛋白序列与实施例中所述的人β2微球蛋白序列具有至少约90%、95%、96%、97%、98%或99%的同一性。在一个实施方式中,所述人β2微球蛋白序列包含一个或多个保守的取代。在一个实施方式中,所述人β2微球蛋白序列包含一个或多个非保守的取代。
此外,本申请提供了一种非人动物,其中编码人源或人源化β2微球蛋白的所述核苷酸序列还包含非人源β2微球蛋白基因的外显子1中所示的核苷酸序列。因此,在一个特定实施方式中,所述非人动物在其基因组中包含编码人源或人源化β2微球蛋白的核苷酸序列,其中所述核苷酸序列包含非人源β2微球蛋白的外显子1和人源β2微球蛋白基因的外显子2、3和4。因此,所述人源或人源化β2微球蛋白多肽由非人源β2微球蛋白基因的外显子1和人源β2微球蛋白基因的外显子2、3和4(例如人β2微球蛋白基因的外显子2和3)所编码。
与包含编码人源/非人源嵌合mhci多肽的核苷酸序列的非人动物类似,包含编码人源或人源化β2微球蛋白的核苷酸序列的非人动物可以选自以下组:小鼠、大鼠、家兔、猪、牛(例如奶牛、公牛、水牛)、鹿、绵羊、山羊、鸡、猫、狗、雪貂、灵长类动物(例如狨猴、猕猴)。在本发明的一些实施方式中,所述非人动物是哺乳动物。在一个特定实施方式中,所述非人动物是鼠源的例如啮齿动物(例如小鼠或大鼠)。在一个实施方式中,所述动物是小鼠。
因此,在一些方面,本申请提供了一种基因改造的小鼠,其中所述小鼠包含编码如本申请所述的人源或人源化β2微球蛋白多肽的核苷酸序列。本申请提供了一种基因改造的小鼠,其中所述小鼠在其内源性β2微球蛋白基因座包含编码人源或人源化β2微球蛋白多肽(例如人源或基本上人源的β2微球蛋白多肽)的核苷酸序列。在一些实施方式中,所述小鼠不表达来自内源性β2微球蛋白基因座的内源性β2微球蛋白多肽(例如功能性内源性β2微球蛋白多肽)。在一些实施方式中,所述基因改造的小鼠包含含有小鼠β2微球蛋白基因的外显子1以及人β2微球蛋白基因的外显子2、3和4的核苷酸序列。在一些实施方式中,所述小鼠表达人源或人源化β2微球蛋白多肽。
在一个方面,本申请提供了一种经修饰的非人源β2微球蛋白基因座,其包含异源β2微球蛋白序列。在一个实施方式中,所述异源β2微球蛋白序列是人源或人源化序列。
在一个实施方式中,所述经修饰的基因座是啮齿动物基因座。在一个特定实施方式中,所述啮齿动物基因座选自小鼠或大鼠基因座。在一个实施方式中,所述非人基因座被至少一个人源β2微球蛋白编码序列所修饰。
在一个实施方式中,所述异源β2微球蛋白序列可操作地与内源性调控元件连接,例如内源性启动子和/或表达控制序列。在一个特定实施方式中,所述异源β2微球蛋白序列是人序列并且所述人序列可操作地与内源性启动子和/或表达控制序列连接。
在一个方面,本申请提供了经修饰的非人源β2微球蛋白基因座,其包含可操作地与内源性启动子和/或表达控制序列连接的人序列。
在多种方面,基因修饰的非人动物,或者来自非人动物的细胞、胚胎或组织所表达的人源或人源化β2微球蛋白保留了内源性和/或人源β2微球蛋白全部的功能性方面。例如,优选的是所述人源或人源化β2微球蛋白结合mhci多肽(例如内源性非人源或人源mhci多肽)的α链。所述人源或人源化β2微球蛋白多肽可以结合、招募或以其他方式与任意其他分子例如与内源性非人源和/或人源β2微球蛋白相关的受体、锚定或信号分子(例如hfe等)相互作用。
除了基因修饰的动物(例如啮齿动物,例如小鼠或大鼠)以外,本申请还提供了组织或细胞,其中所述组织或细胞来源于如本申请所述的非人动物,并且包含外源β2微球蛋白基因或β2微球蛋白序列,即核苷酸和/或氨基酸序列。在一个实施方式中,所述异源β2微球蛋白基因或β2微球蛋白序列是人源或人源化β2微球蛋白基因或者人源或人源化β2微球蛋白序列。优选地,所述细胞是有核细胞。所述细胞可以是已知表达mhci复合物的任意细胞,例如抗原递呈细胞。所述细胞表达的人源或人源化β2微球蛋白多肽可以与内源性非人源mhci(例如啮齿动物mhci)相互作用以形成功能性mhci复合物。所得到的mhci复合物可能能够与t细胞例如细胞毒性t细胞相互作用。因此,本申请还提供了一种如本申请所述的非人动物的细胞与t细胞的体外复合物。
本申请还提供了一种非人细胞,其包含人源或人源化β2微球蛋白基因或序列,以及附加的人源或人源化序列例如本申请公开的嵌合mhci多肽。在这种情况下,所述人源或人源化β2微球蛋白多肽可以与例如人源/非人源嵌合mhci多肽相互作用,并且形成功能性mhci复合物。在一些方面,这种复合物能够与t细胞例如人源或非人源t细胞上的tcr相互作用。因此,本申请还提供了一种如本申请所述的非人源动物的细胞与非人源t细胞形成的体外复合物。
本公开的另一个方面是一种啮齿动物胚胎(例如小鼠或大鼠胚胎),其包含如本申请所述的异源β2微球蛋白基因或β2微球蛋白序列。在一个实施方式中,所述胚胎包含es供体细胞,其包含所述异源β2微球蛋白基因或β2微球蛋白序列,以及宿主胚胎细胞。所述异源β2微球蛋白基因或β2微球蛋白序列是人源或人源化β2微球蛋白基因或β2微球蛋白序列。
本发明还包含一种非人动物细胞,其包含如本申请所述的非人动物的染色体或其片段(例如其中所述染色体或其片段包含编码人源或人源化β2微球蛋白多肽的核苷酸序列)。所述非人细胞可以包含如本申请所述的非人动物的细胞核。在一个实施方式中,所述非人细胞包含作为核转移结果的所述染色体或其片段。
在一个方面,本申请提供了一种非人诱导的多能干细胞,其包含异源β2微球蛋白基因或β2微球蛋白序列。在一个实施方式中,所述诱导的多能干细胞来源于本申请所述的非人动物。在一个实施方式中,所述异源β2微球蛋白基因或β2微球蛋白序列是人源或人源化基因或序列。
本申请还提供了一种杂交瘤或四价体瘤,其来源于如本申请所述的非人动物细胞。在一个实施方式中,所述非人动物是小鼠或大鼠。
本公开还提供了一种制备本申请所述的基因改造的非人动物(例如基因改造的啮齿动物,例如小鼠或大鼠)的方法。所述方法最终生成一种动物,所述动物的基因组中包含编码人源或人源化β2微球蛋白多肽的核苷酸序列。在一个方面,所述方法最终生成一种基因改造的小鼠,所述小鼠在其基因组的内源性β2微球蛋白基因座包含编码人源或人源化β2微球蛋白多肽的核苷酸序列。在一些情况下,所述小鼠不表达来自于内源性小鼠β2微球蛋白基因座的功能性小鼠β2微球蛋白。在一些方面,所述方法利用使用
本申请还提供了一种用于生成基因改造的非人动物的核苷酸构建体。所述核苷酸构建体可以包含:5’和3’非人同源臂、包含人β2微球蛋白序列的人dna片段和两侧具有重组位点的筛选基因表达盒。在一个实施方式中,所述人dna片段是包含人源β2微球蛋白基因的内含子和外显子的基因组片段。在一个实施方式中,所述非人同源臂与非人源β2微球蛋白基因座具有同源性。所述基因组片段可以包含人β2微球蛋白基因的外显子2、3和4。在一个例子中,所述基因组片段包含,从5’至3’:外显子2、内含子、外显子3、内含子和外显子4、全部人β2微球蛋白序列。所述筛选基因表达盒可以位于构建体中β2微球蛋白编码区以外的任意位置,例如其可以位于人β2微球蛋白外显子4的3’端。5’和3’非人同源臂可以分别包含内源性非人β2微球蛋白基因的5’端和3’端基因组序列。在另一个实施方式中,5’和3’非人同源臂可以分别包含内源性非人基因外显子2的5’端和外显子4的3’端基因组序列。
本发明的另一个方面涉及一种修饰非人动物(例如啮齿动物,例如小鼠或大鼠)的β2微球蛋白基因座的方法,以表达本申请所述的人源或人源化β2微球蛋白多肽。修饰小鼠的β2微球蛋白基因座以表达人源或人源化β2微球蛋白多肽的一种方法包括在内源性β2微球蛋白基因座用编码人源或人源化β2微球蛋白多肽的核苷酸序列取代编码小鼠β2微球蛋白的核苷酸序列。在这种方法的一个实施方式中,所述小鼠不表达来自内源性小鼠β2微球蛋白基因座的功能性β2微球蛋白多肽。在一些特定实施方式中,所述编码人源或人源化β2微球蛋白多肽的核苷酸序列包含人β2微球蛋白基因外显子2至4中所示的核苷酸序列。在其他实施方式中,编码所述人源或人源化β2微球蛋白多肽的核苷酸序列包含人β2微球蛋白基因外显子2、3和4中所示的核苷酸序列。
基因修饰mhci/β2微球蛋白的动物
在多种实施方式中,本发明通常提供了一种基因修饰的非人动物,所述动物在其基因组中包含编码人源或人源化mhci和β2微球蛋白多肽的核苷酸序列;因此所述动物表达人源或人源化mhci和β2微球蛋白多肽。
在使用混合的人源/非人源系统组件时会出现功能差异。hlai类与β2微球蛋白的结合比小鼠i类紧密。bernabeu(1984)β2-microgobulinfromserumassociateswithmhcclassiantigensonthesurfaceofculturedcells,nature308:642-645。消除功能差异的尝试体现在对特定人源化mhc小鼠的构建上。已开发了h-2i类和2类敲除小鼠(在小鼠β2微球蛋白ko背景下),其表达具有人的α1和α2以及小鼠h-2db的α3的随机整合的人hla-a2.1/hla-dr1嵌合转基因,其在n-末端通过接头与人β2-微球蛋白的c-末端连接。参见例如pajot等,(2004)amousemodelofhumanadaptiveimmunefunctions:hla-a2.1-/hla-dr1-transgenich-2classi-/classii-knockoutmice,eur.j.immunol.34:3060-3069。据报道这些小鼠生成了针对乙肝病毒的抗原特异性抗体和ctl应答,而仅具有hla-a2.1的转基因小鼠或仅敲除h-2i类/ii类基因的小鼠则不会生成针对乙肝病毒的抗原特异性抗体和ctl应答。据推测导致仅具有hla-a2.1的转基因小鼠的缺陷的原因是这种小鼠具有引入内源性i类和/或ii类基因以避免使用任何转基因的能力,而mhc敲除小鼠则不具有这种选项。然而,所述小鼠至少可以表达h-2db,据推测这是由于培育到小鼠β2微球蛋白敲除背景的小鼠中造成的(参见pajot等,见前;其显然包含完整的内源性i类和ii类基因座)。
据报道与人β2微球蛋白融合的嵌合mhc在细胞表面的表达低于内源性mhc的表达,但是未报导生存率/nk杀伤率以及nk自杀率。pajot等,见前。在mhci类-缺陷β2微球蛋白敲除的小鼠中观察到了cd8+t细胞数的一些改善(占总脾细胞数的2-3%,相比之下在β2ko小鼠中为0.6-1%)。然而,t细胞可变区针对bv5.1、bv5.2和bv11基因片段使用情况发生了改变。据报道cd8+和cd4+t细胞应答仅限于针对免疫所述小鼠的适宜乙肝抗原。但是当小鼠仅经过两种抗原中的一种抗原免疫时,至少两只小鼠杀死了携带所述两种抗原中任意一种的细胞。这可能是由于缺乏nk细胞抑制或缺乏nk细胞选择性导致的。
如上文所述,针对人mhci和人β2微球蛋白转基因的小鼠包含编码嵌合mhci/β2微球蛋白的核苷酸序列,其中所述mhci和β2微球蛋白部分包含在单一多肽链中,从而使得mhciα链和β2微球蛋白彼此之间通过共价键连接以将其栓系在细胞表面上。本申请提供了一种小鼠,所述小鼠在其基因组中包含两个独立的核苷酸序列,其中一个编码人源或人源化mhci多肽,另一个编码人源或人源化β2微球蛋白多肽。本申请提供了一种小鼠,其将表达更像天然存在的mhci复合物的mhci复合物,其中在β2微球蛋白与mhciα链非共价结合的两个单独的多肽链上提供mhciα链和β2微球蛋白。
因此,本公开提供了一种非人动物,所述动物在其基因组中包含:编码人源或人源化mhci多肽的第一核苷酸序列,以及编码人源或人源化β2微球蛋白多肽的第二核苷酸序列。在一个方面,本申请提供了一种非人动物,所述动物在其基因组中包含:(a)编码人源/非人源嵌合mhci多肽的第一核苷酸序列,其中所述嵌合多肽的人部分包含人mhci的肽结合结构域或胞外结构域(例如hla-a、hla-b或hla-c;例如hla-a2),以及(b)编码人源或人源化β2微球蛋白多肽的第二核苷酸序列。
所述第一核苷酸序列可以位于内源性非人源mhci基因座,以使得所述动物在其基因组的mhci基因座包含内源性mhci基因的全部或部分(例如编码肽结合结构域或胞外结构域的部分)被相应的人mhci序列取代。因此,所述动物可以在内源性mhci基因座包含编码人mhci(例如hla-a、hla-b或hla-c;例如hla-a2)胞外结构域以及内源性非人源mhci(例如h-2k、h-2d等,例如h-2kb)跨膜和胞质结构域的核苷酸序列。在一个方面,所述动物是小鼠,并且所述第一核苷酸序列包含编码人hla-a2(例如hla-a2.1)胞外结构域以及小鼠h-2k(例如h-2kb)跨膜和胞质结构域的核苷酸序列。
所述第二核苷酸序列可以位于内源性非人源β2微球蛋白基因座,以使得所述动物在其基因组的β2微球蛋白基因座包含内源性β2微球蛋白基因的全部或部分被相应的人β2微球蛋白序列取代。所述第二核苷酸序列可以包含人β2微球蛋白基因外显子2至外显子4所示的核苷酸序列。或者,所述第二核苷酸序列可以包含人β2微球蛋白基因外显子2、3和4所示的核苷酸序列。在这个实施方式中,核苷酸序列彼此之间可操作地连接。所述第二核苷酸序列可以进一步包含非人β2微球蛋白外显子1的序列。
在一个方面,所述动物不表达来自内源性非人源mhci基因座的功能性mhci(例如不表达内源性mhci的肽结合结构域和胞外结构域),并且所述动物不表达来自内源性非人源β2微球蛋白基因座的功能性β2微球蛋白多肽。在一些方面,所述动物针对包含编码人源/非人源嵌合mhci多肽的核苷酸序列的mhci基因座以及包含编码人源或人源化β2微球蛋白的核苷酸序列的β2微球蛋白基因座是纯合的。在其他方面,所述动物针对包含编码人源/非人源嵌合mhci多肽的核苷酸序列的mhci基因座以及包含编码人源或人源化β2微球蛋白的核苷酸序列的β2微球蛋白基因座是杂合的。
优选地,所述第一和第二核苷酸序列可操作地与内源性表达调控元件(例如启动子、增强子、沉默子等)连接。
本申请包含的所述第一和第二核苷酸序列(及其编码的多肽)的多种其他实施方式是根据说明书所描述的实施方式易于理解的,例如涉及基因改造的mhci动物和基因改造的β2微球蛋白动物的章节所描述的那些。
在一个方面,本公开提供了一种小鼠,所述小鼠在其基因组中包含(a)编码人源/小鼠嵌合mhci多肽(特别是hla-a2/h-2k多肽)的第一核苷酸序列,其中所述嵌合多肽的人部分包含人hla-a2的胞外结构域和小鼠部分包含小鼠h-2k的跨膜和胞质结构域,以及(b)编码人源或人源化β2微球蛋白多肽的第二核苷酸序列(例如,其中所述核苷酸序列包含人源β2微球蛋白基因外显子2至外显子4所示的核苷酸序列或人源β2微球蛋白基因外显子2、3和4所示的核苷酸序列),其中所述第一核苷酸序列位于内源性h-2k基因座,以及所述第二序列位于内源性β2微球蛋白基因座。在一个实施方式中,所述小鼠不表达来自其各自内源性基因座的功能性h-2k和小鼠β2微球蛋白多肽。在一个实施方式中,所述小鼠表达人源/小鼠嵌合mhci多肽和人源或人源化β2微球蛋白多肽。
如下述实施例所述,与仅针对mhci人源化的动物相比,共表达人源或人源化mhci和β2微球蛋白的基因改造的动物显示出在细胞表面嵌合mhci类的表达增加。在一些实施方式中,与缺乏人源或人源化β2微球蛋白时人源或人源化mhci的表达相比,人源或人源化mhci和β2微球蛋白的共表达使得人源或人源化mhci在细胞表面表达的增加超过约10%,例如超过约20%,例如超过约50%或以上,例如约70%。
本公开还提供了一种制备基因改造的非人动物(例如啮齿动物,例如大鼠或小鼠)的方法,其基因组包含本申请所述的第一和第二核苷酸序列。所述方法通常包括生成第一基因改造的非人动物,其基因组包含本申请所述的第一核苷酸序列(即人源或人源化mhci序列),生成第二基因改造的非人动物,其基因组包含本申请所述的第二核苷酸序列(即人源或人源化β2微球蛋白序列),以及将所述第一和第二动物交配以获得其基因组含有这两种核苷酸序列的子代。在一个实施方式中,所述第一和第二动物分别针对所述第一和第二核苷酸序列是杂合的。在一个实施方式中,所述第一和第二动物分别针对所述第一和第二核苷酸序列是纯合的。在一个实施方式中,所述第一和第二动物通过分别使用所述第一和第二核苷酸序列取代内源性非人源基因座产生。在一个方面,所述第一和第二动物通过利用
基因修饰动物的用途
在多种实施方式中,本申请所述的基因修饰的非人动物生成在细胞表面具有人源或人源化mhci和/或β2微球蛋白的apc,并且作为结果以人样方式作为针对ctl的表位递呈来源于胞质蛋白的肽,因为复合物基本上所有的组分均是人源或人源化的。本发明基因修饰的非人动物可以用于在人源化动物中研究人免疫系统的功能;用于鉴定激发免疫应答(例如t细胞表位,例如独特的人癌表位)的抗原和抗原表位,例如用于开发疫苗;用于鉴定针对人病原体或癌抗原的高亲和性t细胞(即在具有高亲合力的人mhci复合物背景下与抗原结合的t细胞),例如用于适应性t细胞治疗;用于评估疫苗候选物和其他疫苗策略;用于研究人自身免疫;用于研究人感染性疾病;以及设计基于人mhc表达的其他更好的治疗策略。
mhci复合物与肽结合并将其递呈至细胞表面。在这种复合物背景下一旦被递呈至表面,所述肽被t细胞识别。例如,当所述肽来源于病原体或其他所关注的抗原(例如肿瘤抗原)时,t细胞识别能够造成t细胞活化,巨噬细胞杀死携带所递呈肽序列的细胞以及b细胞激活与所递呈的序列结合的抗体。
t细胞通过肽结合mhci类胞外结构域和t细胞的cd8胞外结构域与表达mhci复合物的细胞相互作用。cd8+t细胞遇到具有适合与mhci类分子结合的抗原的apc将形成细胞毒性t细胞。因此,在mhci类背景下以高亲合力与t细胞受体结合的抗原在对人类疾病治疗的研发中具有潜在的重要意义。然而,在小鼠mhci背景下的抗原递呈仅与人类疾病略微相关,因为人和小鼠mhc复合物识别不同的抗原,例如小鼠mhci与人mhci可能不识别相同抗原或可能递呈不同表位。因此,针对人类病理学的大部分相关数据是通过对人mhci递呈的抗原表位的研究中获得的。
因此,在多种实施方式中,本发明的基因改造的动物除了其他方面以外在评估抗原在人体内启动免疫应答的能力方面是有用的,并且用于生成多样抗原以及鉴定可以用于人用疫苗研发中的特定抗原。
在一个方面,本申请提供了一种在具有某种肽序列的人中确定抗原性的方法,所述方法包括将如本申请所述的基因修饰的非人动物与包含所述肽序列的分子接触,使所述非人动物产生免疫应答,并且检测非人动物中与本申请所述的人源/非人源嵌合mhci或人源化的mhci复合物(包含人源/非人源嵌合mhci和人源或人源化β2微球蛋白)递呈的所述肽序列结合的细胞。
在一个方面,本申请提供了一种确定是否某种肽将在人体内激发细胞免疫的方法,所述方法包括将如本申请所述的基因修饰的非人动物与所述肽接触,使所述非人动物产生免疫应答,并且检测非人动物中通过本申请所述的人源/非人源嵌合mhci类分子与所述肽的序列结合的细胞。在一个实施方式中,接触后的所述非人动物包含与所述肽结合的mhci类-限制性的cd8+细胞毒性t淋巴细胞(ctl)。在一个实施方式中,ctl杀死携带所述肽的细胞。
在一个方面,本申请提供了一种用于鉴定人ctl表位的方法,所述方法包括将如本申请所述的非人动物与包含预测ctl表位的抗原接触,使所述非人动物产生免疫应答,从所述非人动物中分离与所述表位结合的mhci类-限制性的cd8+ctl,并且鉴定与mhci类-限制性的cd8+ctl结合的表位。
在一个方面,本申请提供了一种鉴定hlai类-限制性的肽的方法,所述肽通过人细胞递呈和通过人淋巴细胞(例如人t细胞)结合结果将对携带所述肽的细胞产生细胞毒性,所述方法包括将如本申请所述的非人动物(或其表达mhci类的细胞)与包含所关注肽的分子接触,分离表达与所关注的肽结合的人源/非人源嵌合i类分子的非人动物细胞,将所述细胞与能够产生hlai类-限制性的细胞毒性的人淋巴细胞接触,并且检测肽诱导的细胞毒性。
在一个方面,本申请提供了一种鉴定在人体内生成细胞毒性t细胞应答的抗原的方法,所述方法包括将预测抗原与如本申请所述的小鼠接触,使所述小鼠产生免疫应答,并且鉴定与hla-a-限制性的分子结合的抗原。
在一个实施方式中,所述抗原包括细菌或病毒表面或包膜蛋白。在一个实施方式中,所述抗原包括人肿瘤细胞表面上的抗原。在一个实施方式中,所述抗原包括假定供人体内使用的疫苗。在一个实施方式中,所述抗原包括在人体内产生抗体的人表位。在另一个实施方式中,所述抗原包括产生靶向表位/mhci复合物的高亲和性ctl的人表位。
在一个方面,本申请提供了一种确定是否预测抗原含有某一表位的方法,所述表位暴露于人免疫系统后产生hla-a-限制性的免疫应答(例如hla-a2-限制性的应答),所述方法包括将如本申请所述的小鼠与预测抗原接触并且测定小鼠中的抗原特异性hla-a-限制性的(例如hla-a2-限制性的)免疫应答。
在一个实施方式中,所述预测抗原选自生物药品或其片段、非自身蛋白、非自身细胞的表面抗原、肿瘤细胞的表面抗原、细菌或酵母或真菌细胞的表面抗原、病毒的表面抗原或包膜蛋白。
此外,本申请所述的基因改造的非人动物可以用于鉴定t细胞受体,例如高亲合力t细胞受体,其识别所关注的抗原,例如肿瘤或其他疾病抗原。所述方法可以包括:将本申请所述的非人动物与抗原接触,使所述非人动物产生针对所述抗原的免疫应答,从所述非人动物中分离包含与由人源或人源化mhci递呈的抗原结合的t细胞受体的t细胞,以及确定所述t细胞受体的序列。
在一个方面,本申请提供了一种鉴定对人肿瘤抗原具有高亲和性的t细胞受体可变结构域的方法,所述方法包括将包含人源化mhciα1、α2和α3结构域(例如hla-a2α1、α2和α3结构域)的小鼠与人肿瘤抗原接触;使所述小鼠产生免疫应答;以及从所述小鼠中分离编码t细胞受体可变结构域的核酸序列,其中所述t细胞受体可变结构域与人肿瘤抗原结合的kd不高于约1纳摩。
在一个实施方式中,所述小鼠进一步在内源性小鼠t细胞受体可变区基因座包含多个未经重排的人t细胞受体可变基因片段的取代,其中所述未经重排的人t细胞受体可变区基因片段与编码包含人可变区和小鼠恒定区的人-小鼠嵌合t细胞受体的基因重组。在一个实施方式中,所述小鼠包含人cd8转基因,并且所述小鼠表达功能性的人cd8蛋白。
对肿瘤抗原具有高亲合力的t细胞受体用于基于细胞的治疗。已通过将人t细胞与hla-a2接触制备针对人肿瘤抗原具有高亲合力的t细胞群,所述hla-a2已经过突变使得cd8与α3亚基的结合最小化,以仅选择那些对肿瘤抗原具有极高亲合力的t细胞(即尽管cd8不能与α3结合但识别所述抗原的t细胞克隆)。参见pittet等,(2003)α3domainmutantsofpeptide/mhcclassimultimersallowtheselectiveisolationofhighaviditytumor-reactivecd8tcells,j.immunol.171:1844-1849。所述非人动物和非人动物细胞用于鉴定与同t细胞受体高亲合力地结合的人hlai类形成复合物或活化的携带t细胞受体的淋巴细胞的肽。
可以采用本领域公知的任何适宜方法检测与t细胞结合或活化t细胞的抗原/hlai类。肽-特异性apc-t细胞的结合和活化是可检测的。例如,据报道t细胞与表达hla-a2的抗原递呈细胞的结合导致pip2在免疫突触中的蓄积,然而交联的mhci类分子则不会。参见fooksman等,(2009)cuttingedge:phosphatidylinositol4,5-bisphosphateconcentrationattheapcsideoftheimmunologicalsynapseisrequiredforeffectortcellfunction,j.immunol.182:5179-5182。
携带tcr的淋巴细胞与表达i类的apc相互作用的功能性后果也是可检测的,并且其包括通过所述淋巴细胞的细胞杀伤。例如,据报道hla-a2α2亚基的接触点通过cd8+ctl产生不依赖于fas的杀伤信号。当在已知(来自晶体学研究)与cd8接触的hla-a2分子的表位上接触(通过抗体)时,表达hla-a2-的jurkat细胞凋亡,其对胞质结构域不具有任何显著的依赖性。参见pettersen等,(1998)thetcr-bindingregionofthehlaclassiα2domainsignalsrapidfas-independentcelldeath:adirectpathwayfortcell-mediatedkillingoftargetcells?j.immunol.160:4343-4352。据推测由hla-a2α2与cd8+ctl的cd8接触诱导的迅速杀伤作用可能主要是由于这种不依赖于fas的hla-a2-介导的通路导致的(同上.),因为其不同于不依赖tcr的α3结构域介导的杀伤作用——其自身能够诱导凋亡(参见woodle等,(1997)anti-humanclassimhcantibodiesinduceapoptosisbyapathwaythatisdistinctfromthefasantigen-mediatedpathway,j.immunol.158:2156-2164)。
还可以通过t细胞增殖检测测定在mhci背景下t细胞与apc展示的肽之间相互作用的后果。或者,其可以通过检测通常与免疫应答的活化相关的细胞因子的释放确定。在一个实施方式中,可以使用ifnγelispot对cd8+t细胞的活化进行监测和定量。
如本申请所述,在本申请所述的基因修饰的非人动物中由于cd8与mhci的种属特异性结合可以阻止cd8+t细胞的活化。对于种属特异性cd8相互作用是理想的实施方式而言,如本申请所述的基因修饰动物(例如啮齿动物,例如小鼠或大鼠)的细胞与人细胞接触(例如在体外),例如人携带cd8的细胞,例如人t细胞。在一个实施方式中,如本申请所述的小鼠表达mhci类的细胞在体外与包含人cd8和t细胞受体的t细胞接触。在一个特定实施方式中,所述t细胞是人t细胞。在一个实施方式中,所述小鼠表达mhci类的细胞包含与人源/小鼠嵌合mhci或者人源化mhci复合物(其包括人β2微球蛋白)结合的肽,所述t细胞是人t细胞,并且测定t细胞与展示所述肽的小鼠细胞结合的能力。在一个实施方式中,测定通过展示所述肽的小鼠细胞对人t细胞的活化。在一个实施方式中,本申请提供了一种通过展示所述肽的细胞检测人t细胞活化的体外方法,所述方法包括将如本申请所述的小鼠或小鼠细胞与所关注的抗原接触,将来自所述小鼠的细胞或所述小鼠细胞(假定其携带来源于与人源或人源化mhci形成复合物的抗原的肽)与人t细胞接触,并且测定人t细胞的活化情况。在一个实施方式中,所述方法用于鉴定人病原体或人肿瘤的t细胞表位。在一个实施方式中,所述方法用于鉴定疫苗的表位。
在一个实施方式中,本申请提供了一种确定由假定的人体治疗造成的t细胞活化的方法,所述方法包括将如本申请所述的基因修饰动物与假定的人体治疗接触(或者例如将来源于这种动物的表达人源或人源化mhci的细胞与假定治疗的肽序列接触),将来源于基因修饰动物的展示人源或人源化mhci/肽复合物的细胞与包含能够与所述基因修饰动物的细胞结合的人t细胞受体和cd8的t细胞接触,以及检测被基因修饰动物展示所述肽的细胞诱导的人t细胞的活化情况。
在多种实施方式中,使用包含人cd8序列的t细胞例如人t细胞或包含编码人cd8的转基因的非人动物t细胞制备与来自如本申请所述动物的表达人源或人源化mhci类的细胞形成的复合物。人cd8的转基因小鼠是本领域公知的。tishon等,(2000)trangenicmiceexpressinghumanhlaandcd8moleculesgeneratehla-restrictedmeaslesviruscytotoxictlymphocytesofthesamespecificityashumanswithnaturalmeaslesvirusinfection,virology275(2):286-293;laface等,(1995)humancd8transgeneregulationofhlarecognitionbymurinetcells,j.exp.med.182:1315-1325。
除了能够鉴定人病原体或肿瘤的抗原和抗原表位以外,本发明的基因修饰动物还用于鉴定与人自身免疫性疾病相关的自身抗原,例如i型糖尿病、多发性硬化症等。例如,takaki等((2006)hla-a*0201-restrictedtcellsfromhumanizednodmicerecognizeautoantigensofpotentialclinicalrelevancetotype1diabetes,j.immunol.176:3257-65)描述了利用携带hla/β2微球蛋白单链的nod小鼠鉴定1型糖尿病的自身抗原。本发明的基因修饰动物还用于研究人自身免疫性疾病的不同方面。因为一些多态性的人mhci等位基因已知与某些疾病的进展相关,例如自身免疫性疾病(例如格雷夫斯氏病、重症肌无力、牛皮癣等;参见bakker等,(2006)ahigh-resolutionhlaandsnphaplotypemapfordiseaseassociationstudiesintheextendedhumanmhc,naturegenetics38:1166-72和supplementaryinformationandinternationalmhcandautoimmunitygeneticsnetwork(2009)mappingofmultiplesusceptibilityvariantswithinthemhcregionfor7immune-mediateddiseases,proc.natl.acad.sci.usa106:18680-85,其均通过引用并入本申请),包含包括这种等位基因的人源化mhci基因座的本发明的基因修饰动物可以作为自身免疫性疾病模型。在一个实施方式中,所述疾病的等位基因是hla-b27,并且所述疾病是强直性脊柱炎或反应性关节炎;因此,在一个实施方式中,用于研究这些疾病的动物包含人源或人源化hla-b27。
涉及mhci复合物的细胞免疫的其他方面是本领域公知的;因此,本申请所述的基因改造的非人动物可以用于研究免疫生物学的这些方面。例如,在体内tcr与mhci类的结合受到其他因素的调节。白细胞免疫球蛋白样受体亚家族b成员(lilrb1或lir-1)在mhci类-限制性的ctl上表达并且通过与apc上mhci类分子的α3亚基上的特定决定簇结合下调t细胞的刺激作用。结构研究显示lir-1与cd8的结合位点重叠,这表明抑制性的lir-1与刺激性的cd8竞争性与mhci类分子结合。willcox等,(2003)crystalstructureofhla-a2boundtolir-1,ahostandviralmajorhistocompatibilitycomplexreceptor,natureimmunology4(9):913-919;shirioshi等,(2003)humaninhibitoryreceptorsig-liketranscript2(ilt2)andilt4competewithcd8formhcclassibindingandbindpreferentiallytohla-g,proc.natl.acad.sci.usa100(15):8856-8861。lir-1通过其(细胞内)免疫受体酪氨酸抑制基序(itim)转导抑制性信号。在nk细胞中,研究表明缺乏itim(通常无法抑制)的kir(抑制性杀伤细胞ig样受体)能够在lir-1存在的情况下抑制与mhci类分子的α3结构域的结合(假设通过lir-1itim)(参见kirwin等,(2005)killercellig-likereceptor-dependentsignalingbyig-liketranscript2(ilt2/cd85j/lilrb1/lir-1)j.immunol.175:5006-5015),这表明与mhci类结合的lir-1与kir之间是协同作用的,从而在调节nk细胞抑制的hlaα3结构域的结合中发挥作用。
如上文所述,mhc分子与不表达tcr的细胞相互作用。这些细胞是nk细胞。nk细胞是细胞毒性淋巴细胞(不同于ctl或细胞毒性t淋巴细胞),其在细胞免疫应答特别是先天免疫中发挥核心作用。nk细胞是针对微生物、病毒和其他非自身(例如肿瘤)实体入侵的第一道防线。nk细胞通过表面受体被激活或抑制,并且其表达cd8但不表达tcr。nk细胞能够与表达mhci类的细胞相互作用,但是该相互作用是通过cd8-结合α3结构域而非tcr-结合、肽携带的α1和α2结构域。nk细胞的主要功能是破坏缺乏充足mhci表面蛋白的细胞。
在自然杀伤(nk)细胞表面的交联mhci类分子使得细胞内酪氨酸磷酸化、mhci类分子从免疫突触迁移和肿瘤细胞杀伤下调。rubio等,(2004)cross-linkingofmhcclassimoleculesonhumannkcellsinhibitsnkcellfunction,segregatesmhcifromthenkcellsynapse,andinducesintracellularphosphotyrosines,j.leukocytebiol.76:116-124。
nk细胞中的mhci类的另一个功能显然是防止自杀。nk细胞携带活化受体2b4和2b4的配体cd48;mhci类可能与2b4结合并阻止cd48对其的活化。betser-cohen(2010)theassociationofmhcclassiproteinswiththe2b4receptorinhibitsself-killingofhumannkcells,j.immunol.184:2761-2768。
因此,本申请所述的基因改造的非人动物能够用于研究这些非-tcr或非-ctl介导的过程以及设计用于其调节的方法。
实施例
本申请将通过下述的非限制性实施例对所述发明进行进一步的说明。这些实施例被列出以辅助阐述本发明,但并非旨在且不应被解释为以任何方式限制其范围。所述实施例不包括对本领域的普通技术人员公知的常规方法(分子克隆技术等)的描述。除非另有明示,否则份为重量份,分子量是平均分子量,温度以摄氏度表示且压力为处于或接近大气压。
实施例1:基因修饰hla-a2小鼠的构建和表征
实施例1:1:hla-a2/h-2k在mg87细胞中的表达。
使用本领域技术人员公知的标准分子克隆技术制备含有hla-a2/h-2k嵌合基因序列(图4a)的病毒构建体,以分析转染细胞中人源/小鼠嵌合mhci的表达情况。
简言之,使用编码α链α1、α2和α3结构域的外显子序列制备人源hla-a/小鼠h-2k嵌合病毒构建体并将其克隆至小鼠h-2k基因跨膜和胞质结构域编码序列的框架中(图4a,pmig-hla-a2/h2k)。如图4所示,所述构建体含有ires-gfp受体序列,其能够用于确定是否所述构建体能够在转染细胞中表达。
在人胚肾293(293t)细胞中制备和扩增含有上文所述嵌合构建体的病毒。将293t细胞接种于10cm培养皿中并使其生长至95%融合。使用25μgpmig-hla-a2/h2k、pmig-人hla-a2或pmig-人源化β2微球蛋白以及5μgpmdg(包膜质粒)、15μgpcl-eco(无包装信号ψ的包装构建体)、1mlopti-mem(invitrogen)制备dna转染混合物。将1ml已事先混合在一起并在室温下孵育5分钟的该dna混合物加入含80μllipofectamine-2000(invitrogen)的1mlopti-mem中。将lipofectamine/dna混合物在室温下继续孵育20分钟,然后加入10cm培养皿中,并将该培养皿在37℃下孵育。24小时后收集细胞培养基并将10ml新鲜的r10(rpmi1640+10%fbs)培养基加入细胞中。重复更换两次该培养基。总计4天后,将所收集的培养基混合,离心并使用无菌滤器过滤以除去细胞碎片。
使用上述制备的扩增病毒转导mg87(小鼠成纤维细胞)细胞。使用pbs洗涤一次来自单一t-75培养瓶的mg87细胞。将3ml0.25%胰酶+edta加入细胞中并在室温下孵育3分钟。将7mld10(高葡萄糖dmem;10%胎牛血清)加入细胞/胰酶混合物中并转移至15ml试管中1300rpm离心5分钟。离心细胞后,吸出培养基并将细胞重悬于5mld10中。计数细胞并以~3.0x105个细胞每孔接种于6孔板中。将pmig-人hla-a2或pmig-hla-a2/h-2k单独或与pmig-人源化β2微球蛋白病毒一并加入孔中,使用未转导的细胞作为对照。将细胞在37℃5%co2条件下孵育2天。制备细胞用于针对在存在或不存在β2微球蛋白的条件下hla-a2表达的facs分析(使用抗-hla-a2抗体,克隆bb7.2)。
图(图4b)以及汇总图中数据的表(图4c)中的结果表明与人源化β2微球蛋白共转染增加人hla-a2或人源/非人源嵌合hla-a2/h-2k的表达,如曲线向右侧迁移所示。
实施例1.2:改造嵌合hla-a2/h-2k基因座。
利用使用
简言之,在单一靶向事件中使用编码人hla-a*0201基因α1、α2和α3结构域的人基因组dna取代编码小鼠h-2k基因α1、α2和α3亚基的基因组序列,所述单一事件使用靶向载体,其包含在两侧具有loxp位点的潮霉素表达盒,所述潮霉素表达盒具有5’小鼠同源臂,其包含包括5’非翻译区的小鼠h-2k基因座的5’序列(utr;5’同源臂如seqidno:1所示),以及3’小鼠同源臂,其包含小鼠h-2kα3编码序列的3’基因组序列(3’同源臂如seqidno:2所示)。
用于靶向内源性h-2k基因座的最终构建体从5’至3’包括:(1)5’同源臂,其包含~200bp包括5’utr的内源性h-2k基因的小鼠5’基因组序列,(2)~1339bp人基因组序列,其包括hla-a*0201先导序列、hla-a*0201先导/α1内含子、hla-a*0201α1外显子、hla-a*0201α1-α2内含子、hla-a*0201α2外显子、~316bpα2-α3内含子的5’端,(3)5’loxp位点,(4)潮霉素表达盒,(5)3’loxp位点,(6)~580bp人基因组序列,其包括~304bpα2-α3内涵子的3’端、hla-a*0201α3外显子和(7)3’同源臂,其包含~200bp包括小鼠h-2kα3与跨膜编码序列之间的内含子的小鼠基因组序列(参见图5针对h-2k靶向载体的示意图)。在靶向载体5’端小鼠/人序列接头处140个核苷酸的序列如seqidno:3所示,在靶向载体3’端人/小鼠序列接头处159个核苷酸的序列如seqidno:4所示。使用该靶向载体进行同源重组得到了经修饰的小鼠h-2k基因座,其含有与内源性小鼠h-2k跨膜和胞质结构域的编码序列可操作地连接的编码hla-a*0201基因α1、α2和α3结构域的人基因组dna,其在翻译后将形成人源/小鼠嵌合mhci类蛋白。
使用目标bacdna电穿孔小鼠f1h4es细胞以形成用于生成在有核细胞(例如t和b淋巴细胞、巨噬细胞、中性粒细胞)表面表达的嵌合mhci类蛋白的小鼠的经修饰的es细胞。通过定量taqmantm检测鉴定含有人hla序列插入的es细胞。设计特定的引物对和探针检测人hla序列以及相关筛选基因表达盒(获得等位基因goa)的插入以及内源性小鼠序列的缺失(缺失等位基因loa)。表1中显示了在定量pcr检测中使用的各探针的名称以及检测部位。
表1:检测基因型使用的探针
可以采用本领域技术人源公知的方法除去筛选基因表达盒。例如,可以使用表达cre的构建体转染携带人源/小鼠嵌合mhci类基因座的es细胞以除去插入含有人hla-a*0201基因序列的靶向构建体引入的“loxed”潮霉素表达盒(见图5)。可以任选地通过与表达cre重组酶的小鼠交配除去潮霉素表达盒。任选地,所述潮霉素表达盒保留在小鼠中。
使用上文所述的靶向es细胞作为供体es细胞并通过
实施例1.3:在基因修饰的小鼠中嵌合hla-a/h-2k的体内表达
对携带实施例1.2中所述的基因修饰的h-2k基因座的杂合子小鼠进行分析,以检测在所述动物的细胞中嵌合hla-a/h-2k蛋白的表达情况。
分别从野生型和hla-a/h-2k嵌合杂合子(a2/h2k)小鼠中收集血样。使用藻红蛋白(pe)偶联的抗-hla-a抗体对细胞中的人hla-a2进行染色,并且将细胞与异藻蓝蛋白偶联的抗-h-2kb抗体在4℃下接触1小时。采用流式细胞术使用对hla-a和h-2kb具有特异性的抗体分析细胞的表达情况。图6a显示了在野生型和嵌合杂合子中h-2kb和hla-a2的表达情况,所述嵌合杂合子表达这两种蛋白。图6b显示了在杂合子小鼠中h-2kb和嵌合hla-a2/h2k的表达情况。
实施例2:基因修饰β2微球蛋白小鼠的构建和表征
实施例2.1:工程化人源化β2微球蛋白基因座。
利用使用
简言之,通过将含有来自rpci-23文库(invitrogen)bac克隆89c24的小鼠β2m上游和下游同源臂细菌同源重组产生靶向载体。对小鼠同源臂进行工程化改造,在外显子2至非编码的外显子4下游约267个核苷酸范围的翼侧插入2.8kb人β2mdna片段(图7)。将在重组酶识别位点(例如loxp位点)翼侧设置的药物筛选基因表达盒(新霉素)工程化至靶向载体以用于随后的选择。将最终的靶向载体线性化并电穿孔至f1h4小鼠es细胞系(valenzuela等,同上)。
通过
实施例2.2:人源化β2微球蛋白小鼠的表征
使用流式细胞术对针对人源化β2微球蛋白(β2m)基因是杂合子的小鼠的表达情况进行评估(图8和图9)。
简言之,使用本领域公知的技术从野生型、人源化β2m、人源化mhc(即人hla)i类以及β2m和mhci类双人源化小鼠的组(每组n=4)中分离血样。使用ack裂解缓冲液(lonzawalkersville)处理每组中各只小鼠的血样以除去红细胞。使用荧光染料偶联的抗-cd3(17a2)、抗-cd19(1d3)、抗-cd11b(m1/70)、抗-人hlai类和抗-人β2微球蛋白(2m2)抗体对其余细胞进行染色。使用bd-facscantotm(bdbiosciences)进行流式细胞术检测。
对来自单一人源化和双人源化动物的细胞中人hlai类的表达情况进行检测,而仅在来自双人源化小鼠的细胞中对β2微球蛋白的表达情况进行检测(图8)。与缺乏人β2m时人hlai类的表达相比,人β2m和人hlai类共表达使得人hlai类在细胞表面可检测的量增加(图9,平均荧光强度2370对比1387)。
实施例3:对来自表达hla-a2/h-2k和人源化β2微球蛋白的基因修饰小鼠的apc递呈的flu和爱泼斯坦-巴尔病毒(ebv)肽的免疫应答。
对来自若干人供体的pbmc进行筛选,以确定hla-a2的表达及其产生针对flu和ebv肽的应答的能力。选择用于后续实验的单一供体。
使用反向选择从所选择供体的pbmc中分离人t细胞。从针对嵌合hla-a2/h-2k是杂合子和针对人源化β2-微球蛋白基因是杂合子的小鼠以及野生型小鼠中分离脾脏非-t细胞。将来自小鼠的约50,000个脾脏非-t细胞加入已使用抗人ifnγ抗体包被的elispot板中。加入flu肽(10微摩)或ebv肽的混合物(各5微摩)。加入polyic,25微克/孔,并将所述孔在37℃5%co2下孵育3小时。将人t细胞(50,000)和抗-人cd28加入脾脏非t细胞和所述肽中,并请将所述孔在37℃5%co2下孵育40小时,随后进行ifnγelispot检测。
如图10所示,当由在其表面表达嵌合hla-a2/h-2k和人源化β2微球蛋白的小鼠apc递呈时,人t细胞能够产生针对flu和ebv多肽的应答。
等同物
本领域技术人员能够识别,或者能够使用不超过常规的实验确定本申请所述的发明的特定实施方式的多种等同物。这种等同物意图被包含在下述权利要求中。
本申请通篇引用的非专利文件、专利申请和专利的全部内容通过引用整体并入本申请。
序列表
<110>瑞泽恩制药公司
<120>制备主要组织相容性复合物基因修饰小鼠的方法
<130>0825a-wo
<150>61/552,582
<151>2011-10-28
<150>61/552,587
<151>2011-10-28
<150>61/700,908
<151>2012-09-14
<160>8
<170>patentin3.5版
<210>1
<211>200
<212>dna
<213>人工的
<220>
<223>mhci目标构建体的5'同源臂
<400>1
ggattccccatctccacagtttcacttctgcacctaacctgggtcaggtccttctgtccg60
gacactgttgacgcgcagtcagctcttacccccattgggtggcgcgatcacccaagaacc120
aatcagtgtcgccgcggacgctggatataaagtccacgcagcccgcagaactcagaagtc180
gcgaatcgccgacaggtgcg200
<210>2
<211>200
<212>dna
<213>人工的
<220>
<223>mhci目标构建体的3'同源臂
<400>2
gtaaggagagtgtgggtgcagagctggggtcagggaaagctggagctttctgcagaccct60
gagctgctcagggctgagagctggggtcatgaccctcaccttcatttcttgtacctgtcc120
ttcccagagcctcctccatccactgtctccaacatggcgaccgttgctgttctggttgtc180
cttggagctgcaatagtcac200
<210>3
<211>149
<212>dna
<213>人工的
<220>
<223>人源/小鼠嵌合mhci基因座在小鼠/人序列5'端接头处的序列
<400>3
agtgtcgccgcggacgctggatataaagtccacgcagcccgcagaactcagaagtcgcga60
atcgccgacaggtgcgatggccgtcatggcgccccgaaccctcgtcctgctactctcggg120
ggctctggccctgacccagacctgggcgg149
<210>4
<211>159
<212>dna
<213>人工的
<220>
<223>人源/小鼠嵌合mhci基因座在小鼠/人序列3'端接头处的序列
<400>4
ggtggtgccttctggacaggagcagagatacacctgccatgtgcagcatgagggtttgcc60
caagcccctcaccctgagatggggtaaggagagtgtgggtgcagagctggggtcagggaa120
agctggagctttctgcagaccctgagctgctcagggctg159
<210>5
<211>21
<212>dna
<213>人工的
<220>
<223>检测潮霉素表达盒的探针
<400>5
acgagcgggttcggcccattc21
<210>6
<211>27
<212>dna
<213>人工的
<220>
<223>检测人hla-a2α2-α3内含子的探针
<400>6
agtccttcagcctccactcaggtcagg27
<210>7
<211>25
<212>dna
<213>人工的
<220>
<223>检测人hla-a2α2-外显子的探针
<400>7
taccaccagtacgcctacgacggca25
<210>8
<211>18
<212>dna
<213>人工的
<220>
<223>检测人hla-a2α2-α3内含子的探针
<400>8
atcctgtaccagagagtg18
- 还没有人留言评论。精彩留言会获得点赞!