用于示踪免疫细胞的试剂盒及方法与流程
本发明属于生物医药领域,具体涉及用于示踪免疫细胞的试剂盒、以及示踪方法。
背景技术:
基于免疫手段治疗慢性疾病和肿瘤是近年来快速发展的领域,其中特异性免疫细胞的数量和功能改善能有效控制许多慢性感染和癌症的进展,为彻底治愈创造机会和条件。免疫细胞研究是医学和生物学实验研究领域中的重要部分;然而,已有的临床研究提示,免疫细胞治疗还没有达到预期的疗效,主要原因是免疫细胞进入体内的变化情况以及到达靶器官的数量和需要的时间尚未明确,理论上认为,足够免疫细胞到达靶器官及其病灶是免疫细胞抗击感染和肿瘤的关键,因此,在临床研究前迫切需要进一步的基础研究,明确修饰后的细胞回输进入体内的走向以及靶器官的归巢现状,为进一步的临床试验提供理论依据。
大量的基础和临床实践证实,活化免疫细胞进入体内的途径有以下的方式:(1)体表淋巴结注射,免疫细胞可以通过淋巴循环进入特定组织和器官,但是淋巴结注射的细胞数量有限,同时通过淋巴结如何到达靶器官尚不能明确;(2)直接在特定靶器官的注入,该方法可以保证免疫细胞相对集中在特定的组织;但该方法复杂,一般需要手术,有创伤性;(3)向联系靶器官的深部血管注射,该方法也可保证足量的免疫细胞通过大血管进入特定器官的,但也有创伤,如大血管穿刺插管等复杂操作;(4)外周静脉内注射,操作简单,注入免疫细胞数量可控,但通过循环进入体内的免疫细胞可流至全身的各个器官,容易被某些网状内皮系统吞噬、滞留,无法估计到达靶器官的数量。因此,需要寻找一种简单、高效的免疫细胞示踪技术,通过现有的成像系统可以清楚观察外源免疫细胞注入后的路径和走向以及到达靶器官的时间和数量,有助于优化最初外周静脉给予的细胞数量。
技术实现要素:
本发明的目的在于针对以上要解决的技术问题,提供一种能够清楚观察免疫细胞在体内的走向、归巢的试剂盒。
本发明的另一目的在于提供能够清楚观察免疫细胞在体内的走向、归巢的方法。
为此,本发明提供了如下技术方案:
一种用于示踪免疫细胞的试剂盒,其包括:klh(keyholelimpethemocyanin,钥孔血蓝蛋白)和人白蛋白。
本发明还提供了一种免疫细胞示踪方法,其包括以下步骤:(1)用klh标记免疫细胞,klh使用剂量为5-15ug/ml;(2)将标记好的免疫细胞在37℃、5%(体积浓度)co2培养箱中孵育24-48小时;(3)洗涤后配制成细胞制剂,细胞浓度为2×106-1×107/ml,注入外周血循环;(4)利用ct影像学在48小时内,不同时间点观察细胞的走向;(5)获得免疫细胞最终归巢所需的时间、定位的器官部位和数量。
作为一种优选的实施方式,所述免疫细胞可以是天然免疫的nk细胞、t细胞、b细胞、树突状细胞(dc细胞),可以来源于外周血、骨髓、脏器等;不同种类的免疫细胞具有特定的标记。以外周血来源的dc细胞为例,与dc细胞表面标志性抗原的特异性抗体cd11、cd86、cd83与dc细胞孵育,进行流式细胞技术鉴定dc细胞为成熟的免疫细胞,保存在dc细胞培养液中,所述dc细胞培养液成分为:aim培养基中,含有gm-csf750-1000iu/ml和il-41000-2000iu/ml。
作为一种优选的实施方式,用klh标记免疫细胞包括:上述dc细胞溶液中加入klh至klh浓度为5-15ug/ml,最优选为10ug/ml,于37℃、5%(体积浓度)co2培养箱中孵育24-48小时。
作为一种优选的实施方式,配制细胞制剂包括:配置溶液:0.9%(质量浓度)生理盐水中加入终浓度为0.5%(质量浓度)的人白蛋白,洗涤klh标记dc细胞两至三次后,以上述dc细胞溶液配制注射用的dc细胞制剂,细胞浓度为2×106-1×107/ml,配制成10mldc细胞在体内走向示踪:从外周静脉注射步骤中获得的10mldc细胞制剂,在以下时间点进行ct影像学观察:0小时、4小时、24小时、48小时,根据klh在体内脏器的显色时间和显色大小,确定dc细胞从外周血进入体内的踪迹。
dc细胞体内脏器归巢包括:根据klh最终聚集在体内某脏器所需时间和显色大小,确定dc细胞从外周血进入体内的最终归巢的器官及器官内的部位,并确定其在归巢部位中停留的时间。
实验结果表明,应用本发明的试剂盒和方法,可以清楚地观察到免疫细胞在体外和体内的走向、归巢。
附图说明
图1是dc细胞成熟前后的表面特定标志示意图。
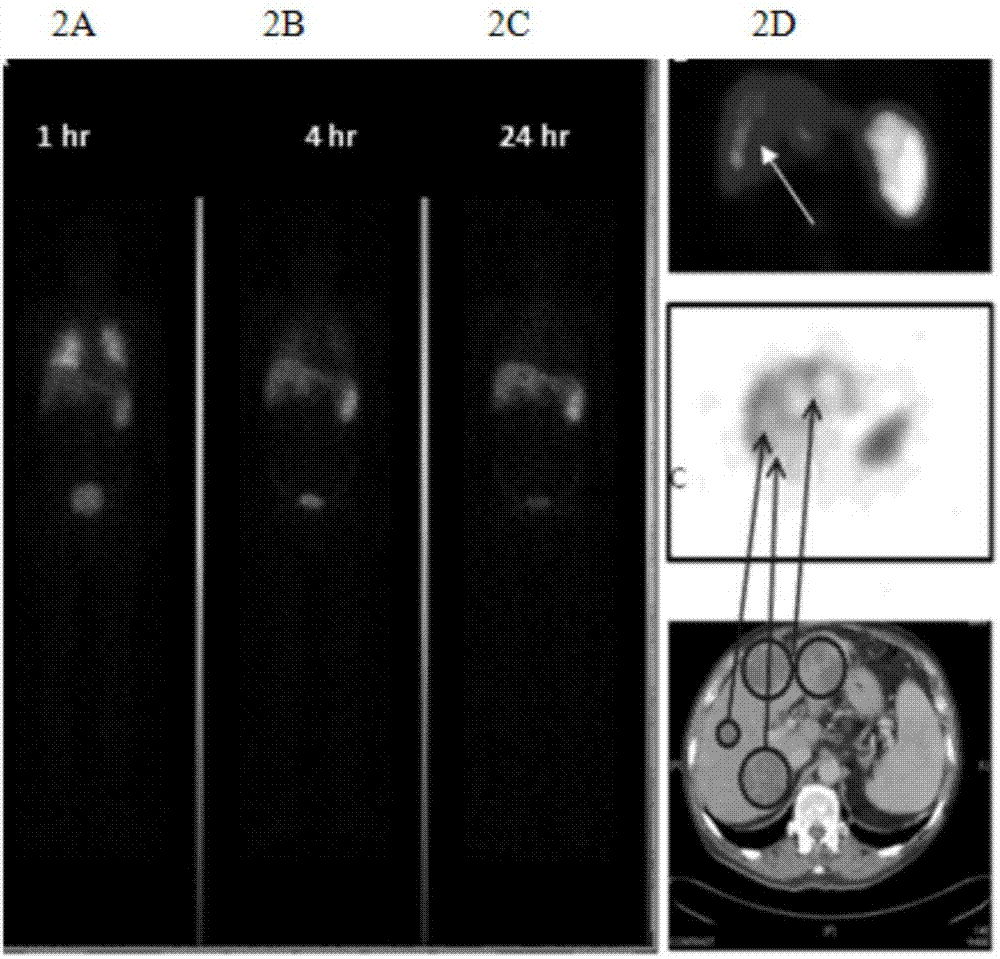
图2示出了外周静脉输注dc细胞后在体内的走向、定位、富集情况。
图3示出了外周静脉注射的免疫细胞的数量变化情况。
图4示出了t细胞的表型鉴定情况。
图5示出了t细胞在动物体内的数量和功能比较。
具体实施方式
下面结合具体实施例和附图对本发明的技术方案作进一步的详述,但并不对本发明的保护范围构成限制。
实例1:免疫细胞在人体内的示踪
本实例以自体免疫细胞从外周静脉注射后,观察免疫细胞在体内走向和归巢的路径以及达到靶器官的时间和数量。实施步骤如下:
(1)获得外周血单个核细胞(pbmc),并诱导培养成熟为dc细胞:
取10ml外周血,常规方法获得pbmc,使用免疫磁珠(从clinmacs公司购得)富集cd14+单核细胞,在dc诱导培养液中培养(培养液成份:常规培养基aim,加入gm-csf750-1000iu/ml和il-41000-2000iu/ml)5天,终浓度为2×106-1×107细胞/ml。
(2)鉴定免疫细胞表型标记:
利用hla-dr–alexafluor700、cd11c-apc(bdbiosciences)、cd141-pe、cd86-pe、cd83-cy5.5与上述步骤(1)获得的成熟dc孵育,并进行流式细胞仪检测,鉴定dc的成熟度。结果如图1和下表1所示。
图1是dc细胞成熟前后的表面特定标志示意图。其中,流式细胞技术鉴定dc细胞表面带有hla-dr、cd11c、cd83特异性标记。
表1:外周血获得的dc表面携带的特异性抗原标记的数量和比率
(3)制备具有示踪作用的注射用的dc细胞制剂:
采用临床级别的klh对dc细胞进行示踪标记,步骤如下:在浓度为2x106细胞/ml的dc溶液中,加入klh,使其中浓度为5-15ug/ml(10ug/ml最佳),于37℃,在5%(体积浓度)co2培养箱中孵育24-48小时,收集细胞,重悬于注射用溶液(0.9%(质量浓度)生理盐水+0.5%(质量浓度)人血白蛋白)中,并以该溶液反复洗涤两至三次,最后溶于10ml注射用溶液,得到细胞浓度为2×106-1x107细胞/ml,示踪细胞为:dc-klh。
(4)dc-klh体内示踪:
从外周静脉中缓慢注射上述dc-klh,5分钟内注射完毕;利用ct成像系统进行观察:如图2所示,图2a显示,dc-klh注射后1小时,可见双肺klh显色,表明dc-klh细胞外周静脉注射后1小时即到达肺部;图2b显示,dc-klh注射后4小时,肺部显色消失,脾脏和肝脏显色,提示免疫细胞已经移至脾脏和肝脏;dc-klh注射后24小时,脾脏显色减少,肝脏显色增强;同时免疫细胞主要积聚在肝内病灶区域,提示dc成功归巢,其显色是肺部显色的80%-85%,提示,静脉注射的免疫细胞在归巢过程中,大约15-20%被代谢。图2c显示,注射后第24小时,dc-klh在脾脏显影消失,而肝脏的显影越来越清晰;图2d显示,注射后第48小时,免疫细胞在肝脏病灶区持续显影,表明细胞仍然在病灶中高表达。提示,通过外周血进行免疫细胞输注,非常简便易行,并且能顺利到达靶器官(图3)。如图3所示,为外周静脉注射的免疫细胞的数量变化。根据klh显色的范围,计算注射后第0小时、1小时、4小时、24小时、48小时免疫细胞数量,与注射后1小时到达肺部的显色范围比较,4小时、24小时、48小时细胞数量分别为90%、85%、70%。可见,与注射前(0小时)相比,注射后1、4、24、48小时,免疫细胞数量有轻微降低,到24小时的目的靶器官,数量为注射前的85%,提示,静脉注入的免疫细胞基本都可以达到效应器官。
实例2:t细胞的示踪与归巢
本实施例以肝损伤大鼠模型的肝脏作为靶器官,本实施例中的t细胞来自人体(其获得符合伦理道德的要求),步骤如下:
(1)扩增培养人外周血t细胞:
从自愿者外周血活动pbmc,使用免疫磁珠(从clinmacs公司购得)富集cd3+t细胞,在t细胞培养液中扩增培养(培养液成份:常规培养基aim,加入okt30.5-2ug/ml、抗cd280.5-2ug/ml、il-2100-300iu/ml)2天,终浓度为2x106-1x107细胞/ml。
(2)鉴定免疫细胞表型和功能标记:
利用鉴定t细胞表型和功能的抗体cd3-q605、cd4-q665、cd8-v500、ifn-r-v450、tnf-a-pe-cy7(从bdbiosciences购置)与上述步骤(1)获得的t细胞孵育,并进行流式细胞仪检测,鉴定t细胞表型和功能(图4)。图4显示了t细胞的表型鉴定,从pbmc中成功获得t细胞及其两个主要亚型:cd+t细胞和cd8+t细胞。
(3)制备具有示踪作用的注射用的t细胞制剂:
采用临床级别的klh对t细胞进行示踪标记,步骤如下:在浓度为2x106细胞/ml的t细胞溶液中,加入klh,使其中浓度为5-15ug/ml,在5%co2培养箱中孵育24-48小时,收集细胞,重悬于注射用溶液(0.9%生理盐水+0.5%人血白蛋白)中,并以该溶液反复洗涤三次,最后溶于10ml注射用溶液,细胞浓度为2x106-1x107细胞/ml,示踪细胞为:t-klh。
(4)t-klh体内示踪:从两个途径注入大鼠体内,观察t细胞在体内的走向、归巢和定位。
途径一:从大鼠外周静脉中缓慢注射上述t-klh,5分钟内注射完毕;利用ct成像系统进行观察:t-klh注射后10分钟,可见双肺klh显色;t-klh注射后1小时,肺部显色消失,脾脏和肝脏显色;t-klh注射后4小时,脾脏显色减少,肝脏显色增强;同时免疫细胞主要积聚在肝内病灶区域,提示t细胞成功归巢,其显色是肺部显色的85%-95%,提示,静脉注射的免疫细胞在归巢过程中,大约10-15%被代谢。提示,通过外周血进行免疫细胞输注,非常简便易行,并且能顺利到达靶器官。
途径二:利用介入手术,从大鼠肝动脉直接注射t细胞,可见细胞通过动脉进入病灶区域,并归巢至肝细胞。
(5)免疫细胞归巢后功能鉴定:
断颈处死上述大鼠,取出肝脏,常规分离肝内淋巴细胞,获得标记有klh的t细胞,进行t-klh细胞频数和功能检测,由图5可见,其中,上图:t细胞分泌ifn-γ功能比较,方式1(外周静脉注射)比方式2(通过介入手术肝动脉插管注入)略有下降,但仍保持较高水平(注射前水平的>85%)。中间图:t细胞分泌tnf-α功能比较,方式1(外周静脉注射)比方式2(通过介入手术肝动脉插管注入)略有下降,但仍保持较高水平(注射前水平的>80%)。下图:t细胞数量的变化:t细胞分泌ifn-γ功能比较,方式1(外周静脉注射)比方式2(通过介入手术肝动脉插管注入)略有下降,但仍保持较高水平(注射前水平的>85%)。结果提示:(a)外源注射的t-klh细胞仍然保持良好功能,t细胞表面分泌较高的细胞因子水平,与体外检测水平无差异;(b)外源注射的t-klh细胞在肝内定位后,细胞数量较低于注射量:经外周静脉注入的细胞,达到肝脏病灶数量有所减少,为注射前的75-85%;经肝动脉插管直接进入肝脏病灶的细胞数量有所减少,为注射前的85-90%;(c)通过静脉注射的t-klh细胞数量低于肝动脉插管注射的细胞数量,但功能无差异(图5)。
- 还没有人留言评论。精彩留言会获得点赞!