一种基于蛋白互作用于检测细胞PD1表达情况的融合蛋白及其应用的制作方法
本发明涉及生物技术领域,特别是涉及一种检测细胞pd1表达情况的融合蛋白及其应用。
背景技术:
程序性死亡受体-1(programmedcelldeathprotein-1,pd1/cd279)是重要的免疫检查点,通过与其两个配体pdl1(b7-h1/cd274)和pdl2(b7-dc/cd273)的作用而抑制t细胞的活化及细胞因子的产生,在维持机体的外周耐受上发挥至关重要的作用。
免疫检查点本是人体免疫系统中起保护作用的分子,起类似刹车的作用,防止t细胞过度激活导致的炎症损伤等。而肿瘤细胞利用人体免疫系统这一特性,通过过度表达免疫检查点分子,抑制人体免疫系统反应,逃脱人体免疫监视与杀伤,从而促进肿瘤细胞的生长。
目前临床上研究和应用最广泛的免疫检查点抑制剂包括ctla-4、pd1和pdl1单抗,通过抑制免疫检查点活性,释放肿瘤微环境中的免疫刹车,重新激活t细胞对肿瘤的免疫应答效应,从而达到抗肿瘤的作用。
淋巴细胞上pd1的表达情况是临床检查、用药指导的重要标志物(biomarker)之一,目前市售的检测pd1的抗体有以下缺点:1.成本高,抗体的研发成本和生产成本较高;2.不灵敏,由于pd1抗体药物发展,高效灵敏的抗体,多用于开发治疗性药物;3.非特异结合,抗体本身易产生非特异结合,影响结果。4.检测结果难以统一,由于每个抗体的识别区不同,结合力不同,因此可能发生由于抗体不同而直接导致结果不同的现象发生。因此,急需开发稳定高效低廉的流式抗体替代品。
由于pdl1和pd1是天然存在的配体和受体,且以pdl1检测pd1能够最真实的反应可能受到免疫检查点影响的淋巴细胞的情况,但由于pdl1与pd1结合后,可以启动程序性死亡,因此简单的以pdl1作为检测pd1的方法尚不可行。
技术实现要素:
针对上述领域中的缺陷,提供一种融合蛋白,该蛋白既保证了pdl1与pd1的结合,又确保不会因为结合而引发程序性死亡。
同时本发明还提供该融合蛋白在检测pd1表达情况中的应用。与传统的抗体检测比较,具有效率高、成本低和更灵敏的优点,是一种快速、高效、精准的检测pd1的新方法。
一种融合蛋白,其特征在于由pdl1蛋白的结合区片段第18-132位氨基酸与gfp绿色荧光蛋白通过连接肽结合而得到。
所述连接肽序列为:ggggsggggsggggs、hhhhpggsvkkr、sapgtp、sapgtpsr或pg。
所述融合蛋白的氨基酸序列如seqidno:1所示。
pdl1-gfp:aftvtvpkdlyvveygsnmtieckfpvekqldlaalivywemedkniiqfvhgeedlkvqhssyrqrarllkdqlslgnaalqitdvklqdagvyrcmisyggadykritvkvnaggggsggggsggggsmskgeelftgvvpilveldgdvnghkfsvsgegegdatygkltlkficttgklpvpwptlvttfgygvqcfarypdhmkqhdffksampegyvqertiffkddgnyktraevkfegdtlvnrielkgidfkedgnilghkleynynshnvyimadkqkngikvnfkirhniedgsvqladhyqqntpigdgpvllpdnhylstqsalskdpnekrdhmvllefvtaagithgmdelyk
上述融合蛋白在检测细胞pd1表达情况中的应用。
本发明基于pd1和pdl1互作的三维立体结构,分析pdl1上参与结合的氨基酸区域为18位到132位氨基酸序列,将pdl1蛋白的结合区片段与gfp绿色荧光蛋白通过连接肽融合,实验表明,本发明的融合蛋白既保证了pdl1与pd1的结合,又确保不会因为结合而引发程序性死亡。
与传统的抗体检测比较,具有效率高、成本低和更灵敏的优点,是一种快速、高效、精准的检测pd1的新方法。
附图说明
图1pdl1与pd1互作的三维结构,
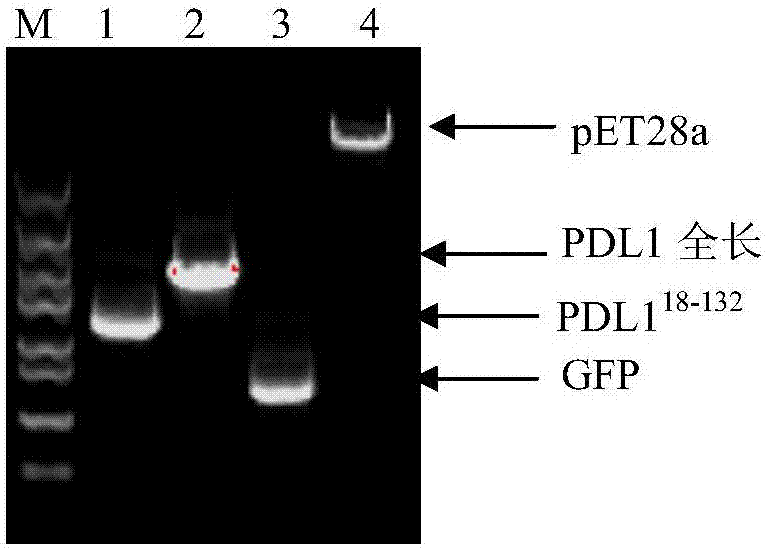
图2电泳分析pcr扩增结果,
其中1:pdl118-132;2:pd1全长;3:gfp;4:pet28a,
图3sds-page电泳分析蛋白表达结果,
图4质谱鉴定结果,
图5sds-page电泳分析蛋白表达及纯化结果,
其中1:空载体沉淀;2:pdl1-gfp蛋白沉淀;3:空载体上清;4:pdl1-gfp蛋白上清;5:流穿样品;6:washingbuffer洗脱样品;7:elutioni洗脱的前2ml;8:elutioni洗脱样品;9:elutionii洗脱样品
图6sds-page电泳分析蛋白表达及纯化结果,
1:空载体上清;2:pdl1-gfp蛋白上清;3:流穿样品;4、5:washingbuffer洗脱样品;6:elutionii洗脱的前2ml;7、8:elutionii洗脱样品;9:h2o洗脱样品,
图7sds-page电泳分析蛋白表达及纯化结果,
1:空载体上清;2:pdl1-gfp蛋白上清;3:流穿样品;4、5:washingbuffer洗脱样品;6:elutionii洗脱的前2ml;7、8:elutionii洗脱样品;9:h2o洗脱样品,
图8pdl1-gfp蛋白纯化(g25脱盐),
图9sds-page电泳分析蛋白表达及纯化结果,
其中1-5:洗脱峰;6:纯化前蛋白
图10流式检测pbmc凋亡情况,
图11流式细胞仪检测pd1表达情况,
其中1-阴性对照,2-流式抗体,3-pdl1-gfp,
图12荧光显微镜观察细胞pd1表达情况。
具体实施方式
下面结合实施例对本发明做进一步的详细说明。
下述实验材料均为市售。
实施例1
实验方法:
1、pdl1上参与结合的区域结构分析
根据解析的pdl1和pd1互作时的三维结构(图1),分析pdl1上参与结合的氨基酸区域为18位到132位氨基酸序列(框内),其中红色标出的为结合位点。参与结合的氨基酸序列为18aftvtvpkdlyvveygsnmtieckfpvekqldlaalivywemedkniiqfvhgeedlkvqhssyrqrarllkdqlslgnaalqitdvklqdagvyrcmisyggadykritvkvna132,标记为:pdl118-132。
pdl1-gfp融合蛋白氨基酸序列设计
pdl1-gfp:aftvtvpkdlyvveygsnmtieckfpvekqldlaalivywemedkniiqfvhgeedlkvqhssyrqrarllkdqlslgnaalqitdvklqdagvyrcmisyggadykritvkvna
ggggsggggsggggs(hhhhpggsvkkr)(sapgtp)(sapgtpsr)(pg)*
mskgeelftgvvpilveldgdvnghkfsvsgegegdatygkltlkficttgklpvpwptlvttfgygvqc
farypdhmkqhdffksampegyvqertiffkddgnyktraevkfegdtlvnrielkgidfkedgnilghk
leynynshnvyimadkqkngikvnfkirhniedgsvqladhyqqntpigdgpvllpdnhylstqsalskd
pnekrdhmvllefvtaagithgmdelyk
*:()中的序列为下画线部分序列的替代序列,为连接肽
2、构建pdl118-132与gfp的融合蛋白
利用pcr反应,以cdna序列为模版,扩增pdl118-132及gfp序列
pcr体系如下:
pcr条件如下:
3、利用同源重组方法,将扩增的到的pdl118-132和gfp片段以及载体进行链接,标记为:pdl1-gfp,反应体系如下:
50℃孵育15min,冰上冷却1min,取2μl重组产物转入dh5α感受态细胞中,加入950μllb培养基37℃200rpm培养1h,取100μl涂布于含100μg/ml卡那霉素的lb的平板,37℃培养过夜。
4、阳性克隆转入rosetta(de3)感受态细胞中
测序正确的阳性克隆,保种并提取质粒,转入rosetta(de3)感受态细胞中。
5、蛋白诱导表达
1)接菌于5ml液体lb培养基(k抗性)中,37℃,220rpm培养12h后,将5ml培养液全部转入300ml液体lb培养基(k抗性)中,培养约3h,od600达到0.5,加入iptg终浓度可以为0.1-1.0mm,温度可以为16℃-30℃,培养过夜12h;
2)10000rpm离心10min收集菌体,沉淀溶于20mmtris-hclph8.2的缓冲液中,进行超声破碎(冰浴),功率65%,时间5min,超3s停5s。超声后10000rpm离心20min,收集上清,沉淀用少量20mmtris-hclph8.2重悬;
3)sds-page分析蛋白表达情况。
6、蛋白纯化
1)ni柱以20mmtris-hcl冲洗5个柱体积后,上样,并收集流穿样品;
2)以5个柱体积的washingbuffer(20mmtris-hcl、100mm咪唑、500mmnacl)洗去杂蛋白收集样品;
3)以5个柱体积的elutonbufferi(20mmtris-hcl、250mm咪唑、500mmnacl)洗目的蛋白,收集样品;
4)以5个柱体积的elutonbufferii(20mmtris-hcl、500mm咪唑、500mmnacl)洗目的蛋白,收集样品;
5)sds-page分析各收集样品中的蛋白情况。
7、培养过程中pbmc凋亡的情况检测
1)pbmc处理:1000rpm离心5min,收集细胞,重悬于用0.5mlpbs洗一次,再以okm+5%fbs中,加入pdl1-gfp蛋白,终浓度为10μg/ml,37℃5%co2培养24h;
2)小心吸取pbmc,2000rpm离心10min;
3)以500μlpbs洗一次,2000rpm离心10min;
4)再以100μlpbs重悬细胞,分别加入7aad和annexinv进行单染,实验组同时加入7aad和annexinv进行双染,避光孵育30min;
5)加入1mlpbs,2000rpm离心10min;
6)再以1mlpbs洗一次,2000rpm离心10min,最后重悬于500μlpbs中备用。
实验结果:
1.pcr扩增pdl118-132及gfp片段
以h358的rna反转录的cdna为模板,分别扩增出pdl118-132片段和gfp片段,(图2)再与pet28a经同源重组进行链接,转入dh5α感受态细胞中,测序正确后,再转入rosetta(de3)中,进行表达;
2.pdl1-gfp蛋白提取
以pet28a转入rosetta(de3)的菌株为阴性对照,蛋白表达情况如图3所示,与载体相比,pdl1-gfp蛋白的上清和沉淀均有一条明显的表达带(图3箭头所指),质谱鉴定结果如图4所示,表达的蛋白为pdl1片段。
3.pdl1-gfp蛋白纯化工艺优化
1)ni柱纯化
扩大培养体系,大量制备pdl1-gfp蛋白纯化后以进行后续实验;蛋白纯化结果如图5(泳道8和9)所示,箭头所示位置为pdl1-gfp蛋白,在洗脱液中,均能得到pdl1-gfp蛋白的粗纯品,但浓度较低;以超滤管进行浓缩后,蛋白如图6(泳道7和8)所示,虽然,目的蛋白pdl1-gfp的浓度增加,但其它杂带也显现出来,因此,需要改进纯化条件,以得到高质量的粗纯品。
2)阴离子交换柱纯化
阴离子交换柱对原核表达的pdl1-gfp进行进一步纯化,结果如图7所示(泳道7-9),与图6相比,可以得到较纯的pdl1-gfp蛋白。
3)g25脱盐柱对离子交换对pdl1-gfp蛋白进行脱盐处理
g25脱盐柱对(2)中所得样品进行进一步纯化,结果如图8和图9所示(泳道1、2和4),与纯化前图9(泳道6)相比,可以得到较纯的pdl1-gfp蛋白。
4.pdl1-gfp蛋白短期内不会引起pbmc的凋亡
pd1/pdl1——程序性死亡受体/程序性死亡配体,因其功能而得名,在肿瘤免疫微环境中,肿瘤细胞上的pdl1,通过结合淋巴细胞上pd1,进而影响淋巴细胞发挥功能,因此,以pdl1检测pd1的首要条件是不能引发细胞程序性死亡,导致细胞凋亡。体外的凋亡实验表明(图10):没有任何处理的pbmc对照,早期凋亡和晚期凋亡的细胞比例为2.2%;加入pdl1-gfp蛋白后24h时,早期凋亡和晚期凋亡的细胞比例为2.1%,与对照组相似;48h后,pbmc早期凋亡和晚期凋亡的细胞比例为2.2%,说明,pdl1-gfp蛋白在短期内,并不能引发pbmc的凋亡,可用于细胞pd1的检测。
5.pdl1-gfp蛋白检测pd1表达情况——流式细胞仪
分别以市售pdl1流式检测抗体(thermoscientific,pd-1monoclonalantibody,ma5-16134)和本文构建的pdl1-gfp对pbmc上的pd1表达情况进行检测,结果如图11所示,1为阴性对照,2为市售pdl1流式检测抗体,可以检测到pd1的存在,阳性比例为67.9%,3为pdl1-gfp检测到的pd1+细胞,比例为99.6%远高于流式体检测到的比例;两种方法的比较见表1,以pdl1-gfp检测pd1,具有成本低,效率高和灵敏度高等优点,因此是体外检测pd1的最佳方法。
表1不同方法检测pd1的比较
6.pdl1-gfp蛋白检测pd1表达情况——荧光显微镜
以pdl1-gfp蛋白对pbmc上的pd1表达情况进行检测,荧光显微镜下观察的结果如图12所示,绿色的pbmc即为表达pd1的细胞。
综上所述,与抗体检测方法比较,以pdl1-gfp可以通过流式检测以及荧光显微镜检测对pd1的表达情况进行分析,且具有成本低、速度快和灵敏度高的优点,因此,以pdl1-gfp检测pd1是行之有效的新方法。
序列表
<110>北京鼎成肽源生物技术有限公司
<120>一种基于蛋白互作用于检测细胞pd1表达情况的融合蛋白及其应用
<130>pp17072-dct
<160>1
<170>siposequencelisting1.0
<210>1
<211>368
<212>prt
<213>programmedcelldeathprotein-1
<400>1
alaphethrvalthrvalprolysaspleutyrvalvalglutyrgly
151015
serasnmetthrileglucyslyspheprovalglulysglnleuasp
202530
leualaalaleuilevaltyrtrpglumetgluasplysasnileile
354045
glnphevalhisglyglugluaspleulysvalglnhissersertyr
505560
argglnargalaargleuleulysaspglnleuserleuglyasnala
65707580
alaleuglnilethraspvallysleuglnaspalaglyvaltyrarg
859095
cysmetilesertyrglyglyalaasptyrlysargilethrvallys
100105110
valasnalaglyglyglyglyserglyglyglyglyserglyglygly
115120125
glysermetserlysglyglugluleuphethrglyvalvalproile
130135140
leuvalgluleuaspglyaspvalasnglyhislyspheservalser
145150155160
glygluglygluglyaspalathrtyrglylysleuthrleulysphe
165170175
ilecysthrthrglylysleuprovalprotrpprothrleuvalthr
180185190
thrpheglytyrglyvalglncysphealaargtyrproasphismet
195200205
lysglnhisaspphephelysseralametprogluglytyrvalgln
210215220
gluargthrilephephelysaspaspglyasntyrlysthrargala
225230235240
gluvallysphegluglyaspthrleuvalasnargilegluleulys
245250255
glyileaspphelysgluaspglyasnileleuglyhislysleuglu
260265270
tyrasntyrasnserhisasnvaltyrilemetalaasplysglnlys
275280285
asnglyilelysvalasnphelysilearghisasnilegluaspgly
290295300
servalglnleualaasphistyrglnglnasnthrproileglyasp
305310315320
glyprovalleuleuproaspasnhistyrleuserthrglnserala
325330335
leuserlysaspproasnglulysargasphismetvalleuleuglu
340345350
phevalthralaalaglyilethrhisglymetaspgluleutyrlys
355360365
- 还没有人留言评论。精彩留言会获得点赞!