一种外源高表达乳酸脱氢酶突变体的高密度发酵方法与流程
本发明具体涉及一种外源高表达乳酸脱氢酶突变体的高密度发酵方法。
背景技术:
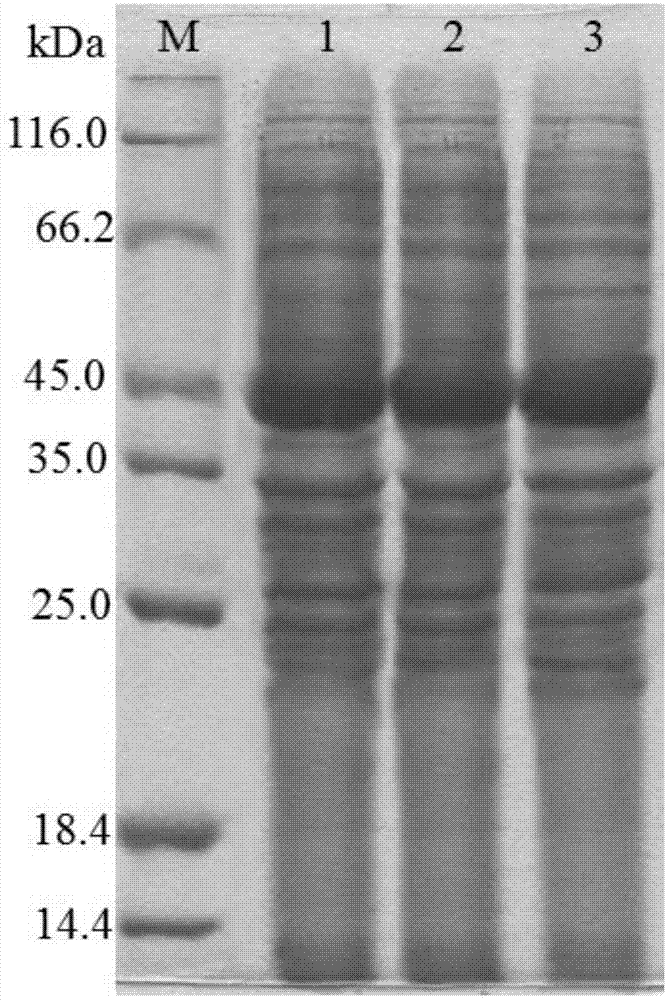
:乳酸菌发酵代谢中有一种乳酸脱氢酶(ldh),这种酶以nadh作为辅酶,经过生化反应将丙酮酸还原成乳酸,同时将nadh氧化成nad。ldh多用于生物转化体系中nad的再生利用。在生物催化制备化学品反应中,大多数氧化还原反应都需要nad或者nadh作为辅酶,而nad和nadh价格昂贵,为了降低生产成本,生物催化反应中的辅酶大多需要循环再生。辅酶再生有多种方法,包括酶法、化学法、基因工程法等,其中酶法是研究最多和经济性最高的方法。在工业生产规模下生物催化反应中重复利用辅酶具有广阔的前景。高密度发酵培养是提高表达量的一种方式,但是由于发酵的过程非常复杂,受到许多因素的影响,如微生物生长所需营养物质、发酵过程中生长抑制物的积累、溶解氧浓度及补料方式等,因此,要通过高密度发酵实现高表达目标蛋白并不容易。目前乳酸脱氢酶的基因工程菌的高密度发酵培养研究却一直没有进展,仍达不到大规模生产的需求。技术实现要素:为了解决上述问题,本发明提供了一种外源高表达乳酸脱氢酶突变体的高密度发酵方法,其特征在于:它包括如下步骤:(1)取含有seqidno.1所示核苷酸序列的重组菌,在培养基中培养至od600值为3.0~5.0,得种子液;(2)取种子液,加入发酵培养基中培养,至ph的上升幅度大于0.2/min、溶氧值上升幅度大于10%/min时,补料,当od600值为20~30时加入终浓度为0.5mmol/l的iptg进行诱导表达,培养至od600值为70~90,得发酵液。进一步地,步骤(1)所述重组菌是重组大肠杆菌。更进一步地,所述大肠杆菌是e.colidh5α、e.colibl21(de3)、e.colitop10或e.colijm109,优选e.colibl21(de3)。进一步地,步骤(1)所述培养基为lb培养基。进一步地,步骤(2)所述发酵培养基每1l包含如下组分:tryptone5~7g,yeastextract2.5~4g,nacl0.5~1.0g,na2hpo4·12h2o15~18g,kh2po43.5~5g,nh4cl2~3g,泡敌0.35~0.5ml,其余为水。进一步地,步骤(2)所述种子液与发酵培养基的体积比为1:15;和/或,步骤(2)中,诱导表达前的培养条件为:温度37℃、ph7.00、溶氧值大于30%;和/或,步骤(2)所述加料方法为恒速补加方法,补料速度为23ml/(h·l);和/或,步骤(2)中,诱导表达的培养条件为:温度30℃、ph7.00、溶氧值大于30%。进一步地,步骤(2)所述补料培养基的组分包括:无水葡萄糖450~500g/l,mgso4·7h2o22~25g/l,zncl20.06~0.075g/l,fecl3·6h2o0.875~1.012g/l,cuso4·5h2o0.05~0.07g/l,na2moo4·2h2o0.05~0.08g/l,cacl20.05~0.08g/l,h3bo30.015~0.02g/l,cocl2·6h2o0.05~0.08g/l,mnso4·h2o0.08~0.09g/l,盐酸3.5~4ml/l,维生素b10.003~0.005g/l,核黄素0.008~0.02g/l,泛酸0.05~0.08g/l,烟酸0.15~0.23g/l,吡哆醇0.045~0.06g/l,生物素0.002~0.003g/l,叶酸0.001~0.002g/l,naoh0.165~0.25g/l。本发明还提供了前述方法制备得到的发酵液。本发明还提供了一种制备粗酶液的方法,其特征在于:步骤如下:取前述方法制备得到的发酵液,离心,收集菌体,破菌,得粗酶液;优选地,所述破菌方法为:按菌体湿重与缓冲液1:3~1:10的比例搅拌均匀后,用高压均质机进行菌体破碎,破菌压力为300~900bar;所述缓冲液是磷酸盐缓冲液、tris缓冲液;和/或,所述缓冲液浓度是10~100mm;和/或,缓冲液ph值范围是ph7.5~8.5,优选为8.0。本发明还提供了前述方法制备得到的粗酶液。本发明还提供了一种乳酸脱氢酶突变体的分离纯化方法,其特征在于:它是将前述粗酶液上样到2mlnisepharose6ff小预柱上,待上样完成后用缓冲液淋洗到没有杂蛋白洗脱为止,然后用缓冲液梯度洗脱,收集目的蛋白峰,再将收集到的目的蛋白上样到superdex7510/300gl层析柱,用缓冲液进行分离,收集目的蛋白,用sds-page电泳检测为单一条带,与理论分子量一致,即完成纯化。进一步地,所述nisepharose6ff小预柱需要预先用50mmph8.0tris平衡;和/或,所述淋洗用缓冲液为50mmtris、500mmnacl、20mm咪唑组成的ph8.0的混合液;和/或,所述梯度洗脱用缓冲液为50mmtris、500mmnacl、250mm咪唑组成的ph8.0的混合液;和/或,所述分离用缓冲液为50mmph8.0tris。本发明方法通过特定的补料方式以及其他条件的配合,可大幅提高含可溶性乳酸脱氢酶突变体宿主菌的收获水平,且发酵工艺简便,成本低廉,可应用于大规模重复再生nad辅酶,应用前景良好。显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。附图说明图1粗酶液中乳酸脱氢酶突变体蛋白的sds-page蛋白电泳图(m为蛋白分子量标准;1为实施例1中粗酶液中的乳酸脱氢酶突变体;2为对比例1中粗酶液中的乳酸脱氢酶突变体;3为对比例2中粗酶液中的乳酸脱氢酶突变体)图2乳酸脱氢酶突变体纯化前后对比图(泳道1:marker;泳道2:破菌上清液;泳道3:纯化后)具体实施方式本发明下述实施例1,对比例1,对比例2中使用到的培养基配方见表1,表2,表3;未注明具体实验条件的,均为按照本领域技术人员熟知的常规操作,例如程丽娟、薛泉宏主编的《微生物学实验技术》。表1.lb培养基配方组分浓度tryptone10g/lyeastextract5g/lnacl10g/l其余为水表2.基础培养基配方表3.补料的培养基配方组分含量无水葡萄糖450~500g/lmgso4·7h2o22~25g/lzncl20.06~0.075g/lfecl3·6h2o0.875~1.012g/lcuso4·5h2o0.05~0.07g/lna2moo4·2h2o0.05~0.08g/lcacl20.05~0.08g/lh3bo30.015~0.02g/lcocl2·6h2o0.05~0.08g/lmnso4·h2o0.08~0.09g/l盐酸3.5~4ml/l维生素b10.003~0.005g/l核黄素0.008~0.02g/l泛酸0.05~0.08g/l烟酸0.15~0.23g/l吡哆醇0.045~0.06g/l生物素0.002~0.003g/l叶酸0.001~0.002g/lnaoh0.165~0.25g/l其余为水实施例1本发明乳酸脱氢酶的大肠杆菌高密度发酵一、重组菌的制备1、乳酸脱氢酶突变体基因lbldh1编码的重组乳酸脱氢酶突变体序列的设计根据菌株lactobacillusbulgaricus的基因组测序结果,对lbldh1基因的序列进行点突变优化,将63位谷氨酸突变为亮氨酸,将192位缬氨酸突变为蛋氨酸,将211位天冬氨酸突变为赖氨酸,然后采用大肠杆菌常用密码子替换稀有密码子,优化后的序列如seqidno.1所示,表达得到的乳酸脱氢酶突变的氨基酸序列如seqidno.2所示。seqidno.1gaattcatgaccaaaatttttgcgtatgcgattcgtgaagatgaaaaaccgttcctgaaagaatgggaagatgcgcacaaagatgtggaagtggaatacaccgataaactgctgaccccggaaaccgtggccctggccaaaggtgccgatggtgttgttgtttaccagcagctggattacaccgcgctgaccctgcaggcgctggcagataacggtattaccaaaatgagcctgcgtaacgtgggtgtggataacattgatatggcgaaagcgaaagaactgggtttccagattaccaacgtgccggtttacagcccgaacgcgattgcggaacacgccgcgattcaggcggcccgcattctgcgtcaggataaagccatggatgaaaaagtggcccgtcatgatctgcgttgggcaccgaccattggccgtgaagttcgcgatcaggtggttggtgtgattggtaccggccacatcggccaggttttcatgcagattatggaaggcttcggcgcgaaagttattgcgtatgatattttccgcaacccggaactggaaaagaaaggctattacatggactcactggacgacctgtacaaacaggcggacgtgattagcctgcacgttccgaaagttccggcgaacgttcacatgatcaacgacgaaagcatcgcgaaaatgaagcaggacgtagttatcgttaacgtaagccgtggtccgctggttgacaccgacgcggttatccgtggtctggacagcggcaagatctttggttacgcaatggacgtttacgaaggtgaagttggcatctttaacgaagactgggaaggcaaggagtttccggacgcacgtctggctgacctgatcgctcgtccgaacgttctggtgaccccgcacaccgctttctacactactcacgccgttcgcaacatggtagttaaagccttcgacaacaacctggaactggttgaaggcaaagaagccgaaactccggttaaagttggctaactcgagseqidno.2efmtkifayairedekpflkewedahkdveveytdklltpetvalakgadgvvvyqqldytaltlqaladngitkmslrnvgvdnidmakakelgfqitnvpvyspnaiaehaaiqaarilrqdkamdekvarhdlrwaptigrevrdqvvgvigtghigqvfmqimegfgakviaydifrnpelekkgyymdslddlykqadvislhvpkvpanvhmindesiakmkqdvvivnvsrgplvdtdavirgldsgkifgyamdvyegevgifnedwegkefpdarladliarpnvlvtphtafytthavrnmvvkafdnnlelvegkeaetpvkvg。在优化后的lbldh1序列的两端分别加入ecorⅰ和xhoⅰ酶切位点,将优化后的序列直接进行全基因合成,得目的片段。2、乳酸脱氢酶突变体重组质粒的构建将目的片段用ecorⅰ和xhoⅰ酶进行双酶切后,连接到同样用ecorⅰ和xhoⅰ酶双酶切后的pet28a(+)载体上,连接好的质粒导入到感受态大肠杆菌dh5α中,进行梯度稀释后涂平板,然后将平板放置到37℃培养箱过夜培养,次日挑取单克隆接种到5ml含有卡拉霉素(kan)的lb培养基中,37℃、160rpm,培养过夜,提取质粒。将质粒送测序,测序正确的质粒命名为pet28a-lbldh1。3、乳酸脱氢酶突变体重组基因工程菌的构建及诱导表达将测序正确的重组质粒pet28a-lbldh1导入到感受态大肠杆菌bl21(de3)中,得重组菌。二、发酵方法1.种子的活化配制50mllb培养基装于250ml三角瓶中。121℃灭菌30min,冷却。取出冻存的工作种子(步骤一制备的重组菌)一支解冻。使用无菌操作,在已灭菌的50mllb培养基中加入卡那霉素溶液使其终浓度为100ug/ml,然后接入整支工作种子。温度37℃,摇速220rpm,培养8~12小时。次日使用无菌操作取样,显微镜检查如无杂菌则可用于下一步操作。从一级种子中取出20ml,按照种子培养液与lb培养基1:50的比例接入活化后的种子。开启摇床调整温度至37℃,摇速220rpm,培养8~12小时,生物量达到od600值为3.0~5.0时作为二级种子。2.发酵罐培养按照1:15的比例将种子培养液转入发酵罐4l基础培养基中培养,控制温度为37℃,ph为7.00,溶氧值大于30%。其中,ph用氨水来控制;溶氧值通过调节空气/氧气流量和搅拌转速来提高,初始搅拌转速为150rpm,最大转速可达500rpm,密度增大后空气流量为0.5l/min,氧气流量可达3l/min。发酵刚开始不补料,当溶氧及ph值快速上升,且ph的上升幅度大于0.2/min,溶氧值大于10%/min时,开始补料。补料速度为23ml/(h·l)。3.诱导表达外源蛋白当od600值为20~30时进行诱导表达,加入终浓度为0.5mmol/l的iptg,降温至30℃。继续培养至od600值为70~90。三、检测发酵结束后,发酵液经10,000g,4℃离心10min收集菌体,菌体湿重为120g/l。称取10g菌体,与缓冲液1:10的比例搅拌均匀后,用高压均质机进行菌体破碎,破菌压力为700bar,收集上清液得到乳酸脱氢酶突变体粗酶液。经sds-page电泳检测,以粗酶液中目的蛋白条带粗细来判断乳酸脱氢酶的表达量。结果如图1。四、乳酸脱氢酶突变体的分离纯化取粗酶液5ml,上样到预先用50mmph8.0tris平衡好的2mlnisepharose6ff小预柱上,待上样完成后用50mmtris500mmnacl20mm咪唑ph8.0的缓冲液淋洗到没有杂蛋白洗脱为止,然后用50mmtris500mmnacl250mm咪唑ph8.0的缓冲液梯度洗脱,收集目的蛋白峰;将收集到的目的蛋白上样到superdex7510/300gl层析柱进行分离,缓冲液为50mmph8.0tris,收集目的蛋白峰经过sds-page电泳检测为单一条带,与理论分子量一致,具体结果见图2。对比例1乳酸脱氢酶突变体的普通发酵一、发酵方法1.种子的活化活化方法同实施例1。2.发酵罐培养按照1:15的比例将种子培养液转入发酵罐4l基础培养基中培养,控制温度为37℃,ph为7.00,溶氧值大于30%。其中,ph用氨水来控制;搅拌转速一直维持为500rpm,空气流量维持在6l/min。本发酵方法不补料。3.诱导表达外源蛋白当od600值生长约为9时进行诱导,加入终浓度为0.5mmol/l的iptg,降温至30℃,继续培养6h。二、检测菌体收集方法以及菌体破壁方法同实施例1。经检测,离心收集菌体湿重为12g/l。sds-page电泳检测结果见图1。对比例2乳酸脱氢酶突变体的空气控制溶氧补料分批发酵一、发酵方法1.种子的活化活化方法同实施例1。2.发酵罐培养按照1:15的比例将种子培养液转入发酵罐4l基础培养基中培养,控制温度为37℃,ph为7.00,溶氧值大于30%。其中,ph用氨水来控制;溶氧值通过调节搅拌转速和空气流量来提高,初始搅拌转速为150rpm,最大转速可达500rpm,初始空气流量为1l/min,最大空气流量可达7l/min。发酵刚开始不补料,当溶氧及ph值快速上升,且ph的上升幅度大于0.2/min,溶氧值大于10%/min时,开始补料。补料速度为23ml/(h·l)。3.诱导表达外源蛋白诱导方法同实施例1。二、检测菌体收集方法以及菌体破壁方法同实施例1。经检测,离心收集菌体湿重为60g/l。sds-page电泳检测结果见图1。实验结果说明,只有采用本发明特定控氧的发酵方式,才能实现高密度发酵,进而提高目标产物的收获水平,而采用其他控氧方式或者不补料,则产量较低,本发明方法的产量高,成本低,工业应用前景良好。序列表<110>四川自豪时代药业有限公司<120>一种外源高表达乳酸脱氢酶突变体的高密度发酵方法<130>gy003-18p1477<160>2<170>siposequencelisting1.0<210>1<211>1014<212>dna<213>目标蛋白的核苷酸序列(artificial)<400>1gaattcatgaccaaaatttttgcgtatgcgattcgtgaagatgaaaaaccgttcctgaaa60gaatgggaagatgcgcacaaagatgtggaagtggaatacaccgataaactgctgaccccg120gaaaccgtggccctggccaaaggtgccgatggtgttgttgtttaccagcagctggattac180accgcgctgaccctgcaggcgctggcagataacggtattaccaaaatgagcctgcgtaac240gtgggtgtggataacattgatatggcgaaagcgaaagaactgggtttccagattaccaac300gtgccggtttacagcccgaacgcgattgcggaacacgccgcgattcaggcggcccgcatt360ctgcgtcaggataaagccatggatgaaaaagtggcccgtcatgatctgcgttgggcaccg420accattggccgtgaagttcgcgatcaggtggttggtgtgattggtaccggccacatcggc480caggttttcatgcagattatggaaggcttcggcgcgaaagttattgcgtatgatattttc540cgcaacccggaactggaaaagaaaggctattacatggactcactggacgacctgtacaaa600caggcggacgtgattagcctgcacgttccgaaagttccggcgaacgttcacatgatcaac660gacgaaagcatcgcgaaaatgaagcaggacgtagttatcgttaacgtaagccgtggtccg720ctggttgacaccgacgcggttatccgtggtctggacagcggcaagatctttggttacgca780atggacgtttacgaaggtgaagttggcatctttaacgaagactgggaaggcaaggagttt840ccggacgcacgtctggctgacctgatcgctcgtccgaacgttctggtgaccccgcacacc900gctttctacactactcacgccgttcgcaacatggtagttaaagccttcgacaacaacctg960gaactggttgaaggcaaagaagccgaaactccggttaaagttggctaactcgag1014<210>2<211>335<212>prt<213>目标蛋白的氨基酸序列(artificial)<400>2gluphemetthrlysilephealatyralailearggluaspglulys151015propheleulysglutrpgluaspalahislysaspvalgluvalglu202530tyrthrasplysleuleuthrprogluthrvalalaleualalysgly354045alaaspglyvalvalvaltyrglnglnleuasptyrthralaleuthr505560leuglnalaleualaaspasnglyilethrlysmetserleuargasn65707580valglyvalaspasnileaspmetalalysalalysgluleuglyphe859095glnilethrasnvalprovaltyrserproasnalailealagluhis100105110alaalaileglnalaalaargileleuargglnasplysalametasp115120125glulysvalalaarghisaspleuargtrpalaprothrileglyarg130135140gluvalargaspglnvalvalglyvalileglythrglyhisilegly145150155160glnvalphemetglnilemetgluglypheglyalalysvalileala165170175tyraspilepheargasnprogluleuglulyslysglytyrtyrmet180185190aspserleuaspaspleutyrlysglnalaaspvalileserleuhis195200205valprolysvalproalaasnvalhismetileasnaspgluserile210215220alalysmetlysglnaspvalvalilevalasnvalserargglypro225230235240leuvalaspthraspalavalileargglyleuaspserglylysile245250255pheglytyralametaspvaltyrgluglygluvalglyilepheasn260265270gluasptrpgluglylysglupheproaspalaargleualaaspleu275280285ilealaargproasnvalleuvalthrprohisthralaphetyrthr290295300thrhisalavalargasnmetvalvallysalapheaspasnasnleu305310315320gluleuvalgluglylysglualagluthrprovallysvalgly325330335当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1