具有α-糖苷酶抑制活性的酰基他定类化合物、其制备方法及应用与流程
本发明属于生物医药领域,更具体地,本发明涉及具有α-糖苷酶抑制活性的酰基他定类化合物及制备方法,以及该类α-糖苷酶抑制剂在防治糖尿病等疾病方面的应用。
背景技术:
糖尿病是一组以高血糖为特征的代谢性疾病,严重威胁人类健康的疾病,世界发病率高达2%,在发展中国家糖尿病的发病率和死亡率均呈现快速上升趋势。在中国,随着社会经济的发展和人民生活水平的提高,糖尿病患病率日渐增高,已经成为糖尿病的重灾区,每年用于糖尿病治疗的医疗支出大为增加,这表明糖尿病已经成为影响社会经济发展的一个重要因素,加大力度进行糖尿病的基础研究具有战略意义。
高血糖是由于胰岛素分泌缺陷或其生物作用受损,或两者兼有引起。在临床上糖尿病一般分为i型糖尿病,ii型糖尿病等。糖尿病时长期存在高血糖症状,严重高血糖时会导致各种组织,特别是眼、肾、心脏、血管、神经的慢性损害、功能障碍,威胁人类健康。由其是随着生活方式的改变以及人口老龄化加剧,糖尿病及其并发症越来越成为人类健康的重要威胁。
现有技术中,ii型糖尿病的临床治疗药物的主要类别包括:双胍类糖尿病药物(二甲双胍、或苯乙双胍)、磺酰脲类糖尿病药物(格列本脲、格列吡嗪、格列齐持、格列波脲、格列美脲、或格列喹酮)、葡萄糖苷酶抑制剂类药物(阿卡波糖、伏格利波糖、或米格列醇)、胰岛素增敏类药物(环格列酮、曲格列酮、罗格列酮、或吡格列酮)、醛糖还原酶抑制剂类药物(阿司他丁、依帕司他、波拉司他、或托瑞司他)、促胰岛素释放类药物(瑞格列奈)、或那格列奈)。
尽管已经开发了多种类的糖尿病治疗药物,但是,也有较多的负面因素制约着一些药物的应用。例如,研究发现胰高血糖素受体拮抗剂由于主要为钒类化合物,在骨骼、肾脏和肝脏易产生蓄积,并引起呕吐、脱水等不良反应。双胍类口服降血糖药可能导致乳酸性中毒,苯乙双胍和丁双胍就是由于这种严重的不良反应而停止销售。
α-糖苷酶抑制剂阿卡波糖、伏格列波糖和米格列醇均来源于放线菌发酵产物,这类化合物均为氨基寡糖类化合物。另外还有一些α-糖苷酶抑制活性的氨基寡糖类化合物也先后被报道,如isovalertatins、acarviostatins等。尽管它们在临床上具有一定的缓解作用,但是疗效仍然有待提高。
因此,本领域还需要寻找新的具有更高生物安全性的药物,以满足临床用药需求。
技术实现要素:
本发明的目的在于提供具有α-糖苷酶抑制活性的酰基他定类化合物及制备方法,以及该类α-糖苷酶抑制剂在治疗糖尿病等疾病方面的应用。
在本发明的第一方面,提供式(i)所示化合物或其异构体、溶剂合物或前体,或其盐,
其中,n为1~5的正整数;
m或t独立地为1~10的正整数;
r1~r6中至少一个基团(如1~5个基团,更特别如1,2,3,4个)为-o-z,该z为酰基;r1~r6中其余基团各自独立地选自:羟基、氢、c1-c4烷基、c2-c4链烯基、c2-c4链炔基、卤素;
r1’~r6’,r1”~r6”,ra,rb各自独立地选自:羟基、氢、c1-c4烷基、c2-c4链烯基、c2-c4链炔基、卤素;
y1~y4各自独立地选自:o、氨基、s;
x2~x6各自独立地选自:o、s。
在一个优选例中,所述的式(i)所示化合物或其异构体、溶剂合物或前体,或其盐,其特征在于,n为1,2或3的正整数;或m为1~6的正整数,如2,3,4,5;或t为1~6的正整数,如2,3,4,5。
在另一优选例中,所述的式(i)所示化合物或其异构体、溶剂合物或前体,或其盐中,所述的酰基包含2~8个碳原子;较佳地包含2~6个,如为2,3,4,5个碳原子;更佳地,所述的酰基包括:乙酰基,丙酰基,丁酰基,戊酰基。
在另一优选例中,所述的式(i)所示化合物或其异构体、溶剂合物或前体,或其盐,所述的酰基为经取代或未经取代的酰基。
在另一优选例中,-o-z基团不在r2位上。
在另一优选例中,所述的经取代的酰基的取代基包括:羟基、c1-c4烷基、c2-c4链烯基、c2-c4链炔基、卤素。
在另一优选例中,所述的r1~r6中其余基团,r1’~r6’,r1”~r6”,ra,rb各自独立地选自:羟基、氢、c1-c2烷基、c2-c3链烯基、c2-c3链炔基、卤素。
在另一优选例中,r1’~r6’,r1”~r6”,ra,rb为羟基。
在另一优选例中,x2~x5为o;y2~y4为o。
在另一优选例中,该化合物选自:
在本发明的另一方面,提供一种制备所述的式(i)化合物的方法,包括:培养海洋链霉菌ho1518,获得培养产物(较佳地为培养上清液),从中分离获得所述的式(i)化合物。
在一个优选例中,对培养产物进行纯化,从不同的洗脱液中,分离不同的式(i)化合物。
在本发明的另一方面,提供所述的式(i)所示化合物或其异构体、溶剂合物或前体,或其盐的用途,用于:抑制α-糖苷酶,或制备抑制α-糖苷酶的组合物;或制备预防、缓解或治疗糖尿病的组合物(包括食品、保健品或药物组合物)。
在本发明的另一方面,提供一种用于抑制α-糖苷酶或用于预防、缓解或治疗糖尿病的组合物,包含:所述的式(i)所示化合物或其异构体、溶剂合物或前体,或其盐;和食品学或药学上可接受的载体。
在一个优选例中,所述的式(i)所示化合物或其异构体、溶剂合物或前体,或其盐在药物组合物中是有效量的;较佳地,所述的有效量按照重量含量为0.001-50%,0.01-30%或0.05-10%等。
在另一优选例中,所述的组合物的剂型包括但不限于:粉剂、注射剂、散剂、溶液剂、片剂、丸剂、胶囊剂、控速释剂、输液剂、混悬剂、颗粒或糖浆。
在本发明的另一方面,提供一种用于抑制α-糖苷酶或用于预防、缓解或治疗糖尿病的药盒,所述的药盒中包括所述的组合物。
在一个优选例中,所述的糖尿病为:ii型糖尿病。
在本发明的另一方面,提供一种抑制α-糖苷酶的方法,所述方法包括:以所述的化合物对α-糖苷酶或含有α-糖苷酶的体系(包括离体体系)进行处理,从而抑制α-糖苷酶的活性。
在一个优选例中,所述的抑制α-糖苷酶的方法为非诊断或治疗性的方法。
在本发明的另一方面,提供一种预防、缓解或治疗糖尿病的方法,所述方法包括:给予需要治疗的对象有效量的所述的式(i)所示化合物或其异构体、溶剂合物或前体,或其盐。
在本发明的另一方面,提供一种提高氨基寡糖类化合物对于α-糖苷酶的抑制活性的方法,包括:在氨基寡糖类化合物加上至少一个酰基基团。
在本发明的另一方面,提供一种海洋链霉菌,其在中国典型培养物保藏中心的保藏号为cctccno:m2018176ho1518。
在本发明的另一方面,提供所述海洋链霉菌或其培养物的用途,用于产生所述的式(i)所示化合物。
在本发明的另一方面,提供一种产生权利要求1所述的式(i)所示化合物的方法,所述方法包括:培养所述的海洋链霉菌,从其培养产物中分离所述的式(i)所示化合物。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
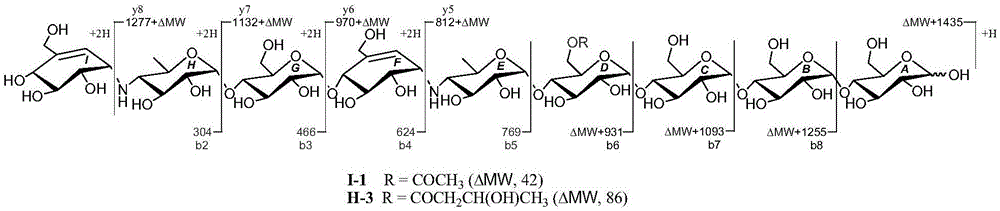
图1a、酰基他定新化合物i-1、h-3的质谱裂解规律示意图。
图1b、i-1的hresims/ms图谱。
图1c、h-3的hresims/ms图谱。
图2a、酰基他定新化合物g-1,g-2和k-1的质谱裂解规律示意图。
图2b、g-1的hresims/ms图谱。
图2c、g-2的hresims/ms图谱。
图2d、k-1的hresims/ms图谱。
图3a、活性测试样品各取样时间点对应的吸光度值曲线。
图3b、按照公式计算测试化合物α-淀粉酶抑制率比较图。
具体实施方式
本发明首次揭示一类新型的酰基他定类化合物,其具有高效的糖苷酶抑制活性。
术语
本文所用的术语“烷基”指直链或支链饱和的、含有1-4个碳原子(较佳地1-2个碳原子)的脂族烃类基团。例如,烷基包括但不限于甲基,乙基,正丙基,异丙基,正丁基,异丁基,叔丁基。
本文所用的术语“链烯基”包括含有至少一个碳碳双键和2-4个碳原子(较佳地2-3个碳原子)的直链和支链烃基。
本文所用的术语“链炔基”包括含有至少一个碳碳三键和2-4个碳原子(较佳地2-3个碳原子)的直链和支链烃基。
本文所用的术语“卤素”指f、cl、br、或i。
本文所用的术语“异构体”包括:几何异构体、对映异构体、非对映异构体(如顺反异构体,构象异构体)。
如本文所用,在通式中省略号“……”的表示方法是本领域人员熟知的,其表示存在任意、一个或多个省略的单元该单元与“……”之前的单元在结构上相同或相应。
本发明中,所述的烷基、链烯基、链炔基是视需要可经取代;例如,经取代或未经取代的烷基,经取代或未经取代的链烯基,经取代或未经取代的链炔基。本文所用“取代”的术语,意指基团中至少一个氢原子经一允许的取代基所取代,例如在取代的过程中取代基会导致一稳定化合物,该稳定化合物不致自动进行诸如重排、环化、脱除或其它转化反应。除非另有定义,否则一经取代的基团在一或多个适当位置具有取代基,且当超过一个位置经取代时,每一取代位置的取代基可为相同或不同。所述的经取代的酰基的取代基包括:羟基、c1-c4烷基、c2-c4链烯基、c2-c4链炔基、卤素。
本文所用的术语“溶剂合物”表示携带有溶剂分子的化合物,例如,所述的溶剂合物可以是水合物。
本发明中,术语“含有”表示各种成分可一起应用于本发明的混合物或组合物中。因此,术语“主要由...组成”和“由...组成”包含在术语“含有”中。
本发明中,“食品学或药学上可接受的”成分是适用于人和/或动物而无过度不良副反应(如毒性、刺激和变态反应)即有合理的效益/风险比的物质。
本发明中,“食品学或药学上可接受的载体”是用于将本发明的式(i)化合物、异构体、溶剂合物、前体,或其盐传送给动物或人的药学上或食品上可接受的溶剂、悬浮剂或赋形剂。载体可以是液体或固体。
化合物
本发明首先提供了一种如结构式(i)所示的化合物:
其中,各基团及代号的定义同前。
本发明人意外地发现,如结构式(i)所示的化合物中r1~r5中至少一个基团为-o-z,该z为酰基,这样的化合物具有高效的糖苷酶抑制活性。
本发明还包括上述式(i)化合物的异构体、溶剂合物、前体,或其盐,只要它们也具有与式(i)化合物具有相同或基本相同的功能。所述的“药学上可接受的盐”是指化合物与无机酸、有机酸、碱金属或碱土金属等反应生成的盐。这些盐包括(但不限于):(1)与如下无机酸形成的盐:如盐酸、硫酸、硝酸、磷酸;(2)与如下有机酸形成的盐,如乙酸、草酸、丁二酸、酒石酸、甲磺酸、马来酸、或精氨酸。其它的盐包括与碱金属或碱土金属(如钠、钾、钙或镁)形成的盐,以酯、氨基甲酸酯,或其它常规的“前体药物”的形式。
化合物具有一个或多个不对称中心。所以,这些化合物可以作为外消旋的混合物、单独的对映异构体、单独的非对映异构体、非对映异构体混合物、顺式或反式异构体存在。
所述的“化合物的前体”指当用适当的方法服用后,该化合物的前体在病人体内进行代谢或化学反应而转变成结构式(i)的一种化合物,或化学结构式(i)的一个化合物所组成的盐或溶液。
本领域人员应理解,在得知了本发明化合物的结构以后,可通过多种本领域熟知的方法、利用公知的原料,来获得本发明的化合物,比如化学合成或从生物(如微生物,特别是海洋链霉菌)中提取的方法,这些方法均包含在本发明中。
作为本发明的优选方式,提供了一种制备本发明的式(i)所示的化合物的方法,所述方法包括:培养海洋链霉菌ho1518,获得培养产物(较佳地为培养上清液),从中分离获得所述的式(i)化合物。之后,包括对培养产物进行纯化,从不同的洗脱液中,分离不同的式(i)化合物。产物的收集、纯化例如可以采用树脂吸附和洗脱法。
其它的制备式(i)化合物的方法也被包含在本发明中,例如通过化学合成的方法将糖单元相连。合成的化合物可以进一步通过柱层析法、高效液相色谱法等方式进一步纯化。
用途
本发明人在研究中发现,式(i)所示的化合物具有高效的抑制α-糖苷酶的作用,因此其是良好的α-糖苷酶抑制剂。作为α-糖苷酶抑制剂,必然对于糖尿病有预防、缓解和治疗作用。
基于本发明人的新发现,本发明提供了式(i)所示的化合物或其异构体、溶剂合物、前体,或其盐的用途,用于(1)抑制糖苷酶,或制备抑制糖苷酶的组合物;(2)制备预防、缓解或治疗糖尿病的组合物,该组合物可以包括食物、保健品或药物组合物。
组合物
本发明还提供了一种组合物,含有:(a)有效量的式(i)所述的化合物、或其异构体、溶剂合物、前体,或其盐;和(b)食品学或药学上可接受的载体或赋形剂。所述的组合物可以是食品组合物、保健品组合物和药物组合物。
在本发明中,所述的组合物含有按照重量比例为例如0.001-50%的式(i)所示的化合物或其药学上可接受的盐。较佳的,所述的组合物含有按照重量比例例如为0.01-30%的式(i)所示的化合物或其异构体、溶剂合物、前体,或其盐;更佳地,所述的组合物含有按照重量比例为例如0.05-10%的式(i)所示的化合物或其异构体、溶剂合物、前体,或其盐。
本发明所述的组合物的剂型可以是多种多样的,只要是能够使活性成分有效地到达哺乳动物机体的剂型都是可以的,可以被制成单位剂型的形式。剂型比如可选自:凝胶剂、气雾剂、片剂、胶囊、粉末、颗粒、糖浆、溶液、悬浮液,等等。根据本发明的化合物所治疗的疾病类型,本领域人员可以选择方便应用的剂型。
从易于制备和储存的立场看,优选的组合物是固态组合物,尤其是片剂和固体填充或液体填充的胶囊。本发明的化合物或其组合物也可储存在适宜于注射或滴注的消毒器具中。本发明的化合物或其组合物也可储存在适当的容器,并置于试剂盒或药盒中。
式(i)化合物或其异构体、溶剂合物、前体,或其盐作为活性成分的有效施用剂量可随给药的模式和待治疗的疾病的严重程度而变化。可调节剂量方案以提供最佳治疗应答。例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。
本发明的化合物或组合物也可用于在离体条件下抑制糖苷酶。例如,在一些为了避免糖苷酶干扰的体系中发挥作用。
海洋链霉菌
本发明还提供了一种新型的海洋链霉菌,其在中国典型培养物保藏中心的保藏号为cctccno:m2018176ho1518。所述的海洋链霉菌可应用于生产本发明的化合物。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
实施例1、菌株的发酵培养及化合物的制备
海洋链霉菌菌株ho1518于2010年采自日照附近50-100m深海域的海洋沉积物,其在中国典型培养物保藏中心的保藏号为cctccno:m2018176ho1518。
以500ml三角瓶培养发酵种子,每瓶内含tsb培养基100ml,内含tsb粉末(美国bd公司)3%。121℃高压蒸汽灭菌20min,冷却后接种菌株ho1518斜面孢子,于恒温摇床220rpm28℃培养2天后作为发酵种子。以2000ml三角瓶培养发酵种子,每瓶内含pharmamedia培养基400ml,内含pharmamedia粉末1%,可溶性淀粉1%,葡萄糖1.2%,玉米浆干粉0.5%,用人工海水配制,调剂ph7.2。人工海水配方(g/l):nacl24.4770,na2so43.9170,kcl0.664,srcl2·6h2o0.0404,mgcl2·6h2o4.981,cacl20.9482,nahco30.192,h3bo30.026,naf0.004,微量元素溶液1ml(组成(g/l):mncl20.389,niso4·6h2o0.056,licl0.028,k2cr2o70.15,na2edta1.00,fecl3·6h2o2.00,alcl30.05,cucl20.02,cocl2·6h2o0.005,zncl20.06,na2moo4·2h2o0.074,ki0.08,bacl2·2h2o0.05),将上述物质溶于自来水并定容至1l。121℃高压蒸汽灭菌20min,冷却后接种菌株ho1518发酵种子,于恒温摇床200rpm28℃培养7-9天。发酵总量为20l,用于后续的分离提取。
发酵产物离心收集上清液,加入2%左右xad-16大孔树脂,摇瓶200rpm吸附过夜。收集大孔树脂,纯水洗脱至几乎无色,而后用25%甲醇、50%甲醇、75%甲醇和纯甲醇进行洗脱处理,分别收集洗脱液蒸干,标记为fr.1-fr.4。lc-ms分析检测确定酰基他定类化合物存在于fr.1和fr.2中。fr.1经过反向硅胶柱层析梯度洗脱,流动相为甲醇-水10%~50%,细分成a-o共15个洗脱部位fr.1a-o。采用制备hplc对酰基他定类化合物进行分离纯化。色谱柱:c18(250×10mm,5μm),流速3ml/min;检测条件:uv210nm。流动相为5-25%乙腈-水梯度洗脱,从fr.1g中分离得到羟丁酰他定i03和乙酰他定i03,保留时间分别为24.4min和25.7min;流动相为8%乙腈-水等度洗脱,从fr.1h中分离得到羟丁酰他定ii03,保留时间为40.1min;流动相为18%甲醇-水等度洗脱,从fr.1i中分离得到乙酰他定ii03,保留时间为36.7min;流动相为20%甲醇-水等度洗脱,从fr.k中分离得到丙酰他定i03,保留时间为39.2min。
实施例2、酰基他定家族新化合物的化学结构
上述获得的5个新化合物均为无色透明固体,易溶于水,紫外吸收为末端吸收。
羟丁酰他定i03(对应于化合物代号g-1)分子式为c41h69no30,分子量为1055.39。
乙酰他定i03(对应于化合物代号g-2)分子式为c39h65no29,分子量为1011.37。
丙酰他定i03(对应于化合物代号k-1)分子式为c40h67no29,分子量为1025.38。
羟丁酰他定ii03(对应于化合物代号h-3)分子式为c60h100n2o42,分子量为1520.58。
乙酰他定ii03(对应于化合物代号i-1)分子式为c58h96n2o41,分子量为1476.55。
上述各个化合物的核磁鉴定数据如表1~表2。
表1、化合物g-1、g-2和k-1的核磁数据*
*a-f环的位置为从化合物的右侧到左侧数起。
表2、化合物i-1和h-3的核磁数据*
*a-i环的位置为从化合物的右侧到左侧数起。
实施例3、酰基他定家族新化合物质谱裂解规律
1、阿卡他定家族ii03骨架类型
酰基他定新化合物i-1和h-3属于阿卡他定家族ii03骨架类型,在正离子质谱裂解模式下,它们形成共同的碎片离子峰m/z304(b2),466(b3),624(b4)和769(b5),与前体化合物—阿卡他定ii03的质谱裂解碎片一致;而在m/zy5-y8和b6-b8处的碎片离子峰及分子离子峰,与阿卡他定ii03分别相差42和86个质量单位。以上说明,酰基他定新化合物i-1和h-3的酰基均取代在d环上。化合物的详细的质谱裂解方式见图1a,其hresims/ms图谱见图1b~c所示。
2、阿卡他定家族i03骨架类型
酰基他定新化合物g-1,g-2和k-1属于阿卡他定家族i03骨架类型,在正离子质谱裂解模式下,它们形成共同的碎片离子峰m/z304(b2),与前体化合物—阿卡他定i03的质谱裂解碎片一致;而在m/zy5和b3-b5处的碎片离子峰及分子离子峰,与阿卡他定i03分别相差42,56和86个质量单位。以上说明,酰基他定新化合物g-1,g-2和k-1的酰基取代位置与i-1和h-3相同,均位于d环。化合物详细的质谱裂解方式见图2a所示,其hresims/ms图谱见图2b~d所示。
实施例4、酰基他定家族新化合物在酶学水平对糖苷酶活性的抑制
上述获得的新化合物属于氨基寡糖类化合物,与化合物阿卡波糖在部分结构上存在相似性。阿卡波糖为ii型糖尿病临床用药,其作用机理为抑制肠道内α-淀粉酶(为典型的糖苷酶)对淀粉的水解,减少葡萄糖的产生,从而达到降低血糖的目的。鉴于此,本发明人以阿卡波糖为阳性对照,测试获得的新化合物的活性。采用下述两种方法:
方法一:以1%可溶性淀粉为底物,以0.1mmol/l阿卡波糖水溶液为阳性对照,水为阴性对照,对化合物g-1、g-2、h-3、i-1和k-1进行活性测试。实验采用1ml反应体系:将0.25ml1%可溶性淀粉、0.25mlph6.9磷酸盐缓冲液和0.25ml0.1mmol/l的测试样品溶液混合后置于20℃水浴中放置10min,迅速加入20℃预热的10u/mlα-淀粉酶(猪胰腺)0.25ml,充分混合后置于20℃水浴中,每3min取样0.1ml,加入0.1ml3mnaoh终止反应。最后向每个样品中加入0.4mldns试剂,沸水浴5min,冷却后加ddh2o定容至4ml。以0.2ml水+0.4mldns按上述方法操作为本底调零,540nm下分别读取各样品对应取样时间的吸光值(abs)。
活性测试样品各取样时间点对应的吸光度值如表3所示。
表3
根据表3结果,制作取样时间点-吸光度值曲线,如图3a所示。由图可见:1、测试化合物均具有α-淀粉酶抑制活性,且抑制活性均显著强于阿卡波糖;2、从曲线上可知,第5个取样点—即酶催化反应15min,几乎所有样品中的葡萄糖浓度均达到最高,说明在15min后可溶性淀粉水解达到最大值。因此以反应15min数据为基础,计算各氨基寡糖化合物抑制活性,其公式为:
抑制率=[(a1-a2)/a1]×100%
a1为不加入氨基寡糖类化合物时540nm处的吸光值,a2为加入氨基寡糖类化合物时540nm处的吸光值。所得结果如图3b所示。可见,在本实验条件下,阿卡波糖对α-淀粉酶抑制率为46.26%,化合物k-1与其抑制率最接近,为50.47%;其余5个化合物对α-淀粉酶活性抑制率明显高于阿卡波糖,i-1和h-3这2个化合物的抑制率达到90%以上。
方法二:将5μl的猪胰腺淀粉酶液(50u/ml)和10倍系列稀释的试验样品溶液(抑制剂,溶于蒸馏水)混合并预先孵育,加入100μl的0.2%可溶性淀粉(底物,溶于100mm磷酸盐缓冲液,ph6.9),20℃孵育30分钟后,加20μl1m盐酸终止反应。
对剩余的淀粉进行定量,反应溶液100μl与卢戈氏碘溶液25μl混合均匀,取上述显色液100μl加到96孔板中,测量630nm的吸收。以阿卡波糖为阳性对照,3个重复。将数据导入prism(version5.0,graphpad),利用曲线计算ic50值,结果如表4。
表4
由表4可见,本发明的化合物对于猪胰腺淀粉酶的抑制活性非常理想。
生物材料保藏
本发明提供的海洋链霉菌菌株ho1518保藏在中国典型培养物保藏中心(cctcc,中国武汉),保藏号为cctccno:m2018176ho1518;保藏日为2018年4月3日。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!