一种使用镜像探针进行甲基化捕获测序的方法与流程
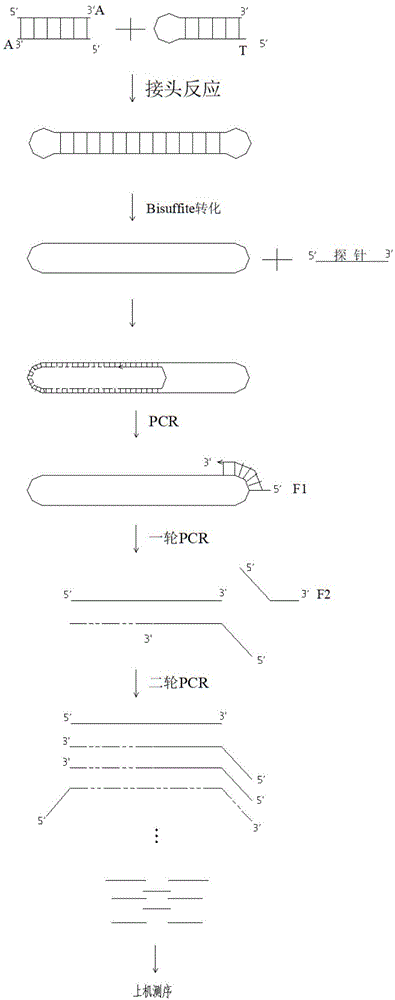
本发明属于生物
技术领域:
,更具体而言,本发明涉及一种使用镜像探针进行甲基化捕获测序的方法。
背景技术:
:dna甲基化是一种对正常发育和很多疾病(肿瘤)发生机制的重要转录调控机制,属于表观遗传修饰之一,具体指的是真核生物以sam等作为甲基供体,在dna甲基转移酶的作用下选择性地将甲基转移到dna中cg两个核苷酸的特定胞嘧啶上,形成5-甲基胞嘧啶。尤其是在cpg双核苷酸富集的区域内,gc的含量超过55%,被称为cpg岛。在多个基因的周围有一些成簇的cpg岛,通过转录调控来调节基因的表达。近年来,各种癌症成为人类健康的极大威胁之一。研究表明,不仅遗传学的改变能够触发和引起癌症,表观遗传学对癌症的发生发展起着重要作用。与正常细胞相比,癌细胞中基因组甲基化水平整体偏低,然而基因的启动子区呈现高甲基化趋势。在肿瘤的相关研究中表明肿瘤抑制基因启动子区往往发生dna高甲基化,发生甲基化的dna改变染色质结构、dna构象及dna与蛋白质相互作用方式,来抑制抑癌基因的表达,当抑癌功能受到抑制,细胞重新进入生长周期,最终导致肿瘤发生。然而,癌症相关基因启动子区则呈现出低甲基化。dna甲基化属于基因表达的调控因子之一,肿瘤抑癌基因甲基化的增加是很多肿瘤发生的一个早期事件,通过检测某些癌细胞或组织中基因的特定性甲基化的改变,可以及早地发现肿瘤的发生。然而对于癌细胞或者组织来讲,获取材料有限以及会对患者带来有创性伤害,随着近年来液体活检技术的兴起,它成为甲基化检测取材的首选技术。因为ctdna上携带有与肿瘤发生相关的特定甲基化类型,成为对肿瘤早期诊断可靠的生物标志物。为了全面地检测到甲基化信息,全基因组亚硫酸氢盐测序可以实现高分辨率且全面的甲基化模式检测,但在构建文库时,通常需要5μg以上的基因组dna。因此,对于起始量有限的样本,这种甲基化检测方法很受限制,同时要求较高的测序深度,高额的检测成本也成为此技术得以广泛应用的一个重要限制条件。相比之下,padlock探针法与亚硫酸氢盐测序相结合的技术,需要几十-几百ng的dna量就可以进行检测,与分析整个基因组不同,这种方法聚焦于基因组的特定区域。但是padlock探针法也有其自身的局限性,不能区分cpg位点上发生的是突变还是非甲基化bisuffite转化。技术实现要素:本发明的目的在于提供一种使用镜像探针进行甲基化捕获测序的方法。本发明提供了一种使用镜像探针进行甲基化捕获测序的方法,所述方法包括:1)设计茎环形接头序列,所述茎环形接头序列符合:(1)接头茎部互补配对部分的碱基对数为8-15对,优选12对,(2)接头的环状部分不能形成4个或4个以上碱基的互补配对,(3)接头的环状部分和茎部配对的碱基数小于4,(4)颈环结构核酸序列中不能与人基因组序列和经bisulfite转化后文库有连续10个及10个以上的碱基互补配对,(5)茎环结构接头上所有的胞嘧啶碱基均为5-甲基胞嘧啶;2)将基因组dna超声打断,或直接采用cfdna进行末端修复和加a;3)连接反应:颈环结构的接头与所述加a的dna片段进行连接反应,并纯化连接产物;4)对所述纯化的连接产物进行bisulfite转化实验,c碱基可以转化为u,而对于mc无变化,形成带有颈环接头的正负插入片段的环形结构;5)文库的产生,使用探针杂交延伸反应获得延伸产物,探针序列结构如下:5’-3’方向:与bisulfite转化后的目标序列互补序列(个数:25-35,优选30个)+agatcggaagagcacacgtctgaactccagtcac+gggggggggg+cactctttccctacacgacgctcttccgatct+nnnnnn(分子标签)+与bisulfite转化后的目标序列互补序列(个数:25-35,优选30个);6)上机测序,对所述延伸产物进行测序,优选对所述延伸引物扩增后进行测序。在一个实施方案中,所述环形结构接头序列如下(5’-3’):c*gtgtaggc*c*tgaatc*gac*tagtc*aac*aggc*c*tac*ac*gt,其中c*代表该碱基有甲基化修饰。在一个实施方案中,探针与目标区域互补的序列的tm值为55-85度,更加优选的,65-75度。在一个实施方案中,对与目标区域互补的序列,设计探针时,对于cpg碱基时,把c改为c/t这两种简并碱基,探针上cg不超过3个,优选不含cg的序列;ca、ct、cc上的c改为t,其他位置上的a、t和g都按照碱基互补配对原则进行设计;探针与目标序列互补序列的tm值范围在65℃-85℃,优选75℃;探针的长度为90-120nt,优选100nt。在一个实施方案中,分子标签在颈环部分。由于本方法可以同时检测到两条互补链的信息,因此通过一次建库既能检测到突变同时也可以检测到甲基化信息,不但节约了样本,而且也极大地节省了建库和上机测序成本。本方法不但可以检测人、动植物基因组的甲基化信息,同时也可以检测微生物等甲基化信息,应用范围极为广泛。附图说明通过以下附图对本发明进行说明:图1示出了建库流程;图2示出了癌症dna甲基化标记物结果及分析。具体实施方式在本发明中,甲基化建库流程,建库流程图见图1:1.设计环形接头序列的要点:(1)互补配对部分的碱基对数为8-15对,优选12对。(2)环状部分不能形成互补配对(3)环状部分的碱基不能与颈部配对的12对碱基之间有任何的配对。(4)颈环结构序列中没有与基因组匹配的碱基。(5)分子标签可以设计在颈环部分,由于标签种类较多,但是会干扰颈环结构的形成,因此标签不建议设计在颈环部分。环形结构接头序列如下(5’-3’):c*gtgtaggc*c*tgaatc*gac*tagtc*aac*aggc*c*tac*ac*gt,c*代表该碱基有甲基化修饰2.末端修复和加a2.1将总量为30ng的cfdna样品完全转移至pcr管中,按如下表格配置反应体系(此操作需在冰盒上进行):表1末端修复、3’端加“a”体系组分量cfdnafragment50μlendrepair&a-tailingbuffer7μlendrepair&a-tailingenzymemix3μl总体积60μl2.2使用移液器吹打混匀(避免剧烈震荡混匀),将pcr管放回冰盒上备用;2.3运行pcr程序,设置pcr仪参数如下:heatlid85℃20℃维持30min65℃维持30min4℃维持∞2.4程序运行完成后立即进行下步连接反应。3.连接反应:颈环结构的接头与修复好的cfdna进行连接反应,这样设计的目的在于可以同时检测到正负链,起到正负链校对的作用。同时可以区分点突变和由bisuffite转化的碱基。3.1在上述step2反应的pcr管中,按如下表格配置反应体系(此操作需在冰盒上进行):表2连接体系组分量来自step2反应结束的样品60μl环化接头(100um)0.5μlnuclease-freewater9.5μlligationbuffer30μldnaligase10μl总体积110μl3.2轻轻吸打混匀6次,避免产生气泡,然后短暂离心;3.3运行pcr仪程序(要求无热盖),设置pcr仪参数如下:heatlidoff20℃维持30min4℃维持∞3.4程序结束后,立即进行下步实验。4.连接产物纯化4.1将agencourtampurexp磁珠拿至室温,震荡混匀备用;4.2在step3中程序运行完的pcr管中,按照1.0×体积的纯化磁珠进行实验,按下面表格配置反应体系:表3磁珠纯化体系组分量来自step3反应结束的样品110μlagencourtampurexpbeads132μl总体积242μl4.3轻轻吸打混匀6次,室温静置孵育5-15min,将pcr管置于磁力架上3min使溶液澄清;4.4移除上清,pcr管继续放置在磁力架上,向pcr管内加入200μl80%乙醇溶液,静置30s;4.5移除上清,再向pcr管内加入200μl80%乙醇溶液,静置30s后彻底移除上清(建议使用10μl移液器移除底部残留乙醇溶液);4.6室温静置3-5min,使残留乙醇彻底挥发;4.7加入22μl的nuclease-freewater,把pcr管从磁力架取下,轻轻吸打重悬磁珠,避免产生气泡,室温静置2min;4.8将pcr管置于磁力架上2min使溶液澄清;4.9用移液器吸取20μl上清液,转移到新的pcr管中(置于冰盒上),在反应管上标记样本编号,准备下一步反应。5.进行bisuffite转化实验,c碱基可以转化为u,而对于mc无变化,形成带有颈环接头的正负插入片段的环形结构。5.1根据下表配制反应体系进行重亚硫酸盐处理:表4重亚硫酸盐体系组分体积(ul)来自4.9结束的样品20μlbisulfitesolution45uldnaprotectbuffer8ul总体积73ul5.2将移液器调至100μl,轻轻吸打混匀6次,然后分成两管置于pcr仪上。5.3运行pcr程序heatlid105℃95℃维持5min60℃维持10min95℃维持5min60℃维持10min4℃保持5.4pcr结束后,简短离心将两管相同样本转移至同一个干净的1.5ml离心管中;5.5每个样本中加入310μlbufferbl涡旋混匀,简短离心;5.6加入250μlethanol(96-100%)至每个样本,涡旋混匀15s,简短离心;5.7将带有收集管的离心柱(dnaspincolumnswithcollectiontubes)放置在板子上,将步骤7.6的混合液体转移到对应的标记好的离心柱中;5.8静置1min,离心1min,将收集管中的液体重新转移至离心柱中,离心1min,弃掉离心管中的液体;5.9加入500μlbufferbw,离心1min,弃掉离下来的液体;5.10加入500μlbufferbd,盖好管盖,室温放置15min,离心1min,弃掉离下来的液体;5.11加入500μlbufferbw,离心1min,弃掉离下来的液体,再重复一次,共2次;5.12加入250μlethanol(96-100%),离心1min,将离心柱放置到新的2ml收集管中,弃掉全部剩余液体;5.13将离心柱放置到干净的1.5ml离心管中,加入20μlnuclease-freewater到离心柱膜中心,轻轻盖上管盖,室温放置1min,离心1min;5.14将收集管中的液体重新转移至离心柱中,室温放置1min,离心1min。6.文库的产生:6.1杂交延伸反应对与目标区域互补的序列,设计探针时采用简并策略,由于cpg上的c存在以下2种状态:未发生甲基化,经亚硫酸盐处理后转化为u对应探针上的碱基为t;发生甲基化,经亚硫酸盐处理后转化为u对应探针上的碱基为t;因此当遇到cpg碱基时,把c改为c/t这两种简并碱基,探针上cg不超过3个,优选不含cg的序列。ca、ct、cc上的c改为t,其他位置上的a、t和g都按照碱基互补配对原则进行设计。并且控制与目标序列互补序列的tm值范围在65℃-85℃,优选75℃。探针的长度为90-120nt,优选100nt。探针序列结构如下:(1)设计探针序列,经过筛选发现把分子标签设计在探针上更为合理,设计结构如下:5’-3’方向:与bisulfite转化后的目标序列互补序列(个数:25-35,优选30个)+agatcggaagagcacacgtctgaactccagtcac+gggggggggg+cactctttccctacacgacgctcttccgatct+nnnnnn(分子标签)+与bisulfite转化后的目标序列互补序列(个数:25-35,优选30个);注意:探针设计的简并性。根据下表配制反应体系进行杂交反应:表5:杂交反应体系bisuffite转化产物15ul探针序列2ul10×ampligasebuffer2.5ulh2o5.5ul总体积25ul(1)用20ul的移液器吹打混匀上述配制好25ul的反应混合液8-10次,快速离心,让管壁所有的液体进入管底。(2)将上述杂交反应物进行杂交过夜,bisulfite处理过的带有颈环接头序列的目标片段,与设计好的探针在ampligasebuffer作用下进行杂交反应,反应条件为55℃,20h。反应条件如下:94℃,30s55℃,20h注意:以0.02℃/s的下降速率,使pcr仪器的温度下降至55℃后,进行杂交反应20h。6.2杂交后的产物连接反应:(1)配制kln混合溶液(1个反应):将20%(v/v)hemoklentaq,0.5unit/μlampligase,100μmofdntpmix和1xampligasebuffer进行混匀,配制反应体系如下:表6:杂交后产物连接反应:20%(v/v)hemoklentaq10ulampligase(5u/ul)5uldntpmix(10μm)0.5ul1xampligasebuffer5ulh2o4.5ul总体积25ul(2)用移液器将配制好的kln混合溶液上下吹打8-10次进行充分混匀,打开pcr盖子,杂交过夜的产物的继续保留在pcr仪上,将25ulkln混合溶液加入到杂交过夜的产物中,用移液器上下吹打8-10次进行充分混匀,继续在55℃反应4-20h。(3)在94℃,2min,让参与反应的酶热失活。6.3exonucleasei/iii进行消化反应:exonucleasei货号:m0293s,exonucleaseiii货号:m0206s(1)将exonucleasei(20units/μl)/iii(200units/μl)按照体积比为1:1进行充分混匀。(2)加入2ul上述按照比例混合好的外切酶至上述产物中,用移液器上下吹打8-10次进行充分混匀。(3)将产物在37℃,孵育2h。(4)在94℃,5min,让参与反应的酶热失活。6.4文库富集:(1)对exonucleasei/iii消化反应中的文库进行富集,根据下表配制mix,将移液器调至70ul,轻轻吸打混匀8-10次,然后置于pcr仪上。(2)pcr反应:f1(5’-3’):caagcagaagacggcatacgagat[index]gtgactggagttcagacgtgtf2(5’-3’):aatgatacggcgaccaccgagatctacactctttccctacacgac表7:pcr反应体系运行pcr仪程序:heatlid100℃95℃维持4min15循环98℃维持20s65℃维持30s72℃维持30s72℃维持5min12℃保持(3)pcr结束后向样品加入120μlampurexp磁珠,用移液器轻轻吸打6次混匀,室温孵育5min。(4)把pcr管转移至磁力架上静置3min;(5)移除上清,pcr管继续置于磁力架上,加入200μl80%无水乙醇,静置30s;(6)移除上清,再向pcr管内加入200μl80%无水乙醇,静置30s后彻底移除上清(可用10ul移液器移除底部残留酒精);(7)室温放置5min,使得残留乙醇彻底挥发;(8)加入25ulnuclease-freewater,将pcr管从磁力架拿下,轻轻吹打混匀重悬磁珠,室温放置2min;(9)将pcr管置于磁力架上2min;(10)用移液器吸23μl上清液转移到新的pcr管中。(11)取1μl文库使用qubitdsdnahsassaykit进行定量,记录文库浓度;(12)取1ul样品稀释至2ng/ul使用agilent2100bioanalyzersystem(highsensitivitydnakit)进行文库片段长度测定,文库长度约在220-320bp之间;(13)混样,使用illumina测序平台进行测序。7.上机测序结果分析:表8:甲基化测序结果样本名t1t2t3t4原始数据(mb)72.363.287.298.5过滤后数据(m)65.256.376.784.9碱基平均质量31.831.231.531.4比对率(%)6563.36267.1整个有效碱基(mb)42.435.647.556.9甲基转化率(%)99.199.399.699.8目标区域有效碱基(mb)6.24.76.87.9目标区域平均深度42173197.34625.95374.1目标区域大小1470147014701470被覆盖靶区域碱基1470147014701470c覆盖率(%)100100100100癌症dna甲基化标记物和基因突变联合检测panel数据结果:癌症dna甲基化标记物和基因突变联合检测panel中包括:甲基化相关基因区和突变基因区域:甲基化相关基因区为,sept9(75369300-75369700),gstp1(67351000-67351500),bcat1(25101900-25102100)和ikzf1(50343800-50344000);基因热点区域为,kras(25398270-25398290),braf(140453130-140453140),nras(115258735-115258755),nras(115256520-115256540),egfr(55259505-55259535),egfr(55249060-55249080),egfr(55241700-55241720)hras(543275-543295)和hras(33870-533880)。1)甲基转化率(bst):由表-8分析得出,样本t1、样本t2、样本t3和样本t4的甲基转化率分别为99.10%、99.30%、99.60%和99.80%,这样的数据表明ca、ct和cc位置上未发生甲基化的c在经过亚硫酸盐处理后有99%以上的c碱基发生了转化,由c转化为u,测序读取到的对应碱基都是t,bst计算方法:通过统计测序结果中在ca、ct和cc位置上c经过亚硫酸盐转化后的总个数和ca、ct和cc位置上c经过亚硫酸盐处理未发生改变的总个数。计算bst(%)=n/(m+n)×100%。n代表在ca、ct和cc位置上c经过亚硫酸盐转化后的总个数,m代表ca、ct和cc位置上c经过亚硫酸盐处理未发生改变的总个数。2)癌症dna甲基化标记物结果及分析见图2。检测了目标区域内157个cpg位点,与作为dna甲基化研究中的金标准,wgbs(全基因组bisulfite甲基化测序)相比较,对4个样品同时进行了ds-padlock和wgbs检测。结果表明:样本中目标区域内cg的覆盖度为100%,cg的>500x覆盖度为96%。由散点图分析得知同一个样本而言,皮尔森系数是0.976,ds-padlock检测方法检测到的甲基化水平与与wgbs检测方法检测到的甲基化化水平接近。3)突变基因检测结果及分析:对于已知存在brafv600e突变的样本t1,测序结果显示该位点深度为5216x,有1524条序列支持突变,其中有762条正链和762条负链同时被检测到。对于已知存在nrasq61r突变的样本t2,测序结果显示该位点深度为3418x,有576条序列支持突变,其中有288条正链和288条负链同时被检测到。对于已知存在egfrl858r突变的样本t3,测序结果显示该位点深度为4318x,有1028条序列支持突变,其中有514条正链和514条负链同时被检测到。对于已知不存在kras,braf,nras,egfr,hras突变的t4,5个基因的目标区域未检测到等位基因突变。结论:结合实验结果1)和2)分析,通过一次建库可以同时检测到样品中的目标区域内的甲基化和突变位点信息,在很大程度上节约了建库的样品、试剂成本和人力成本。此方法可以成功地应用于:①两条链的甲基化状态,②有效检测碱基突变,而不会受到亚硫酸盐对样品处理的影响。本发明方法的优势:1)发卡状接头将正负链锁定在一起,这样的优势在于可以同时检测到两条正负链信息。2)padlock方法只能检测到一条链上的甲基化信息,很难反映另外一条信息,虽然大部分情况下,两条链的甲基化信息是对称的,但也有不对称的情况。尤其在进行bisuffite转化实验之后,很难区分cpg位点上到底是c突变为t还是非甲基化cpg位点。3)与padlock方法相比较,本方法既能检测到目标区域内的突变也可以检测到甲基化信息,不但节约了样本,而且也极大地节省了建库和上机测序成本。4)能够指数级减少由于线性引物序列所引起的交叉反应及二聚体现象。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1