一种基于功能化石墨烯量子点的双循环及双猝灭体系的荧光生物传感器的制备方法与流程
本发明涉及一种基于功能化石墨烯量子点的双循环及双猝灭体系的荧光生物传感器,属于生物传感器技术领域。
背景技术:
microrna(mirna)是一类长度18~25个核苷酸的小单链rna,由dna转录产生,不翻译成蛋白质,通过碱基互补配对的方式与靶基因的3'utr区部分或完全互补,剪切靶基因的转录产物或者抑制转录产物的翻译,从而起到转录后凋控靶基因的表达的作用。mirna在表达上具有组织和时间的特异性,是调节其他功能基因表达的重要调控分子,在生物的各项生理活动、生长发育过程中发挥着重要作用。研究人员证明,mirna在各种生物过程中发挥着重要的调节作用,如基因表达,细胞增殖,细胞凋亡,病毒防御,代谢,造血分化和肿瘤发生。最近,肿瘤来源的无细胞mirna作为生物标志物引起了广泛关注。这些mirna存在于体液中,例如尿液,唾液和血浆,并且具有一些有价值的特征,包括显着的稳定性,对降解的rnase酶的抗性和非侵入性。它们还可以在不同水平影响癌症,无论是在疾病刚发生还是进展中,mirna表达的定量测量对早期诊断和疾病治疗至关重要。然而,mirna的一些特性使其定量检测变得十分困难。一方面是mirna仅长约22个核苷酸,尺寸很小,因此设计合适的杂交探针变得非常困难。另一方面是同一家族成员之间的序列相似性,这使得成功检测低丰度mirna需要非常灵敏的方法。此外,mirna通常不共享共同序列。因此,对于生物医学研究和早期临床诊断而言,开发出更加灵敏和具有特异性的mirna检测方法迫在眉睫。
最近几年,研究人员已经发展了很多mirna的检测技术,包括northernblot、寡核苷酸芯片分析技术、电化学方法和荧光方法。northern印迹是分析mirna表达的最常见的主要方法。然而,rna印迹存在限制其在诊断实践中的适用性的问题。由于mirna的小尺寸和rna的总提取物中的低丰度,该方法对于mirna的直接检测而言不够灵敏。寡核苷酸微阵列分析允许高通量和同时检测多个目标。然而,该技术的相当高效率并未超越其限制。从微阵列获得的数据需要通过其他技术进一步确认。电化学方法通常具有高灵敏度和特殊特异性,但不稳定性是其固有的缺点。荧光测定由于其低成本,简单操作和快速响应而引起了mirna检测的极大关注。为了提高灵敏度,开发了许多用于mirna荧光检测的信号放大策略。酶辅助信号放大方法已成功用于低丰度mirna的分析。然而,酶的使用可能限制探针中的核酸序列,因为它们需要来自探针的特异性识别位点。另外,酶价格昂贵,反应条件复杂。为了解决上述问题,已经设计了非酶信号放大方法并研究了荧光检测mirna。独立于酶的粘性末端介导的链置换(tmsd)反应对于具有动态特性的mirna的信号放大变得越来越有吸引力。tmsd用于协调杂交反应,并且已被证明是用于接收和转移输入的强大的非酶工具。在反应中,入侵链首先与双链体上的突出的单链结构域(称为“立足点”)杂交,导致一个dna从双链体的分支迁移产生链置换。tmsd最突出的例子之一是催化发夹组装(cha),其中引发剂mirna基于tmsd激活与发夹的级联组装步骤,然后置换引发剂以催化发夹的另一自组装过程。这种cha反应可以产生百倍催化扩增,其中背景和转导分析物可以忽略不计地结合各种检测方式。此外,cha以自主和可重新配置的方式操作,仅需要dna链之间的碱基配对设计,不仅在感测平台的灵敏度方面而且在信号放大的便利性方面得到巨大改进。尽管取得了这些进展,但开发一种更可靠,灵敏且具有选择性的荧光方法对于mirnas测定是非常需要的。
技术实现要素:
本发明的目的是为了解决问题,提供了一种基于功能化石墨烯量子点的双循环及双猝灭体系的荧光生物传感器的制备方法,制备得到的荧光生物传感器能够用于定量检测生物体内的mirna。
本发明采用如下技术方案:一种基于功能化石墨烯量子点的双循环及双猝灭体系的荧光生物传感器的制备方法,包括如下步骤:
(1)称取原料柠檬酸、组氨酸和五乙烯六胺混合均匀,其中柠檬酸、组氨酸、五乙烯六胺的摩尔比为0.01:0.1:1~1:1:1,加入去离子水后进行超声溶解得到反应液,将反应液放入烘箱内,在烘箱温度为150~250℃条件下反应0.5~10h,反应结束后过滤得到五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his粗产物;
(2)将步骤(1)中的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his粗产物配制成25-200mg/ml的水溶液后置于透析袋中在去离子水中进行透析,去除溶液中的小分子物质,透析袋中产生沉淀结束透析,将透析袋中的溶液冷冻干燥,得到固体五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his;
(3)将五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his固体溶解在pbs缓冲溶液中,五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his的质量浓度为0.2mg/ml;
(4)取0.1-5μm的ldna溶液30-100μl加入离心管中,然后依次加入0.1-10mlte缓冲溶液、10-100mg/ml的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐溶液10-100μl和10-50mg/ml的n-羟基琥珀酰亚胺溶液5μl,将离心管置于空气浴振动器中活化,将活化的ldna溶液与步骤(3)中100-500μl的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his溶液混合孵育,超滤数次去除未缀合的ldna,得到ldna-封端的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his溶液,水洗将溶液备用;
(5)向ldna-封端的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his溶液中依次加入mb(molecularbeacons)溶液、发夹h1溶液和发夹h2溶液,然后加入20-500μl的1pm~1am的mirna溶液,并在20-40℃下孵育60-180min,加入20-500μl溶解在hepes缓冲液中的摩尔浓度为0.05-1μm氯化血红素溶液,并在室温下反应10-90min以形成g-四链体/dna酶,最后加入0.5-100μl的摩尔浓度为0.1-10μm的h2o2,得到双循环及双猝灭体系的荧光生物传感器。
进一步的,所述步骤(4)中超滤时采用vivaspin超滤离心管在2-8℃条件下以3000-8000g超滤5次。
进一步的,所述步骤(5)中分别加入20-500μl摩尔浓度为50-500nm的mb(molecularbeacons)溶液、20-500μl摩尔浓度为50-500nm的发夹h1溶液和20-500μl摩尔浓度为50-500nm的发夹h2溶液。
进一步的,所述步骤(4)中的活化条件为在15-35℃和100-500rpm下孵育30-180分钟。
进一步的,所述步骤(4)中的孵育条件为15-35℃,100-500rpm的空气浴振动器中孵育过夜。
基于五乙烯六胺和组氨酸功能化石墨烯量子点peha-gqd-his的通用荧光生物传感器平台和用于检测mirna的双循环扩增策略,使用peha-gqd-his作为荧光探针产生用于检测mirna的强荧光信号,将peha-gqd-his上的目标触发的dna纳米组装与g-四链体/dna酶调节的双猝灭机制整合,实现了显着的信号放大。peha-gqd-his的高催化活性进一步加快了h2o2的分解并引起更有效的荧光猝灭,导致第二次信号放大,这种双重放大的生物传感器具有灵敏度高,选择性好和低基质效应等优点,并且在临床诊断和癌症检测中具有一定的应用前景。
五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his中五乙烯六胺的引入是为了增强石墨烯量子点的荧光,从而达到提高检测的信噪比,增强检测体系灵敏度的目的;本发明中涉及到g-四链体/dna酶(模拟过氧化物酶,对过氧化氢具有一定的催化活性),组氨酸的作用就是增强g-四链体/dna酶的催化活性,加快对过氧化氢的降解速率从而提高石墨烯量子点的荧光猝灭效率。
本发明的有益效果为:
(1)荧光发射强度高,相比较于其他量子点而言,石墨烯量子点生物相容性好,片层上具有丰富的亲水基团,水溶性强;五乙烯六胺中含有两个氨基和五个亚氨基,当引入五乙烯六胺时,这些基团的供电子效应极大地增加石墨烯片中的电荷密度,这有助于提高石墨烯量子点的发光效率从而增强peha-gqd-his的荧光发射;
(2)能够提高过氧化物酶的催化活性,对于组氨酸而言,其咪唑环具有强的质子交换能力,该特征使过氧化物酶中的外源组氨酸作为一般酸性催化剂起到提高催化活性的作用;
(3)对于目标物的定量检测具有高灵敏度,peha-gqd-his自身具有高的荧光发射强度和提高g-四链体/dna酶对过氧化氢的催化活性,从而使得peha-gqd-his与双循环放大和荧光双猝灭体系的结合使得对目标mirna的检测具有高的信噪比和好的荧光猝灭效率。
(4)检测具有高选择性,目标mirna的检测方法中设计了一个mb循环,在该方案中,目标mirna与发夹mb特异性结合以开启dna链迁移过程,由于mirna不参与dna链迁移过程,所以可以有效地避免mirna同源性的问题。
附图说明
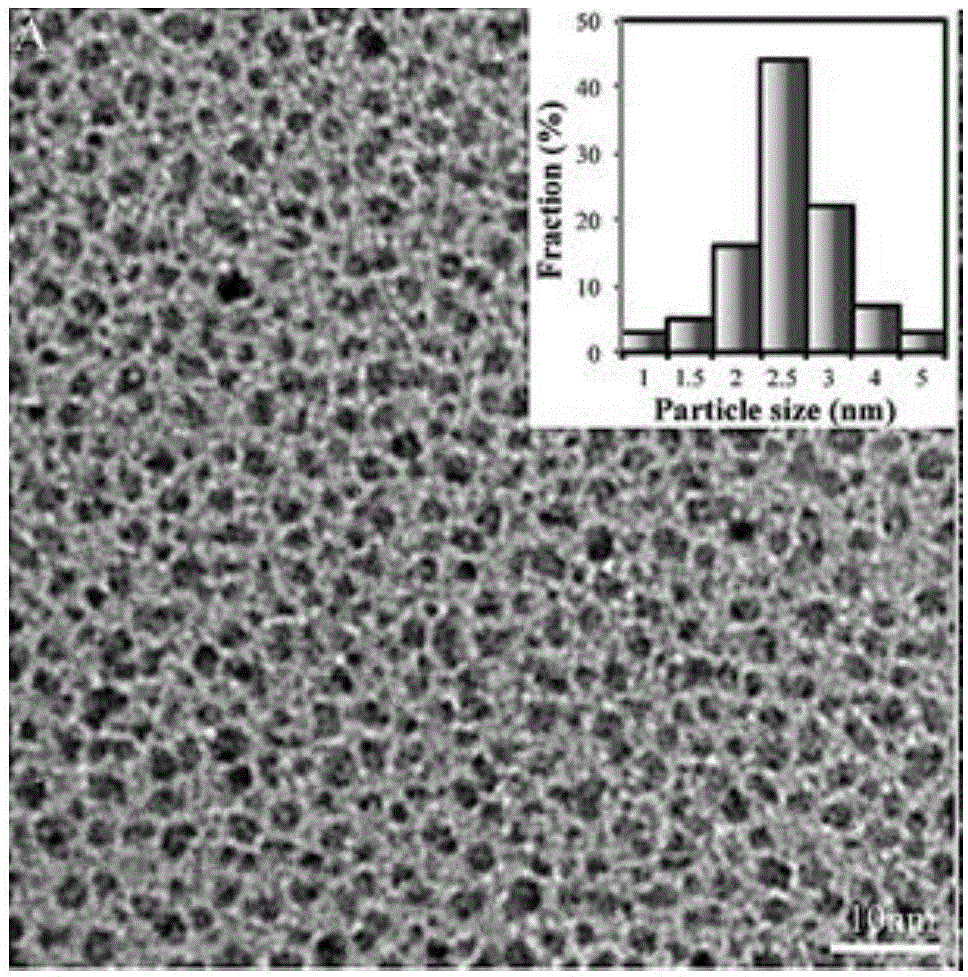
图1为本发明中五乙烯六胺-组氨酸石墨烯量子点的tem图。
图2为本发明中五乙烯六胺-组氨酸石墨烯量子点的hrtem图。
图3为本发明中五乙烯六胺-组氨酸石墨烯量子点的afm图。
图4为本发明中五乙烯六胺-组氨酸石墨烯量子点的ftir光谱图。
图5为本发明中五乙烯六胺-组氨酸石墨烯量子点的荧光激发和发射光谱图。
图6为本发明中对g-四链体/dna酶催化活性的影响。
图7为本发明中不同浓度目标mirna存在下,荧光生物传感平台的荧光发射曲线。
图8为本发明中荧光生物传感平台检测的线性范围。
具体实施方式
下面将结合附图对本发明作进一步的描述。
本发明所用的柠檬酸,组氨酸,五亚乙基六胺,氯化血红素,n-羟基琥珀酰亚胺(nhs),碳酸二乙酯(depc)和3-(3'-二甲基氨基丙基)碳二亚胺(edc)均外购于sigma-aldrich(中国大陆)。所有寡核苷酸均由生工生物工程有限公司(上海)合成和纯化,其序列列于表1中。在含有10mmtris-hcl,4mmmgcl2和15mmkcl(ph8.0)的tris/mg/ki缓冲液中制备dna储备溶液,并储存在-20℃。使用前,将mb,h1和h2序列在95℃加热10分钟,并以1℃min-1缓慢冷却至室温,形成稳定的发夹结构。其他试剂购自国药试剂(中国上海)。除非另有说明,否则所用的所有化学品均为分析级或最高纯度,无需进一步纯化即可按原样使用。
实验所需碱基序列为:
mirna-1415’-uaacacugucugguaaagaugg-3’
linkerdna(ldna)5’-cooh-ttttttttttacagtgtcg-3’
molecularbeacon(mb)5’-ctgtctggtctcactcgtccatctttaccagacagtgtta-3’
hairpinprobe(h1)5’-tgtctggtaaagatggacgagtgagaccagactctttaccagcgacactgtatgtcgggtagggcgggttggg-3’
hairpinprobe(h2)5’-tgtctggtaaagagtctggtctcactcgtccatctttaccagaca-3’
实施例一:
一种基于功能化石墨烯量子点的双循环及双猝灭体系的荧光生物传感器的制备方法,包括如下步骤:
(1)称取原料柠檬酸、组氨酸和五乙烯六胺混合均匀,其中柠檬酸、组氨酸、五乙烯六胺的摩尔比为1:1:1,加入去离子水后进行超声溶解得到反应液,将反应液放入烘箱内,在烘箱温度为150℃条件下反应10h,反应结束后过滤得到五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his粗产物;
(2)将步骤(1)中的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his粗产物配制成25mg/ml的水溶液后置于透析袋中在去离子水中进行透析,去除溶液中的小分子物质,透析袋中产生沉淀结束透析,将透析袋中的溶液冷冻干燥,得到固体五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his;
(3)将五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his固体溶解在pbs缓冲溶液中,五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his的质量浓度为0.2mg/ml;
(4)取0.1μm的ldna溶液100μl加入离心管中,然后依次加入0.1mlte缓冲溶液、10mg/ml的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐溶液100μl和10mg/ml的n-羟基琥珀酰亚胺溶液5μl,将离心管置于空气浴振动器中活化,15℃和500rpm下孵育180分钟,将活化的ldna溶液与步骤(3)中100-500μl的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his溶液混合孵育,孵育条件为15℃,500rpm的空气浴振动器中孵育过夜,超滤数次去除未缀合的ldna,得到ldna-封端的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his溶液,水洗将溶液备用,超滤时采用vivaspin超滤离心管在8℃条件下以3000g超滤5次;
(5)向ldna-封端的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his溶液中依次20μl摩尔浓度为500nm的molecularbeacons溶液、20μl摩尔浓度为500nm的发夹h1溶液和20μl摩尔浓度为500nm的发夹h2溶液,然后加入20μl的1am的mirna溶液,并在20℃下孵育180min,加入20μl溶解在hepes缓冲液中的摩尔浓度为1μm氯化血红素溶液,并在室温下反应10min以形成g-四链体/dna酶,最后加入100μl的摩尔浓度为0.1μm的h2o2,得到双循环及双猝灭体系的荧光生物传感器。
实施例二:
一种基于功能化石墨烯量子点的双循环及双猝灭体系的荧光生物传感器的制备方法,包括如下步骤:
(1)称取原料柠檬酸、组氨酸和五乙烯六胺混合均匀,其中柠檬酸、组氨酸、五乙烯六胺的摩尔比为0.01:0.1:1,加入去离子水后进行超声溶解得到反应液,将反应液放入烘箱内,在烘箱温度为200℃条件下反应2h,反应结束后过滤得到五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his粗产物;
(2)将步骤(1)中的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his粗产物配制成100mg/ml的水溶液后置于透析袋中在去离子水中进行透析,去除溶液中的小分子物质,透析袋中产生沉淀结束透析,将透析袋中的溶液冷冻干燥,得到固体五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his;
(3)将五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his固体溶解在pbs缓冲溶液中,五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his的质量浓度为0.2mg/ml;
(4)取1.0μm的ldna溶液50μl加入离心管中,然后依次加入1.0mlte缓冲溶液、20mg/ml的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐溶液10μl和20mg/ml的n-羟基琥珀酰亚胺溶液5μl,将离心管置于空气浴振动器中,在37℃和250rpm下孵育90分钟,将活化的ldna溶液与步骤(3)中250μl的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his溶液混合,并在25℃和250rpm的空气浴振动器中孵育过夜,超滤数次去除未缀合的ldna,得到ldna-封端的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his溶液,水洗将溶液备用,超滤时采用vivaspin超滤离心管在2-8℃条件下以3000-8000g超滤5次;
(5)向ldna-封端的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his溶液中依次100μl摩尔浓度为100nm的molecularbeacons溶液、100μl摩尔浓度为100nm的发夹h1溶液和100μl摩尔浓度为100nm的发夹h2溶液,然后加入100μl的1pm的mirna溶液,并在37℃下孵育90min,加入100μl溶解在hepes缓冲液中的摩尔浓度为0.05μm氯化血红素溶液,并在室温下反应60min以形成g-四链体/dna酶,最后加入100μl的摩尔浓度为10μm的h2o2,得到双循环及双猝灭体系的荧光生物传感器。
实施例三:
一种基于功能化石墨烯量子点的双循环及双猝灭体系的荧光生物传感器的制备方法,包括如下步骤:
(1)称取原料柠檬酸、组氨酸和五乙烯六胺混合均匀,其中柠檬酸、组氨酸、五乙烯六胺的摩尔比为0.01:0.1:1,加入去离子水后进行超声溶解得到反应液,将反应液放入烘箱内,在烘箱温度为250℃条件下反应0.50h,反应结束后过滤得到五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his粗产物;
(2)将步骤(1)中的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his粗产物配制成200mg/ml的水溶液后置于透析袋中在去离子水中进行透析,去除溶液中的小分子物质,透析袋中产生沉淀结束透析,将透析袋中的溶液冷冻干燥,得到固体五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his;
(3)将五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his固体溶解在pbs缓冲溶液中,五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his的质量浓度为0.2mg/ml;
(4)取5μm的ldna溶液30μl加入离心管中,然后依次加入10mlte缓冲溶液、100mg/ml的1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐溶液10μl和50mg/ml的n-羟基琥珀酰亚胺溶液5μl,将离心管置于空气浴振动器中活化,35℃和100rpm下孵育30分钟,将活化的ldna溶液与步骤(3)中100-500μl的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his溶液混合孵育,孵育条件为35℃,100rpm的空气浴振动器中孵育过夜,超滤数次去除未缀合的ldna,得到ldna-封端的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his溶液,水洗将溶液备用,超滤时采用vivaspin超滤离心管在2℃条件下以8000g超滤5次;
(5)向ldna-封端的五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his溶液中依次500μl摩尔浓度为500nm的molecularbeacons溶液、20μl摩尔浓度为50nm的发夹h1溶液和500μl摩尔浓度为50nm的发夹h2溶液,然后加入500μl的1pm的mirna溶液,并在40℃下孵育60min,加入500μl溶解在hepes缓冲液中的摩尔浓度为0.05μm氯化血红素溶液,并在室温下反应90min以形成g-四链体/dna酶,最后加入0.5μl的摩尔浓度为10μm的h2o2,得到双循环及双猝灭体系的荧光生物传感器。
取实施例二制备得到的五乙烯六胺-组氨酸石墨烯量子点进行表征,由图1tem图可知,五乙烯六胺-组氨酸石墨烯量子点peha-gqd-his由平均粒径为2.7nm的2d石墨烯片组成;
图2的hrtem和fftp分析的结果进一步证实peha-gqd-his是由结晶六方碳网络结构组成,晶格间距为0.22nm,其对应于石墨烯晶体的(100)面。图3的afm图像显示peha-gqd-his的平均高度为约0.9nm。证明大多数peha-gqd-his由1-2个石墨烯层组成。
图4的ftir光谱上,3300cm-1和3500cm-1之间的吸收带是o-h和n-h键的伸缩振动的特征ir吸收,表明存在-oh和-nh2。3000cm-1和2500cm-1之间的吸收带是饱和c-h键的ir吸收,验证了-ch2基团的存在。约1700cm-1处的峰值对应于c=o键的伸缩振动。以1500cm-1为中心的峰是由于c-o键的伸缩振动。图4的ftir光谱中,能够看到可能主要从五乙烯六胺或组氨酸的ftir光谱中发现的弱ir吸收峰。能够证明纳米石墨烯片的形成和五乙烯六胺与组氨酸中官能团的引入。
图5所示,peha-gqd-his的荧光激发和发射光谱如图所示。曲线a为荧光激发光谱,主要分布在300-400nm的波长范围内,其最大激发波长位于352nm。激发波长明显大于小分子有机化合物的激发波长,证明石墨烯片具有大的电子离域范围。在352nm的紫外光照射下,peha-gqd-his可以产生绿色荧光发射。曲线b为相应的荧光发射光谱呈现出准对称的形状,最大发射峰在443nm处。为了评估发光效率,使用硫酸奎宁法测量peha-gqd-his的荧光量子产率。peha-gqd-his的量子产率为90.2%。
在白光(c)和紫外光照射(d)下peha-gqd-his溶液的光学照片。
图6所示,为了研究peha-gqd-his对h2o2催化活性的影响,在g-四链体/dna酶存在的情况下,用h2o2氧化四甲基联苯胺的变色反应来证实。在该反应中,g-四链体/dna酶充当过氧化物酶以催化h2o2以产生电子受体o2并导致四甲基联苯胺的快速氧化。伴随着h2o2对四甲基联苯胺的氧化,溶液颜色将逐渐从无色变为蓝色。该研究表明,当反应时间为30分钟时,根据四甲基联苯胺在650nm处的吸光度来判断g-四链体/dna酶对h2o2催化活性的高低。650nm处的较大吸光度表示g-四链体/dna酶对过氧化氢具有较高的催化活性。在不存在g-四链体/dna酶的情况下,孵育30分钟后,650nm处的吸光度接近于零。这是因为在没有催化剂的情况下,四甲基联苯胺难以被h2o2氧化。在存在g-四链体/dna酶的情况下,在孵育30分钟后,650nm处的吸光度大大增加。结果证实g-四链体/dna酶可以加快h2o2氧化四甲基联苯胺的速度,表明g-四链体/dna酶对过氧化氢具有高催化活性。当peha-gqd-his被引入反应体系时(在g-四链体/dna酶存在下),tmb在652nm处的吸光度将进一步增加,证实peha-gqd-his可提高g-四链体/dna酶对h2o2的催化活性。此外,上图还显示peha-gqd-his与peha-gqd相比可以引起更大的吸光度增加。结果证实peha-gqd-his在提高g-四链体/dna酶的催化活性方面优于peha-gqd。综上所述,提高g-四链体/dna酶的催化活性主要归因于peha-gqd-his中的咪唑环。
曲线a为单独过氧化氢存在时,四甲基联苯胺(tmb)的吸收光谱;
曲线b为g-四链体/dna酶和过氧化氢存在时,四甲基联苯胺(tmb)的吸收光谱;
曲线c为g-四链体/dna酶,五乙烯六胺石墨烯量子点(peha-gqd)和过氧化氢存在的情况下,四甲基联苯胺(tmb)的吸收光谱;
曲线d为g-四链体/dna酶,peha-gqd-his和过氧化氢存在下,四甲基联苯胺(tmb)的吸收光谱。
照片中为在氧化之前(左)和氧化之后(右)的四甲基联苯胺溶液的光学照片。
由上图看出,组氨酸能够提高g-四链体/dna酶的催化活性。
图7显示了不同浓度目标mirna存在下,荧光生物传感平台的荧光发射曲线。图8是荧光生物传感平台检测的线性范围。从图7中可以看出,随着mirna浓度的增加,荧光强度逐渐减弱。结果证实所提出的生物传感系统的荧光信号取决于mirna浓度。此外,峰值荧光强度(fp)与mirna浓度对数的关系曲线在1.0×10-18-1.0×10-12m的浓度范围内呈现强线性关系。其线性相关方程为:fp=-25217log[cmirna(m)]+145686,回归系数为0.9998,检测限(lod)为4.3×10-19m。这些数据表明所提出的生物传感器的灵敏度比先前报道的mirna生物传感器的灵敏度要好得多。
- 还没有人留言评论。精彩留言会获得点赞!