分离的鲤抗病毒蛋白Rhbdd3及其抗病毒活性的制作方法
本发明涉及淡水鱼类基因工程技术领域,尤其涉及一种分离的鲤抗病毒蛋白rhbdd3及其抗病毒活性。
背景技术:
伴随着我国水产养殖业的不断发展,水生动物疾病尤其是病毒性疾病的发病率近年来呈现明显的上升趋势。水生动物病毒病发病快、死亡率高、大多没有有效的疫苗或针对性的药物,一旦发病很难治愈,带来巨大的经济损失,严重制约着我国水产养殖业的健康和可持续发展。因此,开发广谱抗病毒药物和培育鱼类抗病毒新品种具有十分重要的实用价值。
天然免疫是机体抵抗病毒侵袭的第一道防线,最新研究发现,rhomboid家族成员rhbdd3(rhomboiddomain-containingprotein3)在哺乳动物天然免疫中发挥了重要作用。rhomboid家族最先于果蝇中发现,其具有跨膜结构和蛋白酶活性。基于序列的相似性,目前共有14种蛋白归于rhomboid家族,其中5种具有蛋白酶活性,9种则失去了蛋白酶活性。小鼠中研究发现,rhbdd3主要分布于细胞内体且不具有蛋白酶活性,poly(i:c)处理会诱导小鼠nk细胞rhbdd3的上调,rhbdd3进而又可以调节nk细胞和树突状细胞的活性。然而,目前公共数据库中尚无鱼类rhbdd3基因的确定序列,鱼类rhbdd3蛋白的功能也尚未见任何报道。本发明首次通过pcr扩增获得了鲤rhbdd3基因片段的核苷酸序列,并在此基础上构建了rhbdd3真核表达质粒,转染鲤鱼上皮瘤细胞epc和鲑鱼囊胚细胞chse-214后,探明了rhbdd3蛋白过表达对危害重大的鱼类病毒—鲤春病毒血症病毒(svcv)和传染性胰脏坏死病毒(ipnv)增殖的影响。
鲤春病毒血症(svc)是一种由鲤春病毒血症病毒(svcv)导致的急性暴发性出血症。该病常于春季在水温8~20℃,尤其是13~15℃时暴发流行。鲤、锦鲤、草鱼、鲫及其变种、鲢、鳙等多种鲤科鱼类均能被感染。病鱼常聚集于出水口处,体色发黑、眼球突出、肛门红肿、腹部膨大及严重腹水、呼吸缓慢、往往失去平衡而侧游。该病发病急、病鱼死亡率可高达90%左右,严重危害渔业生产并造成毁灭性打击。因其高致病性,svc被世界动物卫生组织oie列为必须申报的疫病,也是我国鱼类口岸检疫的第一类检疫对象。2008年,农业部第1125号公告也将该其列为“中华人民共和国进境动物一类传染病”,也是迄今唯一一个被列为一类传染病的鱼类疫病。目前,尚缺乏有效控制svc的药物和方法,国际上通行的控制措施是进行svcv的监测,及早发现并进行隔离和扑杀。
传染性胰腺坏死病毒(ipnv)为鲑科鱼类高度传染性疾病—传染性胰腺坏死病(ipn)的病原。ipn病往往呈急性流行,感染幼鱼死亡率超过90%。病鱼体色发黑、眼球突出、腹部膨大、皮肤和鳍条出血,组织切片可见胰腺组织坏死。该病常在水温10~15℃时流行,发病后幸存鱼成为ipnv携带者,并可以通过尿液、粪便、鱼卵、精液等将病毒释放到环境中继续传播。ipn最早在美国北部发现,随后在欧洲、日本等多国发生流行,并已于20世纪80年代传入我国,其暴发主要集中在我国东北地区虹鳟以及大西洋鲑的养殖场,且近些年来有逐步蔓延之势,对我国水产养殖业构成了巨大威胁。
因此,本领域的技术人员致力于开发一种具有广谱抗病毒活性且不影响细胞正常活性的抗病毒蛋白,为危害性较大的鱼类传染性病原svcv和ipnv的预防和治疗提供新的药物靶点,也为鱼类抗病毒新品种的培育提供重要的技术依据。
技术实现要素:
有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是提供一种鲤抗病毒蛋白(rhbdd3),具有针对鲤春病毒血症病毒(svcv)和传染性胰腺坏死病毒(ipnv)的抗病毒活性,能降低svcv和ipnv感染性、抑制病毒复制,同时又不影响细胞的正常活性,为svcv及ipnv的预防和治疗提供新的药物靶点,克服现有技术的不足。
为实现上述目的,本发明提供了一种分离的鲤抗病毒蛋白rhbdd3基因,所述rhbdd3基因编码区核苷酸序列是seqidno:1中第1-1050bp所示的序列。
本发明还提供了一种分离的鲤抗病毒蛋白rhbdd3,所述蛋白rhbdd3编码的氨基酸序列是seqidno:2中所示的序列。
本发明还提供了一种包含所述rhbdd3基因编码区核苷酸序列的重组质粒。
本发明还提供了一种制备所述重组质粒的制备方法,所述方法包括以下步骤:
步骤一、提取鲤的rna,反转录所述rna获得鲤cdna;
步骤二、设计rhbdd3基因序列保守区的上游引物和下游引物,以所述步骤一获得的所述鲤cdna为模板扩增,得到扩增片段,将其纯化回收并连接至pmd18-t载体上得到连接产物,将所述连接产物转化dh5α大肠杆菌感受态细胞并筛选阳性克隆后,进行双向序列测定,获得rhbdd3基因序列;
步骤三、根据所述步骤二得到的所述rhbdd3基因序列,设计rhbdd3基因编码区的表达克隆正向引物和反向引物,以所述步骤一获得的所述鲤cdna为模板扩增得到扩增片段,并将所述扩增片段进行分子克隆,得到重组质粒。
进一步地,所述步骤三还包括在扩增前,需在所述表达克隆正向引物和反向引物上分别引入nhei、ecori酶切位点。
进一步地,所述上游引物和下游引物分别为pmd18-rhbdd3-f和pmd18-rhbdd3-r,其中所述pmd18-rhbdd3-f的dna序列为acctcaatatgacagcgtcgtaaac,所述pmd18-rhbdd3-r的dna序列为tatccctgagctatgacgctga。
进一步地,所述表达克隆正向引物和反向引物分别为pci-rhbdd3-f和pci-rhbdd3-r,其中所述pci-rhbdd3-f的dna序列为ttagctagccaccatgctcgatcatcttttttcagcat,所述pci-rhbdd3-r的dna序列为cggaattcctatgacgctgatggcttcttcc。
本发明还提供了一种如上所述的鲤抗病毒蛋白rhbdd3基因在制备抗鲤春病毒血症病毒药物组合物或抗传染性胰腺坏死病毒药物组合物中的应用。
本发明还提供了一种如上所述的鲤抗病毒蛋白rhbdd3在制备抗鲤春病毒血症病毒药物组合物或抗传染性胰腺坏死病毒药物组合物中的应用。
本发明还提供了一种如上所述的鲤抗病毒蛋白rhbdd3基因在培育鱼类抗病毒新品种中的应用。
与现有技术相比,本发明至少具有以下有益的技术效果:
(1)本发明的鲤抗病毒蛋白rhbdd3的表达可以抑制svcv和ipnv病毒的复制,降低svcv和ipnv病毒的感染性;
(2)本发明的鲤抗病毒蛋白rhbdd3的过表达不影响细胞的正常活性;
(3)本发明的rhbdd3蛋白基因和rhbdd3蛋白高度保守,为制备广谱的抗病毒药物提供了新的靶点;
(4)本发明的rhbdd3蛋白基因和rhbdd3蛋白为鱼类抗病毒新品种的培育提供了重要的技术依据。
以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
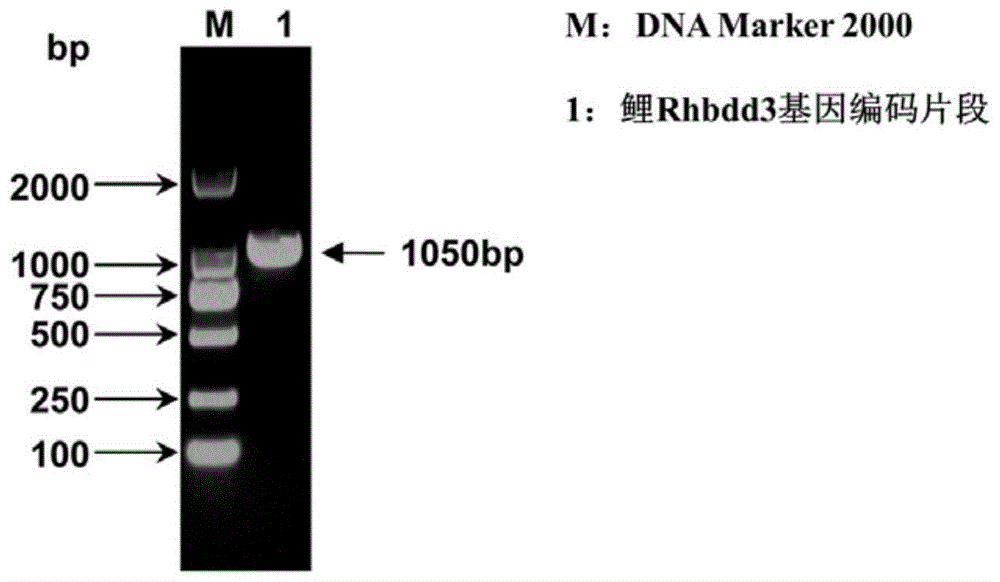
图1是本发明的一个较佳实施例的鲤rhbdd3基因编码区的扩增结果示意图;
图2是本发明的一个较佳实施例的鲑rhbdd3基因编码区的扩增结果示意图;
图3是本发明的一个较佳实施例的鲑rhbdd3基因编码区的扩增序列比对结果示意图;
图4是本发明的一个较佳实施例的构建的重组质粒pci-rhbdd3限制性内切酶双酶切的结果示意图;
图5是本发明的一个较佳实施例的利用免疫印迹法检测rhbdd3过表达的结果示意图;
图6是本发明的一个较佳实施例的利用细胞增殖/毒性检测试剂cck-8检测rhbdd3过表达对epc细胞活性影响的结果数据图;
图7是本发明的一个较佳实施例的利用细胞增殖/毒性检测试剂cck-8检测rhbdd3过表达对chse-214细胞活性影响的结果数据图;
图8是本发明的一个较佳实施例的利用间接免疫荧光法检测rhbdd3蛋白过表达对svcv感染影响的荧光成像结果示意图;
图9是本发明的一个较佳实施例的利用免疫印迹法检测rhbdd3过表达对svcv感染影响的免疫印迹结果示意图;
图10是本发明的一个较佳实施例的利用荧光定量pcr法检测rhbdd3蛋白过表达对svcv增殖影响的结果数据图;
图11是本发明的一个较佳实施例的利用间接免疫荧光法检测rhbdd3蛋白过表达对ipnv感染影响的荧光成像结果示意图;
图12是本发明的一个较佳实施例的利用免疫印迹法检测rhbdd3过表达对ipnv感染影响的免疫印迹结果示意图;
图13是本发明的一个较佳实施例的利用荧光定量pcr法检测rhbdd3过表达对ipnv增殖影响的结果数据图;
图14是本发明的一个较佳实施例的应用的pci-neo空载体的结构示意图谱;
图15是本发明的一个较佳实施例的制备的重组质粒pci-rhbdd3的结构示意图谱。
具体实施方式
以下参考说明书附图介绍本发明的多个优选实施例,使其技术内容更加清楚和便于理解。本发明可以通过许多不同形式的实施例来得以体现,本发明的保护范围并非仅限于文中提到的实施例。
(1)鲤rna的提取
采用经典的trizol法提取样品总rna。取鲤组织块用眼科剪剪碎后直接放入研钵中,加入少量液氮,迅速研磨,研磨充分后转入离心管,取50-100mg组织加入1mltrizol,混匀,室温放置10min,然后4℃,12000×g,离心5min。
取上清加入200μl氯仿,振荡混匀后室温放置15min,4℃,12000×g,离心15min。
取上层水相至另一新的离心管,加入500μl异丙醇,冰上放置10min,4℃,12000×g,离心15min。
弃上清,加入冰上预冷的75%的乙醇1ml洗涤沉淀,4℃,7500×g,离心10min。
弃上清,室温晾干,用无rna酶的水溶解rna沉淀,立即进行反转录。
(2)鲤cdna的合成
采用invitrogen公司的反转录试剂盒,按照说明书操作步骤进行cdna合成,具体步骤如下:
在pcr反应管中依次加入1μg上述提取的所述rna、1μl随机六聚体引物、补充无rna酶的水至总体积12μl;于65℃反应5min,立即置于冰上,然后加入4μl5×reactionbuffer、1μlribolockrnaseinhibitor、2μl10mmdntpmix和1μlrevertaidm-mulvrt,25℃反应5min,之后42℃保温45min获得cdna。
(3)鲤rhbdd3基因的扩增
首先利用primerexpress5.0和bioedit7.0软件,根据genbank中鲤、鲫鱼、斑马鱼、金线鲃等预测的rhbdd3基因序列保守区设计引物pmd18-rhbdd3-f和pmd18-rhbdd3-r,以所述鲤cdna为模板进行pcr扩增,引物dna序列为:
pmd18-rhbdd3-f:acctcaatatgacagcgtcgtaaac;
pmd18-rhbdd3-r:tatccctgagctatgacgctga。
pcr反应体系如下:ddh2o30.5μl、10×labufferii(mg2+plus)5μl、dntpmixture(2.5mmol/l)8μl、上下游引物(10μmol/l)各2μl、lataqpolymerase(5u/μl)0.5μl、cdna模板2μl,总体积为50μl。
pcr反应条件为:95℃预变性5min;95℃变性30s,52℃退火30s,72℃延伸2min,共35个循环;72℃延伸10min;4℃保温。
pcr扩增产物经1%琼脂糖凝胶电泳,切胶纯化回收后连接至pmd18-t载体上。连接产物转化dh5α大肠杆菌感受态细胞,菌液pcr筛选阳性克隆并送生工生物工程(上海)股份有限公司进行双向序列测定。
(4)重组质粒pci-rhbdd3的构建
利用primerexpress5.0软件,根据所述(3)中rhbdd3基因序列,设计rhbdd3基因编码区的表达克隆正向引物pci-rhbdd3-f和反向引物pci-rhbdd3-r,并分别在所述正向引物和所述反向引物上引入nhei、ecori酶切位点,以所述鲤cdna为模板进行rhbdd3基因编码区的pcr扩增,引物dna序列为:
pci-rhbdd3-f:ttagctagccaccatgctcgatcatcttttttcagcat;
pci-rhbdd3-r:cggaattcctatgacgctgatggcttcttcc。
pcr扩增反应体系同(3)中所述,扩增结果如图1所示。将pcr扩增片段切胶纯化回收,然后分别将回收的片段和pci-neo载体(购于promega公司,图谱如图14所示)用nhei和ecori限制性内切酶37℃酶切3h,酶切片段纯化回收,在t4dna连接酶作用下于16℃连接过夜。转化后利用菌液pcr和双酶切筛选阳性克隆,并送生工生物工程(上海)股份有限公司进行双向序列测定,重组质粒命名为pci-rhbdd3(图谱如图15所示)。
此外,本发明还利用鲑鱼组织进行了鲑总rna的提取,反转录获得鲑cdna,并进行了鲑rhbdd3基因编码区的扩增(图2),方法同(1)至(4)中所述。序列测定发现,扩增的鲑rhbdd3基因编码区核苷酸序列与鲤rhbdd3基因编码区序列相似性高达100%(图3),表明rhbdd3基因在鲤和鲑中十分保守,体现了本发明的rhbdd3基因和rhbdd3蛋白在鱼类中可应用的广泛性。
(5)重组质粒pci-rhbdd3和空载体pci-neo的制备
将30μl测序正确的单克隆菌液接种到3ml含50μg/ml氨苄青霉素的lb液体培养基中,37℃、220转/分钟,摇床培养过夜,用质粒提取试剂盒(购于invitrogen公司)提取所述重组质粒pci-rhbdd3和所述空载体质粒pci-neo,具体步骤如下:
将培养过夜的菌液置于1.5ml离心管中,室温、12000×g离心1min,弃尽上清,重复以上操作直至所有菌液离心完毕;
在细菌沉淀中加入250μlresuspensionsolution悬浮沉淀;
加入250μllysissolution温和并充分地上下翻转4-6次使菌体充分裂解,直至形成透亮的溶液,此步骤不宜超过5min;
加入350μlneutralizationsolution并充分地上下翻转4-6次,室温、12000×g,离心5min;
吸取上清并转移至吸附柱,室温、12000×g,离心1min,弃滤液;
用500μlwashsolution洗两次,弃滤液;
室温、12000×g,离心空柱1min;
吸附柱移入新的1.5ml离心管中,在吸附柱膜中央加50μleluentsolution,室温静置2min,12000×g离心1min;
用分光光度计测定质粒浓度。
(6)重组质粒pci-rhbdd3的双酶切鉴定
将构建的pci-rhbdd3重组质粒用nhei和ecori限制性内切酶37℃酶切3h,凝胶电泳结果显示,重组质粒经酶切后获得了大小分别约5460bp和1050bp的两条特异性片段(结果如图4所示),与目标片段大小一致,进一步序列测定表明所构建的重组质粒阅读框正确无误。
(7)重组质粒pci-rhbdd3和空载体pci-neo转染epc细胞
具体步骤如下(以24孔细胞培养板为例):
转染前一天,铺24孔细胞培养板,第二天待细胞密度达到约70%-90%时转染,转染时每孔制备以下混合液:
a管:将0.8μg质粒溶于50μlopti-mem培养基中;
b管:将2μllipofectamine2000(购于invitrogen公司)溶于50μlopti-mem培养基中,混匀,室温放置5min;
然后将ab两管混合,室温放置20min,期间将细胞用opti-mem洗两次;
将混合物加入对应孔中,轻轻混匀,培养4-6h后换成含10%fbs的完全培养基。
(8)rhbdd3过表达对细胞活性影响的检测
利用细胞增殖/毒性检测试剂cck-8(购于dojindo公司)检测rhbdd3蛋白过表达对细胞活性影响。其基本原理为,cck-8试剂中含有2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2h-四唑单钠盐(wst-8),它在电子载体1-methoxypms的作用下能被细胞内的脱氢酶还原为水溶性的橙黄色甲臜,生成甲臜的量与细胞数成正比,可间接测定活细胞数量。具体步骤如下:
转染前一天,接种100μlepc或chse-214细胞悬液到96孔细胞培养板中,培养过夜,待细胞密度达到约70%-90%时按(7)中所述方法转染重组质粒pci-rhbdd3和空载体pci-neo;
分别于转染后12、36和72h向每孔中加入10μl的cck-8;
将培养板于培养箱内孵育1h,利用酶标仪测定450nm波长处的吸光度。
结果如图6和图7所示,表明rhbdd3的过表达并不影响epc和chse-214细胞的活性。
(9)免疫印迹实验(westernblot)
具体步骤如下:
所述重组质粒pci-rhbdd3和所述空载体pci-neo转染epc细胞24h后,弃上清,用pbs洗两次,每次3min,加入ripa裂解液,用枪吹打数下,使裂解液和细胞充分接触,冰上孵育10min,将细胞裂解液转移至1.5mlep管中,12000×g,离心5min,取20μl离心上清和5μl的5×蛋白上样缓冲液混匀,95℃煮5min,进行sds-page。10%sds-page凝胶采用sds-page凝胶配制试剂盒配制(购于上海翊圣生物科技有限公司);
裁剪与分离胶大小完全吻合的滤纸和pvdf膜,在转移缓冲液中平衡15min;
凝胶电泳结束后,分离胶于适量转移缓冲液中平衡10min;
组装转印夹层,在恒压下转移蛋白20v,40min;
转膜完毕,将膜取出,放入杂交盒,加10ml5%pbst-牛血清白蛋白(bsa)封闭液,37℃孵育2h;
倒掉封闭液,加入本实验室制备的rhbdd3抗体(一抗,用封闭液以体积比1:1000稀释),37℃孵育2h;
pbst洗3次,每次10min,加入hrp标记的山羊抗兔igg抗体(二抗,购于上海翊圣生物科技有限公司,以体积比1:10000稀释),37℃孵育1h;
倒掉二抗,pbst洗3次,每次10min;
加入ecl发色底物(购自天根生化科技(北京)有限公司),条带在5-10min内显色。
免疫印迹结果如图5所示,表明pci-rhbdd3转染后,rhbdd3蛋白的表达水平得到了显著提高。
病毒感染细胞的免疫印迹步骤与上述步骤相同,只是以体积比1:1000稀释的兔抗svcvm蛋白抗体(本实验室制备)、兔抗ipnvvp2蛋白抗体(本实验室制备)或内参hsp90蛋白兔抗(购于cellsignalingtechnology公司)作为一抗。
结果如图9和图12所示,rhbdd3蛋白过表达后,svcvm蛋白和ipnvvp2蛋白表达水平明显降低,提示病毒的感染得到了抑制。
(10)间接免疫荧光(if)
所述重组质粒pci-rhbdd3和所述空载体pci-neo转染epc或chse-214细胞24h后,以moi=1接种svcv或以moi=0.5接种ipnv,于感染后不同时间用pbs洗细胞2次,每次3min,每孔加入300μl4%多聚甲醛,室温固定30min;
吸除固定液,pbs洗细胞3次,每孔加入300μl含0.2%tritonx-100的pbs通透15min;
吸除通透液,pbs洗3次,加入4%bsa的封闭液,37℃封闭2h;
吸除封闭液,加入用封闭液稀释的一抗(本实验室制备,兔抗svcvm蛋白抗体或兔抗ipnvvp2蛋白抗体,均以体积比1:800稀释),37℃孵育2h;
吸除一抗,pbs洗3次,每次3min,加入荧光二抗(alexafluor488标记的驴抗兔或alexafluor594标记的驴抗兔,购于invitrogen公司,以体积比1:2000稀释),37℃孵育1h;
吸除二抗,pbs洗3次,每次3min,加入dapi染核液(购于roche公司,以体积比1:2000稀释),室温染色10min,pbs洗3次,每次3min;
每孔加入500μlpbs,置于倒置荧光显微镜下观察并拍照。
结果如图8和图11所示,rhbdd3过表达后被感染细胞数目明显减少,表明rhbdd3蛋白不仅可以抑制svcv的增殖,还可以抑制ipnv的增殖。
(11)rhbdd3蛋白过表达对svcv增殖的影响
所述重组质粒pci-rhbdd3(实验组)和所述空载体pci-neo(对照组)转染epc细胞24h后,以moi=1接种svcv,于感染后12、24和36h分别收取实验组和对照组的病毒感染液,进行svcvn基因拷贝数测定。具体操作步骤如下:
所述重组质粒pci-rhbdd3和所述空载体pci-neo转染epc细胞;
转染后24h,用无血清m199洗两次,以moi=1接种svcv,20℃吸附1h后换成含2%fbs的m199培养基;
感染后12、24和36h分别收取实验组和对照组的病毒感染液,用trizol法提取rna;
采用反转录试剂盒(购于invitrogen公司)进行cdna合成;
利用sybrgreen荧光定量pcr方法进行svcvn基因拷贝数测定。
荧光定量pcr引物dna序列如下:
正向引物:n-tf1:atcaggccgattatccttcca;
反向引物:n-tr1:agataagcattcacatgctgtat。
在200μl荧光pcr反应管中依次加入10μl2×sybrpremixextaq(购于takara公司)、浓度10μmol/l正向引物、反向引物各0.4μl、0.4μlroxreferencedyeii和待测样品cdna2μl,补充双蒸水至20μl,置于7500fast荧光定量pcr仪中进行反应,反应条件为95℃30s;之后95℃5s、60℃30s40个循环,结束后,立即由仪器进行熔解曲线分析,最后通过abi75002.0.6软件计算扩增产物tm值;将对照组24hn基因拷贝数设为1进行统计分析。
结果如图10所示,表明rhbdd3过表达可以显著抑制svcv的增殖。
(12)rhbdd3蛋白过表达对ipnv增殖的影响
所述重组质粒pci-rhbdd3(实验组)和所述空载体pci-neo(对照组)转染chse-214细胞后24h,以moi=0.5接种ipnv,于感染后18h收取实验组和对照组的病毒感染液,进行ipnvvp3基因拷贝数测定。具体操作步骤如下:
所述重组质粒pci-rhbdd3和所述空载体pci-neo转染chse-214细胞;
转染后24h,用无血清dmem洗两次,以moi=0.5接种ipnv,20℃吸附1h后换成含2%fbs的dmem培养基;
感染后18h收取实验组和对照组的病毒感染液,用trizol法提取rna;
采用反转录试剂盒(购于invitrogen公司)进行cdna合成;
利用sybrgreen荧光定量pcr方法进行ipnvvp3基因拷贝数测定。
荧光定量pcr引物dna序列如下:
正向引物:vp3-f1:cgaccgacatgaacaaaatca;
反向引物:vp3-r1:agttgcagctgtattcgcaca。
在200μl荧光pcr反应管中依次加入10μl2×sybrpremixextaq(购于takara公司)、浓度10μmol/l正向引物、反向引物各0.4μl、0.4μlroxreferencedyeii和待测样品cdna2μl,补充双蒸水至20μl,置于7500fast荧光定量pcr仪中进行反应,反应条件为95℃30s;之后95℃5s、60℃30s40个循环,结束后,立即由仪器进行熔解曲线分析,最后通过abi75002.0.6软件计算扩增产物tm值;将对照组vp3基因拷贝数设为1进行统计分析。
结果如图13所示,表明rhbdd3的过表达可以显著抑制ipnv的增殖。
本发明通过基因克隆技术从鲤中分离出rhbdd3基因,通过一系列的试验验证,表明本发明获得的rhbdd3蛋白具有优异的抗病毒特性,可显著降低svcv和ipnv的感染性、抑制病毒复制,在细胞抵御svcv和ipnv的感染过程中发挥着重要作用。此外,rhbdd3的过表达不影响细胞的正常活性。本发明的rhbdd3蛋白及其基因为制备抗svcv和ipnv药物提供了新的靶点,也为鱼类抗病毒新品种的培育提供了重要的技术依据。
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
序列表
<110>上海市水产研究所
<120>分离的鲤抗病毒蛋白rhbdd3及其抗病毒活性
<130>20190619
<160>6
<170>siposequencelisting1.0
<210>1
<211>1050
<212>dna
<213>鲤(cyprinuscarpio)
<400>1
atgctcgatcatcttttttcagcatggatgtggtttggatcaaaccggccaggatattgt60
agtggaacatttgtaatagtcatattcattttattgacttggctctgtggtattcacgcc120
agcctaagtttaggaccaggtggggaatttcctggattttatgactttatcttctacgcc180
ttcagtaatgaagagttgacctcatttctctacaacatcaccctgctgctgtggatcggg240
ccctgtcaggagagaagatggggcacttttgtcttcctagctctctcttttatctccact300
gtgcttcttcctcctatctatggcctttttctctttgttaccggggatgaagccagcagg360
gttagtggatactcagccacccaccttgccctgctcacagctcagtgtcggcaagtgaag420
cagagacgggtcctgcgttttgttcctgtctggttcttgccttggctcttcttgctcctc480
gacctctttctgcttcccagtgctccaggactgctgcatttttatgccatttgtctggga540
ctcaactacaataatgagtttattgaaatactggagcagatagagagactgggtgcatgt600
tcctgcttgccaaaatgggcctacatccctgttacctctcatccatacctgccagtttac660
cacaacacctcaataagaccagagccttcaaccagtagatcccagttggaggatcattcg720
gcatggcaatattctgtgtcagagtggcatcaggagcctttgttggcaacagattcacag780
ttgttagaggagcagatgctgagagcagggatattagcatcactccacgatgcaccagaa840
ggtgaagcggacaaagtggaagtacccaagtcctcagtgtcttcattaaggttgcaacag900
ctggagaagatgggcttccccacagagaaagctgttgtggctctggccgctacagggcag960
ttggatggagcgatctctttgcttattgatgatcagattggggaggaggctgtggtcatc1020
tctaaagggaagaagccatcagcgtcatag1050
<210>2
<211>349
<212>prt
<213>鲤(cyprinuscarpio)
<400>2
metleuasphisleupheseralatrpmettrppheglyserasnarg
151015
proglytyrcysserglythrphevalilevalilepheileleuleu
202530
thrtrpleucysglyilehisalaserleuserleuglyproglygly
354045
glupheproglyphetyrasppheilephetyralapheserasnglu
505560
gluleuthrserpheleutyrasnilethrleuleuleutrpilegly
65707580
procysglngluargargtrpglythrphevalpheleualaleuser
859095
pheileserthrvalleuleuproproiletyrglyleupheleuphe
100105110
valthrglyaspglualaserargvalserglytyrseralathrhis
115120125
leualaleuleuthralaglncysargglnvallysglnargargval
130135140
leuargphevalprovaltrppheleuprotrpleupheleuleuleu
145150155160
aspleupheleuleuproseralaproglyleuleuhisphetyrala
165170175
ilecysleuglyleuasntyrasnasnglupheilegluileleuglu
180185190
glnilegluargleuglyalacyssercysleuprolystrpalatyr
195200205
ileprovalthrserhisprotyrleuprovaltyrhisasnthrser
210215220
ileargprogluproserthrserargserglnleugluasphisser
225230235240
alatrpglntyrservalserglutrphisglngluproleuleuala
245250255
thraspserglnleuleuglugluglnmetleuargalaglyileleu
260265270
alaserleuhisaspalaprogluglyglualaasplysvalgluval
275280285
prolysserservalserserleuargleuglnglnleuglulysmet
290295300
glypheprothrglulysalavalvalalaleualaalathrglygln
305310315320
leuaspglyalaileserleuleuileaspaspglnileglygluglu
325330335
alavalvalileserlysglylyslysproseralaser
340345
<210>3
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>3
acctcaatatgacagcgtcgtaaac25
<210>4
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>4
tatccctgagctatgacgctga22
<210>5
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>5
ttagctagccaccatgctcgatcatcttttttcagcat38
<210>6
<211>31
<212>dna
<213>人工序列(artificialsequence)
<400>6
cggaattcctatgacgctgatggcttcttcc31
- 还没有人留言评论。精彩留言会获得点赞!