一种金属盐催化α-二酮化合物的合成方法与流程
本发明涉及催化以及有机化学技术领域,具体涉及一种金属盐催化α-二酮化合物的合成方法。
背景技术:
α-二酮是一类活泼的双官能团化合物,其结构为1,2-二羰基结构,反应活性中心多,是重要的有机合成中间体,用于合成杂环化合物和杂环金属络合物,在分析化学中可用作显色剂。α-二酮还广泛存在于多种天然产物中,在低浓度下具有奶油香味,因此被用作人造奶油及糖果等的增香剂,在香料市场需求量巨大。α-二酮还应用于药物及药物类似物中,这类结构常见于光学材料及染料当中。在日常生活中,α-二酮还可以作为除臭剂,可用在食品、牙膏和空气清洁剂中。
制备α-二酮的传统方法主要有以下三种:亲核加成-消去反应方法灵活,但操作较复杂,且反应需要低温,一般用来合成较为复杂的α-二酮;偶合法方法简单,条件温和,但刚刚发展,还很不成熟,有些偶合反应产物较为复杂;氧化法操作简单,但氧化剂一般有毒,且易造成深度氧化,并且金属氧化剂贵,反应温度较高。因此,我们正为寻求低成本、低毒、高效、操作简单的新合成方法和试剂。
技术实现要素:
本发明的目的在于提供一种金属盐催化α-二酮化合物的合成方法,合成方法简单,条件温和,产率较高。
本发明实现目的之一所采用的方案是:一种金属盐催化α-二酮化合物的合成方法,采用炔丙醇、酸酐为原料,在金属盐的催化作用下,反应得到一类烯二酮结构的化合物,结构式如下:
其中,r1、r2选自甲基、乙基、环己基、苯基中的任意一种,r3选自甲基、乙基、丙基、异丙基、异丁基、正庚基中的任意一种。
具体反应如下:
其中,炔丙醇可选择2-甲基-3-丁炔-2-醇、3-甲基-1-戊炔-3-醇、3-乙基-1-戊炔-3-醇、乙炔环己醇、2-苯基-3-丁炔-2-醇中的任意一种;酸酐可以选择乙酸酐、丙酸酐、正丁酸酐、异丁酸酐、异戊酸酐、正辛酸酐中的任意一种。当然还有其它炔丙醇和酸酐也能实现本发明,可根据需要选择。
优选地,所述金属盐为高氯酸根金属盐或三氟甲磺酸银。
优选地,所述金属盐催化剂为高氯酸银或高氯酸铜。
优选地,所述炔丙醇与金属盐的摩尔比为1:0.01-1:0.02。
优选地,该合成方法的反应体系为无溶剂体系。
优选地,该合成方法所加的溶剂为1-乙基-3-甲基咪唑高氯酸盐、1-乙基-3-甲基咪唑三氟甲磺酸盐、四氢呋喃、甲苯、二氯甲烷中的任意一种,溶剂用量为炔丙醇的1-1.5摩尔当量。
优选地,所述炔丙醇和酸酐摩尔比为1:1-1:5。
优选地,所述反应的温度为(-10)-30℃。
优选地,所述反应的时间为6-72h。
优选地,所述反应完成后,产物通过碱洗、柱层析进行分离;碱洗通过饱和的碳酸氢钠洗除酸;用柱层析方法进行产物分离时,采用硅胶作为固定相,展开剂为纯正己烷~正己烷:石油醚=1:1。
本发明具有以下优点和有益效果:本发明的合成方法简单,条件温和,首次利用炔丙醇和酸酐一锅法合成一类α-二酮产物,原材料廉价易获得,产率很高,最高可达90%。
附图说明
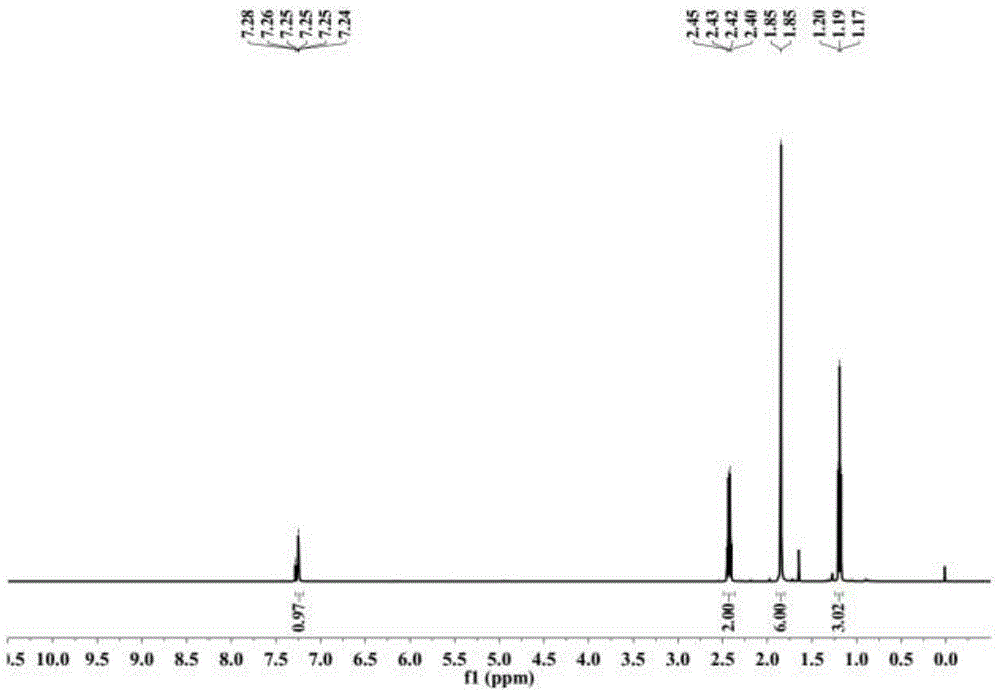
图1为实施例1中6-甲基-5-庚烯-3,4-二酮的1h核磁谱图;
图2为实施例1中6-甲基-5-庚烯-3,4-二酮的13c核磁谱图。
具体实施方式
为更好地理解本发明,下面的实施例是对本发明的进一步说明,但本发明的内容不仅仅局限于下面的实施例。
实施例1
6-甲基-5-庚烯-3,4-二酮的合成
在一个彻底干燥的schlenk反应管中,加入0.0207g(0.1mmol,2mol%)高氯酸银(agclo4)、0.4206g(5mmol)2-甲基-3-丁炔-2-醇、3.2535g(25mmol)丙酸酐。随之将体系置于25℃、磁力搅拌下反应12h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物6-甲基-5-庚烯-3,4-二酮,产率90%。
图1为本实施例中6-甲基-5-庚烯-3,4-二酮的1h核磁谱图,图2为本实施例中6-甲基-5-庚烯-3,4-二酮的13c核磁谱图。
从图1中可以看出:1hnmr(500mhz,chloroform-d)δ7.25(m,1h),2.43(q,j=7.6hz,2h),1.85(d,j=2.1hz,6h),1.19(t,j=7.6hz,3h)。这与该化合物理应的1h核磁谱图对应。
从图2中可以看出:13cnmr(126mhz,cdcl3)δ189.9,172.4,111.5,108.1,77.3,77.0,76.8,27.6,21.9,8.9。这与该化合物理应的13c核磁谱图对应。
由此,用该方法可以顺利合成目标产物。
实施例2
6-甲基-5-庚烯-3,4-二酮的合成
在一个彻底干燥的schlenk反应管中,加入0.0207g(0.1mmol,2mol%)高氯酸银(agclo4)、0.4206g(5mmol)2-甲基-3-丁炔-2-醇、3.2535g(25mmol)丙酸酐。随之将体系置于25℃、磁力搅拌下反应6h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物6-甲基-5-庚烯-3,4-二酮,产率88%。
实施例3
6-甲基-5-庚烯-3,4-二酮的合成
在一个彻底干燥的schlenk反应管中,加入0.0104g(0.05mmol,1mol%)高氯酸银(agclo4)、0.4206g(5mmol)2-甲基-3-丁炔-2-醇、0.6507g(5mmol)丙酸酐。随之将体系置于25℃、磁力搅拌下反应12h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物6-甲基-5-庚烯-3,4-二酮,产率61%。
实施例4
6-甲基-5-庚烯-3,4-二酮的合成
在一个彻底干燥的schlenk反应管中,加入0.0262g(0.1mmol,2mol%)高氯酸铜(cu(clo4)2)、0.4206g(5mmol)2-甲基-3-丁炔-2-醇、0.6507g(5mmol)丙酸酐。随之将体系置于25℃、磁力搅拌下反应12h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物6-甲基-5-庚烯-3,4-二酮,产率30%。
实施例5
6-甲基-5-庚烯-3,4-二酮的合成
在一个彻底干燥的schlenk反应管中,加入0.0257g(0.1mmol,2mol%)三氟甲磺酸银(agotf)、0.4206g(5mmol)2-甲基-3-丁炔-2-醇、0.6507g(5mmol)丙酸酐。随之将体系置于25℃、磁力搅拌下反应12h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物6-甲基-5-庚烯-3,4-二酮,产率42%。
实施例6
6-甲基-5-庚烯-3,4-二酮的合成
在一个彻底干燥的schlenk反应管中,加入0.0207g(0.1mmol,2mol%)高氯酸银(agclo4)、0.4206g(5mmol)2-甲基-3-丁炔-2-醇、0.6507g(5mmol)丙酸酐、(5mmol,1当量)甲苯。随之将体系置于25℃、磁力搅拌下反应12h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物6-甲基-5-庚烯-3,4-二酮,产率60%。
实施例7
6-甲基-5-庚烯-3,4-二酮的合成
在一个彻底干燥的schlenk反应管中,加入0.0207g(0.1mmol,2mol%)高氯酸银(agclo4)、0.4206g(5mmol)2-甲基-3-丁炔-2-醇、0.6507g(5mmol)丙酸酐、(6.5mmol,1.5当量)二氯甲烷。随之将体系置于25℃、磁力搅拌下反应12h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物6-甲基-5-庚烯-3,4-二酮,产率72%。
实施例8
6-甲基-5-庚烯-3,4-二酮的合成
在一个彻底干燥的schlenk反应管中,加入0.0207g(0.1mmol,2mol%)高氯酸银(agclo4)、0.4206g(5mmol)2-甲基-3-丁炔-2-醇、0.6507g(5mmol)丙酸酐。随之将体系置于-10℃、磁力搅拌下反应12h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物6-甲基-5-庚烯-3,4-二酮,产率20%。
实施例9
6-甲基-5-庚烯-3,4-二酮的合成
在一个彻底干燥的schlenk反应管中,加入0.0207g(0.1mmol,2mol%)高氯酸银(agclo4)、0.4206g(5mmol)2-甲基-3-丁炔-2-醇、3.2535g(25mmol)丙酸酐。随之将体系置于30℃、磁力搅拌下反应12h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物6-甲基-5-庚烯-3,4-二酮,产率20%。
实施例10
5-甲基-4-庚烯-2,3-二酮的合成
在一个彻底干燥的schlenk反应管中,加入0.0207g(0.1mmol,2mol%)高氯酸银(agclo4)、0.4907g(5mmol)3-甲基-1-戊炔-3-醇、2.552g(25mmol)乙酸酐、0.5265g(2.5mmol,0.5当量)1-乙基-3-甲基咪唑高氯酸盐。随之将体系置于25℃、磁力搅拌下反应12h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物5-甲基-4-庚烯-2,3-二酮,产率85%。
实施例11
5-乙基-4-庚烯-2,3-二酮的合成
在一个彻底干燥的schlenk反应管中,加入0.0207g(0.1mmol,2mol%)高氯酸银(agclo4)、0.5609g(5mmol)3-乙基-1-戊炔-3-醇、0.5045g(5mmol)乙酸酐。随之将体系置于25℃、磁力搅拌下反应12h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物5-甲基-4-庚烯-2,3-二酮,产率18%。
实施例12
5-环己基-4-戊烯-2,3-二酮的合成
在一个彻底干燥的schlenk反应管中,加入(0.1mmol,2mol%)高氯酸银、0.6209g(5mmol)1-乙炔基环己醇、2.5523g(25mmol)乙酸酐。随之将体系置于25℃、磁力搅拌下反应12h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物5-环己基-4-戊烯-2,3-二酮,产率62%。
实施例13
5-苯基-4-己烯-2,3-二酮的合成
在一个彻底干燥的schlenk反应管中,加入(0.1mmol,2mol%)高氯酸银、0.7310g(5mmol)2-苯基-3-丁炔-2-醇、2.5523g(25mmol)乙酸酐。随之将体系置于25℃、磁力搅拌下反应72h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物5-苯基-4-己烯-2,3-二酮,产率25%。
实施例14
2-甲基-2-辛烯-4,5-二酮的合成
在一个彻底干燥的schlenk反应管中,加入(0.1mmol,2mol%)高氯酸银、0.4206g(5mmol)2-甲基-3-丁炔-2-醇、3.9549g(25mmol)正丁酸酐。随之将体系置于25℃、磁力搅拌下反应12h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物2-甲基-2-辛烯-4,5-二酮,产率52%。
实施例15
2,6-二甲基-2-庚烯-4,5-二酮的合成
在一个彻底干燥的schlenk反应管中,加入(0.1mmol,2mol%)高氯酸银、0.4206g(5mmol)2-甲基-3-丁炔-2-醇、3.9549g(25mmol)异丁酸酐。随之将体系置于25℃、磁力搅拌下反应12h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物2,6-二甲基-2-庚烯-4,5-二酮,产率8%。
实施例16
2,7-二甲基-2-辛烯-4,5-二酮的合成
在一个彻底干燥的schlenk反应管中,加入0.0207g(0.1mmol,2mol%)高氯酸银(agclo4)、0.4206g(5mmol)2-甲基-3-丁炔-2-醇、4.6562g(25mmol)异戊酸酐。随之将体系置于25℃、磁力搅拌下反应12h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物2,7-二甲基-2-辛烯-4,5-二酮,产率70%。
实施例17
2-甲基-2-十二烯-4,5-二酮的合成
在一个彻底干燥的schlenk反应管中,加入0.0207g(0.1mmol,2mol%)高氯酸银(agclo4)、0.4206g(5mmol)2-甲基-3-丁炔-2-醇、6.7603g(25mmol)正辛酸酐。随之将体系置于25℃、磁力搅拌下反应12h,反应完成后,用饱和的碳酸氢钠去除酸,将粗产品通过柱层析分离的方法,以纯正己烷~正己烷:石油醚=1:1为洗脱液纯化得到目标产物2-甲基-2-十二烯-4,5-二酮,产率70%。
以上所述是本发明的优选实施方式而已,当然不能以此来限定本发明之权利范围,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和变动,这些改进和变动也视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!