用于二氧化碳捕获的稳定无机氧化物载体及衍生吸附剂的制作方法
本发明涉及用于从气体(尤其是从废气)捕获二氧化碳的稳定无机氧化物载体和吸附剂,以及一种用于制备稳定无机氧化物载体或吸附剂的方法。
整个专利申请中使用的术语定义:
本专利申请以下使用的“载体”包括但不局限于“吸附剂”。
本专利申请以下使用的“二氧化碳捕获/捕捉”包括但不局限于“吸附二氧化碳”。
“孔隙度”定义为多孔材料的空气体积与多孔材料总体积的比率。
“孔隙大小分布”定义为多孔材料的代表性体积内每个孔隙大小的相对丰度。
“孔隙度初湿含浸技术”描述一种用于合成多相催化剂的技术。在水溶液或有机溶液中溶解金属前体,然后加入孔隙体积与所加入溶剂体积相等的催化剂载体。通过毛细管作用使溶液含浸到孔隙中。然后干燥催化剂,去除多孔催化剂载体中的挥发性成分,在催化剂表面沉淀金属。
背景技术:
:
一个世纪前,前工业时代的大气二氧化碳平均浓度为280ppm,到2010年已攀升至390ppm以上。为满足全球不断增加的能源需求而进行的快速工业发展,导致大气二氧化碳浓度不断上升。大型工业设施是向环境排放二氧化碳的主要来源,如发电厂、炼油厂以及水泥、金属和铝等其他加工厂。大气二氧化碳浓度上升是全球变暖的原因之一。为了应对全球变暖,近年来各国一直鼓励实施各种预防措施,如使用核能和风能等低碳或不含碳的能源,以及捕获和封存二氧化碳等其他方法。随着全球转向低碳和不含碳能源,二氧化碳捕获和封存似乎是控制目前二氧化碳排放的最有前途的方法。
现有知识:
在各种燃烧后二氧化碳捕获方法中,如固体吸附、溶液吸附、膜和低温分离,固体吸附方法的优势最大,其二氧化碳捕获能力更强,再生能量消耗更少,运营成本更低,方便改造现有技术。
固体干燥可再生化学吸附方法在选择性吸收和释放二氧化碳方面具有巨大潜力。但是,目前报道的化学吸附方法主要缺点在于吸附剂再生特性差,如再生温度高,多次循环吸附能力差。高再生温度的主要原因是在二氧化碳化学吸附过程中,吸附剂表面形成的稳定中间产物需要高温才能完全分解。(例如,钾盐载体吸附剂表面形成的稳定产物,如KAl(CO3)2(OH)2)
因此,需要提供用于二氧化碳捕获的稳定载体及衍生吸附剂,此类载体及衍生吸附剂能够减少/避免二氧化碳捕获过程中稳定中间产物的形成,因此完全再生需要的温度显著降低,延长连续工作的使用寿命。
发明目的:
本发明的一些目的如下所述:
本发明的第一个目的是改善现有技术的一个或多个问题,或者至少提供一种有用的替代方案。
本发明的第二个目的是提供一种稳定无机氧化物载体,用于制备一种从各种气体捕获二氧化碳的吸附剂。
本发明的第三个目的是提供一种稳定无机载体,用于制备一种从各种气体捕获二氧化碳的吸附剂,使得二氧化碳捕获过程中吸附剂表面形成的稳定中间产物显著减少。
本发明的第四个目的是提供一种稳定无机载体,用于制备一种从各种气体捕获二氧化碳的吸附剂,此类稳定载体的连续工作使用寿命更长,并且在多次吸附再生循环中具有稳定的二氧化碳吸附能力。
本发明的第五个目的是提供一种用于制备稳定无机氧化物载体的方法。
本发明的第六个目的是提供一种稳定无机载体衍生吸附剂,用于从各种气体捕获二氧化碳,此类吸附剂具有出色的再生特性,在多次吸附再生循环中具有稳定的二氧化碳吸附能力。
本发明的第七个目的是提供一种用于从各种气体捕获二氧化碳的吸附剂,此类吸附剂的再生温度显著降低,从而减少能源需求。
本发明的第八个目的是提供一种用于从各种气体捕获二氧化碳的吸附剂制备方法。
配合附图阅读以下说明,本发明的其他目的和优势将得以进一步明确,但这些描述并不意图限制本发明的范围。
技术实现要素:
:
现有技术中用于制备CO2吸附剂的载体问题在于,再生后载体的二氧化碳吸附能力显著降低或削弱,无法实现商用。本发明通过提供一种CO2吸附剂载体制备方法解决此问题,该吸附剂的二氧化碳吸附能力出众,使用寿命长达11次循环。
本发明涉及一种用于从气体捕获二氧化碳的稳定无机氧化物载体制备方法,所述方法包括以下步骤:
a.稳定从以下组中选择的至少一种含氧化铝前体,该组包括伽马氧化铝、硅石氧化铝、勃姆石、假勃姆石和三水铝石,具体措施是热处理所述含氧化铝前体,获得含有以下组中选择的至少一种形态的稳定含氧化铝前体,该组包括伽马氧化铝、伊塔氧化铝、西塔氧化铝、德尔塔氧化铝和阿尔法氧化铝;
b.用至少一种碱性或碱土化合物含浸稳定氧化铝;
c.干燥含浸碱性或碱土化合物的稳定氧化铝,获得稳定无机氧化物载体。
该方法还可以在含氧化铝前体稳定前加入用至少一种碱金属含浸含氧化铝前体的预先步骤,具体措施是在20到50℃温度范围内(建议20到30℃)用碱金属氢氧化物处理含氧化铝前体10到20分钟,在80到140℃(建议120℃)烤炉内干燥10到24小时(建议12小时)。
稳定过程中含氧化铝前体的形态转变对决定载体的二氧化碳吸附能力起到关键作用。
新鲜载体的二氧化碳吸附能力为二氧化碳理论吸附能力的95%到98%,而再生载体的二氧化碳吸附能力为二氧化碳理论吸附能力的70%到85%。本发明方法制备的再生载体二氧化碳吸附能力至少是已知载体二氧化碳吸附能力的3.5倍。
附图说明:
图1说明按照本发明的实施例2A、2B、2C和2D稳定氧化铝载体的孔隙大小分布(PSD),在实施例2D吸附剂中,实施例2D稳定氧化铝载体含浸35wt%的K2CO3。
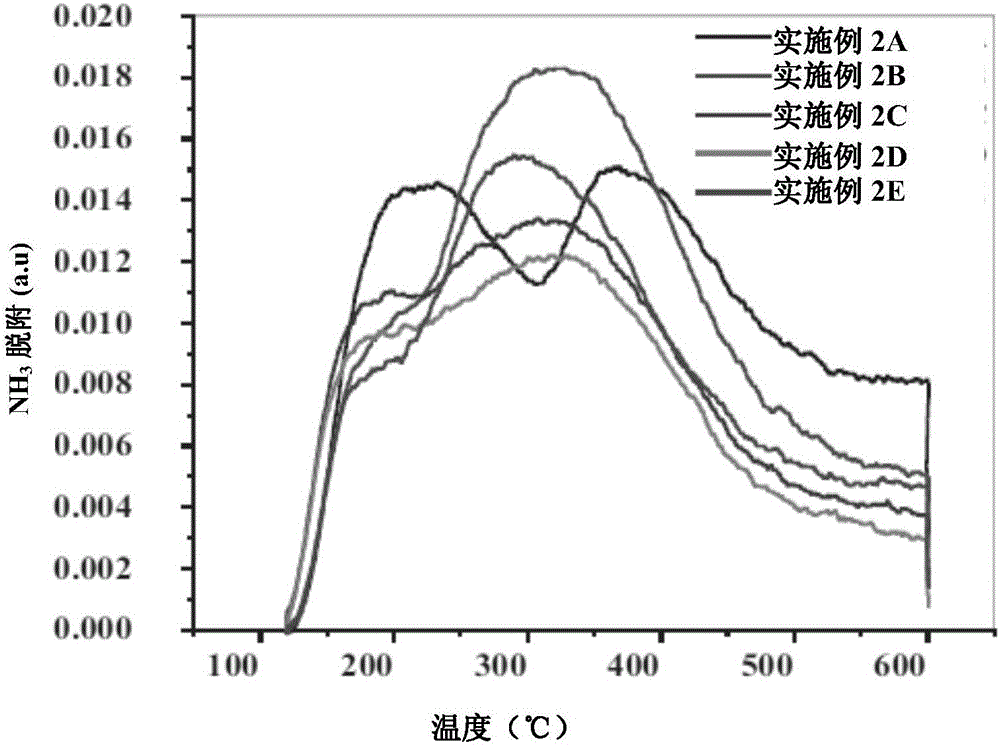
图2说明按照本发明的稳定氧化铝载体的氨程序升温脱附(TPD);
图3说明按照本发明的稳定氧化铝载体的X射线衍射(TPD);
图4说明按照本发明的以下X射线衍射:(a)实施例2D的稳定氧化铝载体;(b)实施例2D的吸附剂,实施例2D稳定氧化铝载体表面含浸35%K2CO3;(c)捕获二氧化碳后的实施例2D吸附剂;(d)再生捕获二氧化碳饱和的实施例2D吸附剂后;
图5说明按照本发明的实施例2D吸附剂的多次循环二氧化碳吸附能力。
具体实施方式:
本发明的一个方面是提供一种稳定无机氧化物载体,用于制备从各种气体捕获二氧化碳的吸附剂。本发明的另一个方面还提供一种用于制备稳定无机氧化物载体的方法。
按照本发明的稳定无机氧化物载体是一种含有氧化铝的载体,包含从以下组中选择的一种或多种氧化铝,该组包括伽马氧化铝、伊塔氧化铝、西塔氧化铝、德尔塔氧化铝、阿尔法氧化铝和硅石氧化铝。
按照本发明的一个具体实施方式,稳定无机氧化物载体包括从以下组中选择的至少一种氧化铝,该组包括伽马氧化铝、伊塔氧化铝、西塔氧化铝、德尔塔氧化铝和阿尔法氧化铝,建议阿尔法氧化铝。按照本发明的另一个具体实施方式,稳定无机氧化物载体包含硅石氧化铝。
按照本发明制备稳定无机氧化物载体的方法通常包括以下步骤:
a.稳定从以下组中选择的至少一种含氧化铝前体,该组包括伽马氧化铝、硅石氧化铝、勃姆石、假勃姆石和三水铝石,具体措施是热处理所述含氧化铝的前体,获得含有以下组中选择的至少一种氧化铝的稳定前体,该组包括伽马氧化铝、伊塔氧化铝、西塔氧化铝、德尔塔氧化铝和阿尔法氧化铝;
b.用至少一种碱性或碱土化合物含浸稳定氧化铝,获得含浸碱性或碱土化合物的稳定氧化铝;
c.干燥含浸碱性或碱土化合物的稳定氧化铝,获得稳定无机氧化物载体。
在将含氧化铝前体在550℃到800℃下稳定前,可以通过碱金属氢氧化物处理,用至少一种碱金属含浸含氧化铝前体。适合本发明用途的碱金属氢氧化物包括但不局限于氢氧化钠。在20到50℃下用碱金属氢氧化物溶液处理伽马氧化铝10到20分钟,获得含浸碱金属的伽马氧化铝。然后在80到140℃(建议120℃)干燥含浸碱金属的伽马氧化铝10到24小时,建议12小时。按照本发明的一个具体实施方式,在20到30℃下用碱金属氢氧化物处理伽马氧化铝。在120℃烤炉内干燥碱金属含浸的伽马氧化铝12小时。
煅烧含氧化铝前体/及其碱金属含浸形态进行稳定。含氧化铝前体的煅烧应确保至少将部分含氧化铝前体转化为含有以下组中选择的至少一种氧化铝形态的化合物,该组包括伊塔氧化铝、西塔氧化铝、德尔塔氧化铝和阿尔法氧化铝。按照本发明的一个典型具体实施方式,在550到1100℃的氧化或惰性环境中煅烧干燥后的碱金属含浸伽马氧化铝。
含氧化铝前体的稳定主要包括优化含氧化铝前体的表面积、孔隙度和表面羟基浓度,并通过转化较不稳定的四面体Al3+优化晶格中的八面体Al3+。按照本发明稳定含氧化铝前体可以提供稳定载体,显著减少二氧化碳捕获方法中在吸附剂表面形成的稳定中间产物量如KAl(CO3)2(OH)2。由于稳定中间产物形成减少,吸附剂可以在更低温度下再生而不破坏。因此,工艺提供的吸附剂具有更好的再生特性和稳定吸附能力。
按照本发明选择稳定方法取决于所使用的含氧化铝前体的性质。合适含氧化铝前体包括但不局限于勃姆石、假勃姆石、三水铝石、一种或多种形态氧化铝以及硅石氧化铝。按照一个典型具体实施方式,含氧化铝前体包含伽马氧化铝。按照另一个典型具体实施方式,含氧化铝前体包含硅石氧化铝。
按照本发明的一个具体实施方式,伽马氧化铝用作含氧化铝前体,通过热处理伽马氧化铝获得稳定无机氧化物载体。热处理通常指煅烧伽马氧化铝。伽马氧化铝煅烧应确保至少将部分伽马氧化铝转化为含有以下组中选择的至少一种氧化铝,该组包括伊塔氧化铝、西塔氧化铝、德尔塔氧化铝和阿尔法氧化铝。按照本发明的一个典型具体实施方式,在550到1100℃的氧化或惰性环境中煅烧伽马氧化铝。
按照本发明的一个典型具体实施方式,用于含浸稳定氧化铝的碱性或碱土化合物为碳酸钾。
在550℃到1100℃(具体为700℃到1100℃,更具体为900℃到1100℃)的氧化或惰性环境中煅烧含氧化铝前体进行稳定,在550到800℃下煅烧含浸含氧化铝前体进行稳定。
稳定无机载体中碱性或碱土化合物数量为载体总重量的5wt%到60wt%,具体为25wt%到40wt%。
用于在含氧化铝前体上含浸碱性或碱土化合物的含浸技术是从以下组中选择的至少一种,该组包括干燥孔隙度含浸方法和孔隙度初湿含浸方法。使用的含浸技术为孔隙度初湿含浸技术。
煅烧过程中,伽马氧化铝完全或部分转化为至少一种氧化铝形态。按照本发明的一个具体实施方式,煅烧伽马氧化铝获得的稳定无机氧化物载体包含伽马氧化铝以及从以下组中选择的至少一种氧化铝,伊塔氧化铝、西塔氧化铝、德尔塔氧化铝和阿尔法氧化铝。按照本发明的另一个具体实施方式,煅烧伽马氧化铝获得的稳定无机氧化物载体包含从以下组中选择的至少一种氧化铝,伊塔氧化铝、西塔氧化铝、德尔塔氧化铝和阿尔法氧化铝。在此具体实施方式中,伽马氧化铝以外的氧化铝形态数量远多于伽马氧化铝形态。
按照本发明方法获得的稳定伽马氧化铝载体具有以下特性:载体表面积为170到320m2/g;孔隙度为0.2到0.55cm3/g。稳定伽马氧化铝载体表面部分或完全分布在伽马和德尔塔氧化铝中。
按照另一个具体实施方式,硅石氧化铝用作含氧化铝前体,通过热处理硅石氧化铝获得稳定无机氧化物载体。热处理主要指煅烧硅石氧化铝。在550到1100℃下煅烧硅石氧化铝。按照另一个具体实施方式,硅石氧化铝用作含氧化铝前体,通过蒸气处理硅石氧化铝获得稳定无机氧化物载体。在550到900℃下存在蒸气的条件下对硅石氧化铝进行蒸气处理8到18小时。煅烧和蒸气处理硅石氧化铝可将硅石氧化铝转化为更多晶形态。煅烧和/或蒸气处理载体获得的稳定无机氧化物载体包含从以下组中选择的至少一种氧化铝,该组包括伊塔氧化铝、德尔塔氧化铝和西塔氧化铝。
稳定无机载体进一步用碱性或碱土化合物含浸10到24小时,然后在80到140℃(具体为120℃)下干燥。
按照本发明方法获得的稳定无机氧化物载体的表面羟基浓度更低,有助于减少二氧化碳捕获过程中形成的稳定中间产物量。此外,有效的稳定方法还将活性更高的四面体Al3+转化为稳定的八面体Al3+,从而减少氧化铝晶格中的前者数量。
按照本发明方法获得的稳定硅石氧化铝载体具有以下特性:载体表面积为200到550m2/g;孔隙度为0.18到0.95cm3/g。稳定硅石氧化铝载体表面部分或完全分布在德尔塔氧化铝和西塔氧化铝中。稳定载体的平均孔隙直径在100到之间。
此外,还通过X射线衍射图谱(指出含氧化铝前体稳定过程中转化的氧化铝形态)和氨程序升温脱附(TPD)(以总酸度衡量酸性部位)说明按照本发明的稳定载体的特性。
在另一个方面中,本发明提供一种用于从各种废气捕获二氧化碳的吸附剂。用于本发明用途的吸附剂包含用至少一种碱性或碱土化合物含浸的稳定无机氧化物载体。
合适碱性或碱土化合物包括但不局限于碱性或碱土碳酸盐、碱性或碱土重碳酸盐以及碱性或碱土氧化物。按照本发明的一个典型具体实施方式,在稳定无机氧化物载体表面含浸的碱性或碱土化合物量为吸附剂总重量的5到60wt%。按照本发明的一个典型具体实施方式,碱性或碱土化合物为碳酸钾。
在另一个方面中,本发明提供一种用于从各种废气捕获二氧化碳的吸附剂制备方法。按照本发明的吸附剂制备方法包含在稳定载体表面含浸至少一种碱性或碱土化合物的方法。
可以采用相关现有技术的合适已知方法,在稳定载体表面含浸碱性或碱土化合物。此类含浸方法包括但不局限于孔隙度初湿含浸方法。按照此方法,在水中溶解金属前体以获得其水溶液。用于本发明的金属前体包括碱性或碱土前体。合适碱性或碱土前体包括但不局限于碱性或碱土碳酸盐、碱性或碱土重碳酸盐以及碱性或碱土氧化物。按照本发明的一个具体实施方式,碱性或碱土前体为碳酸钾。然后向获得的碱土水溶液加入稳定无机氧化物载体。允许将稳定无机氧化物载体含浸碱土水溶液预先确定的时间,然后在预先确定的温度下干燥以获得吸附剂。稳定载体上含浸的间碱性或碱土金属前体量为吸附剂总重量的5到60wt%。
按照本发明的吸附剂用于从各种废气捕获二氧化碳。吸附剂的吸附能力至少为二氧化碳理论吸附能力的90%。按照本发明的吸附剂能够在低温下再生,并继续用于捕获二氧化碳气体。吸附剂再生通常在100到150℃的惰性气体流下进行。此外,按照本发明的吸附剂在进行多次循环吸附再生方法后具有稳定的吸附能力。吸附剂的二氧化碳吸附能力稳定,为二氧化碳理论吸附能力的70到90%。
通过参照下列描述中的非限定性具体实施方式,对此处具体实施方式及其各种特征和有利细节进行说明。其中省去了对已知组分及处理技术的描述,以避免不必要地使本发明的具体实施方式模糊不清。本发明所采用的实施例仅旨在便于理解本发明具体实施方式可能的实践方式,并进而使本领域的技术人员能够实践本发明的实施方式。因此,不应将此类实施例视为限制本发明具体实施方式的范围。
实施例1
测量CO2吸附能力:
在固定床反应器中150mL/min惰性气体流下,用15vol%水蒸气处理吸附剂10分钟。然后在55℃下使预处理吸附剂化学吸附含有8vol%CO2的模拟气体混合物,直到几乎完全饱和。然后在存在惰性气体的条件下,在150℃下加热二氧化碳饱和的吸附剂,再生饱和吸附剂。获得的再生吸附剂继续用于捕获二氧化碳。
实施例2A
未改性伽马氧化铝载体:
采用孔隙度初湿含浸方法,用碳酸钾含浸从商业来源获得的伽马氧化铝,获得吸附剂。在典型吸附剂制备方法中,将120℃隔夜干燥的50g伽马氧化铝快速加入含有30g K2CO3的30mL室温脱盐水溶液中。在氮气流下干燥获得的混合物,然后在120℃烤炉中干燥12小时。通过ICP分析确定伽马氧化铝表面含浸的K2CO3量。发现碳酸钾含浸量约为37wt%。
按照实施例1介绍的过程计算新鲜吸附剂的CO2吸附能力和多次吸附再生循环后的稳定吸附能力,结果分别为理论吸附能力的91%和20%。CO2吸附和二氧化碳饱和吸附剂再生的温度分别维持在55℃和130℃。
确定伽马氧化铝的表面积、孔隙度、孔隙大小分布、NH3-TPD酸度测量、研磨指数和形态分析。表1总结相关结果(参考表-1中实施例2对应数据)。附图的图1还说明伽马氧化铝的孔隙大小分布。伽马氧化铝载体的N2-表面积为188m2/g,总表面酸度为0.55mmol NH3/g,孔隙度为0.48cm3/g,孔隙直径为
实施例2B
通过700℃下煅烧稳定的伽马氧化铝:
实施例2A的伽马氧化铝在700℃和空气/氮气流下煅烧6小时。获得的稳定伽马氧化铝用作制备吸附剂的载体。表1总结此实施例中稳定伽马氧化铝的物理化学和机械特性以及形态分析(参考表-1中实施例2B对应数据)。在700℃下煅烧后发现,氧化铝总酸度相比实施例-2A的伽马氧化铝减少,但孔隙直径增加约19%(从98增加至)。附图图1还说明此实施例的稳定伽马氧化铝的孔隙大小分布。煅烧伽马氧化铝可去除游离水、毛细管水和中间层水。此类水在高煅烧温度下的冷凝导致孔隙直径增加,而表面积和孔隙度减小说明壁晶体的结构改变。羟基团的加热脱水造成稳定伽马氧化铝表面酸度下降。附图图2说明用于测量稳定伽马氧化铝酸度的NH3程序升温脱附。实施例2B中稳定伽马氧化铝的氧化铝形态是伊塔氧化铝和伽马氧化铝的混合,如附图图3所示。
为制备吸附剂,将50g此实施例的稳定伽马氧化铝加入含有26g K2CO3的27mL室温脱盐水溶液中。在氮气流下干燥获得的混合物,然后在120℃烤炉中干燥12小时。通过ICP分析确定含浸K2CO3量,发现K2CO3含浸量约为31wt%。
按照实施例1介绍的方法执行吸附剂的CO2吸附和再生研究。此实施例的吸附剂CO2吸附能力和多次循环稳定吸附能力分别为理论吸附能力的98%和71%。按照实施例2A介绍,维持吸附和再生温度。
实施例2C
通过900℃下煅烧稳定的伽马氧化铝
按照实施例2B介绍的相同方法对实施例2A的伽马氧化铝进行煅烧,但煅烧温度不同。煅烧温度维持在900℃。获得的稳定伽马氧化铝载体用于进一步制备吸附剂。在典型制备方法中,将65g此实施例的稳定伽马氧化铝快速加入含有30.3g K2CO3的30mL室温脱盐水溶液中。在氮气流下干燥获得的混合物,然后在120℃烤炉中干燥12小时。通过ICP分析确定含浸K2CO3量,发现K2CO3含浸量为31wt%。按照实施例1介绍的方法执行CO2吸附-再生分析。此实施例吸附剂的新鲜吸附能力和多次循环稳定吸附能力分别为理论吸附能力的98%和78%。
确定此实施例的稳定伽马氧化铝载体的各种物理化学特性(参考表-1中实施例2C的对应数据)。相比实施例2A的稳定氧化铝载体,此实施例的稳定伽马氧化铝载体总酸度下降约26%(0.55到0.41mmol NH3/g),孔隙直径增加约74%(98到)。晶体形成导致孔隙直径增加。附图图1还说明此实施例的稳定伽马氧化铝载体的孔隙大小分布。壁晶体结构的变化还显著减少表面积(从188到100m2/g)。实施例2C的稳定伽马氧化铝载体中的氧化铝形态主要为德尔塔氧化铝,以及少量西塔氧化铝(参考附图图3了解实施例2C的稳定伽马氧化铝X射线衍射)。
实施例2D
通过950℃下煅烧稳定的伽马氧化铝
按照实施例2B介绍的相同方法对实施例2A的伽马氧化铝进行煅烧,但煅烧温度不同。煅烧温度维持在950℃。获得的稳定伽马氧化铝载体用于制备吸附剂。为此,将56.7g获得的稳定伽马氧化铝载体加入含有31.12g K2CO3的约32mL室温脱盐水溶液中。在氮气流下干燥获得的混合物,然后在120℃烤炉中干燥12小时。通过ICP分析确定含浸K2CO3量,发现K2CO3含浸量约为35wt%。按照实施例1介绍的方式分析此实施例吸附剂的多次循环CO2吸附再生特性。此实施例吸附剂的新鲜CO2吸附能力和多次循环稳定吸附能力分别为理论吸附能力的95%和85%(参考附图图5了解实施例2D吸附剂的多次循环二氧化碳吸附能力)。
此外,附图图4说明实施例2D吸附剂在捕获二氧化碳前后以及再生二氧化碳饱和吸附剂后的X射线衍射比较分析。从图4可以发现,在使用实施例2D稳定伽马氧化铝载体制备的吸附剂中,CO2吸附和再生步骤后形成的减活性成分(如KAl(CO3)2(OH)2)的极少。
表1总结此实施例中稳定伽马氧化铝载体的物理化学和机械特性(参考表-1中实施例2D对应数据)。可以发现,相比实施例2A稳定氧化铝载体,总酸度下降约38%,孔隙直径增加约82%(参考附图图1了解稳定伽马氧化铝载体和含有含浸35wt%K2CO3稳定伽马氧化铝载体的吸附剂的孔隙大小分布)。由于煅烧温度升高,化学键结合的中间层羟基团从氧化铝中移除,导致表面酸性部位减少(参考附图图2了解氨程序升温脱附)。XRD分析表明,实施例2D的稳定伽马氧化铝中的氧化铝形态是德尔塔氧化铝和西塔氧化铝混合(参考附图图3)。
实施例2E
通过碱处理改性伽马氧化铝,然后在700℃下煅烧
通过碱处理稳定实施例2A的伽马氧化铝。在典型稳定方法中,将99g实施例2A的伽马氧化铝加入含有1g NaOH的79.2mL室温脱盐水溶液中。在氮气流下干燥获得的混合物,然后在120℃烤炉中干燥12小时。在700℃马弗炉和空气环境中煅烧干燥样品6小时。获得的碱性稳定氧化铝用作制备吸附剂的载体。为此,将50g碱性稳定氧化铝载体加入含有27g K2CO3的约27mL室温脱盐水溶液中。在氮气流下干燥获得的混合物,然后在120℃烤炉中干燥12小时。通过ICP分析确定含浸K2CO3量,发现K2CO3含浸量约为35wt%。按照实施例1介绍的程序评估此实施例吸附剂的CO2吸附再生特性。此实施例的吸附剂CO2吸附能力和多次循环稳定吸附能力分别为理论吸附能力的98%和70%。
表1总结此实施例中碱性稳定氧化铝载体的物理化学和机械特性(参考表-1中实施例2E对应数据)。相比实施例2A的未改性氧化铝,碱处理后,伽马氧化铝的总酸度下降约18%,孔隙直径增加约13%(参考附图图2)。此实施例的碱性稳定氧化铝的氧化铝形态是伊塔氧化铝和伽马氧化铝的混合,如附图图3所示。
实施例2F
通过750℃下蒸气处理改性硅石氧化铝
通过蒸气处理方式,稳定从Saint Gobain Siral 11/22获得的硅石氧化铝(硅/铝比率0.66)。对于硅石氧化铝稳定,在750℃固定床管式反应器中煅烧20g硅石氧化铝6小时,然后在150℃ 2bar(绝对压力)下用100%蒸气处理12小时。获得的稳定硅石氧化铝用作制备吸附剂的载体。为此,将7g稳定硅石氧化铝快速加入含有7g K2CO3的约13.2mL室温脱盐水溶液中。在氮气流下干燥获得的混合物,然后在120℃烤炉中干燥12小时。通过ICP分析确定含浸K2CO3量,发现约为50wt%。按照实施例1介绍的吸附再生研究评估CO2吸附能力。按照此实施例制备的吸附剂的CO2吸附能力和多次循环稳定吸附能力分别为理论吸附能力的98%和81%。
确定此实施例稳定硅石氧化铝的各种物理化学特性(参考表-1中的实施例2F对应数据)。相比未处理的硅石氧化铝,蒸气处理后,总酸度下降79%,孔隙直径增加14%。稳定硅石氧化铝的表面积显著下降约56%,孔隙度增加10%。
表1:稳定氧化铝和稳定硅石氧化铝的物理化学特性:
CO2CC:CO2吸附能力:CO2CCR:再生后CO2吸附能力
贯穿本说明书中的单词“包括”,或其变形都被理解为意指包含一种所述要素、整数或步骤、或一组要素、整数或步骤,但不排除任何其他要素、整数或步骤,或要素、整数或步骤组。
“至少”或“至少一种”表达方式表明使用一个或多个要素、成分或数量,本发明的具体实施方式中的使用是为实现一个或多个预期的目的或结果。
本说明书中包含的任何关于文件、条例、材料、装置、物品等的讨论仅用于构成本发明内容的目的。不应视为承认该类事项中的任一或全部构成现有技术的基础或作为与本公开相关领域的公共常识,因为其在该应用的优先日期前在别处已经存在。
通过参照描述中的非限定性具体实施方式,对这些具体实施方式及其各种特征和有利细节进行了解释。其中省去了对已知组分及处理技术的描述,以避免不必要地使本发明的具体实施方式模糊不清。本发明所采用的实施例仅旨在便于理解本发明具体实施方式可能的实践方式,并进而使本领域的技术人员能够实践本发明的实施方式。因此,不应将此类实施例视为限制本发明具体实施方式的范围。
上述具体实施方式的描述将充分披露本发明中具体实施方式的一般性,在没有脱离一般概念的前提下,其他人可以很容易地运用现有知识修改和/或调整此类具体实施方式的各种应用。因此,这些调整和修改应被确定为包含在与所披露的具体实施方式相当的含义和范围内。需要了解的是,文中所使用的措辞或用辞是为了描述而非限制。因此,虽然文中的具体实施方式描述的是首选具体实施方式,熟知本领域的技术人员认识到在所描述的具体实施方式的精神与范围内,可以对文中的具体实施方式进行修改。
技术优势:
本发明涉及“用于捕获二氧化碳的稳定无机氧化物载体及衍生吸附剂”,具有以下技术优势,包括但不局限于实现:
·一种稳定无机氧化物载体,可减少/减小二氧化碳捕获过程中载体表面的稳定中间产物(如KAl(CO3)2(OH)2)形成,从而减少再生稳定无机氧化物载体衍生吸附剂所需的能量,
·一种用于从废气捕获二氧化碳的稳定无机氧化物载体衍生吸附剂,该吸附剂在多次吸附再生后具有稳定的二氧化碳吸附能力。
各种物理参数、尺寸或数量中提交数值仅为近似值,应设想高于/低于参数、尺寸或数量指定数值的值落在本发明的范围内,除非在本说明书中有特定的相反的声明。
虽然已将相当多的重点放在首选实施方式中,但应理解为,在不偏离本发明原则的前提下,可以有多种实施方式,并且可以对优选实施方式做出许多更改。根据本发明内容,本发明的优选实施方式及其它实施方式的这些及其它变化对本领域的技术人员来说是显而易见的,由此可以清楚地了解以上实施方式的描述仅仅为本发明内容的说明性描述,而非限制性描述。
- 还没有人留言评论。精彩留言会获得点赞!