一种非均相紫外光催化氧化降解有机废水的方法与流程
本发明涉及废水处理领域,具体涉及一种非均相紫外光催化氧化降解有机废水的方法。
背景技术:
尖晶石型结构的铁酸盐因带有表面电荷和含有变价元素而具有良好的表面吸附和氧化还原等化学活性,在不同介质条件下,对难降解有机物有吸附及降解作用。采用化学共沉淀法制备铁锰氧体时,虽然H2O2具有强氧化性,但单独用其降解废水效果不是很好,不能将其用到极致。另外,紫外光芬顿反应会产生难以分离的固废,难回收和重复利用,且需要酸性条件下才有效果。考虑到铁锰氧体是混相尖晶石,具有吸附性能,同时还是软磁性材料,容易磁分离,可重复利用,本发明拟以铁锰氧体、紫外光共同作用,以期提升有机废水的降解效果。
技术实现要素:
有鉴于此,本发明提供了一种非均相紫外光催化氧化降解有机废水的方法,该方法采用紫外光、铁锰氧体共同催化双氧水来降解有机废水,降解率可达85%以上。
本发明采取的技术方案如下:
一种非均相紫外光催化氧化降解有机废水的方法,包括:先采用化学共沉淀法制备铁锰氧体,再将铁锰氧体、有机废水和双氧水依次加入有机废水处理装置中,最后打开有机废水处理装置的紫外光源照射处理有机废水;
所述有机废水处理装置包括一避光腔体,所述避光腔体中设置有反应管和紫外灯管,所述反应管内插有进气管,进气管与风机连通;所述紫外灯管外部套有石英套管,且外接稳压电源;
所述铁锰氧体、有机废水和双氧水加入有机废水处理装置的反应管中。
所述反应管可以是石英管。进气管优选插入至反应管的底部。
优选的,所述铁锰氧体的制备方法具体包括:
将液态Fe3+和Mn2+按物质的量比2.1:1的比例混合获得混合液,然后将该混合液滴加至质量分数10%的氢氧化钠溶液中,边滴加边搅拌,滴加完毕后进行水浴陈化,水浴温度为90℃,陈化时间2h;陈化完毕后过滤,洗涤沉淀物,80℃条件下烘干,然后在400℃条件下煅烧2h即可;所述氢氧化钠的用量为Fe3+和Mn2+物质的量之和的3倍。
优选的,所述有机废水为印染废水。
优选的,按处理1L浓度50mg/L的模拟印染废水的量计算,需加入铁锰氧体2g,体积分数30%的双氧水50mL。
优选的,所述紫外光的波长为254nm,照射时间为30min。
需要说明的是,1.2.4-酸即1-氨基-2-羟基-4-萘磺酸,又称4-氨基-3-羟基萘-1-磺酸,1,2,4-氨基萘酚或1-氨基-2-萘酚-4-磺酸,本发明简称为1.2.4-酸,为生产染料“6-硝”的中间体,为便于研究,本实验用1.2.4-酸配制的水溶液模拟印染废水。
本发明的有益效果在于:
H2O2具有强氧化性,铁锰氧体具有吸附性能,同时还是软磁性材料,容易磁分离,可重复利用,因此,本发明以紫外光、铁锰氧体及双氧水三者共同作用,充分发挥三者优势,得到良好的有机废水光催化氧化处理效果,利用紫外光和铁锰氧体共同催化H2O2降解50mg/L的模拟染料废水,降解率可达85.93%,借助XRD表征,结果表明在降解废水前后铁锰氧体的晶体结构无明显差异,铁锰氧体催化降解1.2.4酸的效果在多次使用后无明显变化。
附图说明
图1有机废水处理装置示意图;紫外灯管可以有一根,也可以有多根,紫外灯管外部套有石英套管,外连电源;支架设置在装置的中部和中间,用于支撑紫外灯管及反应管;反应管支架用于支撑反应管;通过风机将空气通过进气管送至反应管底部,起到对反应物的搅拌作用。
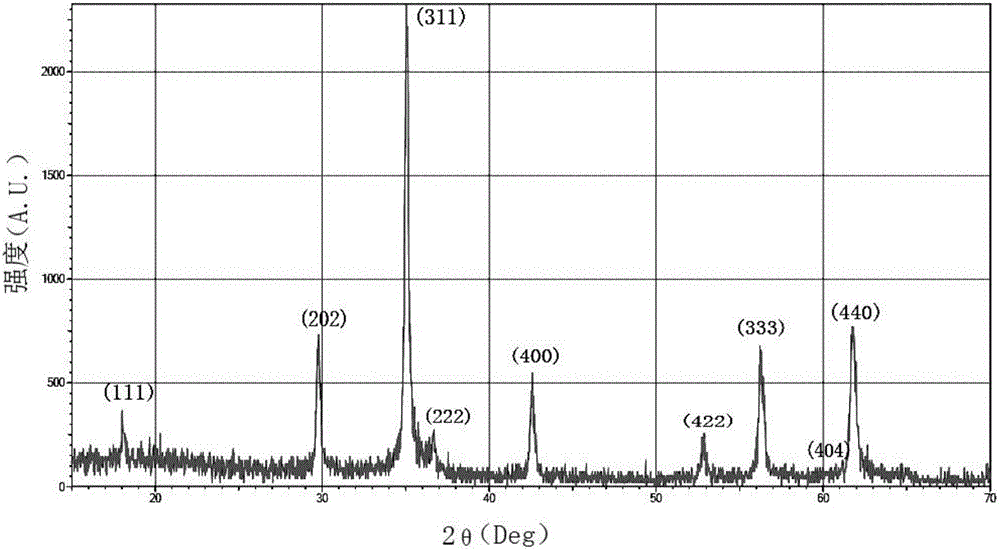
图2实施例1制备的铁锰氧体的XRD图。
附图标记:
1-紫外灯管,2-反应管,3-支架,4-反应管支架,5-进气管,6-风机,7-电源。
具体实施方式
实施例1
铁锰氧体的制备:
用电子天平准确称取27.029g FeCl3·6H2O用蒸馏水溶解,倒入100ml容量瓶中定容;用电子天平准确称取9.895g MnCl2·4H2O用蒸馏水溶解,倒入100ml容量瓶中定容。移取10ml FeCl3溶液、5ml MnCl2溶液混合于100ml烧杯中,用电子天平称取氢氧化钠(氢氧化钠按Fe3+和Mn2+物质的量和的3倍称取,比理论值略多,配成质量分数10%的溶液),用蒸馏水于锥形瓶中溶解。设置恒温水浴锅水温为60℃,待其恒温后将装有混合液的烧杯和装有氢氧化钠的锥形瓶放于恒温水浴锅中,预热。在电动搅拌器缓慢的搅拌下将FeCl3溶液和MnCl2溶液的混合液缓慢滴加到氢氧化钠溶液中。滴加完后,停止搅拌,进行水浴陈。陈化温度90℃,陈化2h。陈化后,将反应物置于布氏漏斗中用抽滤机进行抽滤,再用去离子水洗涤数次,洗去多于的氢氧化钠以及实验中生成的氯化钠,得到共沉淀产物。将得到的沉淀于80℃的烘箱中烘0.5h,然后用马弗炉进行煅烧,煅烧温度400℃、煅烧时间2h。用研钵将煅烧后的沉淀研磨成粉末,装入样品袋中,待用。
取少量样品粉末做XRD分析,采用岛津国际贸易(上海)有限公司生产的XRD-7000型X-射线衍射仪,Cu靶,Kɑ辐射源,石墨单色器,管电压40.0KV,管电流30mA,步长0.02°,扫描速度11.0000(deg/min)。
图2即为该粉体的X射线衍射谱图,将该谱图中主要衍射峰与尖晶石型MnFe2O4的标准PDF卡片(PDF ID number:46-1045)的衍射峰(111)、(220)、(311)、(222)、(400)、(422)、(333)、(404)和(440)进行比对,可以看出峰型基本吻合。水浴相转化法制备的铁锰氧体产物即为尖晶石结构的MnFe2O4,且主要衍射峰的峰型发育完整,表明制得的铁酸锰晶粒细小,且晶化程度好,为单相MnFe2O4纳米晶体。
铁锰氧体、紫外光共同催化H2O2降解1.2.4-酸:
用电子天平称取铁锰氧体0.5g放入100ml有机废水处理装置(图1所示)的反应管中,然后将50ml 50mg/L的1.2.4-酸模拟废水加入反应管中,再向反应管中加入5ml体积分数30%的过氧化氢,打开紫外灯管,并开启风机,空气通过进气管到达反应管底部,起到搅拌作用。等到废水中没有气泡产生后,将有机废水处理装置关闭,打开反应管,将废水倒出,过滤,收集滤液,用紫外分光光度计在246nm下测量吸光度,由朗伯-比尔定律,将测量结果代入1.2.4酸溶液的标准曲线,得到降解后的1.2.4酸浓度,按下式计算降解率。
1.2.4-酸的降解率=(Cm1-Cm2)/Cm1*100%
其中Cm1为1.2.4-酸的初始浓度,Cm2为处理后溶液中1.2.4-酸的浓度。
通过计算,利用紫外光和铁锰氧体共同催化H2O2降解50mg/L的1.2.4-酸模拟的染料废水,降解率可达85.93%。
对比实施例1
铁锰氧体的制备参照实施例1,称取0.1g铁锰氧体样品,加入到25mg/L50ml模拟1.2.4-酸废水中,充分搅拌15min,过滤,取滤液用紫外光度计在246nm下测其吸光度,计算降解率。单独铁锰氧体自身吸附作用引起的1.2.4-酸废水去除率为2.07%。
对比实施例2
移取0.5ml体积分数30%H2O2于50ml 40mg/L模拟1.2.4-酸废水中,搅拌15min。单独H2O2催化降解1.2.4-酸模拟废水,降解率为2.76%。
对比实施例3
铁锰氧体的制备参照实施例1,称取0.1g铁锰氧体,加入到50ml 50mg/L模拟1.2.4-酸废水中,然后加入5ml体积分数30%的H2O2,充分搅拌15min后过滤,取滤液用紫外光度计在246nm下测吸光度,计算降解率。无紫外光催化下,铁锰氧体催化H2O2降解1.2.4-酸模拟废水的降解率为41.96%。
对比实施例4
铁锰氧体的制备参照实施例1,称取0.1g铁锰氧体,并量取50ml 50mg/L模拟1.2.4-酸废水,放入有机废水处理装置中反应15min后过滤,取滤液用紫外光度计在246nm下测量吸光度,计算降解率,紫外光、铁锰氧体共同作用于1.2.4-酸模拟废水,降解率为57.27%。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例、对比实施例,而是包括符合本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种可光催化降解染料且重复使用的磁性Fe3O4微球的制备方法及其应用与制造工艺
- 一种具有染料敏化TiO2可见光催化降解气体甲醛的装置及方法与制造工艺
- 一种光催化材料TiO<sub>2</sub>提拉镀膜装置的制造方法
- 一种除甲醛环保降解膜的制作方法
- 一种纺织纤维/石墨烯/TiO<sub>2</sub>复合环境催化材料的制备方法
- 一种用于降解甲醛的纳米催化剂的制备方法
- 具有光催化性能的连续纤维素/TiO<sub>2</sub>气凝胶纤维的制备方法
- 一种降解甲醛的介孔复合材料及其制备方法
- 一种网载TiO<sub>2</sub>/活性炭的吸附-光催化净水复合材料的制备方法
- TiO<sub>2</sub>/Ga<sub>2</sub>O<sub>3</sub>复合光催化胶体的制备方法