一种用于吸附Hg2+的Fe凝胶的制备方法与流程
本发明涉及一种用于吸附Hg2+的Fe凝胶的制备方法。
背景技术:
众所周知,在室温的条件下,汞是唯一的金属能以液体的形式存在于自然界中。它通常以二价的Hg2+的形式存在于水中,而且具有剧毒,被认为是最危险的一种污染物。美国环境保护组织曾明确指出,饮用水中的重金属的浓度不得高于10nm,在自然界中,汞离子会通过食物链富集,当人体内的重金属的含量过高时,就会对人体产生危害,迫害人体的免疫系统及神经系统,从而导致神经性疾病的发生。因此,考虑到人们的健康问题,寻找一种简单,快捷的方法来检测Hg2+已经迫在眉睫。
在过去,已经有很多应用于吸附Hg2+的吸附方法,如原子吸收光谱法、原子荧光光谱法、比色吸附法、以及电化学发光等。但这些方法总有一些不可避免的弊端:分光光度法中离子常彼此干扰,导致测定选择性不理想。高效液相色谱法和电感耦合法所需仪器昂贵,样品预处理较为复杂,操作过程较为复杂。化学发光法的选择性较差,不太适用于浓度较低的生物样品测定。而正是因为这些弊端,限制了很多方法在现实当中的应用。而荧光吸附法不仅方法简单方便,而且还具有选择性强,灵敏度高,重现性好,取样量少,简介快速等优点。近年来,荧光分析法也得到了越来越多的应用:废水处理,大气污染,土壤治理,人与动植物等应用范围极广。
凝胶是胶体粒子或有机分子在一定条件下相互连接,形成空间网络结构,网络结构中空隙内充满溶剂分子(分散介质、液体、或者气体)的一种特殊的胶体分散体系。凝胶在流变性上表现出类固体的流变学性质,具有极高的粘度,又具有高的弹性(剪切屈服应力值>2000Pa)。从外观上看,凝胶处于类固体的状态,具有倒置不流动的特点,这也是判断一个样品是否为凝胶的基本条件。自1860年,首次报道以来,凝胶由于其优良的生物相容性和多层次、多尺度的超微结构,在日化用品、环境工程和生物医学等领域得到了广泛的应用。
按照凝胶的分散介质的不同,可以将其分为有机凝胶、气凝胶和水凝胶,本专利中的凝胶都是有机凝胶,之所以形成凝胶的主要原因就是通过分子间的氢键、静电作用、π-π堆积、范德华力、配位等弱的相互作用以及构筑了基元之间相互作用的协同效应,凝胶属于块状材料,因此其应用要比金属有机骨架材料更为广泛,目前主要是应用于污水处理,检测水中的亚甲基蓝,吸附甲醛转变成无毒的有机盐,甚至可以被应用于重金属离子的吸附中,众所周知,重金属离子中,Hg2+对人体的危害很大,一旦通过食品或者是饮用水而被人体吸收,对人的身体危害相当之大,因此凝胶的出现对于环境污染的治理以及人们生存环境的保护和自身健康都起到了一定的作用,并将成为一种新兴的块状材料。
技术实现要素:
本发明的目的是要解决现有用于吸附Hg离子的物质吸附量低的问题,而提供一种用于吸附Hg2+的Fe凝胶的制备方法。
本发明的一种用于吸附Hg2+的Fe凝胶的制备方法是按以下步骤完成的:
一、将FeCl3·6H2O和5-氨基间苯二甲酸加入到烧杯中,然后向烧杯中加入N-N-2-甲基甲酰胺,在超声频率为35KHz~45KHz的条件下超声处理至固体物质完全溶解,得到混合溶液;
步骤一中所述FeCl3·6H2O与5-氨基间苯二甲酸的摩尔比为0.1:(0.08~0.12);
步骤一中所述FeCl3·6H2O的物质的量与N-N-2-甲基甲酰胺的体积的比为0.1mmol:(1.5~2.5)mL;
二、将步骤一得到的混合溶液置于内衬聚四氟乙烯的反应釜内,再将反应釜放在温度为100~120℃的烘箱内反应45h~50h,自然冷却至室温,得到用于吸附Hg2+的Fe凝胶。
本发明的有益效果
本发明以FeCl3·6H2O和5-氨基间苯二甲酸为原料合成用于吸附Hg2+的Fe凝胶,研究发现随着金属所占凝胶的比例的增加,有助于形成更稳定的凝胶结构,可以放置的时间也越久,这是由于金属Fe和5-氨基间苯二甲酸之间交叉配位,金属的比例越高,就越有利于形成稳定的凝胶,但是金属如果比例过高,会导致缺陷减少的,导致其对重金属的吸收效果不是很理想。因此金属所占凝胶的比例及其重要,经检测,1.5mL DMF(N-N-2-甲基甲酰胺)的Fe凝胶对汞离子的吸收量为5.7381mmol/L,2mL DMF的Fe凝胶对汞离子的吸收量为4.9044mmol/L,2.5mLDMF的Fe凝胶对凝胶的汞离子的吸收量为4.7526mmol/L。由实验结果可以看出1.5mL DMF的Fe凝胶对汞离子的吸收量最大,这是由于浓度高的铁凝胶其缺陷也相对较多,因此对Hg离子的吸附量也会更大。
附图说明
图1为试验一至试验三制备的用于吸附Hg2+的Fe凝胶的实物照片;其中A代表试验一制备的用于吸附Hg2+的Fe凝胶,B代表试验二制备的用于吸附Hg2+的Fe凝胶,C代表试验三制备的用于吸附Hg2+的Fe凝胶;
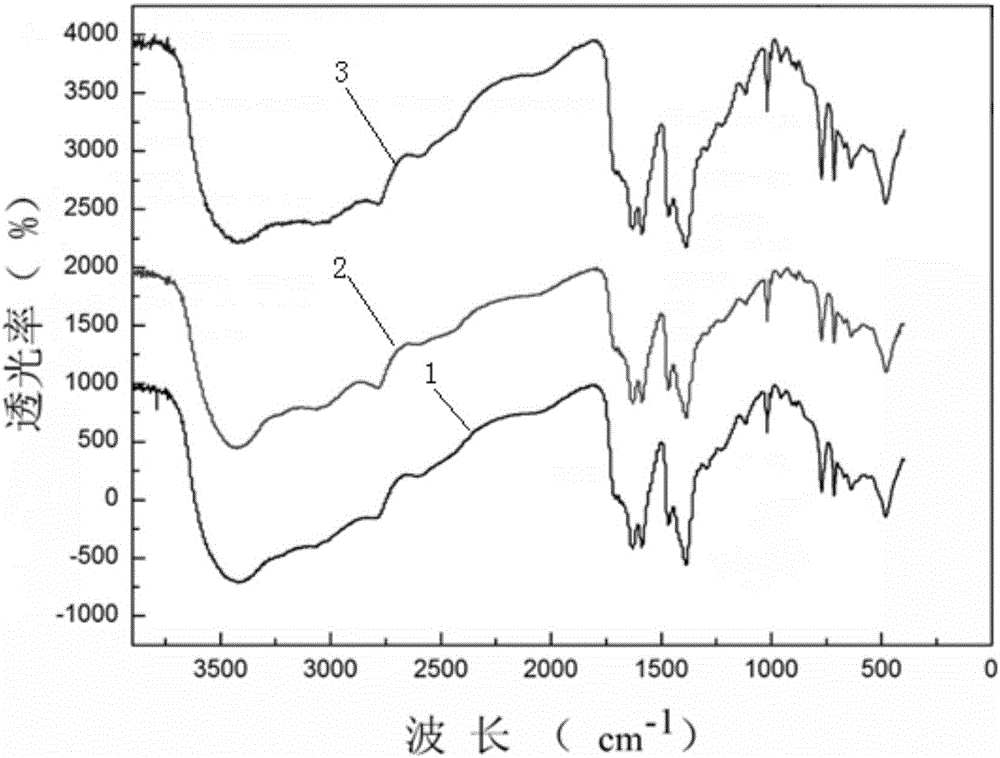
图2为试验一至试验三制备的用于吸附Hg2+的Fe凝胶的傅里叶变换红外光谱图;
图3为不同浓度的Hg2+的标准曲线图;
图4为试验一至三制备的Fe凝胶对不同浓度下的Hg2+的荧光发射光谱图。
具体实施方式
具体实施方式一:本实施方式的一种用于吸附Hg2+的Fe凝胶的制备方法是按以下步骤完成的:
一、将FeCl3·6H2O和5-氨基间苯二甲酸加入到烧杯中,然后向烧杯中加入N-N-2-甲基甲酰胺,在超声频率为35KHz~45KHz的条件下超声处理至固体物质完全溶解,得到混合溶液;
步骤一中所述FeCl3·6H2O与5-氨基间苯二甲酸的摩尔比为0.1:(0.08~0.12);
步骤一中所述FeCl3·6H2O的物质的量与N-N-2-甲基甲酰胺的体积的比为0.1mmol:(1.5~2.5)mL;
二、将步骤一得到的混合溶液置于内衬聚四氟乙烯的反应釜内,再将反应釜放在温度为100~120℃的烘箱内反应45h~50h,自然冷却至室温,得到用于吸附Hg2+的Fe凝胶。
具体实施方式二:本实施方式与具体实施方式一不同的是:步骤一中所述FeCl3·6H2O与5-氨基间苯二甲酸的摩尔比为0.1:(0.09~0.11)。其他步骤及参数与具体实施方式一相同。
具体实施方式三:本实施方式与具体实施方式一或二不同的是:步骤一中所述FeCl3·6H2O与5-氨基间苯二甲酸的摩尔比为0.1:0.1。其他步骤及参数与具体实施方式一或二相同。
具体实施方式四:本实施方式与具体实施方式一至三之一不同的是:步骤一中所述FeCl3·6H2O的物质的量与N-N-2-甲基甲酰胺的体积的比为0.1mmol:2mL。其他步骤及参数与具体实施方式一至三之一相同。
具体实施方式五:本实施方式与具体实施方式一至四之一不同的是:步骤一中在超声频率为40KHz的条件下超声处理至固体物质完全溶解。其他步骤及参数与具体实施方式一至四之一相同。
具体实施方式六:本实施方式与具体实施方式一至五之一不同的是:步骤二中将反应釜放在温度为110℃的烘箱内反应45h~50h,自然冷却至室温。其他步骤及参数与具体实施方式一至五之一相同。
具体实施方式七:本实施方式与具体实施方式一至六之一不同的是:步骤二中将反应釜放在温度为100~120℃的烘箱内反应48h,自然冷却至室温。其他步骤及参数与具体实施方式一至六之一相同。
用以下试验来验证本发明的有益效果
试验一、本试验的一种用于吸附Hg2+的Fe凝胶的制备方法是按以下步骤完成的:
一、将0.027g的FeCl3·6H2O和0.018g的5-氨基间苯二甲酸加入到烧杯中,然后向烧杯中加入1.5mL的N-N-2-甲基甲酰胺,在超声频率为40KHz的条件下超声处理至固体物质完全溶解,得到混合溶液;
二、将步骤一得到的混合溶液置于内衬聚四氟乙烯的反应釜内,再将反应釜放在温度为110℃的烘箱内反应48h,自然冷却至室温,得到用于吸附Hg2+的Fe凝胶。
试验二、本试验的一种用于吸附Hg2+的Fe凝胶的制备方法是按以下步骤完成的:
一、将0.027g的FeCl3·6H2O和0.018g的5-氨基间苯二甲酸加入到烧杯中,然后向烧杯中加入2mL的N-N-2-甲基甲酰胺,在超声频率为40KHz的条件下超声处理至固体物质完全溶解,得到混合溶液;
二、将步骤一得到的混合溶液置于内衬聚四氟乙烯的反应釜内,再将反应釜放在温度为110℃的烘箱内反应48h,自然冷却至室温,得到用于吸附Hg2+的Fe凝胶。
试验三、本试验的一种用于吸附Hg2+的Fe凝胶的制备方法是按以下步骤完成的:
一、将0.027g的FeCl3·6H2O和0.018g的5-氨基间苯二甲酸加入到烧杯中,然后向烧杯中加入2.5mL的N-N-2-甲基甲酰胺,在超声频率为40KHz的条件下超声处理至固体物质完全溶解,得到混合溶液;
二、将步骤一得到的混合溶液置于内衬聚四氟乙烯的反应釜内,再将反应釜放在温度为110℃的烘箱内反应48h,自然冷却至室温,得到用于吸附Hg2+的Fe凝胶。
(一)傅里叶变换红外光谱检测
对试验一至试验三制备的用于吸附Hg2+的Fe凝胶进行傅里叶变换红外光谱吸附,得到如图1所示的试验一至试验三制备的用于吸附Hg2+的Fe凝胶的傅里叶变换红外光谱图;其中1为试验一制备的用于吸附Hg2+的Fe凝胶,2为试验二制备的用于吸附Hg2+的Fe凝胶,3为试验三制备的用于吸附Hg2+的Fe凝胶。从图1可以看出,在3100-3700cm-1为内存在一个强宽带,该宽带为O-H伸缩振动峰与N-H伸缩振动峰的叠加,2900cm-1出峰为芳香胺出的尖锐而独立的小峰,1603.43cm-1处出峰为羧基与铁发生配位致使羧基红移导致,1571.1cm-1、1545.43cm-1、1535.06cm-1处出峰为苯环骨架伸缩振动峰,1382cm-1处为C-O单键伸缩振动吸收峰,1111.26cm-1处出峰为C-N键的伸缩振动吸收峰767.76cm-1、710.56cm-1、616.57cm-1处为苯环上的间位取代出的特征峰。
(二)对Hg2+吸收量的检测
①标准曲线的制定
分别对浓度依次为0.0025mol/L、0.005mol/L、0.01mol/L、0.015mol/L、0.02mol/L和0.025mol/L的Hg2+进行分光光度计检测,得到不同浓度的Hg2+的标准曲线图如图2所示,标准曲线方程为A=39.7326C-0.06788,R2=0.99205。
②Hg2+吸附
称取0.13575g的HgCl2(0.01mol/L)加水进行超声至完全溶解后于500mL的容量瓶中定容,分别称取0.0378g试验一制备的Fe凝胶、0.0361g试验二制备的Fe凝胶和0.0324g试验三制备的Fe凝胶于三个离心管中,分别取45ml HgCl2溶液加入到离心管中,在25℃下恒温振荡反应,在不同时间(5min、10min、20min、30min、1h、2h、3h、5h)进行取样,取上清液用分光光度计检测吸光度,得到试验一至三制备的铁凝胶对不同浓度下的Hg2+的荧光发射光谱图如图3所示;其中1为试验一制备的铁凝胶,2为试验二制备的铁凝胶,3为试验三制备的铁凝胶。进而计算出Hg离子的吸收量,其中1.5ml DMF凝胶的汞离子的吸收量为5.7381mmol/L,2ml DMF凝胶的汞离子的吸收量为4.9044mmol/L,2.5ml DMF凝胶的汞离子的吸收量为4.7526mmol/L。
结论:金属铁离子与配体交叉配位,在形成凝胶的过程中处于一种过饱和状态并产生缺陷,吸附Hg2+由主要就是利用其缺陷来达到吸附的目的,由实验结果可以看出1.5ml DMF凝胶的汞离子的吸收量最大,分析原因可能是浓度高的铁凝胶其缺陷也相对较多,因此对Hg离子的吸附量也会更大。
- 还没有人留言评论。精彩留言会获得点赞!