一种非离子型生物质基表面活性剂及其制备方法与流程
本发明涉及一种非离子型生物质基表面活性剂及其制备方法。
背景技术:
表面活性剂是一类结构中同时含有亲水基团和疏水基团的两亲分子,由于能够显著降低气-液界面和液-液界面张力,起到润湿、乳化、增溶等作用,从而在化工、食品等领域有着广泛利用。目前全球各种表面活性剂的总产量为1780万吨,年均增长率约6%。然而,大量的表面活性剂的制备原料都来源于化学加工品。同时,此类表面活性剂难于降解,对环境的污染也是不容小觑的问题。因此,发展环境友好型且性能优越的表面活性剂是绿色化学的发展方向。
技术实现要素:
本发明的目的是提供一种非离子型生物质基表面活性剂及其制备方法,利用生物质中碳水化合物中的极性头基,通过设计引入疏水基团将其转化为表面活性剂这一功能化学品,为表面活性剂领域提供新的途径和思路。
本发明提供的式Ⅰ-式Ⅲ所示化合物,
式Ⅰ-式Ⅲ中,R1、R2、R3、R4各自独立的选自H、碳原子数为1~22(优选6~16、更优选8~12)的支链或直链烷基,但R1、R2不同时为H,R3、R4不同时为H。
式Ⅰ所示化合物具体可为下述式Ⅰ-A或Ⅰ-B所示化合物:
本发明提供的式Ⅰ-式Ⅲ所示化合物的制备方法,包括如下步骤:
(1)山梨醇(D-山梨醇)经卤化试剂的选择性卤化,得到式Ⅳ所示化合物、式Ⅴ所示化合物或式Ⅵ所示化合物;
式Ⅳ-式Ⅵ中,X为卤素(如Cl、Br或I,优选Br);
(2)式Ⅳ所示化合物、式Ⅴ所示化合物、式Ⅵ所示化合物分别与烷基胺经亲核取代,得到式Ⅰ所示化合物、式Ⅱ所示化合物、式Ⅲ所示化合物;
式Ⅰ-式Ⅲ中,R1、R2、R3、R4各自独立的选自H、碳原子数为1~22的支链或直链烷基,但R1、R2不同时为H,R3、R4不同时为H。
上述的制备方法,步骤(1)中,所述山梨醇与所述卤化试剂的物质的量之比可为1:(1~6),优选为1:2.2。
所述卤化试剂可为乙酰氯、乙酰溴、亚硫酰氯、溴化磷、五氯化磷、三碘化磷、氢氯酸、氢溴酸和氢碘酸等有机卤代物中的一种。
所述选择性卤化的温度可为15~35℃,优选20℃、18℃,时间可为2~24小时,优选14小时。
所述选择性卤化在有机溶剂Ⅰ中进行,所述有机溶剂Ⅰ可为1,4-二氧六环、N,N-二甲基甲酰胺、氯仿和二氯甲烷等中的任一种。
所述山梨醇与所述有机溶剂Ⅰ的质量体积比可为1g:(3~20)mL,优选为1g:(5~10)mL,更优选为1g:5mL、1g:8mL。
上述的制备方法,步骤(2)中,式Ⅳ所示化合物、式Ⅴ所示化合物或式Ⅵ所示化合物与所述烷基胺的物质的量之比可为1:(1~6),优选为1:(1~3),更优选为1:2.5。
所述烷基胺根据式Ⅰ-式Ⅲ所示化合物中的R1、R2、R3、R4基团进行相应的选择。
所述亲核取代的温度可为30~50℃,优选40℃,时间可为5~24小时,优选8~12小时,更优选12小时。
所述亲核取代在有机溶剂Ⅱ中进行,所述有机溶剂Ⅱ可为甲醇、乙醇、丙酮、二氯甲烷和氯仿中的任一种。
式Ⅳ所示化合物、式Ⅴ所示化合物或式Ⅵ所示化合物与所述有机溶剂Ⅱ的质量体积比可为1g:(0.5~20)mL,优选为1g:(3~10)mL,更优选为1g:4mL。
本发明提供的式Ⅶ所示化合物,
式Ⅶ中,R1、R2各自独立的选自H、碳原子数为1~22(优选6~16、更优选8~12)的支链或直链烷基,但R1、R2不同时为H。
式Ⅶ所示化合物具体可为下述式Ⅶ-A所示化合物:
本发明提供的式Ⅶ所示化合物的制备方法,包括如下步骤:
(1)1,5-脱水-D-山梨醇经卤化试剂的选择性卤化,得到式Ⅷ所示化合物;
式Ⅷ中,X为卤素(如Cl、Br或I,优选Br);
(2)式Ⅷ所示化合物与烷基胺经亲核取代,得到式Ⅶ所示化合物;
式Ⅶ中,R1、R2各自独立的选自H、碳原子数为1~22的支链或直链烷基,但R1、R2不同时为H。
上述的制备方法,步骤(1)中,所述1,5-脱水-D-山梨醇与所述卤化试剂的物质的量之比可为1:(1~6),优选为1:1.1。
所述卤化试剂可为乙酰氯、乙酰溴、亚硫酰氯、溴化磷、五氯化磷、三碘化磷、氢氯酸、氢溴酸和氢碘酸等有机卤代物中的一种。
所述选择性卤化的温度可为15~35℃,优选20℃、18℃,时间可为2~24小时,优选14小时。
所述选择性卤化在有机溶剂Ⅰ中进行,所述有机溶剂Ⅰ可为1,4-二氧六环、N,N-二甲基甲酰胺、氯仿和二氯甲烷等中的任一种。
所述1,5-脱水-D-山梨醇与所述有机溶剂Ⅰ的质量体积比可为1g:(3~20)mL,优选为1g:(5~10)mL,更优选为1g:5mL、1g:8mL。
上述的制备方法,步骤(2)中,式Ⅷ所示化合物与所述烷基胺的物质的量之比可为1:(1~6),优选为1:(1~3),更优选为1:2.5。
所述烷基胺根据式Ⅶ所示化合物中的R1、R2基团进行相应的选择。
所述亲核取代的温度可为30~50℃,优选40℃,时间可为5~24小时,优选8~12小时,更优选12小时。
所述亲核取代在有机溶剂Ⅱ中进行,所述有机溶剂Ⅱ可为甲醇、乙醇、丙酮、二氯甲烷和氯仿中的任一种。
式Ⅷ所示化合物与所述有机溶剂Ⅱ的质量体积比可为1g:(0.5~20)mL,优选为1g:(3~10)mL,更优选为1g:4mL。
本发明提供的式Ⅸ-式Ⅺ所示化合物,
式Ⅸ-式Ⅺ中,R1、R2、R3、R4各自独立的选自H、碳原子数为1~22(优选6~16、更优选8~12)的支链或直链烷基,但R1、R2不同时为H,R3、R4不同时为H。
式Ⅸ所示化合物具体可为下述式Ⅸ-A所示化合物或式Ⅸ-B所示化合物:
本发明进一步提供了上述任一项所述的式Ⅸ-式Ⅺ所示化合物的制备方法,包括如下步骤:
(1)异山梨醇经卤化试剂选择性卤化,得到式ⅩⅡ所示化合物、ⅩⅢ所示化合物或ⅩⅣ所示化合物;
ⅩⅡ-ⅩⅣ中,X为卤素(如Cl、Br或I,优选Br);
(2)式ⅩⅡ所示化合物、ⅩⅢ所示化合物、ⅩⅣ所示化合物分别与烷基胺经亲核取代,得到式Ⅸ所示化合物、式Ⅹ所示化合物、式Ⅺ所示化合物;
式Ⅸ-式Ⅺ中,R1、R2、R3、R4各自独立的选自H、碳原子数为1~22的支链或直链烷基,但R1、R2不同时为H,R3、R4不同时为H。
上述的制备方法,步骤(1)中,所述异山梨醇与所述卤化试剂的物质的量之比可为1:(1~6),优选为1:2.2。
所述卤化试剂可为乙酰氯、乙酰溴、亚硫酰氯、溴化磷、五氯化磷、三碘化磷、氢氯酸、氢溴酸和氢碘酸等有机卤代物中的一种。
所述选择性卤化的温度可为15~35℃,优选20℃、18℃,时间可为2~24小时,优选14小时。
所述选择性卤化在有机溶剂Ⅰ中进行,所述有机溶剂Ⅰ可为1,4-二氧六环、N,N-二甲基甲酰胺、氯仿和二氯甲烷等中的任一种。
所述异山梨醇与所述有机溶剂的质量体积比可为1g:(3~20)mL,优选为1g:(5~10)mL,更优选为1g:5mL、1g:8mL。
上述的制备方法,步骤(2)中,式ⅩⅡ所示化合物、ⅩⅢ所示化合物或ⅩⅣ所示化合物与所述烷基胺的物质的量之比可为1:(1~6),优选为1:(1~3),更优选为1:2.5。
所述烷基胺根据式Ⅸ-式Ⅺ所示化合物中的R1、R2、R3、R4基团进行相应的选择。
所述亲核取代的温度可为30~50℃,优选40℃,时间可为5~24小时,优选8~12小时,更优选12小时。
所述亲核取代在有机溶剂Ⅱ中进行,所述有机溶剂Ⅱ可为甲醇、乙醇、丙酮、二氯甲烷和氯仿中的任一种。
式ⅩⅡ所示化合物、ⅩⅢ所示化合物或ⅩⅣ所示化合物与所述有机溶剂Ⅱ的质量体积比可为1g:(0.5~20)mL,优选为1g:(3~10)mL,更优选为1g:4mL。
本发明还提供了上述任一项所述的式Ⅰ所示化合物、式Ⅱ所示化合物、式Ⅲ所示化合物、式Ⅶ所示化合物、式Ⅸ所示化合物、式Ⅹ所示化合物式Ⅺ所示化合物在作为或制备表面活性剂中的应用。
本发明具有如下有益效果:
本发明非离子型生物质基表面活性剂以价格低廉、环境友好的生物质为原料,利用糖类的极性基团作为头基,合成过程简单,符合绿色环保的发展方向。本发明非离子型生物质基表面活性剂具有溶解性好,降低表面张力的能力强,乳化性能好,用量少,生物降解性好等特点,可做成乳化剂、增粘剂、增溶剂、润湿剂、洗涤剂等应用于化工、食品、石油开采等领域。此外,N-烷基取代的分子结构使得该表面活性剂在结构上具有可调控性,且其能够对pH等环境因素具有响应性,拓宽了该非离子型生物质基表面活性剂的应用。
附图说明
图1为本发明式Ⅰ所示化合物、式Ⅶ所示化合物、式Ⅸ所示化合物的合成路线,其中图1A为式Ⅰ所示化合物的合成路线,图1B为式Ⅶ所示化合物,图1C为式Ⅸ所示化合物的合成路线。
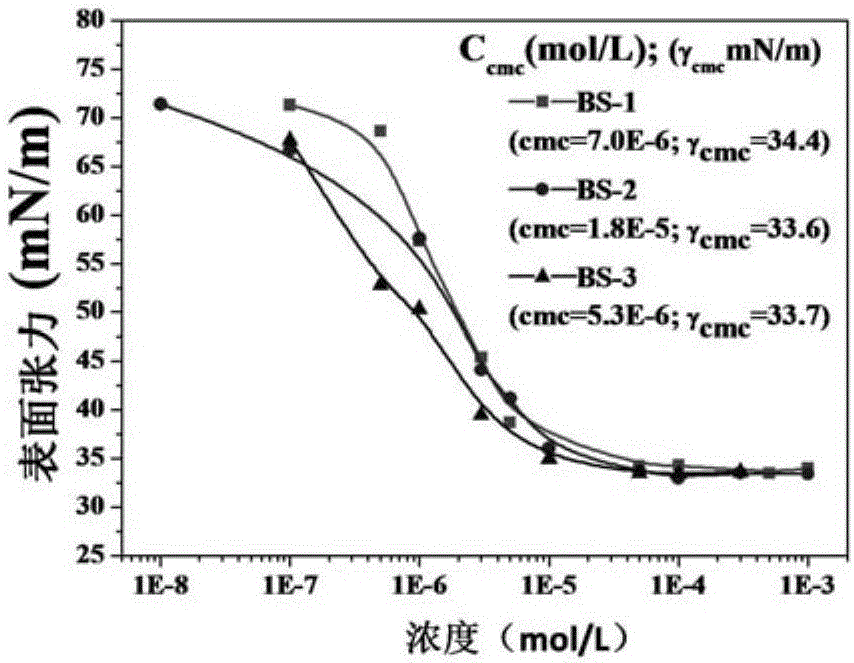
图2为非离子型生物质基表面活性剂的表面张力曲线,其中,BS-1为实施例1制备得到的表面活性剂,BS-2为实施例2制备得到的表面活性剂,BS-3为实施例3制备得到的表面活性剂。
图3为非离子型生物质基表面活性剂所形成的乳液照片,其中从左向右依次为BS-1-二氯甲烷/水-4:1,BS-2-二氯甲烷/水-6:1,BS-3-二氯甲烷/水-5:1,BS-1-正庚烷/水-5:1,BS-2-正庚烷/水-10:1;其中,所述非离子型生物质基表面活性剂的用量依次为:BS-1,200ppm;BS-2,300ppm;BS-3,150ppm。
图4为非离子型生物质基表面活性剂所形成的乳液的显微镜照片,其中图4A为BS-1-二氯甲烷/水-4:1乳液的显微镜照片,图4a为4A对应的荧光显微镜照片;4B为BS-1-正庚烷/水-5:1乳液的显微镜照片,图4b为4B对应的荧光显微镜照片。其中,荧光显微镜中所用染料为苏丹红。
图5为非离子型生物质基表面活性剂的表面张力曲线,其中,BS-5为实施例5制备得到的表面活性剂。
图6为非离子型生物质基表面活性剂的增溶效果,其中,BS-5为实施例5制备得到的表面活性剂。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、合成非离子型生物质基表面活性剂BS-1
按照图1(A)所示路线合成非离子型生物质基表面活性剂,具体步骤如下:
(1)在反应容器中加入10.1g D-山梨醇,加入80mL 1,4-二氧六环,置于冰浴中搅拌,滴加10.1mL乙酰溴。调节反应温度至18℃,搅拌14h。减压蒸馏除去溶剂,二氯甲烷萃取得到式Ⅳ-A所示溴代山梨醇,黄色液体,收率85%。结构验证数据如下:1H-NMR(400MHz,D2O):δ=3.27(dd,1H),3.33(dd,1H),5.30(m,1H),5.41(dd,1H),5.08(m,1H),3.37(dd,1H),3.51(dd,1H);MALDI-TOF-MS(M+H)+:Calcd.for C6H12Br2O4:307.Found:308.经验证,结构正确。
(2)将6.2g式Ⅳ-A所示溴代山梨醇,5.68g正辛胺,20mL无水甲醇加入反应容器,升温至40℃搅拌12h,反应结束后将反应液减压浓缩,用丙酮/乙醚重结晶得到白色固体式Ⅰ-A所示化合物,收率73%。结构验证数据如下(BS-1):1H-NMR(400MHz,D2O):δ=0.76-0.78(t,J=6.0Hz,6H,-CH3),1.19-1.21(m,24H,),1.23-1.29(m,J=12.0,6.0Hz,4H),1.54-1.59(m,4H),2.88-2.91(m,J=6.0Hz,4H);MALDI-TOF-MS(M+Na)+:Calcd.for C22H48N2O4:404.3.Found:427;经验证,结构正确。
实施例2、合成非离子型生物质基表面活性剂BS-2
按照图1(A)所示路线合成非离子型生物质基表面活性剂,具体步骤如下:
(1)在反应容器中加入10.1g D-山梨醇,加入80mL 1,4-二氧六环,置于冰浴中搅拌,滴加10.1mL乙酰溴。调节反应温度至18℃,搅拌14h。减压蒸馏除去溶剂,二氯甲烷萃取得到式Ⅳ-A所示溴代山梨醇,黄色液体,收率85%。1H-NMR(400MHz,D2O):δ=3.27(dd,1H),3.33(dd,1H),5.30(m,1H),5.41(dd,1H),5.08(m,1H),3.37(dd,1H),3.51(dd,1H);MALDI-TOF-MS(M+H)+:Calcd.for C6H12Br2O4:307.Found:308.经验证,结构正确。
(2)将6.2g式Ⅳ-A所示溴代山梨醇,8.15g正十二胺,25mL无水甲醇加入反应容器,升温至40℃搅拌12h,反应结束后将反应液减压浓缩,用丙酮/乙醚重结晶得到白色固体式Ⅰ-B所示化合物,收率67%。结构验证数据如下(BS-2):1H-NMR(400MHz,D2O):δ=0.77-0.79(t,J=6.0Hz,6H),1.20-1.22(m,44H),1.23-1.30(m,4H),1.54-1.59(m,J=12.0,6.0Hz,4H),2.89-2.91(m,J=12.0,6.0Hz,4H);MALDI-TOF-MS(M+H)+:Calcd.for C30H64N2O4:516.4.Found:517.6;经验证,结构正确。
实施例3、合成非离子型生物质基表面活性剂BS-3
按照图1(C)所示路线合成非离子型生物质基表面活性剂,具体步骤如下:
(1)在反应容器中加入10.1g异山梨醇,加入80mL 1,4-二氧六环,置于冰浴中搅拌,滴加10.1mL乙酰溴。调节反应温度至18℃,搅拌14h。减压蒸馏除去溶剂,二氯甲烷萃取得到ⅩⅡ-A所示溴代山梨醇脱水衍生物,浅黄色液体,收率90%。结构验证数据如下:1H-NMR(400MHz,D2O):δ=3.82(dd,1H),3.88(dd,1H),5.42(m,1H),5.36(dd,1H),5.12(m,1H),3.94(dd,1H),3.86(dd,1H);MALDI-TOF-MS:Calcd.for C6H12Br2O2:271.Found:294(M+Na);经验证,结构正确。
(2)将8.0g式ⅩⅡ-A所示溴代山梨醇脱水衍生物,12.0g正十二胺,25mL无水甲醇加入反应容器,升温至40℃搅拌12h,反应结束后将反应液减压浓缩,用丙酮/乙醇重结晶得到白色固体式Ⅸ-A所示化合物,收率78%。结构验证数据如下(BS-3):1H-NMR(400MHz,D2O):δ=0.78-0.82(t,J=6.0Hz,6H),1.21-1.24(m,44H),1.26-1.31(m,4H),1.53-1.59(m,J=12.0,6.0Hz,4H),2.92-2.96(m,J=12.0,6.0Hz,4H);MALDI-TOF-MS:Calcd.for C30H60N2O2:480.Found:503(M+Na);经验证,结构正确。
实施例4、合成非离子型生物质基表面活性剂BS-4
按照图1(C)所示路线合成非离子型生物质基表面活性剂,具体步骤如下:
(1)同实施例3。
(2)将8.0g式ⅩⅡ-A所示溴代异山梨醇,15.6g正十六胺,30mL无水甲醇加入反应容器,升温至40℃搅拌12h,反应结束后将反应液减压浓缩,用丙酮/乙醇重结晶得到白色固体式Ⅸ-B所示化合物,收率86%。结构验证数据如下(BS-4):1H-NMR(400MHz,D2O):δ=0.79-0.82(t,J=6.0Hz,6H),1.22-1.26(m,48H),1.25-1.31(m,4H),1.53-1.59(m,J=12.0,6.0Hz,4H),2.92-2.96(m,J=12.0,6.0Hz,4H);MALDI-TOF-MS:Calcd.for C38H76N2O2:592.Found:615(M+Na)。经验证,结构正确。
实施例5、合成非离子型生物质基表面活性剂BS-5
按照图1(B)所示路线合成非离子型生物质基表面活性剂,具体步骤如下:
(1)在反应容器中加入10.1g 1,5-脱水-D-山梨醇,加入50mL 1,4-二氧六环,置于冰浴中搅拌,滴加4.8mL乙酰溴。调节反应温度至18℃,搅拌12h。减压蒸馏除去溶剂,得到Ⅷ-A所示溴代1,5-脱水-D-山梨醇,无色液体,收率87%。结构验证数据如下:1H-NMR(400MHz,D2O):δ=3.58(dd,1H),3.63(dd,1H),5.21(dd,1H),5.13(dd,1H),3.91(dd,1H),4.02(dd,1H);δ=3.95(m,1H),δ=3.98(m,1H);MALDI-TOF-MS:Calcd.for C6H11BrO4:225.Found:226(M+H);经验证,结构正确。
(2)将4.0g式Ⅷ-A所示溴代1,5-脱水-D-山梨醇,6.25g正癸胺,25mL无水甲醇加入反应容器,升温至40℃搅拌12h,反应结束后将反应液减压浓缩,用丙酮/无水乙醚重结晶得到白色固体式Ⅶ所示化合物,收率72%。结构验证数据如下(BS-5):1H-NMR(400MHz,D2O):δ=0.77-0.79(t,J=6.0Hz,6H),1.20-1.22(m,32H),1.24-1.30(m,J=12.0,6.0Hz,4H),1.56-1.60(m,4H),2.89-2.92(m,J=6.0Hz,4H),4.01(dd,1H);δ=3.92(m,1H),δ=3.94(m,1H);MALDI-TOF-MS(M+H)+:Calcd.for C16H33NO4:303.Found:304;经验证,结构正确。
实施例6、非离子型生物质基表面活性剂的表面活性和乳化性能的评价
一、表面张力
仪器:Dataphysics DCAT-21表面张力测量仪(德国Dataphysics公司);BX-101型超级恒温槽控制实验温度为(25±0.1)℃。
测量方法:用Wilhelmy-plate法测定一系列浓度的非离子型生物质基表面活性剂在25℃时的平衡表面张力。从低浓度开始,测定表面张力值随时间的变化,取平衡点时的值则为该浓度下的平衡表面张力。
由表面张力对浓度作曲线,得到γ-logC曲线,曲线的拐点为所述非离子型生物质基表面活性剂的临界胶束浓度(CMC)。
实验结果如图2所示。从图2可以看出,本发明非离子型生物质基表面活性剂具有较低的表面张力(10-5~10-6mol/L)。
二、乳化性能
测定方法:在25℃条件下,称取5mg非离子型生物质基表面活性剂置于容器中,加入15mL正庚烷,3mL去离子水,双手同时上下摇动5次,乳液形成,静置观察乳液的性质。
实验结果如图3和图4所示,可以看出本发明非离子型生物质表面活性剂乳化性能好。通过在界面上排布从而形成不同强度的界面膜,从而能够稳定乳液。
实施例7、增溶作用
增溶实验主要是通过测定增溶到表面活性剂溶液中芘的极化指标I1/I3值在CMC前后的变化,从而得到表面活性剂增溶效果。此方法的依据是:疏水性的荧光探针芘增溶到介质中能够表现出与介质性质相对应的荧光特性。芘增溶到表面活性剂溶液中,由于对聚集体的微环境敏感,在胶束化前和胶束化后则表现出不同的荧光行为。I1和I3是芘荧光发射光谱中第一个(373nm)和第三个(384nm)电子振动峰。荧光强度使用Hitachi F-4500荧光仪测定。芘的激发波长是335nm,发射光谱的扫描范围是350-500nm。激发光和发射光狭缝均设置为2.5nm,扫描速率选择240nm/min。以芘的荧光发射光谱中的第一个峰(373nm处)和第三个峰(384nm处)的强度之比(I1/I3)评价聚集体内部的微极性,其中以I1/I3对表面活性剂浓度作曲线,曲线的拐点处为表面活性剂的CMC。
具体实验方法:将4μl浓度为1×10-3M荧光探针芘的乙醇溶液注入样品瓶中待乙醇挥干,加入4ml不同浓度的样品溶液,搅拌24h后测定。实验温度控制在(25.0±0.1)℃。
实验结果如图5和6所示,可以看出本发明非离子型生物质表面活性剂不仅具有较低的表面张力,而且对强疏水分子芘有较强的增溶作用。
- 还没有人留言评论。精彩留言会获得点赞!