一种基于铁镁铝类水滑石吸收与还原Cr(VI)的方法与流程
本发明涉及一种用于重金属吸收与还原的铁镁铝类水滑石的制备及应用,具体为Mg6-xFexAl2(OH)16CO3·4H2O的制备方法,属于环境功能材料及重金属处理技术领域。
背景技术:
含铬废水主要来自采矿、冶金、电镀、制革及重铬酸盐生产等行业。工业生产中产生的 铬渣如果露天堆放,受雨雪淋浸,所含的铬被溶出渗入地下水或进入河流、湖泊中会严重污 染环境。在重金属污染种类中,铬污染排在第二位。铬的毒性与其存在价态有关,环境中的 铬主要以Cr(III)和Cr(VI)两种价态存在,Cr(III)以阳离子形式存在,而Cr(VI)则以铬酸根阴离 子形式存在,其中Cr(VI)比Cr(III)毒性高上百倍,并易被人体吸收且在体内蓄积,引起鼻炎、 结核病、腹泻、支气管炎、皮炎等疾病。
意识到Cr(VI)的环境及生态危害,国内外许多学者投身于Cr(VI)的环境治理中,在酸性条件下,Cr(VI)的氧化性和稳定性均较强,很难被氧化降解。目前,去除水体或铬渣浸出液中Cr(VI)的方法主要有化学沉淀法、离子交换法、吸附法、膜分离法、电解还原法和化学试剂还原法等,其中吸附法应用最为广泛。与其他方法相比,吸附法具有去除率高、操作简便、吸附剂可再生等优点,广泛用于含铬废水的处理。目前研究较多的吸附吸附剂主要有天然矿物质、农林废弃物、聚合物、树脂、微生物絮凝剂以及炭(碳)质吸附剂等。但是,吸附法只是把Cr(VI)从一相转移到另一相中,不仅不能从根本上去除Cr(VI),而且在后续Cr(VI)的处理过程中极易产生二次污染。在一定条件下,如果促使高毒性Cr(VI)向无毒性Cr(III)的转变,可有效避免铬对环境的二次污染。然而,目前仍在寻求一种有效集Cr(VI)吸附及还原为Cr(III)一体的材料与方法。
技术实现要素:
本发明针对当前Cr(VI)吸附材料存在的缺陷,提供一种还原型Fe(II)参与的Mg6-xFexAl2(OH)16CO3·4H2O类水滑石制备方法。本发明以铁镁铝盐为原料,低温水热法制备。该方法原料低廉、工艺简单,且使用Fe(II)部分取代Mg(II),为Cr(VI)向Cr(III)的转变提供还原环境,实现Cr(VI)的环保循环吸附,有效避免二次污染,为实际含铬废水的绿色处理提供理论指导与技术支持。
为实现上述目的,本发明制备Mg6-xFexAl2(OH)16CO3·4H2O类水滑石及其吸附还原Cr(VI)的步骤包括:
a)按化学计量比称取含镁原料、含铁原料、含铝原料及碱金属氢氧化物与碳酸盐原料,在含镁原料、含铁原料、含铝原料中加入去离子水形成均匀溶液A,在碱金属氢氧化物和碳酸盐原料中加入去离子水形成均匀溶液B;其中,化学计量比以掺杂Fe(II)的Mg6Al2(OH)16CO3·4H2O为目标产物,其通式为Mg6-xFexAl2(OH)16CO3·4H2O,Fe掺杂量x:0.3~1.2;
b) 磁力搅拌下将溶液A滴加到溶液B中,并将所形成的混合悬浊液倒入高压反应釜中,60~80 ℃下预热1h后再升至 120~180 ℃进行6~18h的热处理。最后,经洗涤、抽滤及干燥后形成Mg6-xFexAl2(OH)16CO3·4H2O样品;
c) 将样品加入到6组配置好的重铬酸钾溶液中,待充分搅拌后,每间隔2h取其中一组的上清液做吸附率测试,同时检测吸附材料中Cr(VI)的还原程度。
其中,所述含镁原料为硝酸镁或氯化镁;所述含铁原料为硝酸亚铁或氯化亚铁;所述含铝原料为硝酸铝或氯化铝;所述碱金属氢氧化物为氢氧化钠或氢氧化钾;所述的碱金属碳酸盐为碳酸钠或碳酸钾。
步骤a中,限定Fe(II)掺杂量为0.3~1.2,由于Fe(II)为还原剂,含量太小时,无法有效还原Cr(VI)为Cr(III);含量过高时,无法保持原水滑石的层状结构。
步骤b中,Mg6-xFexAl2(OH)16CO3·4H2O的干燥处理在真空干燥箱内进行,以免大量的Fe2+在使用前被氧化成Fe3+。
优选的,步骤a中原料初始浓度为0.2 mol/L~0.6 mol/L。
优选的,步骤b中滴加溶液A的速度为10~30滴/min。
优选的,步骤b中预热温度为60~80 ℃。
优选的,步骤b中水热反应在温度为120~180 ℃下进行。
优选的,步骤c中所有重铬酸钾溶液初始浓度为80~100 mg/L。
本发明的有益效果:
本发明以铁镁铝盐为原料,低温水热法制备。该方法原料低廉、工艺简单,且使用Fe(II)部分取代Mg(II),为Cr(VI)向Cr(III)的转变提供还原环境,有效避免二次污染,实现Cr(VI)的环保循环吸附,为实际含铬废水的绿色处理提供理论指导与技术支持。
附图说明
图1为本发明实施例1所得Mg5.7Fe0.3Al2(OH)16CO3·4H2O的XRD图,由图1可知:实施例1所得荧光材料的XRD结果为与标准类水滑石结构的衍射峰相符,且未明显出现Fe(II)或其他杂质峰。
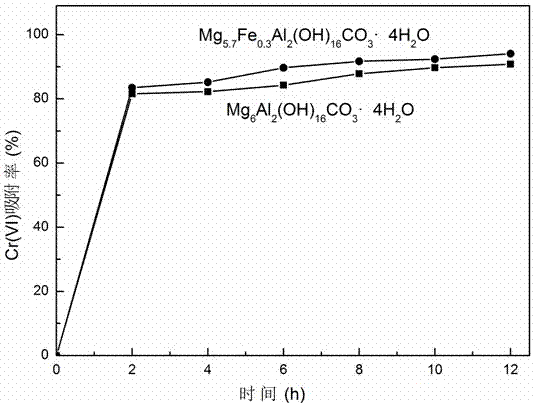
图2为本发明实施例1所得吸附材料的Cr(VI)吸附率图,由图2可知:实施例1所得Mg5.7Fe0.3Al2(OH)16CO3·4H2O材料对Cr(VI)有明显的吸附,且比未掺杂Fe(II)的镁铝水滑石吸附效果好。
图3为本发明实施例1吸附后的Mg5.7Fe0.3Al2(OH)16CO3·4H2O的Fe元素的XPS图,由图3的Fe 2p峰可知:进入类水滑石结构的Fe(II)经氧化后转变为Fe(III),意味着为吸附后的Cr(VI)提供了还原环境。
图4为本发明实施例1吸附后的Mg5.7Fe0.3Al2(OH)16CO3·4H2O的Cr元素的XPS图,由图4可知:吸附在类水滑石上的Cr(VI),经Fe2+还原后转变为无毒的Cr(III),避免了后期处理时的二次污染。
图5为本发明实施例2所得Mg5.4Fe0.6Al2(OH)16CO3·4H2O的XRD图,由图5可知:实施例2所得荧光材料的XRD结果为与标准类水滑石结构的衍射峰相符,且未明显出现Fe(II)或其他杂质峰。
图6为本发明实施例2所得吸附材料的Cr(VI)吸附率图,由图6可知:实施例2所得Mg5.4Fe0.6Al2(OH)16CO3·4H2O材料对Cr(VI)有明显的吸附,且比未掺杂Fe(II)的镁铝水滑石吸附效果好。
图7为本发明实施例3所得Mg4.8Fe1.2Al2(OH)16CO3·4H2O的XRD图,由图7可知:实施例3所得荧光材料的XRD结果为与标准类水滑石结构的衍射峰相符,且未明显出现Fe(II)或其他杂质峰。
图8为本发明实施例3所得吸附材料的Cr(VI)吸附率图,由图8可知:实施例3所得Mg4.8Fe1.2Al2(OH)16CO3·4H2O材料对Cr(VI)有明显的吸附,且比未掺杂Fe(II)的镁铝水滑石吸附效果好。
具体实施方式
本发明制备Mg6-xFexAl2(OH)16CO3·4H2O类水滑石及其吸附还原Cr(VI)的步骤包括:
a) 按化学计量比称取含镁原料、含铁原料、含铝原料及碱金属氢氧化物与碳酸盐原料,在含镁原料、含铁原料、含铝原料中加入去离子水形成均匀溶液A,在碱金属氢氧化物和碳酸盐原料中加入去离子水形成均匀溶液B;其中,化学计量比以掺杂Fe(II)的Mg6Al2(OH)16CO3·4H2O为目标产物,其通式为Mg6-xFexAl2(OH)16CO3·4H2O,Fe掺杂量x:0.3~1.2;
b) 磁力搅拌下将溶液A滴加到溶液B中,并将所形成的混合悬浊液倒入高压反应釜中,60~80 ℃下预热1h后再升至 120~180 ℃进行6~18h的热处理。最后,经洗涤、抽滤及干燥后形成Mg6-xFexAl2(OH)16CO3·4H2O样品;
c) 将样品加入到6组配置好的重铬酸钾溶液中,待充分搅拌后,每间隔2h取其中一组的上清液做吸附率测试,同时检测吸附材料中Cr(VI)的还原程度。
其中,所述含镁原料为硝酸镁或氯化镁;所述含铁原料为硝酸亚铁或氯化亚铁;所述含铝原料为硝酸铝或氯化铝;所述碱金属氢氧化物为氢氧化钠或氢氧化钾;所述的碱金属碳酸盐为碳酸钠或碳酸钾。
步骤a中,限定Fe2+掺杂量为0.3~1.2,由于Fe(II)为还原剂,含量太小时,无法有效还原Cr(VI)为Cr(III);含量过高时,无法保持原水滑石的层状结构。
步骤b中,Mg6-xFexAl2(OH)16CO3·4H2O的干燥处理在真空干燥箱内进行,以免大量的Fe(II)在使用前被氧化成Fe(III)。
优选的,步骤a中原料初始浓度为0.2 mol/L~0.6 mol/L。
优选的,步骤b中滴加溶液A的速度为10~30滴/min。
优选的,步骤b中预热温度为60~80 ℃。
优选的,步骤b中水热反应在温度为120~180 ℃下进行。
优选的,步骤c中所有重铬酸钾溶液初始浓度为80~100 mg/L。
下面结合实施例对本发明的具体实施方式做进一步的描述,并不因此将本发明限制在所述的实施例范围之中。
实施例1
合成过程:
1) 按Mg5.7Fe0.3Al2(OH)16CO3·4H2O的化学计量比称取原料硝酸镁(Mg(NO3)2)1.6872g、硝酸亚铁(Fe(NO3)2)0.1079g、硝酸铝(Al(NO3)3·9H2O)1.5005g、氢氧化钠(NaOH)1.28g与碳酸钠(Na2CO3)0.212g,在Mg(NO3)2、Fe(NO3)2、Al(NO3)3·9H2O中加入去离子水形成均匀溶液A,在NaOH与Na2CO3中加入去离子水形成均匀溶液B。
2) 磁力搅拌下将溶液A滴加到溶液B中,并将所形成的混合悬浊液倒入高压反应釜中,60 ℃下预热1h后再升至 120 ℃进行15h的热处理。最后,经洗涤、抽滤及干燥后形成Mg5.7Fe0.3Al2(OH)16CO3·4H2O样品;
3) 将样品加入到配置好的6组浓度为80 mg/L重铬酸钾溶液中,待充分搅拌后,每间隔2h取其中一组的上清液做吸附率测试,同时检测吸附材料中Cr(VI)的还原程度。
图1为本发明实施例1所得Mg5.7Fe0.3Al2(OH)16CO3·4H2O的XRD图,由图1可知:实施例1所得荧光材料的XRD结果为与标准类水滑石结构的衍射峰相符,且未明显出现Fe(II)或其他杂质峰。图2为本发明实施例1所得吸附材料的Cr(VI)吸附率图,由图2可知:实施例1所得Mg5.7Fe0.3Al2(OH)16CO3·4H2O材料对Cr(VI)有明显的吸附,且比未掺杂Fe(II)的水滑石吸附效果好。图3为本发明实施例1吸附后的Mg5.7Fe0.3Al2(OH)16CO3·4H2O的Fe元素的XPS图,由图3的Fe 2p峰可知:进入类水滑石结构的Fe(II)经氧化后转变为Fe(III),意味着为吸附后的Cr(VI)提供了还原环境。图4为本发明实施例1吸附后的Mg5.7Fe0.3Al2(OH)16CO3·4H2O的Cr元素的XPS图,由图4可知:吸附在类水滑石上的Cr(VI),经Fe(II)还原后转变为无毒的Cr(III),避免了后期处理时的二次污染。
实施例2
合成过程:
1) 按Mg5.4Fe0.6Al2(OH)16CO3·4H2O的化学计量比称取原料氯化镁(MgCl2)1.0283g、氯化亚铁(FeCl2)0.1521g、氯化铝(AlCl3)0.5334g、氢氧化钾(KOH)1.7952g与碳酸钾(K2CO3)0.2764g,在MgCl2、FeCl2、AlCl3中加入去离子水形成均匀溶液A,在KOH与K2CO3中加入去离子水形成均匀溶液B。
2) 磁力搅拌下将溶液A滴加到溶液B中,并将所形成的混合悬浊液倒入高压反应釜中,70 ℃下预热1h后再升至 180 ℃进行18h的热处理。最后,经洗涤、抽滤及干燥后形成Mg5.4Fe0.6Al2(OH)16CO3·4H2O样品;
3) 将样品加入到配置好的6组浓度为90 mg/L重铬酸钾溶液中,待充分搅拌后,每间隔2h取其中一组的上清液做吸附率测试,同时检测吸附材料中Cr(VI)的还原程度。
图5为本发明实施例2所得Mg5.4Fe0.6Al2(OH)16CO3·4H2O的XRD图,由图5可知:实施例2所得荧光材料的XRD结果为与标准类水滑石结构的衍射峰相符,且未明显出现Fe(II)或其他杂质峰。图6为本发明实施例2所得吸附材料的Cr(VI)吸附率图,由图6可知:实施例2所得Mg5.4Fe0.6Al2(OH)16CO3·4H2O材料对Cr(VI)有明显的吸附,且比未掺杂Fe(II)的水滑石吸附效果好。
实施例3
合成过程:
1) 按Mg4.8Fe1.2Al2(OH)16CO3·4H2O的化学计量比称取原料硝酸镁(Mg(NO3)2)1.4208g、氯化亚铁(FeCl2)0.3042g、硝酸铝(Al(NO3)3·9H2O)1.5005g、氢氧化钠(NaOH)1.28g与碳酸钾(K2CO3)0.2764g,在Mg(NO3)2、FeCl2、Al(NO3)3·9H2O中加入去离子水形成均匀溶液A,在NaOH与K2CO3中加入去离子水形成均匀溶液B。
2) 磁力搅拌下将溶液A滴加到溶液B中,并将所形成的混合悬浊液倒入高压反应釜中,80 ℃下预热1h后再升至 150 ℃进行12h的热处理。最后,经洗涤、抽滤及干燥后形成Mg4.8Fe1.2Al2(OH)16CO3·4H2O样品;
3) 将样品加入到配置好的6组浓度为100 mg/L重铬酸钾溶液中,待充分搅拌后,每间隔2h取其中一组的上清液做吸附率测试,同时检测吸附材料中Cr(VI)的还原程度。
图7为本发明实施例3所得Mg4.8Fe1.2Al2(OH)16CO3·4H2O的XRD图,由图7可知:实施例3所得荧光材料的XRD结果为与标准类水滑石结构的衍射峰相符,且未明显出现Fe(II)或其他杂质峰。图8为本发明实施例3所得吸附材料的Cr(VI)吸附率图,由图8可知:实施例3所得Mg4.8Fe1.2Al2(OH)16CO3·4H2O材料对Cr(VI)有明显的吸附,且比未掺杂Fe(II)的水滑石吸附效果好。
- 还没有人留言评论。精彩留言会获得点赞!