基于FRET用于检测样品中核酸靶标的试剂盒及其应用的制作方法
本发明属于分析检测领域,涉及基于fret(荧光共振能量转移)用于检测样品中核酸靶标的试剂盒及其应用。
背景技术:
国民经济的高速发展极大提升了国民对健康的关注。为在获得高标准健康的同时实现健康的低成本,亟需开发新型的诊断技术或药物筛选方法。
荧光共振能量转移(fret)是指两种荧光物质在超近距离(<10nm)时发生能量转移的现象。受激发的供体以非辐射方式把能量转移给受体荧光物质,使其发光。这种荧光共振能量转移在生物分析化学领域作为一种简便快捷的检测模式已越来越受到青睐,并在体外诊断领域,药物筛选等领域得到广泛的应用。其中,以镧系偶合物为荧光共振能量转移供体的检测模式,相比一般荧光检测方法,可以有效的去除散色、自发荧光等样品对荧光检测的干扰,大大提高信噪比,从而提高检测灵敏度和检测准确性。
微小rna因在分子生物学层面对生命现象起着极其重要的调控作用,而成为近年来备受瞩目的明星生物分子。人体中有2500种以上的微小rna,它们通过控制绝大部分基因的转录-翻译过程调控细胞内蛋白质的平衡。多种重大疾病的重要病发机理之一已被确证是微小rna的失控表达。微小rna在血液内的稳定性高,其与各种疾病早期诊断、预后具有高关联性,从而使其体外诊断成为未来诊断技术的重要前沿课题。要将微小rna作为实用型疾病诊断的有效生物标记物,其重要前提是方便准确地建立对血清、组织细胞、相应rna提取物中的微小rna进行分析定量的方法,但由于微小rna通常只有18-24个碱基的长度且序列之间具有高相似性,使得传统检测中单纯依靠杂交的模式难以有效应用。目前微小rna的检测通常利用实时荧光定量pcr,但该技术存在难以避免的背景扩增,且所需检测仪器价格昂贵,无法在临床实验室得到广泛应用。目前均相检测法备受临床实验室青睐,该方法避免了洗涤、离心等繁琐的人工操作,大大简化对人力、装备的要求,因此发展一种微小rna的均相检测技术对于实现微小rna成为诊断疾病的有效可靠生物标记物有着重要的意义。
2015年,巴黎十一大学的nikohildebrandt教授工作组首次将基于镧系偶合物的时间分辨荧光共振能量转移检测技术应用在多组分微小rna的快速诊断上(angew.chem.int.ed.2015,54,1-7),实现了同一样本中3种微小rna的同时检出。微小rna的准确检出依赖于获得其与核酸探针稳定结合,形成有效能量转移结构,此过程中需要用到t4rna连接酶2(t4rnaligase2),而该连接酶只能识别核酸片段5’端骨架为rna的结构,因此,对核酸适配体的设计要求苛刻,该核酸适配体必须同时满足既能与待测微小rna序列互补,又拥有5’端为rna结构的要求。为满足该要求,nikohildebrandt教授工作组只能合成一种由dna和rna骨架共同构成的核酸适配体,这极大提高了检测成本及探针的设计、合成难度,限制了该方法的应用范围。目前尚未有研究可以解决规避该复杂结构核酸适配体,转为仅仅采用dna核酸探针的试剂盒。
技术实现要素:
本发明的目的在于提供基于fret用于检测样品中核酸靶标的试剂盒,该试剂盒包括splintr连接酶,使用该试剂盒无需采用由dna和rna骨架共同构成的核酸适配体即可实现基于fret来检测核苷酸靶标。
本发明的另一目的在于提供一种基于fret用于检测样品中核酸靶标的生物传感体系的构建方法。
本发明的再一目的在于提供一种splintr连接酶在制备基于fret用于检测样品中核酸靶标的试剂盒中的应用。
本发明的再一目的在于提供一种基于fret检测样品中核酸靶标的方法。
为实现上述目的,本发明提供基于fret用于检测样品中核酸靶标的试剂盒,所述试剂盒包括:
(i)供体核酸片段;
(ii)受体核酸片段;
(iii)能与所述受体核酸片段结合的第一核酸适配体;
(iv)能与所述供体核酸片段结合的第二核酸适配体;
(v)能使所述第一核酸适配体与所述第二核酸适配体结合的splintr连接酶。
本发明中所述的splintr连接酶(
根据本发明的具体实施方案,在本发明所述试剂盒中,所述供体核酸片段为标记第一荧光物质的供体核酸片段或为生物素化供体核酸片段;
所述第一荧光物质包括镧系偶合物;
优选地,所述镧系偶合物包括时间分辨荧光检测用激发态寿命大于50ns的荧光物质;
更优选地,所述激发态寿命大于50ns的荧光物质包括铽的荧光化合物(luminescentterbiumcomplex,l4tb)或铕的荧光化合物(luminescenteuropiumcomplex,l4eu);
任选地,当所述供体核酸片段为生物素化供体核酸片段时,所述试剂盒还包括使其成为标记第一荧光物质的供体核酸片段的试剂,优选地,该试剂为l4tb标记的链霉亲和素;
所述受体核酸片段为标记第二荧光物质的受体核酸片段;所述第二荧光物质与所述第一荧光物质具有两者间能发生共振能量转移的光谱特性;
所述第二荧光物质包括有机荧光染料、纳米荧光材料和荧光蛋白质中的一种或多种;
优选地,所述有机荧光染料包括cy3、cy5或cy5.5;所述纳米荧光材料包括量子点纳米荧光材料或碳点纳米荧光材料;所述荧光蛋白质包括cfp、gfp、yfp或rfp。
根据本发明的具体实施方案,在本发明所述试剂盒中,所述第一核酸适配体还含有与所述核酸靶标的第一部分序列完全互补或部分互补的序列,其中,所述第一部分序列位于所述核酸靶标的3'或5'端;
所述第二核酸适配体含有与所述受体核酸片段完全互补或部分互补的序列;且
所述第二核酸适配体还含有与所述核酸靶标的第二部分序列完全互补或部分互补的序列,所述第二部分序列位于所述核酸靶标的另一端,所述核酸靶标的第二部分序列的每一端位于所述的核酸靶标的第一部分序列的外部;
优选地,所述第二部分序列为所述核酸靶标除所述第一部分序列外的剩余序列。
根据本发明的具体实施方案,在本发明所述试剂盒中,所述的供体核酸片段、受体核酸片段、第一核酸适配体或第二核酸适配体为单链的dna;
所述核酸靶标包括微小rna、ssrna和sirna中的一种或多种,优选链长小于等于30bp的微小rna,更优选地,所述微小rna为mir-208a。
本发明所述mir-208a具有seqidno:5序列;
seqidno:5’-uagcagcacguaaauauuggcg-3’。
根据本发明的具体实施方案,在本发明所述试剂盒中,所述供体核酸片段为seqidno:1;所述受体核酸片段为seqidno:2;所述第一核酸适配体为seqidno:3;所述第二核酸适配体为seqidno:4。
seqidno:15’-cgatcagtcaggcaa-3’。
seqidno:25’-ttgtgttccgataggctaaaaaa-3’。
seqidno:35’-ttgcctgactgatcgcgccaatattt-3’。
seqidno:45’-acgtgctgctaagcctatcggaacacaa-3’。
优选地,所述seqidno:1的5’端标记有l4tb;或其5’端标记有teg-生物素;任选地,当所述seqidno:1的5’端标记有teg-生物素时,所述试剂盒还包括l4tb的链霉亲和素;
优选地,所述seqidno:2的3’端标记有cy5。
本发明发展了一种包含splintr连接酶的试剂盒,利用该新型核酸连接酶可构建高灵敏核酸及其类似物检测生物传感体系(生物传感器),尤其是微小rna检测生物传感体系,相较于现有技术(angew.chem.int.ed.2015,54,1-7)使用的t4rna连接酶2检测微小rna,本发明试剂盒无需包含复杂的dna-rna杂交结构核酸适配体,仅需设计合成全dna单链核酸适配体即可实现对微小rna的有效准确检测。本发明所述试剂盒在临床应用中具有更好的实用性价值,并可在此基础上提供可实现多种生物标记物的高灵敏快速均相检测的方法。
另一方面,本发明提供一种基于fret用于检测样品中核酸靶标的生物传感体系的构建方法,所述方法包括如下步骤:
(a)制备本发明标记第一荧光物质的供体核酸片段或生物素化供体核酸片段,及标记第二荧光物质的受体核酸片段;
(b)制备本发明第一核酸适配体及第二核酸适配体;
(c)在缓冲溶液中分散制得的标记第一荧光物质的供体核酸片段或生物素化供体核酸片段、标记第二荧光物质的受体核酸片段、第一核酸适配体及第二核酸适配体;并且加入splintr连接酶以及atp得所述生物传感体系,优选地,该酶在所述生物传感体系的浓度为0.1~1反应单位/100~150μl,atp的浓度为0.8~1.2mm;
当加入生物素化供体核酸片段时,在缓冲溶液中还分散使其成为标记第一荧光物质的供体核酸片段的试剂;优选地,该试剂为l4tb标记的链霉亲和素;
任选地,所述方法还包括将步骤(c)所得生物传感体系进行冻干处理。
本发明所述冻干处理是将除了待检测核酸靶标以外在缓冲溶液中混合好的生物传感体系进行冻干处理,使其转变成粉末状,以使其更好的保存,确保生物传感体系中的生物分子不会被降解而是去活性。
再一方面,本发明提供一种splintr连接酶在制备基于fret用于检测样品中核酸靶标的试剂盒中的应用。
优选地,所述应用包括如下步骤:
(a)根据本发明所述的方法构建待检测核酸靶标的生物传感体系;
(b)加入待检测核酸靶标后,以供体核酸片段中标记的第一荧光物质的发射光为体系检测荧光能量来源,检测体系中的供体通道荧光强度与受体通道荧光强度,并将两者的比值为定量依据;
(c)比较步骤(b)中得到的供体通道荧光强度与受体通道荧光强度的比值与预先建立的标准工作曲线,以确定待检测核酸靶标的量;
任选地,当本发明所述生物传感体系的构建方法包括将步骤(c)所得生物传感体系进行冻干处理时,上述步骤(a)还包括在冻干处理所得粉末中加入水以构建待检测核酸靶标的生物传感体系。
根据本发明的具体实施方案,在本发明所述应用中,建立标准工作曲线的步骤包括:将待检测核酸靶标加入所述生物传感体系中反应,检测供体通道信号及受体通道信号,计算荧光强度比值;采用不同浓度的待检测核酸靶标重复上述步骤,根据在不同待检测核酸靶标的浓度条件下,得到的供体通道信号与受体通道信号强度的比值,绘制待检测核酸靶标的标准浓度工作曲线;
优选所述待检测核酸靶标包括链长小于等于30bp的微小rna,更优选地,所述微小rna为mir-208a。
本发明的原理是采用高特异性的splintr连接酶,将标记有第一荧光物质的供体核酸片段、标记有第二荧光探针的受体核酸片段、第一核酸适配体及第二核酸适配体在待测核酸靶标的介导下,例如在微小rna的介导下,相互连接形成可实现高效荧光共振能量转移的复合结构,从而产生转移荧光信号,构建出基于高连接活性的核酸靶标的高灵敏高特异荧光检测传感器,例如基于高连接活性的微小rna的高灵敏高特异荧光检测传感器。
再一方面,本发明提供一种基于fret检测样品中核酸靶标的方法,所述方法包括如下步骤:
(a)根据本发明所述的方法构建待检测核酸靶标的生物传感体系;
(b)加入待检测核酸靶标后,以供体核酸片段中标记的第一荧光物质的发射光为体系检测荧光能量来源,检测体系中的供体通道荧光强度与受体通道荧光强度,并将两者的比值为定量依据;
(c)比较步骤(b)中得到的供体通道荧光强度与受体通道荧光强度的比值与预先建立的标准工作曲线,以确定待检测核酸靶标的量;
任选地,当本发明所述生物传感体系的构建方法包括将步骤(c)所得生物传感体系进行冻干处理时,上述步骤(a)还包括在冻干处理所得粉末中加入水以构建待检测核酸靶标的生物传感体系。
根据本发明的具体实施方案,在本发明所述基于fret检测样品中核酸靶标的方法中,建立标准工作曲线的步骤包括:将待检测核酸靶标加入所述生物传感体系中反应,检测供体通道信号及受体通道信号,计算荧光强度比值;采用不同浓度的待检测核酸靶标重复上述步骤,根据在不同待检测核酸靶标的浓度条件下,得到的供体通道信号与受体通道信号强度的比值,绘制待检测核酸靶标的标准浓度工作曲线;
本发明检测核酸靶标的原理是采用高特异性的splintr连接酶,将标记有第一荧光物质的供体核酸片段、标记有第二荧光探针的受体核酸片段、第一核酸适配体及第二核酸适配体在待测核酸靶标的介导下,例如在微小rna的介导下,相互连接形成可实现高效荧光共振能量转移的复合结构,从而产生转移荧光信号,构建出基于高连接活性的核酸靶标的高灵敏高特异荧光检测传感器,例如基于高连接活性的微小rna的高灵敏高特异荧光检测传感器。
本发明所述的检测样品中核酸靶标的方法为均相检测法,其具有如上所述的优势。
本发明以检测样品中的微小rna为例,详细说明如下:
(1)生物传感器的构建
在缓冲溶液中,例如ph7.4左右的缓冲液中,依次加入标记第一荧光物质的供体核酸片段、标记第二荧光物质的受体核酸片段、第一核酸适配体及第二核酸适配体及splintr连接酶,当加入微小rna后即通过核酸片段间的配对形成结构稳定的微小rna检测传感器;其中,缓冲溶液里包含一定浓度的镁离子作为splintr连接酶的辅助因子,一定浓度的atp作为连接反应的能量供给源;缓冲溶液中加入含微小rna待测样本后,均匀混合,在37℃孵育30分钟。
(2)荧光信号的采集及样品检测
利用酶标仪对体系中的荧光共振能量转移进行定量,分别读取供体通道的荧光强度和受体通道的荧光强度,其比值作为本生物传感器检测微小rna的有效检测指标。
本发明中的生物传感器,不仅可直接对体系中的微小rna进行快速准确定量,也可通过在核酸适配体的微小rna检测区域设计不同序列实现对不同序列生物分子,如dna、rna、核酸类似物等的靶向检测。
所述的第一荧光物质包括:l4tb、l4eu等时间分辨荧光检测用长寿命荧光物质;
所述的第二荧光物质包括:cy3、cy5、cfp、量子点纳米材料、gfp、yfp、rfp等;包括发光波长在400~700nm的现有技术产品。
综上所述,本发明主要提供基于fret用于检测样品中核酸靶标的试剂盒,其可应用于均相检测,当应用于检测微小rna时,其利用splintr连接酶对dna和rna杂交链均可实现高效连接的特点,无需对核酸适配体进行特殊修饰,有效避免dna/rna异类杂交。本发明既能保证检测传感器结构稳定高效形成,大大提高检测效率,又可有效简化核酸片段的设计和制备,降低检测成本。
附图说明
图1为基于fret用于检测微小rna的生物传感器的检测特异性比较结果示意图;
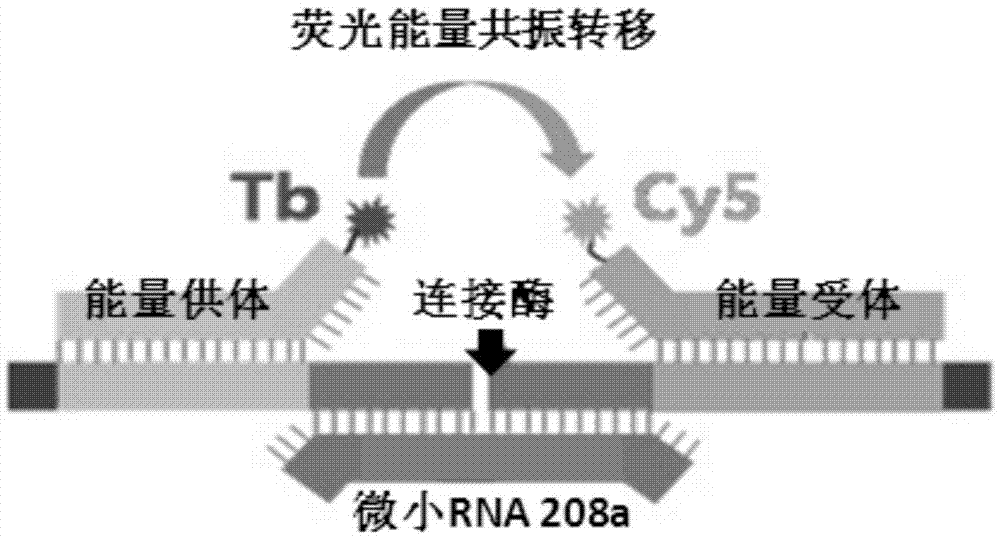
图2为基于fret用于检测微小rna的生物传感器的结构示意图;
图3atp浓度相同(10μmol)时,微小rna荧光检测生物传感体系中splintr连接酶的浓度优化实验结果示意图;
图4为splintr连接酶浓度相同(0.1u)时,微小rna荧光检测生物传感体系中atp的浓度优化实验结果示意图;
图5为本发明构建的基于荧光共振能量转移的生物传感器在最优条件下检测mir-208a的标准曲线。
具体实施方式
为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现结合具体实施例及附图对本发明的技术方案进行以下详细说明,应理解这些实例仅用于说明本发明而不用于限制本发明的范围。
实施例1
本实施例欲检测样品中mir-208a,其序列为:5’-uagcagcacguaaauauuggcg-3’;
检测如上mir-208a的方法包括如下步骤:
(1)核酸片段的制备
(a)制备生物素化的供体核酸片段:
生物素化的供体核酸片段序列为5’-teg-生物素-cgatcagtcaggcaa-3’;
(b)制备cy5标记的受体核酸片段的:
受体核酸片段序列为5’-ttgtgttccgataggctaaaaaa-3’,3’端标记cy5荧光染料;
(c)制备与供体核酸片段结合的第一核酸适配体:
该核酸配体的序列为5’-ttgcctgactgatcgcgccaatattt-3’。
(d)制备与受体核酸片段结合的第二核酸配体:
该核酸配体序列为5’-acgtgctgctaagcctatcggaacacaa-3’,5’端磷酸化修饰;
(e)合成mir-208a
mir-208a序列为:5’-uagcagcacguaaauauuggcg-3’
(2)基于荧光能量共振转移的微小rna检测生物传感器构建:
将前述的制备好的第一核酸适配体、第二核酸配体、sa-l4tb(标记有l4tb的链霉亲和素)、atp分散于1ml缓冲溶液(pbs,ph7.4)中,终浓度均为2nm,在室温下混合均匀,分别加入100μl/孔于样品板中。根据实验设计分别在不同孔中分别加入生物素化的供体核酸片段(仅供体,终浓度2nm);cy5标记的受体核酸片段(仅受体,终浓度2nm);生物素化的供体核酸片段和cy5标记的受体核酸片段(供体+受体,无连接酶,终浓度2nm);生物素化的供体核酸片段和cy5标记的受体核酸片段(终浓度均为2nm)和0.01反应单位splintr连接酶(供体+受体,0.01u连接酶);生物素化的供体核酸片段和cy5标记的受体核酸片段(终浓度均为2nm)和0.1反应单位splintr连接酶(供体+受体,0.1u连接酶);生物素化的供体核酸片段和cy5标记的受体核酸片段(终浓度均为2nm)和1反应单位splintr连接酶(供体+受体,1u连接酶)。
在反应孔中加入浓度为1nm的mir-208a,并最后补足反应总体积至150μl,37℃孵育30分钟,利用酶标仪测量485±20nm(供体)及665±8nm(受体)通道内荧光信号的变化,分别绘制不同孔中柱状图。所得结果如图1所示,从图1中可以看出只有在待测mir-208a存在时,该生物传感器才能产生有效荧光共振能量转移现象。所形成的生物传感器的结构示意图如图2所示。
将前述的制备好的生物素化的供体核酸片段、cy5标记的受体核酸片段、第一核酸适配体、第二核酸适配体、sa-l4tb(标记有l4tb的链霉亲和素)、atp分散于1ml缓冲溶液(pbs,ph7.4)中,终浓度均为2nm,在室温下混合均匀,分别加入100μl/孔于样品板中。根据实验设计分别在不同孔中分别加入splintr连接酶,使其终浓度分别为0.1、1、2、5、10个反应单位。
在反应孔中加入浓度为1nm的mir-208a,37℃孵育30分钟,利用酶标仪测量485±20nm(供体)及665±8nm供体/(受体)通道内荧光信号的变化,分别绘制加入不同浓度splintr连接酶的信号柱状图。所得结果如图3所示,从图3中可以看出利用受体通道与供体通道中荧光信号的比值,可判断当splintr连接酶为1u时检测的特异性最好;
将前述的制备好的生物素化的供体核酸片段、cy5标记的受体核酸片段、第一核酸适配体、第二核酸适配体、sa-l4tb(标记有l4tb的链霉亲和素)、splintr连接酶分散于1ml缓冲溶液(pbs,ph7.4)中,终浓度均为2nm,在室温下混合均匀,分别加入100μl/孔于样品板中。根据实验设计分别在不同孔中分别加入atp,使其终浓度分别为0.1、1、10、100、1000μm。
在反应孔中加入浓度为1nm的mir-208a,37℃孵育30分钟,利用酶标仪测量485±20nm(供体)及665±8nm供体/(受体)通道内荧光信号的变化,分别绘制加入不同浓度atp的信号柱状图。所得结果如图4所示,从图4中可以看出利用受体通道与供体通道中荧光信号的比值,可判断当atp为1μmol时检测的特异性最好。
实施例2
(1)将实施例1制备好的生物素化的供体核酸片段、cy5标记的受体核酸片段、第一核酸适配体、第二核酸配体、atp、splintr连接酶分散于1ml缓冲溶液(pbs,ph7.4)中,终浓度均为2nm,在室温下混合均匀,各核酸片段存在序列相互互补部分,而在溶液形成杂交。随后,向溶液中加入标记有l4tb的链霉亲和素(终浓度为2nm),因其会与标记有teg-生物素的供体核酸特异性结合,而获得l4tb标记的供体核酸片段,即传感检测体系中的能量供体。
(2)绘制生物传感器检测mir-208a的工作曲线
将浓度分别为20pm、100pm、500pm、1nm、1.5nm、2nm的mir-208a加入如上构建的生物传感器中,在37℃孵育30分钟,利用酶标仪测量485±20nm(供体)及665±8nm(受体)通道内荧光信号的变化,以两者的比值为检测指标,绘制定量mir-208a的工作曲线,所得结果如图5所示。
(3)检测样本中微小rna16的浓度
将未知浓度的mir-208a直接加入如上构建的生物传感器体系,在37℃孵育30分钟,利用酶标仪测量供体/受体通道内荧光信号的变化,以两者的比值为检测指标,结合工作曲线,计算得到样本中目标mir-208a的浓度为850pm。
最后说明的是:以上实施例仅用于说明本发明的实施过程和特点,而非限制本发明的技术方案,尽管参照上述实施例对本发明进行了详细说明,本领域的普通技术人员应当理解:依然可以对本发明进行修改或者等同替换,而不脱离本发明的精神和范围的任何修改或局部替换,均应涵盖在本发明的保护范围当中。
- 还没有人留言评论。精彩留言会获得点赞!