细胞检测装置及细胞检测方法与流程
本发明涉及一种细胞检测装置及细胞检测方法。
背景技术:
关于利用流式细胞仪的样本测定装置,已知有一种装置具有检测流经流动室的测定试样中粒子的粒子检测部件、以及拍摄流经流动室的测定试样中粒子的拍摄部件。比如,日本专利公报特开昭63-94156号上记述的样本测定装置在细胞检测部件的下游一侧配置有用于拍摄细胞的结构。样本测定装置向流经流动室的测定试样中的细胞照射激光,以细胞发出的信号为触发点(trigger)用CCD照相机拍摄测定试样中的细胞。
在上述结构中,为提高粒子图像的质量而放慢粒子流经流动室的速度,因此,比如当想获得数十万个细胞中仅存在一个这样的测定试样中含量极少的细胞图像时,需要测定大量测定试样,从而存在细胞图像获取时间非常长的问题。
技术实现要素:
本发明的范围只由权利要求书所规定,在任何程度上都不受这一节发明内容的陈述所限。
本发明第一形态涉及一种细胞检测装置,包括:流动室,用于供含有粒子的测定试样流动;粒子检测部件,用于检测出供应到流动室的测定试样中的粒子;粒子分类部件,用于根据粒子检测部件的检测结果将满足检测条件的粒子与其他粒子分类;试样供应部件,用于向流动室提供含由粒子分类部件分类出的满足检测条件的粒子的拍摄用试样;粒子拍摄部件,用于对供应到流动室的分类后的拍摄用试样中的粒子进行拍摄。
优选地,在所述粒子分类部件完成粒子分类后,所述试样供应部件将含有所述粒子分类部件所分类的满足检测条件的粒子的拍摄用试样供应到所述流动室。
优选地,所述试样供应部件具有中间存放部件,所述中间存放部件用于存放含有所述粒子分类部件所分类的满足检测条件的粒子的拍摄用试样。
优选地,所述中间存放部件浓缩含有所述粒子分类部件所分类的满足检测条件的粒子的拍摄用试样,并将其供应到所述流动室。
优选地,所述试样供应部件具有归还流路,所述归还流路使通过了所述粒子检测部件的检测位置的试样相对于所述检测位置而言归还到所述流动室的上游侧,并使其作为拍摄用试样再次流入所述流动室。
优选地,所述粒子检测部件具有用一定波长的光照射检测位置的光源;以及接受因所述光的照射而从所述测定试样产生的光的受光部件。
优选地,所述受光部件具有接受因所述光的照射而从所述测定试样产生的散射光的第一检测器;以及接受因所述光的照射而从所述测定试样产生的荧光的第二检测器。
优选地,所述粒子拍摄部件在基于来自所述第一检测器的检测信号的拍摄时间对所述粒子进行拍摄。
优选地,所述流动室的流路与所述测定试样流动的方向垂直的第一方向的宽度比与所述第一方向垂直的第二方向的宽度宽;所述粒子拍摄部件从所述第二方向拍摄所述拍摄用试样中的粒子的图像。
优选地,所述粒子检测部件具有用一定波长的光照射检测位置的光源、以及拍摄所述光照射的所述检测位置的照相机,根据所述照相机的拍摄信号检测所述粒子。
优选地,所述粒子检测部件通过所述照相机拍摄所述粒子分类部件所分类的满足检测条件的粒子,针对同一所述粒子获取与所述粒子拍摄部件所获取的图像不同的其他图像。
优选地,所述粒子检测部件的所述照相机在所述粒子拍摄部件的拍摄中是共用的;所述细胞检测装置还具有光学单元,所述光学单元在所述照相机的拍摄图像上分离作为所述粒子拍摄部件获取的所述粒子的图像与作为所述粒子检测部件获取的所述粒子的图像。
优选地,所述粒子检测部件的检测位置与所述粒子拍摄部件的拍摄位置在所述流动室中的所述测定试样的流动方向上是一致的。
优选地,还包括:改变在所述流动室流动的测定试样的速度的变速部件;当所述测定试样流入所述流动室,通过所述粒子检测部件检测所述粒子时,所述变速部件让所述测定试样以第一速度流动;当含有所述粒子分类部件所分类的满足检测条件的粒子的拍摄用试样流入所述流动室,通过所述粒子拍摄部件拍摄所述粒子时,所述变速部件让所述拍摄用试样以低于所述第一速度的第二速度流动。
优选地,还包括:向所述流动室供应与所述测定试样一起流动的鞘液的鞘液供应部件;所述变速部件改变供应到所述流动室的所述鞘液的流量,以此改变在所述流动室流动的所述测定试样的速度。
优选地,还包括:粒子排列部件,该粒子排列部件对粒子进行排列以便使所述粒子分类部件所分类的满足检测条件的粒子通过所述流动室的所述粒子拍摄部件的拍摄位置。
优选地,当所述测定试样流入所述流动室并通过所述粒子检测部件检测所述粒子时,所述粒子排列部件不进行作业;当含所述粒子分类部件所分类的满足检测条件的粒子的拍摄用试样流经所述流动室,并通过所述粒子拍摄部件拍摄所述粒子时,所述粒子排列部件进行作业。
优选地,还包括:回收部件,所述回收部件回收含所述粒子分类部件所分类的满足检测条件的粒子的拍摄用试样。
优选地,还包括:控制部件,所述控制部件根据所述粒子拍摄部件所获取的图像判断所述拍摄用试样中是否含有受检细胞;所述控制部件让所述回收部件回收含所述受检细胞的所述拍摄用试样。
优选地,所述试样供应部件数次将含有所述粒子分类部件所分类的满足检测条件的粒子的拍摄用试样归还到所述流动室;所述控制部件根据在第一归还作业中所述粒子拍摄部件所获取的图像判断所述拍摄用试样中是否含有第一受检细胞,将含有所述第一受检细胞的所述拍摄用试样回收到所述回收部件;所述控制部件根据在与所述第一归还作业不同的第二归还作业中所述粒子拍摄部件所获取的图像判断所述拍摄用试样中是否含有与所述第一受检细胞不同的第二受检细胞,并将含所述第二受检细胞的所述拍摄用试样回收到所述回收部件。
优选地,还包括:用于输出所述粒子拍摄部件获取的图像的输出部件。
优选地,受检细胞是循环肿瘤细胞、循环内皮细胞、血管内皮祖细胞、间充质干细胞、造血干细胞或抗原特异性T细胞。
本发明第二层面还涉及一种细胞检测方法,其包括以下步骤:让含粒子的测定试样流入流动室的步骤;检测出供应到流动室的测定试样中的粒子的步骤;根据粒子的检测结果,将满足检测条件的粒子与其他粒子分类的步骤;向流动室供应含分类出的满足检测条件的粒子的拍摄用试样的步骤;对供应到流动室的分类后的拍摄用试样中的粒子进行拍摄的步骤。
通过本发明可以高效地获取测定对象细胞的图像。
附图说明
图1为实施方式1涉及的细胞检测装置的结构示意图;
图2为实施方式1涉及的粒子检测部件及粒子拍摄部件的结构示意图;
图3为实施方式1涉及的细胞检测装置的结构框图;
图4为实施方式1涉及的细胞检测装置进行处理的流程图;
图5(a)、(b)为实施方式1涉及的从检测处理开始的处理流程图;
图6(a)为实施方式1涉及的从拍摄处理开始的处理流程图,图6(b)为实施方式1涉及的细胞检测装置进行的显示处理的流程图;
图7(a)、(b)为实施方式1涉及的输出部件上显示的界面的示图;
图8为实施方式2涉及的粒子检测部件及粒子拍摄部件的结构示意图;
图9(a)、(b)为实施方式2涉及的输出部件上显示的界面的示图;
图10为实施方式3涉及的粒子检测部件及粒子拍摄部件的结构示意图;
图11为实施方式3涉及的照相机受光面上的区域的示意图;
图12为实施方式4涉及的粒子检测部件及粒子拍摄部件的结构示意图;
图13为实施方式4涉及的照相机受光面上的区域的示意图;
图14(a)为实施方式5涉及的细胞检测装置的结构框图,图14(b)为实施方式5涉及的细胞检测装置进行的处理的流程图;
图15为实施方式5涉及的从拍摄处理开始的处理流程图;
图16(a)为实施方式6涉及的变速部件的结构示意图,图16(b)为实施方式6涉及的细胞检测装置进行的处理的流程图;
图17为实施方式6涉及的以拍摄处理开始的处理的流程图;
图18为实施方式7涉及的细胞检测装置进行的处理的流程图;
图19(a)为实施方式7涉及的判断为有活性的CEC的图像示图,图19(b)为实施方式7涉及的判断为无活性的CEC的图像示图;
图20(a)、(b)为实施方式7涉及的输出部件上显示的界面的示图;
图21为实施方式8涉及的细胞检测装置的结构示意图;
图22为实施方式8涉及的细胞检测装置进行处理的流程图。
优选实施方式
下面将参照附图说明本发明的优选实施方式。
(实施方式1)
实施方式1为本发明在以血液样本中所含循环肿瘤细胞为受检细胞进行拍摄的装置中的应用。以下称循环肿瘤细胞为CTC(Circulating Tumor Cell)。来自发展的癌细胞的CTC随着血液和淋巴液的流动而循环,转移到远处内脏。在乳腺癌、前列腺癌及大肠癌等转移性癌症患者中,血液中的CTC在判断治疗效果时和作为预后预测因子时被认为有作用。测定CTC在判断治疗效果、无进展生存率、总生存率等预测预后时很有效。在血液中循环的CTC极其微量,每10mL血液中只有数个~数十个左右。
如图1所示,细胞检测装置10包括试样供应部件10a、流动室17、鞘液供应部件18、变速部件19、粒子检测部件20、粒子分类部件21、废液存放部件22、粒子排列部件27、粒子拍摄部件28。试样供应部件10a包括:喷嘴11、供应流路12、阀13、注射器14、阀15、喷射嘴16、归还流路23、阀24、中间存放部件25、阀26。细胞检测装置10所配备的阀可以以电磁方式开关。
试样供应部件10a向流动室17供应放在试样容器10b中的测定试样,粒子分类部件21完成粒子分类后,向流动室17供应含有由粒子分类部件21分类的、满足检测条件的粒子的测定试样。以下将含有由粒子分类部件21分类的、满足检测条件的粒子的测定试样称为“拍摄用试样”。
试样容器10b盛放含粒子的测定试样。预先在采自人的末梢血—即样本中混入以下所示试剂制备出测定试样:·使红细胞溶血的溶血剂、·含检测白细胞用CD45标记抗体的试剂、·含与17号染色体结合的Ch17探针的试剂、·含与Her2基因结合的Her2探针的试剂、·含用色素Alexa488标记的与Ch17探针结合的抗体的试剂、·含用色素PE标记的与Her2探针结合的抗体的试剂、·含染色细胞核的色素7AAD的试剂。
样本中混入上述试剂后,在溶血剂的作用下,红细胞溶血。在白细胞表面表达的CD45抗原被CD45的标记抗体标记。17号染色体被色素Alexa488标记。Her2基因被色素PE标记。细胞核被色素7AAD染色。对色素Alexa488、PE和7AAD照射后述光源121射出的488nm波长的光,则激发起不同波长的荧光。也可以用色素FITC取代色素Alexa488,用色素PE-Cy7取代色素PE。
标记与Ch17探针结合的抗体的色素、标记与Her2探针结合的抗体的色素和染色细胞核的色素的激发波长不同时,后述光源121变为射出与色素激发波长相应的多种光的光源。这种光源可以使用基板上安装数个发光元件所得到的多光激光器。或者光源121也可以是用分色镜将从数个半导体激光器射出的激光结合的结构。比如,与色素Alexa488的激发波长不同的色素有色素Alexa647、色素HOECHST。色素Alexa647用于标记Her2基因,色素HOECHST能用于标记细胞核。
细胞检测装置10也可以具有自动制备测定试样的试样制备部件。此时,试样制备部件将上述试剂混入样本,自动制备测定试样。
供应流路12是连接喷嘴11和喷射嘴16的流路。供应流路12上配置有阀13、15和注射器14。喷射嘴16的前端插入流动室17的入口171。注射器14能够对供应流路12施加正压和负压。注射器14负压驱动,则试样容器10b内的测定试样从喷嘴11吸移,吸到注射器14内。注射器14正压驱动,则吸入注射器14的测定试样从喷射嘴16排出,送到流动室17。
流动室17具有入口171、废弃出口172和归还出口173,内部具有流路17a、17b、17c。流路17a连接着入口171,流路17b连接废弃出口172,流路17c连接归还出口173。流动室17由具有透光性的玻璃和合成树脂构成。图1中为方便起见显示了相互垂直交叉的XYZ轴。在流动室17,X轴负向侧为流动室17的上游侧,X轴正向侧为流动室17的下游侧。流路17a、17b排列成直线形。流路17b位于流路17a的下游侧。流路17c在流路17a和流路17b之间从流路17a分岔。从喷射嘴16送出的测定试样流入流路17a,然后流到流路17b或流路17c。
鞘液供应部件18储存鞘液,还通过变速部件19向流动室17的流路17a供应鞘液。鞘液供应部件18上连接着后述空压源36。通过从空压源36向其提供的正压,鞘液供应部件18将鞘液送到变速部件19。从喷射嘴16送到流路17a的测定试样在被鞘液包被的状态下向下游流动。以此,测定试样中所含粒子排成一列并在此状态下通过检测位置20a。
变速部件19包括流路19a和19b、阀19c和19d、孔19e。流路19a和19b在连接鞘液供应部件18和流动室17的流路中并列配置。流路19a中配置有阀19c,流路19b上配置有阀19d和孔19e。流路19a和19b的截面直径相同。孔19e的截面直径比流路19a和19b截面直径小。
在阀19c打开,阀19d关闭的状态下,鞘液供应部件18送出的鞘液通过流路19a向流动室17供应。另一方面,在阀19c关闭,阀19d打开的状态下,鞘液供应部件18送出的鞘液通过流路19b供应到流动室17。鞘液通过流路19a和19b时供应到流动室17的鞘液每单位时间的流量分别设为V1、V2时,由于孔19e,V2会小于V1。
从喷射嘴16向流路17a供应的测定试样如上所述,在被鞘液包被的状态下流向下游。因此,流经流路17a的测定试样由供应到流动室17的鞘液每单位时间的流量来决定。在此,假设供应到流动室17的鞘液每单位时间流量为V1、V2时,流经流路17a的测定试样的速度分别设为第一速度和第二速度,由于V2小于V1,所以第二速度低于第一速度。如此,变速部件19通过切换供应到流动室17的鞘液流量,以此就能将流经流路17a的测定试样的速度切换为第一速度和第二速度。测定试样以第一速度流入流路17a,拍摄用试样以第二速度流入流路17a。
粒子检测部件20检测出流经流路17a的粒子。具体而言,粒子检测部件20向被置于流路17a的检测位置20a的粒子照射光,并检测产生的前向散射光和荧光。关于粒子检测部件20的结构,待后参照图2说明。
粒子分类部件21根据粒子检测部件20的检测结果,分类满足受检细胞的检测条件的粒子和其他粒子。含有不满足受检细胞检测条件的粒子的测定试样通过流路17b送到废液存放部件22,含有满足受检细胞检测条件的粒子的测定试样通过流路17c送到归还流路23。
粒子分类部件21具有部件21a、以及使部件21a向流路17b突出的驱动部件。部件21a位于开放流路17b的位置时,流经流路17a的测定试样经流路17b送到废液存放部件22。废液存放部件22与流动室17的废弃出口172连接,用于存放不要的测定试样。另一方面,部件21a位于堵塞流路17b的位置时,流经流路17a的测定试样经流路17c送到归还流路23。满足受检细胞检测条件的粒子位于流路17a的分岔位置17d时,粒子分类部件21驱动部件21a来堵塞流路17b。以此,位于分岔位置17d的粒子经流路17c送到归还流路23。
关于粒子分类部件21,也可以配备气泡产生器来取代图1所示结构。此时,粒子分类部件21用气泡产生器中产生的气泡来使向X轴正方向流动的粒子的前进方向改为流路17c的方向。粒子分类部件21还可以具有带压电体和电极的压电致动器(Piezo actuator)或带压电结晶基板和叉指型电极(Interdigitated array electrode)的超声波发生部件,以此取代图1所示结构。此时,粒子分类部件21向粒子施加通过压电致动器或超声波发生部件所产生的超声波,使向X轴正方向流动的粒子的前进方向改为流路17c方向。
归还流路23连接流动室17的归还出口173和阀13与注射器14之间的供应流路12。归还流路23上配置着阀24、26和中间存放部件25。归还流路23使通过了粒子检测部件20的检测位置20a的测定试样相对于检测位置20a来说归还到流动室17的上游一侧,并使其作为拍摄用试样再次流入流动室17。
中间存放部件25用于存放从流路17c供应到归还流路23的拍摄用试样。中间存放部件25能够浓缩存放的拍摄用试样。中间存放部件25最好由淘析转头(elutriator rotor)和离心分离机构成。当浓缩拍摄用试样时,也可以用过滤器等。
中间存放部件25也可以通过喷嘴向反应管排出从流路17c供应到归还流路23的拍摄用试样,由反应管存放拍摄用试样。存放在反应管的拍摄用试样送到流动室17时,中间存放部件25通过喷嘴从反应管吸移拍摄用试样。然后,所吸移的拍摄用试样由注射器14送入流动室17。
从试样容器10b供应到流动室17的测定试样与鞘液混在一起,因此,通过归还流路23送到中间存放部件25的拍摄用试样浓度降低。比如,中间存放部件25浓缩浓度降低的拍摄用试样,使其回到与装在试样容器10b的测定试样浓度同样的浓度。如此,通过中间存放部件25可以提高因鞘液而降低的拍摄用试样浓度。中间存放部件25浓缩的拍摄用试样与测定试样同样地,在注射器14驱动下,再次返回同一喷射嘴16,从喷射嘴16送入流动室17的流路17a。
粒子排列部件27具有配置于流路17a侧面的压电致动器27a、27b。压电致动器27a、27b具有压电体和电极。在与粒子拍摄部件28进行拍摄的方向Z轴方向和粒子流动方向X轴方向垂直的Y轴方向上,粒子排列部件27通过压电致动器27a、27b从流路17a两侧向流经流路17a的粒子施加超声波。以此,在压电致动器27a、27b之间,如虚线所示形成超声波驻波。超声波驻波的节点位于流路17a的中心轴。
通过归还流路23回到流路17a的拍摄用试样中所含粒子由于被施加了超声波而排列起来沿流路17a中心轴流动。如此,粒子排列起来,则粒子能精确地通过粒子拍摄部件28的拍摄位置,即检测位置20a。因此,粒子拍摄部件28可以拍摄出更精确的图像。
粒子排列部件27只要能形成超声波驻波即可,也可以用具有压电结晶基板和叉指型电极的超声波发生部件,以此取代压电致动器27a、27b。
粒子拍摄部件28在检测位置20a拍摄通过归还流路23供应到流动室17的分类后拍摄用试样中的粒子。具体而言,粒子拍摄部件28光照位于检测位置20a的粒子并拍摄产生的荧光。关于粒子拍摄部件28的结构,后面将参照图2说明。已通过检测位置20a的拍摄用试样全部送往废液存放部件22。至此,细胞检测装置10的处理结束。
在实施方式1,粒子检测部件20检测粒子的检测位置20a、以及粒子拍摄部件28拍摄粒子的拍摄位置在流路17a的测定试样流动方向上是一致的。以此,可使流动室17小型化。如果无需小型化的话,粒子拍摄部件28也可以在与检测位置20a不同的流路17a的位置拍摄粒子。另外,粒子拍摄部件28的设置位置不限于此,其也可以在流路17b和流路17c等分岔位置17d的下游。
如此,测定试样中所含的粒子第一次通过检测位置20a时,由粒子检测部件20检测出来。根据粒子检测部件20的检测结果,只将满足受检细胞检测条件的粒子送往归还流路23。此后,通过归还流路23送还至流动室17的粒子第二次通过检测位置20a时,由粒子拍摄部件28对其进行拍摄。即,检测粒子在第一次循环中进行,粒子的拍摄则在第二次循环中进行。以此可以更高效地获取细胞图像。
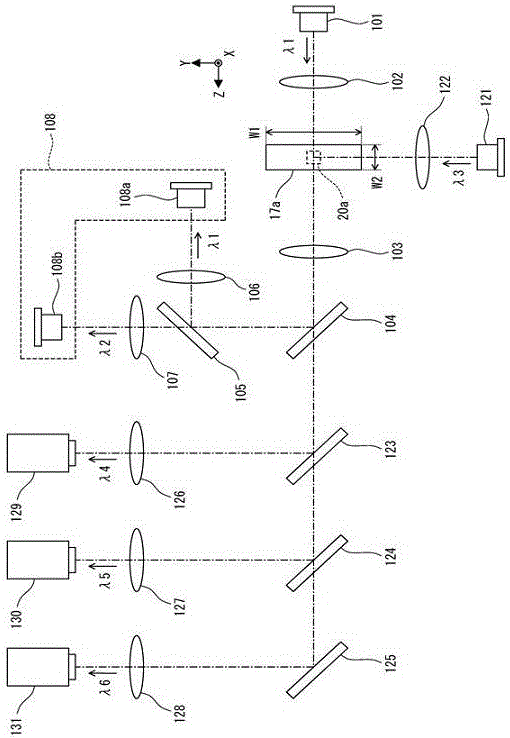
如图2所示,粒子检测部件20包括光源101、照射镜102、物镜103、分色镜104和105、聚光镜106和107、受光部件108。受光部件108具有第一检测器108a和第二检测器108b。粒子拍摄部件28具有光源121、照射镜122、分色镜123、124和125、聚光镜126、127和128、照相机129、130和131。
图2中显示了与图1XYZ轴相应的XYZ轴。与测定试样流动方向垂直的第一方向为Y轴方向,与第一方向垂直的第二方向为Z轴方向。关于流路17a,第一方向的宽度W1比第二方向的宽度W2宽。
光源101为半导体激光光源。从光源101射出的光为波长λ1的激光。波长λ1是红色波长范围的波长。照射镜102聚集从光源101射出的光,并使其照射到流路17a。从光源101射出的光从第二方向、即Z轴方向射入流路17a。射入流路17a的波长λ1的光照射到位于检测位置20a的粒子。由此,从粒子产生波长λ1的前向散射光,从CD45的标记抗体产生波长λ2的荧光。
物镜103聚集波长λ1的前向散射光和波长λ2的荧光,聚集后述波长λ4、λ5、λ6的荧光。分色镜104反射波长λ1的前向散射光和波长λ2的荧光,使波长λ4、λ5、λ6的荧光透射过去。分色镜105反射波长λ1的前向散射光,使波长λ2的荧光透射过去。聚光镜106聚集波长λ1的前向散射光。第一检测器108a接受波长λ1的前向散射光。第一检测器108a是光电二极管,其输出与所接受的前向散射光强度相应的电信号。聚光镜107聚集波长λ2的荧光。第二检测器108b接受波长λ2的荧光。第二检测器108b是雪崩光电二极管,其输出与所接受的荧光强度相应的电信号。
光源121是半导体激光光源。从光源121射出的光是波长λ3的激光。波长λ3约为488nm。照射镜122聚集光源121射出的光,并将其照射到流路17a。光源121射出的光从第一方向、即Y轴方向射入流路17a。射入流路17a的波长λ3的光照射位于检测位置20a的粒子。由此从色素Alexa488产生波长λ4的荧光,从色素PE产生波长λ5的荧光,从色素7AAD产生波长λ6的荧光。
如此,从光源121射出的荧光激发用光从第一方向射入流路17a,以此可以高效地产生荧光。即在流路17a流动的粒子在短边方向很难晃动。因此,从流路17a的短边一侧射入荧光激发用光时,即使缩小荧光激发用光的宽度,也可以将荧光激发用光照射到检测位置20a的粒子。因此,能高效地向粒子照射荧光激发用光,所以可以高效地产生荧光。
波长λ4、λ5、λ6的荧光由物镜103聚光。在图2中,粒子拍摄部件28与粒子检测部件20共用物镜103。由物镜103聚集的波长λ4、λ5、λ6的荧光透过分色镜104。分色镜123反射波长λ4的荧光,使波长λ5、λ6的荧光透射过去。分色镜124反射波长λ5的荧光,透射波长λ6的荧光。分色镜125反射波长λ6的荧光,分色镜125也可以置换为反射镜。
聚光镜126、127、128分别聚集波长λ4、λ5、λ6的荧光。照相机129、130、131分别接受波长λ4、λ5、λ6的荧光,输出位于检测位置20a的粒子的图像信息作为拍摄信号。照相机129、130、131也可以是TDI(Time Delay Integration,时间延迟积分)照相机。使用TDI照相机可以获得更高精度的图像信息。
在此,照相机129、130、131拍摄粒子的方向是Z轴方向。流路17a如上所述,与拍摄方向和粒子流动方向垂直的方向——即Y轴方向的宽度W1比拍摄方向—即Z轴方向的宽度W2大。因此,粒子在Z轴方向上的位置不易出现参差不齐的情况,所以,即使提高放大率(Magnification)使景深变短时,也很容易对粒子对焦。因此,可以精确地获取粒子图像。
如图3所示,细胞检测装置10包括图1所示粒子检测部件20、粒子分类部件21、中间存放部件25、粒子排列部件27、粒子拍摄部件28。细胞检测装置10还具有控制部件31、存储部件32、输入部件33、输出部件34、驱动部件35和空压源36。控制部件31比如是CPU。控制部件31从细胞检测装置10各部件接收信号,并控制细胞检测装置10各部件。控制部件31按照存储部件32存储的程序控制各部件。存储部件32是ROM、RAM、硬盘等。
控制部件31获取粒子检测部件20的第一检测器108a和第二检测器108b输出的信号波形的峰值,以此针对各粒子获得波长λ1的前向散射光强度和波长λ2的荧光的强度。控制部件31按照各粒子分别将波长λ1的前向散射光强度和波长λ2的荧光强度存入存储部件32。控制部件31根据粒子拍摄部件28的照相机129、130、131输出的信号生成粒子图像,将生成的图像按照各粒子分别存入存储部件32。
控制部件31通过输入部件33从操作者接受指示,使输出部件34显示粒子图像等。输入部件33是鼠标和键盘,输出部件34是液晶屏等显示器。
驱动部件35包括分别驱动图1所示阀的机构、驱动注射器14的机构和升降喷嘴11的机构。空压源36向细胞检测装置10各部件提供正压和负压。
下面参照图4~图6(a)所示流程图就细胞检测装置10的处理进行说明。
如图4所示,操作者输入开始指示,则在步骤S1,控制部件31进行检测处理。具体而言,控制部件31同时开始进行后述图5(a)、(b)所示处理。以此,试样容器10b的测定试样供应到流动室17,此测定试样中所含粒子由粒子检测部件20检测出来。只有满足受检细胞的检测条件的粒子供应到归还流路23。图5(a)、(b)的处理结束后,控制部件31将处理推进到步骤S2。
在步骤S2,控制部件31进行浓缩处理。以此,中间存放部件25中存放的拍摄用试样被浓缩。浓缩后的拍摄用试样存在中间存放部件25。
在步骤S3,控制部件31进行拍摄处理。具体而言,控制部件31开始后述图6(a)所示处理。以此,被中间存放部件25浓缩的拍摄用试样再次供应到流动室17。再次供应到流动室17的拍摄用试样中所含粒子被粒子拍摄部件28拍摄。图6(a)所示处理结束,归还到流动室17的拍摄用试样全部送往废液存放部件22,则图4所示细胞检测装置10的处理结束。
如图5(a)所示,在步骤S101,控制部件31以第一速度让测定试样流入流动室17。具体而言,控制部件31打开阀19c,关闭阀19d,从鞘液供应部件18向流动室17供应鞘液。然后,控制部件31将试样容器10b内的测定试样从喷射嘴16送到流路17a。
在步骤S102,控制部件31开始粒子检测部件20的检测。具体而言,控制部件31从光源101向检测位置20a照射光,通过第一检测器108a和第二检测器108b分别接受波长λ1的前向散射光和波长λ2的荧光。控制部件31就检测位置20a的粒子获取波长λ1的前向散射光强度和波长λ2的荧光强度。
在步骤S103,控制部件31判断检测位置20a的粒子是否为满足受检细胞检测条件的粒子。具体而言,如果波长λ2的荧光强度在一定阈值以下且波长λ1的前向散射光强度在一定阈值以上,则控制部件31判断检测位置20a的粒子是满足受检细胞检测条件的粒子。据此,波长λ2的荧光强度大于一定阈值的粒子和波长λ1的前向散射光强度小于一定阈值的粒子被排除。当粒子是受检细胞的CTC时,粒子不与CD45的标记抗体结合,所以波长λ2的荧光强度在一定阈值以下。而且,当粒子是受检细胞的CTC时,粒子尺寸大,所以波长λ1的前向散射光强度在一定阈值以上。
如此,检测出的粒子是白细胞以外的粒子时,且检测出的粒子尺寸较大时,控制部件31视为检测出的粒子很可能是受检细胞,在步骤S103判断为是。
在制备测定试样时也可以不用溶解红细胞的溶血剂。此时,红细胞尺寸很小,波长λ1的前向散射光强度会小于一定阈值,因此,测定试样中的红细胞被排除。
在步骤S103判断为是,则在步骤S104,控制部件31存储在步骤S103被判断为满足受检细胞检测条件的粒子通过检测位置20a的时间。在步骤S105,控制部件31判断是否试样容器10b中的测定试样全部供给流动室17且全部粒子均通过检测位置20a。控制部件31反复进行步骤S103、S104的处理,直到全部粒子通过检测位置20a。如果全部粒子通过检测位置20a,则图5(a)的处理结束。
如图5(b)所示,在步骤S201,控制部件31判断充当归还对象的粒子是否已到达分岔位置17d。具体而言,当距图5(a)步骤S104所存储的时间起已过去一定时间时,控制部件31判断在图5(a)步骤S103被判断为满足受检细胞检测条件的粒子已到达分岔位置17d。
充当归还对象的粒子到达分岔位置17d后,在步骤S202,控制部件31驱动粒子分类部件21,以使部件21a堵塞流路17b一定时间。以此,满足受检细胞检测条件的粒子经流路17c送到归还流路23。图5(b)的处理在图5(a)的处理结束后反复进行,直至经过一定时间。如此,测定试样所含满足受检细胞的条件的粒子全部送到归还流路23。
不满足受检细胞检测条件的粒子通过分岔位置17d时,也可以堵塞流路17c。此时,粒子分类部件21具有堵塞流路17c的部件。控制部件31在步骤S202用堵塞流路17c的部件堵塞流路17c,并让部件21a从流路17b避让。
如图6(a)所示,在步骤S301,控制部件31让中间存放部件25浓缩的拍摄用试样以比第一速度慢的第二速度流入流动室17。具体而言,控制部件31关闭阀19c,打开阀19d,从鞘液供应部件18向流动室17供应鞘液。然后,控制部件31将中间存放部件25浓缩的拍摄用试样从喷射嘴16送到流路17a。
在步骤S302,控制部件31驱动粒子排列部件27,对流路17a施加超声波。以此,流经流路17a的粒子沿流路17a的中心轴流动。在步骤S303,控制部件31与图5(a)的步骤S102同样地,开始粒子检测部件20的检测。
在图5(a)的处理中,与图6(a)的处理不同,粒子排列部件27不驱动。这是因为,即使不驱动粒子排列部件27,当测定试样以第一速度流入流路17a时,测定试样所含粒子也很容易位于流路17a的中心轴位置。然而,归还的拍摄用试样以低于第一速度的第二速度流入流路17a,所以,粒子有可能晃动。因此,在图6(a)的处理中驱动粒子排列部件27。
在步骤S304,控制部件31根据第一检测器108a接受的前向散射光强度判断粒子是否位于检测位置20a。具体而言,当前向散射光强度超过一定阈值时,控制部件31判断粒子位于检测位置20a。粒子位于检测位置20a后,在步骤S305,控制部件31通过粒子拍摄部件28对位于检测位置20a的粒子进行拍摄。具体而言,控制部件31从光源121向检测位置20a照射光,分别用照相机129、130、131接受波长λ3、λ4、λ5的荧光。控制部件31根据照相机129、130、131输出的拍摄信号生成检测位置20a的粒子的图像。在步骤S305,可以由照相机129、130、131拍摄数个图像,也可以拍摄视频。
在步骤S306,控制部件31判断是否中间存放部件25浓缩的拍摄用试样全部供应到流动室17且全部粒子已通过检测位置20a。控制部件31反复进行步骤S304、S305的处理,直到全部粒子通过检测位置20a。当全部粒子通过检测位置20a时,图6(a)的处理结束。至此,对于归还到流动室17的拍摄用试样中所含的全部粒子获取了图像。
如此,在第一次循环中判断粒子是否很可能为CTC,在第二次循环中对粒子进行拍摄,因此可以通过变速部件19将测定试样在第一次循环中的速度设定得比拍摄用试样在第二次循环中的速度高。如此可以提高细胞检测装置10的处理效率。
当图4~图6(a)的处理结束后,操作者通过输入部件33向细胞检测装置10输入显示结果的指示。
如图6(b)所示,在步骤S401,控制部件31判断操作者是否输入了显示结果的指示。若步骤S401判断为是,则控制部件31在步骤S402解析在图6(a)的步骤S305获取的全部粒子图像,提取细胞核内含有基于17号染色体的光点和基于Her2基因的光点的细胞。然后,在步骤S402,控制部件31还分析提取的细胞的图像,判断各个细胞是否为有Her2基因扩增的细胞,提取有Her2基因扩增的细胞作为CTC。在此,控制部件31将细胞核内含有基于17号染色体的二个光点和基于Her2基因的三个以上光点的细胞提取出来作为有Her2基因扩增的细胞,即CTC。
在步骤S403,控制部件31根据步骤S402的提取结果在输出部件34显示含有光点的细胞数和有Her2基因扩增的细胞(CTC)数。在步骤S404,控制部件31在输出部件34显示步骤S402提取的含光点的细胞的图像。
如图7(a)、(b)所示,在步骤S403、S404,输出部件34上显示界面40。界面40中显示含光点的细胞数、有Her2基因扩增的细胞(CTC)数、以及含光点细胞的图像。操作者参照细胞数就可以知道是否发生了Her2基因扩增,从而可以提供帮助医生等决定最佳治疗药物的有用信息。
横向并列的四幅图像是关于同一个粒子的图像。四幅图像从左侧起依次为标记17号染色体基因的色素所造成的荧光的图像41、标记Her2基因的色素所造成的荧光的图像42、染色细胞核的色素所造成的荧光的图像43、及合并(merge)图像41~43所得到的图像44。图像41~44是灰度变换(gradation)后转换为灰度图(gray scale)所得到的。
图7(a)所示粒子图像是无Her2基因扩增的细胞图像,图7(b)所示粒子图像是有Her2基因扩增的乳腺癌细胞图像。当有数个含光点的粒子图像时,操作人员可以在界面40上切换显示粒子图像。界面40上也可以另外设置能够分别显示有Her2基因扩增的细胞图像和无Her2基因扩增的细胞图像的按钮等。
图像41的光点数表示17号染色体的基因数。图像42的光点数表示Her2基因的数量。图像43的光点表示细胞核。以此,操作人员实际参照图像就能知道细胞核内是否存在17号染色体的基因和Her2基因。而且,如果无Her2基因扩增,则如图7(a)所示,图像41、42的光点为2个,如果有Her2基因扩增,则如图7(b)所示,图像41的光点为2个,图像42的光点为多于2个的数目。由此,操作人员实际参照图像就能知道是否发生了Her2基因的扩增。
也可以通过对在CTC中表达的EpCAM抗原有特异性且与磁性流体粒子结合了的抗体来对表达EpCAM抗原的CTC进行磁标记。如此磁标记CTC时,要对装有测定试样的样室施加磁场梯度(magnetic field gradient)。如此,磁标记的CTC排列在样室的观察表面,因此对观察表面进行观测就能检测出有无CTC。然而,有的CTC不表达EpCAM抗原,以此方法可能会漏掉不表达EpCAM抗原的CTC。在实施方式1,根据粒子拍摄部件28拍摄的图像来判断有无Her2基因扩增,判断是否为CTC。因此,采取实施方式1可以降低漏掉CTC的可能性。
(实施方式2)
如图8所示,实施方式2与实施方式1相比,粒子拍摄部件28还包括聚光镜141和照相机142,分色镜104、123~125的功能发生了改变。细胞检测装置10的其他结构与实施方式1相同。
实施方式2的分色镜104使波长λ1的前向散射光中的一半被反射,一半被透射。检测位置20a的粒子产生的波长λ1的前向散射光中,一半被分色镜104反射,一半透射过分色镜104,并透射过分色镜123~125。聚光镜141聚集波长λ1的前向散射光。照相机142接受波长λ1的前向散射光,并输出位于检测位置20a的粒子的图像信息作为拍摄信号。关于控制部件31,从归还流路23将拍摄用试样归还到流动室17时,若根据第一检测器108a接受的前向散射光强度判断粒子位于检测位置20a,则根据照相机142输出的拍摄信号生成明场图像。
在实施方式2中,在图6(b)的步骤S403、S404,在输出部件34上显示图9(a)、(b)所示界面40。图9(a)、(b)所示界面40中除了图7(a)、(b) 所示图像41~44外,还显示了明场图像45。在实施方式2中,操作人员可以在图像41~44的基础上再参照图像45,以此就能确认细胞的种类等。
(实施方式3)
如图10所示,实施方式3与实施方式1相比,粒子检测部件20的结构不同。在实施方式3,使用光学单元151、聚光镜152和照相机153作为检测波长λ1的前向散射光和波长λ2的荧光的结构。细胞检测装置10的其他结构与实施方式1相同。
光学单元151具有由2片分色镜组合而成的结构。光学单元151的2片分色镜以相互略微不同的角度反射波长λ1的前向散射光和波长λ2的荧光,并在后述照相机153的受光面153a上使其分离。光学单元151透射波长λ4、λ5、λ6的荧光。聚光镜152聚集波长λ1的前向散射光和波长λ2的荧光。照相机153接受波长λ1的前向散射光和波长λ2的荧光,并输出位于检测位置20a的粒子的图像信息作为拍摄信号。
如图11所示,照相机153在受光面153a上的区域161、162分别接受波长λ1的前向散射光和波长λ2的荧光。受光面153a是配备在照相机153的CMOS图像传感器等拍摄元件的受光面。照射到受光面153a的光的位置随着粒子在流路17a移动而如箭头所示,分别在区域161、162内移动。如此,通过光学单元151,二种光在受光面153a上分离,所以控制部件31可以从照相机153输出的拍摄信号提取与各光对应的信号。
获取波长λ1的前向散射光强度和波长λ2的荧光强度时,控制部件31加上从区域161输出的信号,获取波长λ1的前向散射光强度,加上从区域162输出的信号获取波长λ2的荧光强度。控制部件31在图5(a)的步骤S103检测粒子时参考获取的各强度。获取粒子图像时,控制部件31与上述同样地获取前向散射光的强度,图6(a)的步骤S304判断粒子是否位于检测位置20a时,参考获取的强度。此时,控制部件31同时处理来自区域161的图像信号,生成粒子的明场图像。控制部件31与图9(a)、(b)同样地显示生成的明场图像。
明场图像显示在输出部件34时,与实施方式2同样地,操作人员会一并参照明场图像,由此即可确认细胞的种类等。粒子检测部件20也可以具有分别个别地接受波长λ1的前向散射光和波长λ2的荧光的照相机,以此取代照相机153。
(实施方式4)
如图12所示,实施方式4与实施方式3相比省略了分色镜123~125、聚光镜126~128及照相机129~131,光学单元151的结构发生了变化。照相机153的受光面上还追加了后述区域163、164、165。细胞检测装置10的其他结构与实施方式3相同。
光学单元151具有由5片分色镜组合而成的结构。光学单元151的5片分色镜以相互略微不同的角度反射波长λ1的前向散射光和波长λ2、λ4~λ6的荧光,并在照相机153的受光面153a上使其分离。聚光镜152聚集波长λ1的前向散射光和波长λ2、λ4~λ6的荧光。照相机153接受波长λ1的前向散射光和波长λ2、λ4~λ6的荧光,其输出位于检测位置20a的粒子的图像信息作为拍摄信号。
如图13所示,照相机153在受光面153a上的区域161~165分别接受波长λ1的前向散射光和波长λ2、λ4~λ6的荧光。如此,通过光学单元151,五种光在受光面153a上被分离,所以控制部件31可以从照相机153输出的拍摄信号提取与各光对应的信号。基于来自区域161、162的信号的处理与实施方式3相同。从归还流路23向流动室17归还了拍摄用试样后,如果判断粒子位于检测位置20a,则控制部件31根据照相机153输出的拍摄信号,生成与照射到区域161的前向散射光相应的明场图像和与照射到区域163~165的荧光相应的图像。
实施方式4比实施方式3省略了粒子拍摄部件28的照相机129~131,粒子检测部件20的照相机153在粒子拍摄部件28的拍摄中是共用的。因此,细胞检测装置10的结构能比实施方式3更简化。
(实施方式5)
如图14(a)所示,实施方式5与实施方式1相比追加了回收流路51、阀52、隔膜泵53、回收部件54。细胞检测装置10的其他结构与实施方式1相同。
回收流路51连接中间存放部件25与阀26之间的归还流路23和回收部件54。回收流路51上配置有阀52和隔膜泵53。隔膜泵53能够向回收流路51施加正压和负压。隔膜泵53被负压驱动,则存放在中间存放部件25的浓缩后拍摄用试样被吸入隔膜泵53内。隔膜泵53被正压驱动时,吸入隔膜泵53的拍摄用试样送到回收部件54。
如图14(b)所示,实施方式5与实施方式1相比,在图4的处理中,追加了步骤S11、S12来取代步骤S3。
在步骤S11,控制部件31进行拍摄处理。具体而言,控制部件31同时开始进行后述图15所示处理和图5(b)所示处理。以此,中间存放部件25浓缩的拍摄用试样再次供应到流动室17。然后,再次供应到流动室17的拍摄用试样所含粒子由粒子拍摄部件28进行拍摄,只有根据拍摄的图像被判断为CTC的粒子才再次送到归还流路23并存放在中间存放部件25,除此之外的粒子被送到废液存放部件22。在步骤S12,控制部件31进行浓缩处理和回收处理。以此浓缩存放在中间存放部件25的拍摄用试样。然后,经浓缩的拍摄用试样送到回收部件54,被回收部件54回收。在步骤S12也可以不进行浓缩,使拍摄用试样回收到回收部件54。
在图15的处理中,与图6(a)所示处理相比,在步骤S305后段追加了步骤S311、S312。
在步骤S311,控制部件31分析在步骤S305生成的图像,判断此图像所示粒子。具体而言,控制部件31判断图像所示粒子是否为细胞核内含有基于17号染色体的2个光点和基于Her2基因的3个以上光点的细胞,即是否为CTC。在步骤S312,控制部件31判断粒子是CTC时,存储此粒子通过检测位置20a的时间。
被判断为CTC的粒子在图5(b)所示处理中由粒子分类部件21送到归还流路23。以此,当判断为CTC的粒子全部送到归还流路23,含有这些粒子的拍摄用试样由中间存放部件25浓缩后,回收到回收部件54。如此,判断为CTC的粒子回收到回收部件54后,操作人员可以对判断为CTC的粒子在显微镜下进行观察等,进行诊断。
控制部件31也可以进行如下处理:将从归还流路23归还、由粒子拍摄部件28拍摄的拍摄用试样全部送到归还流路23。此时,粒子拍摄部件28所拍摄的、送入归还流路23的拍摄用试样由中间存放部件25浓缩后,回收到回收部件54。于是,操作人员可以在显微镜下确认拍摄的全部粒子。
(实施方式6)
如图16(a)所示,实施方式6与实施方式1相比,变速部件19还具有流路19f、阀19g、孔19h。细胞检测装置10的其他结构与实施方式1相同。
流路19f在连接鞘液供应部件18与流动室17的流路中与流路19a、19b并列配置。流路19f上配置有阀19g和孔19h。流路19f的截面直径与流路19a、19b的截面直径相同。孔19h的截面直径比流路19f的截面直径小,比孔19e的截面直径大。当只有阀19g打开时,从鞘液供应部件18送出的鞘液通过流路19f供应到流动室17。
在此,鞘液通过流路19f时供应到流动室17的鞘液每单位时间的流量设为V3,由于孔19h,V3小于V1,大于V2。因此,供应到流动室17的鞘液每单位时间的流量为V1、V3、V2时,测定试样流过流路17a的速度分别设为第一速度、第二速度、第三速度,则第二速度低于第一速度,高于第三速度。
如图16(b)所示,实施方式6与实施方式1相比,在图4的处理中追加了步骤S21~S23来取代步骤S3。
在步骤S21,控制部件31进行拍摄处理。具体而言,控制部件31同时开始图15所示处理和图5(b)所示处理。以此,中间存放部件25浓缩的拍摄用试样再次供应到流动室17。再次供应到流动室17的拍摄用试样中所含粒子由粒子拍摄部件28拍摄。只有根据拍摄的图像被判断为CTC的粒子送到归还流路23,除此之外的其他粒子送到废液存放部件22。
在步骤S22,控制部件31通过中间存放部件25浓缩仅含有被判断为CTC的粒子的拍摄用试样。在步骤S23,控制部件31进行拍摄处理。具体而言,控制部件31开始图17所示处理。以此,中间存放部件25浓缩的拍摄用试样再次供应到流动室17。再次供应到流动室17的拍摄用试样中所含粒子由粒子拍摄部件28拍摄。在步骤S23拍摄的拍摄用试样送入废液存放部件22。在步骤S23拍摄的拍摄用试样也可以由图14(a)所示回收部件回收。
在图17所示处理中,与图6(a)所示处理相比,追加了步骤S321来取代步骤S301。在步骤S321,控制部件31使中间存放部件25浓缩的拍摄用试样以低于第二速度的第三速度流入流动室17。
如此,在第二次循环中被判断为CTC的粒子在第三次循环中以更低的速度流入流动室17,所以能够仅对判断为CTC的粒子以高分辨率拍摄。在第三次循环的拍摄作业之前,在第二次循环中高速进行CTC判断,排除CTC以外的粒子。如此,即使在第三次循环中低速拍摄,也可以使整体的处理时间维持在较短水平。
也可以使操作人员能够设定是否以第三速度进行拍摄。若不以第三速度拍摄,就以第二速度拍摄。也可以根据第二速度进行拍摄的分析结果,由控制部件31决定是否以第三速度拍摄。在此结构中,控制部件31决定不以第三速度拍摄时,例如与实施方式5同样地,将图16(b)步骤S22浓缩的拍摄用试样回收到回收部件54。让测定试样和拍摄用试样流入流动室17的速度也可以是四级以上。
(实施方式7)
受检细胞不限于CTC。在病情判断和用药决策中,拍摄和检测如循环内皮细胞(CEC:Circulating Endothelial Cell)、血管内皮祖细胞(EPC:Endothelial Progenitor Cell)、间充质干细胞(MSC:Mesenchymal Stem Cell)、造血干细胞(HSC:Hematopoietic Stem Cell)或抗原特异性T细胞等也很有效。让荧光标记的抗体对在这些细胞上表达的表面抗原特异性结合,以此就能检测出来这些细胞。受检细胞与实施方式1同样地通过分析粒子拍摄部件28拍摄的拍摄图像来进行检测。
在实施方式7中,还通过确认受检细胞所含信号分子的细胞内的状态来判断受检细胞的活性状态。信号分子是能够根据其举动来评价受检细胞功能性的分子。荧光标记的抗体特异性地结合在信号分子上,以此检测信号分子。确认检测出的信号分子状态,以此判断受检细胞的活性状态等。信号分子的检测和活性状态等的判断均通过分析粒子拍摄部件28拍摄的图像来实现。
用于荧光标记受检细胞和信号分子的色素可以使用实施方式1例示的色素,也可以使用其他色素。根据用于荧光标记的抗体和色素来变换制备测定试样中使用的试剂。激发这些色素的光的波长可以如实施方式1所示为单一波长,或者也可以是不同波长。使各色素激发荧光的波长相互不同时,例如,图2所示光源121采用多光激光器。
在实施方式7也与实施方式1同样地首先通过图5(a)、(b)的流程图进行受检细胞的分类。
受检细胞为循环内皮细胞、血管内皮祖细胞或间充质干细胞时,在制备测定试样时,将一定试剂混入样本。在此混合的试剂是溶解红细胞的试剂、含检测白细胞用CD45的标记抗体的试剂、含与在受检细胞表达的表面抗原特异性结合并被色素荧光标记的抗体的试剂、含与信号分子特异性结合且被色素荧光标记的抗体的试剂、以及染色细胞核的试剂。与实施方式1同样地,溶解红细胞的试剂也可以省略。
在图5(a)的步骤S103,控制部件31进行与实施方式1同样的处理。当荧光强度在一定阈值以下且前向散射光强度在一定阈值以上时,控制部件31判断检测位置20a的粒子为受检细胞—即循环内皮细胞、血管内皮祖细胞或间充质干细胞的可能性很高。当粒子是受检细胞时,粒子不与CD45的标记抗体结合,所以荧光强度在一定值以下。在步骤S103,当粒子是白细胞以外的粒子且粒子尺寸很大时,控制部件31判断粒子为受检细胞—即循环内皮细胞、血管内皮祖细胞或间充质干细胞的可能性很高。
当受检细胞是造血干细胞时,在制备测定试样时将一定试剂混入样本。在此混合的试剂是溶解红细胞的试剂、含检测从造血干细胞分化的全部血细胞用标记抗体的试剂、含与在造血干细胞表达的表面抗原特异性结合且被色素荧光标记的抗体的试剂、含与造血干细胞中信号分子特异性结合且被色素荧光标记的抗体的试剂、以及染色细胞核的试剂。含检测从造血干细胞分化的全部血细胞用的标记抗体的试剂一般称为谱系标记物(lineage marker)。在此,谱系标记物的各抗体用同一色素标记。与实施方式1同样地,溶解红细胞的试剂也可以省略。
在图5(a)的步骤S103,当荧光强度在一定阈值以下且前向散射光强度在一定阈值以上时,控制部件31判断检测位置20a的粒子是受检细胞—即造血干细胞的可能性很高。当粒子是受检细胞时,粒子不与谱系标记物(lineage marker)结合,所以荧光强度在一定值以下。此外,造血干细胞比从造血干细胞分化出来的其他所有血细胞都要大。因此,在步骤S103,当荧光强度在一定阈值以下且前向散射光强度在一定阈值以上时,检测位置20a的粒子是造血干细胞的可能性很高。
当受检细胞是抗原特异性T细胞时,在制备测定试样时将一定试剂混入样本。在此混合的试剂是溶解红细胞的试剂、从谱系标记物除去了CD2和CD3的抗体的试剂、含与在T细胞表达的表面抗原特异性结合的CD3的标记抗体的试剂、含与在T细胞中的抗原特异性T细胞中表达的表面抗原特异性结合、且被色素标记的MHC四聚物(MHC Tetramer)的试剂、含与抗原特异性T细胞中的信号分子特异性结合且被色素荧光标记的抗体的试剂、以及染色细胞核的试剂。在此,从谱系标记物中除去CD2和CD3后的抗体用同一色素标记。与实施方式1一样,溶解红细胞的试剂也可以省略。
在图5(a)的步骤S103,当荧光强度在一定阈值以下时,控制部件31判断检测位置20a的粒子是T细胞的可能性很高。当粒子是T细胞时,粒子不与谱系标记物结合,所以荧光强度在一定值以下。因此,在步骤S104,当荧光强度在一定阈值以下时,检测位置20a的粒子是T细胞的可能性很高。
如此,对于已经判断了是否很可能为受检细胞的粒子,控制部件31进行图5(b)的处理。据此被判断为很可能是受检细胞的粒子通过流路17c送入归还流路23。然后,控制部件31通过中间存放部件25进行浓缩,并将拍摄用试样再次供应到流动室17,进行图6(a)的处理,依次对很可能是受检细胞的粒子进行拍摄。
通过以上处理,控制部件31生成很可能是受检细胞—即循环内皮细胞、血管内皮祖细胞、间充质干细胞、造血干细胞或抗原特异性T细胞的粒子图像。生成的图像中包括与在受检细胞表达的表面抗原特异性结合的标记抗体的荧光图像、以及与受检细胞中信号分子特异性结合的标记抗体的荧光图像。照相机129~131接受各标记抗体产生的不同波长的荧光,输出各荧光的图像信息。当采用图8的结构时,根据来自照相机142的拍摄信号进一步生成粒子的明场图像。
当拍摄处理结束后,操作人员通过输入部件33向细胞检测装置10输入显示结果的指示。
如图18所示,当操作人员输入显示结果的指示,且在步骤S411判断为是时,在步骤S412,控制部件31对拍摄的所有粒子图像进行图像分析,提取受检细胞。
受检细胞为循环内皮细胞、血管内皮祖细胞、间充质干细胞或造血干细胞时,控制部件31在步骤S412就每个粒子参照与在受检细胞表达的抗体特异性结合的标记色素的图像,判断该图像中是否包含超过一定强度的荧光的区域。当图像中包括荧光区域时,控制部件31判断对象粒子是受检细胞。
当受检细胞为抗原特异性T细胞时,控制部件31在步骤S412首先就每个粒子参照与在T细胞表达的抗体特异性结合的CD3的标记色素的图像,判断该图像中是否包含超过一定强度的荧光的区域。当图像中包括荧光区域时,控制部件31判断判断对象粒子是T细胞。此外,就判断为T细胞的各粒子,控制部件31分别参照与在抗原特异性T细胞表达的表面抗原结合的MHC四聚物的标记色素图像,判断此图像中是否包含超过一定强度的荧光的区域。当图像中包括荧光区域时,控制部件31判断判断对象粒子是抗原特异性T细胞。
在步骤S413,控制部件31分析提取的受检细胞图像,判断各细胞有无活性,提取有活性的受检细胞。在此,控制部件31参照与信号分子特异性结合的标记色素的图像,检测细胞内的信号分子的状态。控制部件31根据检测出的信号分子的状态,判断受检细胞有无活性。
例如,当受检细胞是循环内皮细胞(CEC)时,信号分子可以为NFκB。在步骤S413,控制部件31根据作为信号分子的NFκB是否局部存在于细胞核内来判断循环内皮细胞有无活性。循环内皮细胞从血管内壁剥落并流入血液中。除炎症的刺激外,由于压迫等造成的压力变化也会导致循环内皮细胞剥落。控制部件31根据作为信号分子的NFκB是否局部存在于细胞核内来判断上述剥落原因中由炎症刺激所造成的剥落。控制部件31将因炎症刺激而剥落的循环内皮细胞作为有活性的循环内皮细胞提取出来。
如图19(a)所示,因炎症刺激而剥落的循环内皮细胞具有NFκB在细胞核内局部存在的倾向。图19(a)左图中显示了细胞核的荧光图像。图19(a)左图中为方便用虚线表示细胞核轮廓。图19(a)右图中显示了作为信号分子的NFκB的荧光图像,与左图细胞核相应的区域也用虚线表示。图19(a)的左图和右图中,越接近黑色就分别表示来自细胞核的荧光和来自NFκB的荧光强度越高。根据图19(a)例示,可以知道作为信号分子的NFκB局部存在于细胞核内。
在图19(b)例示中,作为信号分子的NFκB并没有局部存在于细胞核内。在图19(b)的右图中,虚线区域为细胞核的区域。如此,因炎症刺激以外的刺激而剥落的循环内皮细胞中,存在NFκB不局部存在于细胞核内的倾向。控制部件31分析信号分子的荧光图像,根据作为信号分子的NFκB是否局部存在于细胞核内来判断循环内皮细胞有无活性。
当受检细胞为血管内皮祖细胞、间充质干细胞、造血干细胞或抗原特异性T细胞时也同样地,控制部件31根据信号分子局部存在的位置评价这些细胞的功能性,提取因损伤等原因而增加的细胞作为有活性的细胞。比如,当受检细胞为血管内皮祖细胞或间充质干细胞时,控制部件31根据信号分子局部存在的位置来评价这些细胞的修复功能,将修复功能强的细胞作为有活性的细胞提取出来。
评价受检细胞功能性不一定要依据信号分子局部存在的位置,也可以根据其他因素进行评价。可以根据评价功能性所使用的因素,适当变更信号分子的种类。
返回图18,在步骤S414,控制部件31在输出部件34上显示在步骤S412、S413提取的受检细胞数量、以及有活性的受检细胞数量。在步骤S415,控制部件31在输出部件34上显示受检细胞的图像。比如当受检细胞是循环内皮细胞(CEC)时,在步骤S414、S415,输出部件34上显示图20(a)、(b)所示界面60。
界面60上显示循环内皮细胞(CEC)数量、有活性的循环内皮细胞(CEC)数量、以及循环内皮细胞(CEC)的图像。操作人员参照循环内皮细胞(CEC)数量就可以知道血液中循环内皮细胞是否增加。此外,参照有活性的循环内皮细胞(CEC)数量就可以掌握处于活性状态的循环内皮细胞比例。这些信息可以作为医生等决定治疗方针的辅助信息。
横向并列的二幅图像是同一粒子的图像。图像61是与细胞核特异性结合的标记抗体所产生的荧光的图像,图像62是与信号分子特异性结合的标记抗体产生的荧光的图像。如上所述,信号分子是循环内皮细胞中所含蛋白质NFκB。检测循环内皮细胞时要使用与在循环内皮细胞表达的抗原特异性结合的CD146的标记抗体。图像61、62是灰度变换(gradation)后转换为灰度图(gray scale)所得到的。界面60中除了图像61、62之外还可以包括明场图像。
图20(a)所示粒子的图像是有活性的循环内皮细胞的图像,图20(b)所示粒子的图像是无活性的循环内皮细胞的图像。当有数张循环内皮细胞粒子的图像时,操作人员可以在界面60上切换显示粒子图像。界面60上也可以另外设置能够分别显示有活性的循环内皮细胞的图像和无活性的循环内皮细胞的图像的按钮等。
在实施方式7,除了CTC外,还获取循环内皮细胞、血管内皮祖细胞、间充质干细胞、造血干细胞或抗原特异性T细胞等的、在判断病情和确认用药上有用的细胞的图像,这些细胞的图像与提取的细胞数量一起根据操作人员要求显示出来。医生等可以将显示的信息用于决定治疗方针。
例如,心肌梗塞和脑梗塞的患者的循环内皮细胞比健康人多。此外,组织有损伤,则血管内皮祖细胞和间充质干细胞数量与健康人相比有所增加。因此,医生等通过掌握这些细胞的数量就能掌握患者患心肌梗塞等疾病的可能性、及患者组织受损的可能性。
在实施方式7,根据信号分子的反应来检测并显示循环内皮细胞、血管内皮祖细胞、间充质干细胞、造血干细胞或抗原特异性T细胞的活性状态。如此,进一步显示受检细胞的活性状态,可以进一步提高受检细胞检测结果的特异性。
例如,当受检细胞为循环内皮细胞时,如图20(a)、(b)所示,与循环内皮细胞(CEC)数量一起显示有活性的循环内皮细胞(CEC)数量。据此,医生等可以准确掌握因炎症刺激而剥落的循环内皮细胞数量,能够更确切地掌握患者患心肌梗塞等疾病的可能性。最近,对特定抗原有应答的T细胞被用于免疫疗法。比如有一种目前正在试行的治疗方法,即将可对癌细胞特异性应答的T细胞输回血液中,监测其作用。根据实施方式7,在这种监测中,可以通过细胞数和图像向医生等提示抗原特异性T细胞的活性状态。据此,医生等可以确认此免疫治疗的效果。
(实施方式8)
在实施方式8,被判断为CTC的粒子和被判断为CEC的粒子被回收。在实施方式8中,在制备测定试样时,与实施方式1相比,还混入了在实施方式7所示的CEC的检测用试剂。在实施方式8,光源121射出二种波长的光用以分别拍摄CTC和CEC。
如图21所示,在实施方式8,与实施方式1相比,流动室17还具有回收出口174,其内部还具有流路17e。流路17e在流路17a与流路17b之间从流路17a分岔,连接到回收出口174。粒子分类部件21还具有部件21b和21c。细胞检测装置10还具有回收流路71、阀72、中间存放部件73、阀74和75、隔膜泵76和77、回收部件78和79。回收流路71与流动室17的回收出口174连接。细胞检测装置10的其他结构与实施方式1相同。
粒子分类部件21分别使部件21b、21c向流路17c、17e突出。部件21a位于打开流路17b的位置时,在分岔位置17d的粒子经流路17b送到废液存放部件22。部件21b位于打开流路17c的位置,部件21a、部件21c分别位于堵塞流路17b、17e的位置时,在分岔位置17d的粒子经流路17c送到归还流路23。部件21c位于打开流路17e的位置,部件21a、21b分别位于堵塞流路17b、17c的位置时,在分岔位置17d的粒子经流路17e送到回收流路71。
如图22所示,操作人员输入开始指示后,在步骤S31,控制部件31进行检测处理。以此试样容器10b的测定试样供应到流动室17,此测定试样中所含粒子由粒子检测部件20检测出来。根据受光部件108接受的前向散射光和荧光,判断位于检测位置20a的粒子是否很可能是CTC或CEC。具体而言,如果波长λ2的荧光强度在一定阈值以下且波长λ1的前向散射光强度在一定阈值以上,则控制部件31判断检测位置20a的粒子很可能是CTC或CEC。
很可能是CTC或CEC的粒子经流路17c送到归还流路23。除此之外的其他粒子经流路17b送到废液存放部件22。在步骤S32,控制部件31将送到归还流路23的拍摄用试样通过中间存放部件25进行浓缩。
在步骤S33,控制部件31进行拍摄处理。以此,通过中间存放部件25浓缩的拍摄用试样再次供应到流动室17,此拍摄用试样中所含粒子由粒子拍摄部件28拍摄。此时,光源121射出用于拍摄CTC的波长的光。根据粒子拍摄部件28所获取的荧光图像,判断粒子是否为CTC。被判断为CTC的粒子经流路17e送到回收流路71,被判断为不是CTC的粒子经流路17c送入归还流路23。
在步骤S34,控制部件31用中间存放部件73对送到回收流路71的拍摄用试样进行浓缩处理,中间存放部件73所浓缩的拍摄用试样回收到回收部件78。以此,被判断为CTC的粒子回收到回收部件78。另一方面,在步骤S35,控制部件31用中间存放部件25浓缩送到归还流路23的拍摄用试样。
在步骤S36,控制部件31进行拍摄处理。以此,中间存放部件25所浓缩的拍摄用试样再次供应到流动室17,此拍摄用试样中所含粒子由粒子拍摄部件28拍摄。此时,光源121射出用于拍摄CEC的波长的光。根据粒子拍摄部件28所获取的荧光图像,判断粒子是否为CEC。被判断为CEC的粒子经流路17e送到回收流路71,被判断为不是CEC的粒子经流路17b送入废液存放部件22。
在步骤S37,控制部件31用中间存放部件73对送到回收流路71的拍摄用试样进行浓缩处理,经中间存放部件73浓缩的拍摄用试样回收到回收部件79。以此,被判断为CEC的粒子回收到回收部件79。
在实施方式8,细胞检测装置10进行一次作业就能获取CTC图像和CEC图像,还可以分别回收CTC和CEC。以此,与CTC的拍摄和回收、以及CEC的拍摄和回收分别进行的情况相比,可以节省操作人员的作业,缩短处理所需时间。回收的粒子不限于CTC和CEC,也可以是EPC等其他粒子。
- 还没有人留言评论。精彩留言会获得点赞!