以三重改性的TiO2纳米线阵列为支架的电化学免疫传感器的构建方法与流程
本发明属于电化学免疫传感器构建技术领域,具体涉及一种以三重改性的TiO2纳米线阵列为支架的电化学免疫传感器的构建方法,该电化学免疫传感器可用于检测癌胚抗原。
背景技术:
:
准确、灵敏地检测肿瘤标志物对癌症的筛选、诊断和治疗都起着至关重要的作用。癌胚抗原(carcinoembryonic antigen,CEA)是大肠癌组织产生的一种糖蛋白,是一个广谱性肿瘤标志物,它能向人们反映出多种肿瘤的存在,对大肠癌、乳腺癌和肺癌的疗效判断、病情发展监测和愈后健康评估非常重要, 97%的健康成人血清CEA浓度在2.5 ng mI-1以下。许多免疫分析法,包括荧光免疫分析、电化学酶免疫分析、化学发光免疫分析、酶联免疫吸附法等均被广泛用于检测肿瘤标记物。在众多免疫分析法中,电化学免疫分析法具有快速、有效和灵敏等特点。
随着纳米科学与技术的飞速发展,各种各样的纳米材料,包括碳纳米材料、石墨烯、二氧化硅、量子点、贵金属等被广泛应用于免疫传感器中以提高其分析性能。在众多纳米材料中,TiO2纳米材料由于其优良的化学稳定性、优异的生物相容性、比表面积大、机械性能好、合成方法简便以及环境友好性等优点吸引了广泛的关注。尤其是一维TiO2纳米结构,如TiO2纳米管,被广泛用于光电化学和电化学免疫传感器。Zhi-Da Gao等人用TiO2纳米管阵列为传感器支架,用辣根过氧化物酶标记的信号抗体-Au纳米颗粒作信号探针来检测免疫球蛋白浓度。由于TiO2纳米管的显著管状特征——大的表面积和内部空间,此免疫传感器与其他普通平板电极相比,性能得到有效增强。其对兔免疫球蛋白的浓度线性范围为0.1—105 ng mL-1,检测限为0.01 ng mL-1。
尽管有大量的研究关注TiO2纳米线阵列的光电化学性能,但可能由于其导电性较差、比表面积相对较小的缺点,限制了电子转移和生物分子的负载量,因而很少有人将其用于电化学传感器的制备。值得注意的是,据报道,化学掺杂金属离子作为一种高效的方法可以促进TiO2等半导体纳米材料的电荷分离和导电性。例如 Wang等人通过水热法制备了W掺杂的TiO2核-壳纳米线阵列。在刻蚀/再生长过程中,W元素被掺杂入TiO2壳内以提高其光电性能。而且电化学阻抗结果还表明W掺杂后,TiO2纳米线阵列导电性显著增强。
石墨烯在不同领域的成功应用激发起了制备类似纳米材料的研究兴趣。据报道,MoS2包含一个Mo金属层和两个S层,Mo金属层通过范德华力夹在两个S层之间。由于其独特的几何结构,MoS2成为典型的石墨烯类似物之一。重要的是,MoS2具有与石墨烯近似的优良性能,如优异的电子性能、特殊的光学特性、优良的机械性能以及表面易修饰特点。尽管MoS2在很多领域如晶体管、燃料电池、储能等都得到了广泛应用,但其在电化学传感器方面的应用还很有限。Vasilescu等人制备了一种由MoS2和石墨烯量子点构成的纳米材料用于负载酶分子。碳基丝网印刷电极的导电性在修饰MoS2-石墨烯量子点后大大增强,同时也为漆酶提供了一个生物相容性支架。该漆酶生物传感器对咖啡酸在浓度范围0.38-100 uM内有很好的响应,其检测限为0.32μM,灵敏度为17.92 nA uM-1。
BS3是一种双氨基交联剂,具有水溶性、非裂解性、膜不渗透性等特点,它含有一个末端氨基反应基团(Sulfo-NHS酯基),可与任何含有伯胺基团的分子反应。因此,其广泛应用于生物分子的交联。
本发明通过两步水热反应制备了三重修饰的TiO2纳米线阵列。具体来说,第一步水热反应制备出TiO2纳米线阵列;第二步实现了同时“刻蚀、掺杂和沉积”,MoS2片沉积在刻蚀/掺杂过的TiO2纳米线阵列表面。然后将壳聚糖溶液滴加在改性后的TiO2纳米线阵列表面,以BS3为氨基交联剂将捕获抗体Ab1共价结合在其表面。水热法还被用于制备圆柱形TiO2纳米柱,BS3也被用于结合HRP和信号抗体以制备示踪标记物。三重改性后的TiO2纳米线阵列的多项性能得到显著提高,并被用作一种新型免疫传感器平台支架。其优点包括:首先,刻蚀加上Mo掺杂有助于促进电子转移,增强导电性;另外,二维薄层MoS2片的沉积不仅能增强导电性,而且能增强电极比表面积,有助于吸附更多的生物分子。因而本发明所制备的新型免疫传感器支架具有优良的导电性,大的比表面积,有助于提高检测范围与灵敏度,目前还未见有相关报道。
技术实现要素:
:
本发明目的在于研制一种以三重改性的TiO2纳米线阵列为支架的电化学免疫传感器的构建方法,该电化学免疫传感器能够快速地测定癌胚抗原,且灵敏度较高、线性范围较大、检测限较低。
为实现上述目的,本发明采用如下技术方案:
一种以三重改性的TiO2纳米线阵列为支架的电化学免疫传感器的构建方法,其包括如下步骤:
①三重改性的TiO2纳米线阵列的制备:
TiO2纳米线阵列的制备:将13 mL 浓HCl用15 mL 去离子水稀释,室温下搅拌5 min,加入300μL钛酸丁酯后,继续搅拌15 min以得到澄清溶液;将所得澄清溶液与干净的FTO基片一起转移至反应釜内,在150℃下反应12 h;冷却至室温,取出FTO基片,用去离子水洗涤并在N2流下烘干,FTO基片上均匀覆盖一层白色薄膜,即为TiO2纳米线阵列;
TiO2纳米线阵列的同时“刻蚀、掺杂和沉积”:将30 mL超纯水、0.01 M 盐酸羟胺、 0.005 M 九水硫化钠、0.002 M二水钼酸钠、50μL聚乙二醇与上述制备得到的TiO2纳米线阵列一起置于反应釜内,250℃下反应24 h,冷却至室温,取出FTO基片,用去离子水洗涤并在N2流下烘干;观察到所得TiO2纳米线阵列上覆盖有一层黑色沉积物,即为MoS2纳米片,该FTO基片记为改性的FTO电极;
②信号抗体标记物的制备:
TiO2纳米柱的制备:将1.8 mL四氯化钛缓慢加入到含19 mL超纯水的烧杯中,冰水浴0-5℃下搅拌10 min获得白色悬浮液;再加入1.8 mL氯仿,继续搅拌10 min,然后转入反应釜内,160℃反应12h,冷却至室温,离心收集白色沉淀并洗涤至中性,然后60℃真空干燥12 h,即得TiO2纳米柱,室温下储存备用;
TiO2纳米柱的氨基化:将100 mg TiO2纳米柱置于含20 mL乙醇、1 mL 28%氨水和4 mL 3-氨丙基三乙氧基硅烷的混合液中,室温下搅拌12h以防止TiO2纳米柱沉降,然后离心分离,弃去上清液,所得白色沉淀物洗涤、干燥后,室温下储存备用,记为NH2-TiO2纳米柱;
辣根过氧化物酶︱氨基化TiO2纳米柱︱信号抗体Ab2生物共轭体的制备:将2 mg BS3溶解在1 mL PBS缓冲液中获得溶液A,然后将3 mg NH2-TiO2纳米柱分散于溶液A中,搅拌下加入300μL 2 mg·mL-1的辣根过氧化物酶水溶液并在室温下孵育30 min;然后加入20μL含0.5 mg·mL-1信号抗体Ab2的PBS缓冲液,4℃下搅拌8 h,离心分离,所得沉淀物用PBS缓冲液洗涤并用含2%牛血清蛋白的PBS缓冲液在室温下封闭30 min,最后用PBS缓冲液洗涤后,分散于1.0 mL含0.1% 牛血清蛋白的PBS缓冲液中,备用,记为HRP︱NH2- TiO2纳米柱︱Ab2;
②免疫传感器的构建:
首先,将30μL 0.3 wt% 的壳聚糖醋酸溶液滴加在改性的FTO电极表面,室温下自然晾干,然后滴加30μL含2 mg·mL-1 BS3的PBS缓冲液并在室温下孵育1 h,然后再滴加30μL 0.38 mg·mL-1 的捕获抗体Ab1,室温下孵育1 h,再在4℃、100%湿度饱和环境下孵育12h后,分别用洗涤缓冲液和PBS缓冲液洗涤,再用20μL封闭缓冲液孵育30 min,最后分别用洗涤缓冲液和PBS缓冲液洗涤3 min,4℃下储存备用。
具体的,步骤③中,所述洗涤缓冲液为:含0.05 %(w/v)Tween 20的PBS缓冲液(0.05 M,pH 7.0);所述封闭缓冲液为:含5 %(w/v)牛血清蛋白(BSA)的PBS缓冲液(0.05 M,pH 7.0)。
和现有技术相比,本发明方法的有益效果:
通过水热法制备了TiO2纳米线阵列,然后采用同时“刻蚀、掺杂和沉积”技术对其进行三重改性,在此改性过程中,Mo元素被成功掺杂入TiO2纳米线阵列,能有效提高电子传递速率;同时,二维薄层MoS2片被成功沉积于电极表面,不仅能增强导电性,还极大地提高了电极比表面积,有助于负载更多量的生物分子,从而提高该传感器的灵敏度。
附图说明:
图1为TiO2纳米线阵列、TiO2纳米柱的SEM图和TEM图,其中A和B分别为纯TiO2纳米线阵列的SEM平面图和截面图;C和D分别为不同放大倍数的三重改性后的TiO2纳米线阵列SEM平面图;E和F分别为TiO2纳米柱的SEM图和TEM图;
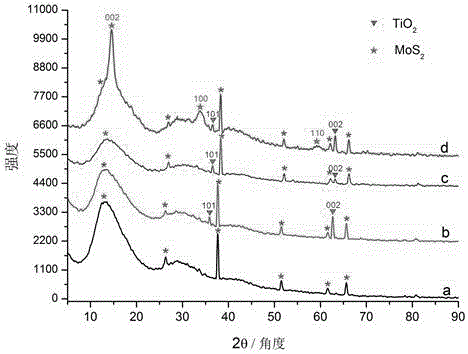
图2为不同材料的XRD图谱,其中a为FTO基片; b为纯TiO2纳米线阵列;c为在王水中浸泡24 h后除去表面MoS2后的只刻蚀/掺杂的TiO2纳米线阵列;d为三重改性后的TiO2纳米线阵列;
图3为奈奎斯特图,其中a为裸FTO基片;b为三重改性后的TiO2纳米线阵列;c为三重改性后的TiO2纳米线阵列︱壳聚糖︱BS3︱Ab1;d为三重改性后的TiO2纳米线阵列︱壳聚糖︱BS3︱Ab1︱BSA;e为三重改性后的TiO2纳米线阵列︱壳聚糖︱BS3︱Ab1︱BSA︱CEA︱标记的Ab2;f为纯TiO2纳米线阵列修饰的FTO基片;
图4为测试溶液的pH值对本发明免疫传感器电流响应的影响;
图5为CEA在电极表面培育时间对免疫传感器电流响应的影响;
图6为捕获抗体Ab1浓度的优化;
图7为不同干扰物对CEA测定的干扰;
图8为还原电流随CEA浓度增加的变化曲线。
具体实施方式:
以下结合实施例对本发明的技术方案作进一步地详细介绍,但本发明的保护范围并不局限于此。
下述实施例中,所用到的BS3购自西格玛奥德里奇有限公司,捕获抗体Ab1、信号抗体Ab2均购自成都双流正龙生化制品研究室。
实施例1:
一种以三重改性的TiO2纳米线阵列为支架的电化学免疫传感器的构建方法,其包括如下步骤:
①三重改性的TiO2纳米线阵列的制备:
TiO2纳米线阵列的制备:
合成前,先将几片FTO基片依次用丙酮、乙醇和超纯水洗涤,在N2流下烘干备用。将13 mL 浓HCl (37 wt %)用15 mL去离子水稀释,室温下搅拌5 min。然后加入300μL钛酸丁酯,继续搅拌15 min以得到澄清溶液。将所得澄清溶液与上述洗涤干净的FTO基片一起转移至50 mL聚四氟乙烯内衬的高压反应釜内,在150℃下反应12 h。冷却至室温,取出FTO基片,用去离子水洗涤并在N2流下烘干。FTO基片上均匀覆盖有一层白色薄膜,后被多种方法证明即为TiO2纳米线阵列。
TiO2纳米线阵列的同时“刻蚀、掺杂和沉积”:将30 mL超纯水、0.01 M 盐酸羟胺、0.005 M九水硫化钠、0.002 M二水钼酸钠、50μL聚乙二醇与上述所制备得到的TiO2纳米线阵列一起置于50 mL聚四氟乙烯内衬的高压反应釜内,250℃下反应24 h,冷却至室温,取出FTO基片,用去离子水洗涤并在N2流下烘干。观察到所得TiO2纳米线阵列上覆盖有一层黑色沉积物,后被多种方法证明即为MoS2纳米片,该FTO基片记为改性的FTO电极。
②信号抗体Ab2标记物的制备:
TiO2纳米柱的制备:将1.8 mL 四氯化钛缓慢加入到含19 mL超纯水的烧杯中,冰水浴0-5℃下强力搅拌10 min获得白色悬浮液;再加入1.8 mL 氯仿,继续搅拌10 min,然后转入聚四氟乙烯内衬的高压反应釜内,160℃ 反应12 h。冷却至室温,离心收集白色沉淀,分别用去离子水和无水乙醇洗涤至中性,然后60℃真空干燥12 h,即得TiO2纳米柱,室温下储存备用。
TiO2纳米柱的氨基化:将100 mg TiO2纳米柱置于含20 mL乙醇、1 mL 28%氨水和4 mL 3-氨丙基三乙氧基硅烷的混合液中,室温下搅拌过夜(12h)以防止TiO2纳米柱沉降。然后离心分离,弃去上清液,所得白色沉淀物洗涤、干燥后,室温下储存备用,记为NH2-TiO2纳米柱。
辣根过氧化物酶︱氨基化TiO2纳米柱︱信号抗体Ab2生物共轭体的制备:将2 mg BS3溶解在1 mL的磷酸盐(PBS,0.02 M)缓冲液中获得溶液A,然后将3 mg NH2-TiO2纳米柱分散于溶液A中,搅拌下加入300μL 2 mg·mL-1的辣根过氧化物酶水溶液并在室温下孵育30 min。然后加入20μL含0.5 mg·mL-1信号抗体Ab2的PBS缓冲液,4℃下搅拌8 h,离心分离,所得沉淀物用PBS缓冲液洗涤并用含2%牛血清蛋白的PBS缓冲液在室温下封闭30 min。最后用PBS缓冲液洗涤后,分散于1.0 mL含0.1%牛血清蛋白的PBS缓冲液中,备用,记为HRP︱NH2- TiO2纳米柱︱Ab2。
③免疫传感器的构建:
首先,将30μL 0.3 wt% 的壳聚糖醋酸溶液滴加在改性的FTO电极表面,室温下自然晾干,然后滴加30μL含2 mg·mL-1 BS3的PBS缓冲液并在室温下孵育1 h,然后再滴加30μL 0.38 mg·mL-1 的捕获抗体Ab1,室温下孵育1 h,再在4℃、100%湿度饱和环境下孵育过夜(12h)后,分别用洗涤缓冲液和PBS缓冲液洗涤,再用20μL封闭缓冲液孵育30 min,最后分别用洗涤缓冲液和PBS缓冲液洗涤3 min,4℃下储存备用。
步骤③中,所述洗涤缓冲液为:含0.05 %(w/v)Tween 20的PBS缓冲液(0.05 M,pH 7.0);所述封闭缓冲液为:含5 %(w/v)牛血清蛋白(BSA)的PBS缓冲液(0.05 M,pH 7.0)。
④测试过程:
为进行免疫反应和电化学测试,上述制备所得的电化学免疫传感器先用30μL不同浓度的CEA稀释液或血清样品在室温下孵育50 min,然后分别用洗涤缓冲液和PBS缓冲液洗涤1.5 min。再用30μL步骤②所得产物HRP︱NH2-TiO2纳米柱︱Ab2在室温下孵育60 min,并分别用洗涤缓冲液和PBS缓冲液洗涤3 min。随后,将该电化学免疫传感器、参比电极、对电极置于含5 mL PBS缓冲液的电化学电池中,接着将氢醌(终浓度2 mM)和过氧化氢(终浓度1 mM)注入此电池中,在加入过氧化氢前后分别在-0.2 V下进行时间-电流曲线扫描,以定量测定CEA。
SEM和TEM均用于表征TiO2纳米线阵列和TiO2纳米柱的形貌。如图1所示,纯TiO2纳米线阵列的SEM平面图(A)和SEM截面图(B)均表明水热反应后,FTO表面的白色薄膜是致密、垂直排列的纳米线阵列,它们拥有矩形横截面,其平均直径和长度分别约为150-180 nm和1.5-2μm。同时“刻蚀、掺杂、沉积”改性后,TiO2纳米线阵列表面覆盖了一层黑色沉积物,如SEM图(C),(D)所示,它们呈蜂窝型层状结构,其表面积很大,有助于进一步负载大量的生物分子。SEM和TEM图还用于表征所制备的TiO2纳米柱,如SEM图(E),TEM图(F)所示,所有TiO2纳米柱为圆柱形结构,其平均直径约为20 nm, 平均长度约为180 nm,这有助于生物分子的负载。
为表征TiO2纳米线阵列改性前后的晶型结构及组成,图2展示了它们的XRD图。图2 a展示了FTO基片的衍射峰并用星号标记以方便比较。图2 b为纯TiO2纳米线阵列的XRD图,其中在36.1°和 62.7°处的两个特征衍射峰分别对应四方金红石型TiO2的 (101) 和 (002) 晶面。三重改性后,如图2 d所示, TiO2纳米线阵列表面沉积的MoS2在14.5°、33.8° 和 59.5°处出现了三个明显的特征衍射峰,分别对应MoS2的 (002)、(100) 和 (110) 晶面。在王水中浸泡除去表面MoS2后,该刻蚀/掺杂的TiO2纳米线阵列的XRD图谱(图2 c)与纯TiO2纳米线阵列(图2 b)有相似的衍射峰。与纯TiO2纳米线阵列相比,所有衍射峰无明显偏移。
电化学阻抗(EIS)法监测免疫传感器的组装过程:
作为评估动力学过程和修饰电极界面性能的有效工具,电化学阻抗被用来监测本发明实施例1所制备用以检测CEA的电化学免疫传感器的组装过程。
阻抗实验是在含有0.1 M KCl电解质的5 mM K3[Fe︱CN)6]︱K4[Fe(CN)6]溶液中进行, 所施加直流电压为0.230 V,上面叠加5 mV的交流电压。阻抗实验都是在100 KHz~100 mHz频率范围内记录奈奎斯特图。图3中的所有奈奎斯特图在高频区均包含一个半圆,它对应电子转移阻力(Ret);在低频区呈现出一个直线部分,它对应扩散控制过程。半圆直径与修饰电极表面的铁氰化钾电子传递系数成反比,这为我们判断材料导电性提供了一个视觉判断标准。如图3所示,裸FTO电极(曲线a)呈现出一个很小的半圆,代表表面电阻很小,属于扩散控制过程。与此相反,纯TiO2纳米线阵列(曲线f)半径最大,表明TiO2导电性较差。但是,同时“刻蚀、掺杂、沉积”改性后,TiO2纳米线阵列(曲线b)明显减小,表明同时Mo-掺杂和MoS2沉积大大增强了TiO2纳米线阵列的导电性。在曲线c-e中,三重改性TiO2纳米线阵列电极依次被修饰上Ab1、BSA、和标记信号抗体Ab2,从图中可以看出,伴随着逐步修饰过程,半圆直径逐渐增加,这主要是由于蛋白质的低导电性和位阻效应,阻碍了电化学探针向电极表面的电子传递,同时也表明了各种材料被层层组装于电极表面。
电化学免疫传感器检测条件的优化:
测试溶液的pH值是影响酶传感器性能的一个重要因素,因为强酸和强碱环境均会破坏生物分子的活性。溶液pH对免疫传感器电流响应的影响如图4所示。电流响应值在pH 5.0-7.0范围内随着pH值的增加而快速增加,当pH超过7.0后,开始减小。因此,含0.10 M KCl的0.05 M PBS(pH 7.0)缓冲液被选作检测液用于检测AFP。
CEA在免疫传感器表面的培育时间是影响免疫传感器分析性能的另一个重要因素。在室温下,CEA免疫传感器的电流响应值随AFP培育时间的增加而显著增加,超过50 min后基本达到一个恒定值(如图5所示),这表明AFP与电极表面的捕获抗体Ab1的结合达到饱和。因此,将50 min选作此夹心型免疫分析的培育时间。
电极表面的捕获抗体Ab1浓度也进行了优化,如图6所示,刚开始CEA免疫传感器的电流响应值随Ab1浓度的增加而显著增加,当Ab1浓度超过0.38 mg mL-1后,电流响应值基本不变,甚至还略有减小,说明0.38 mg mL-1为Ab1浓度饱和值,超过后无法负载于电极表面,因此0.38 mg mL-1选定为捕获抗体Ab1的最佳浓度值。
定量检测CEA:
基于特异性夹心型免疫反应和H2O2为媒介的HRP催化反应,如下两反应式所示:
苯醌 + 2H+ + 2e− → 氢醌。
该CEA免疫传感器在优化条件下被用于定量检测CEA,如图7所示,加入H2O2后,该传感器电流迅速达到稳定,还原峰电流随CEA浓度的增加而增加。校准曲线(图7中的插图)显示峰电流与分析物浓度之间有良好的线性关系,线性范围为0.001 ng/mL 至 150 ng/mL,相关系数为0.996(n=4).在信噪比为3的条件下,CEA的检测限低至0.5 pg/mL,这比很多报道的免疫传感器均低。
重现性、选择性、稳定性测试:
为了探究此免疫传感器的准确度和重现性,本发明在相同条件下分别制备4根电极,在相同条件下进行分析测试,所得结果相对标准偏差(RSD)为 5.6 %,表明此免疫传感器具有良好的准确性和重现性。
为评估该免疫传感器的特异性,本发明引入了几种可能的干扰物,包括α-甲胎蛋白(AFP), 前列腺癌蛋白抗原(PSA),肿瘤抗原125(CA125),免疫球蛋白G(IgG)和牛血清蛋白(BSA)。此免疫传感器分别用含有上述其中一种干扰物(100 ng·mL-1)的1 ng·mL-1 CEA孵育。如图8所示,其中A为纯CEA不含干扰物,B,C,D,E,F分别为CEA与AFP,PSA,CA125,IgG,BSA的混合物。没有干扰物相比,由干扰物引起的电流变化小于5.2 %,这表明此免疫传感器具有良好的选择性。
此外,此免疫传感器的稳定性也通过测量它们在4℃条件下储存2周前后的电流响应进行了评估。结果表明,2周后90.7 %的电流响应得以保留,这表明此免疫传感器具有良好的稳定性。
- 还没有人留言评论。精彩留言会获得点赞!