一种快速检测硫离子的方法与流程
本发明属于化学检测领域,具体涉及一种快速检测硫离子的方法。
背景技术:
随着社会经济的发展及人类生产活动的加剧,环境污染已经严重威胁到人类赖以生存的环境和身体健康,尤其是含硫污染物的排放,不仅污染水土资源,污水中的硫离子在酸性环境中还易变成硫化氢气体,从而造成大气污染。
含硫污染物主要来源有三种:其一,工业生产过程中所排放的含硫废水,这些废水未经过处理便直接排放到河流湖泊中,造成严重的水污染,硫化物含量是我国饮用水及地表水检测项目最重要的指标之一,含硫量超标将会直接威胁人类的身体健康及水生植物的生存环境;其二,自然界的硫酸盐遇到厌氧菌之后,便会还原成硫离子,从而造成各种环境污染;其三,肉类腐烂过程中的含硫氨基酸会分解产生硫化氢这类恶臭性气体。硫化氢(H2S)是一种毒性很大的气体,具有刺激性和窒息性,也称之为神经毒气,如果人体摄入超标的的气体,会直接导致呼吸系统、循环系统、消化系统及中枢神经系统受到不同程度的损伤,严重情况下会直接致命;硫化氢在污染大气的同时,还会与大气中的臭氧(O3)发生氧化还原反应生成硫酸,这也是造成酸雨的原因之一;含硫(S2-)废水不仅会造成水生植物的死亡,还会腐蚀存放在水中的金属设备。
另外,研究发现,硫化氢(H2S)也是一种重要的信号分子,在人体的各种复杂的生理学过程中也扮演着十分重要的角色,例如细胞凋亡、神经调节、血管舒张、血管生成调控、氧气传感等。
由于硫离子(或硫化氢)的自身特性,使得其在环境污染及生理学方面的检测变成了一项非常有实际意义的任务。如果能够灵敏、可靠地检测出生理样品以及活细胞中硫化氢的含量,将有助于理解硫化氢在致病过程中的作用机制。
硫化物的浓度是一个重要的水污染指数,特别是甚至微摩尔浓度硫化物也能使许多水生生物中毒。高硫化物浓度会刺激粘膜,导致呼吸性瘫痪和意识丧失。
研究表明硫化氢溶于水之后,在饮用水中硫化氢的浓度即使小于0.07mg/m3时,也会对饮用水的水质造成一定的影响。当水中硫化氢浓度达到0.15mg/m3时,会对新投入河塘的鱼苗生长定产生一定的影响,同时也会对河塘周围植物的根系产生一定的毒害作用。硫化氢不仅具有毒性,其溶液呈酸性且具有腐蚀性,可导致管道、罐类等设备发生硫化物应力开裂、氢鼓泡、氢致开裂等,导致泵类叶轮腐蚀磨损加快及出现腐蚀性气孔等问题。
目前,关于硫离子(或硫化氢)的检测方法已有报道,主要有:离子色谱法、电化学分析法、光谱检测法、传统滴定法和荧光检测法。现有技术中,硫离子(或硫化氢)的检测方法成本高、灵敏度低、检测限低。
因此,开发设计一种可以检测低浓度硫离子(或硫化氢)的新型检测材料是非常必要的。
技术实现要素:
本发明的目的在于提供一种快速检测硫离子的方法,利用4-氨基-1-萘磺酸钠(简称ANS)的荧光能够有效地被MnO2纳米材料猝灭的性质,制备ANS/MnO2复合体系,往该体系中加入微量的S2-时,由于S2-与MnO2发生氧化还原反应,在溶液中生成了二价锰离子,从而使ANS的荧光强度增强,且荧光增强的强度与S2-离子的浓度成线性关系,实现对S2-离子的检测,该方法操作简单,能快速实时的对S2-进行检测。
本发明提供的一种快速检测硫离子的方法,包括以下步骤:
(1)将4-氨基-1-萘磺酸钠溶液与MnO2纳米片溶液混匀,得到ANS/MnO2复合体系,静置后,测其荧光强度;
(2)向与步骤(1)相同的体系中分别加入不同浓度的S2-离子溶液,静置后,分别测其荧光强度;与步骤(1)的荧光强度比较,构建荧光增强强度与S2-离子的浓度线性关系;
(3)向与步骤(1)相同的体系中加入未知浓度的S2-离子溶液,静置后,测溶液的荧光强度,与步骤(1)的荧光强度比较,根据步骤(2)获得的线性关系得到未知浓度的S2-的浓度。
进一步的,步骤(1)、步骤(2)和步骤(3)所述体系中4-氨基-1-萘磺酸钠溶液终浓度均为2×10-6mol·L-1;MnO2纳米片终浓度均为60×10-6mol·L-1;试验中采用的体系终体积为2mL;
选择MnO2纳米片终浓度为60×10-6mol·L-1,因为此浓度下荧光恢复效果相比其他浓度好。
进一步的,步骤(1)中所述静置,时间为15-20min;目的是待荧光信号稳定,减少测量误差。
步骤(1)具体为:取浓度为10-5mol·L-1的4-氨基-1-萘磺酸钠溶液400μL于10mL比色管中,往上述体系中加入80μL1.5×10-3mol·L-1MnO2纳米片溶液,最后用去离子水稀释至2mL,此时,4-氨基-1-萘磺酸钠终浓度为2×10-6mol·L-1,MnO2纳米片的浓度为60×10-6mol·L-1,混合均匀,静置反应15-20min,再测其荧光强度。
所述MnO2纳米片的制备方法为:
分别量取2mL 30%的H2O2溶液与12mL浓度为1.0mol·L-1的四甲基氢氧化铵(TMA)溶液于烧杯中,待溶液混合均匀后,再量取10mL浓度为0.3mol·L-1的MnCl2·4H2O加入烧杯中,将得到的深棕色悬浮液在室温下置于磁力搅拌器上搅拌约12小时,之后在转速8000r/min下20min离心,弃去上层清液,将沉淀分别用无水乙醇和去离子水清洗至离心后上层清液透明为止,得到的黑褐色固体为MnO2纳米片;
将所获得的黑褐色固体分散在去离子水中,超声处理1h制成1.5×10-2mol·L-1的MnO2溶液。
进一步的,步骤(2)中所述S2-离子溶液包括但不限制于Na2S溶液。
步骤(2)和步骤(3)中所述静置时间≥2h;目的是待荧光信号稳定,减少测量误差。
进一步的,步骤(2)中S2-的终浓度分别为0mol·L-1、2.5×10-6mol·L-1、5×10-6mol·L-1、10×10-6mol·L-1、17.5×10-6mol·L-1、22.5×10-6mol·L-1、25×10-6mol·L-1、27.5×10-6mol·L-1、32.5×10-6mol·L-1、47.5×10-6mol·L-1和50×10-6mol·L-1。
步骤(2)具体为:取浓度为10-5mol·L-1的ANS溶液400μL于10mL比色管中,再加入80μL 1.5×10-3mol·L-1MnO2纳米片溶液并混合均匀,静置反应15-20min后,分别加入不同浓度的Na2S溶液,稀释至2mL,此时,4-氨基-1-萘磺酸钠溶液终浓度为2×10-6mol·L-1;MnO2纳米片终浓度为60×10-6mol·L-1;S2-的终浓度分别为0mol·L-1、2.5×10-6mol·L-1、5×10-6mol·L-1、10×10-6mol·L-1、17.5×10-6mol·L-1、22.5×10-6mol·L-1、25×10-6mol·L-1、27.5×10-6mol·L-1、32.5×10-6mol·L-1、47.5×10-6mol·L-1和50×10-6mol·L-1,静置2h后,分别测溶液的荧光强度;与步骤(1)的荧光强度比较,构建荧光增强强度与S2-离子的浓度线性关系。
步骤(2)中线性关系为F-F0=86.17+9.94C,线性相关系数R2=0.983。
F0是步骤(1)测得的荧光强度,F为步骤(2)中加入不同浓度S2-后溶液的荧光强度,C为加入的S2-的终浓度,R2为线性相关系数。
步骤(3)具体为:取浓度为10-5mol·L-1的ANS溶液400μL于10mL比色管中,加入80μL 1.5×10-3mol·L-1MnO2纳米片溶液并混合均匀,静置反应15-20min后,加入未知浓度的Na2S溶液,稀释至2mL,此时,4-氨基-1-萘磺酸钠溶液终浓度为2×10-6mol·L-1;MnO2纳米片终浓度为60×10-6mol·L-1;静置2h后,测溶液的荧光强度;与步骤(1)的荧光强度比较,根据步骤(2)获得的线性关系得到未知浓度的S2-的浓度。
与现有技术相比,本发明合成MnO2纳米片具有非常高的比表面积、丰富的结构多样性和独特的电子性质等优点,将MnO2纳米片加入4-氨基-1-萘磺酸钠(简称ANS)溶液中,通过内滤光效应(IFE)和静态猝灭效应(SQE)猝灭ANS的荧光。当往ANS/MnO2复合体系中加入微量的S2-,由于S2-与MnO2发生氧化还原反应生成Mn2+从而使ANS荧光恢复,且加入的S2-在一定浓度范围内,能够使溶液的荧光强度呈线性增强,荧光增强强度与S2-离子的浓度构建线性关系,继而实现了对S2-的痕量检测。检测限为1.5μM,线性范围为2.5μM~50μM,线性相关系数R2=0.983.灵敏度较好;该方法操作简单,快速有效,为S2-提供了一种新型的检测方法。
附图说明
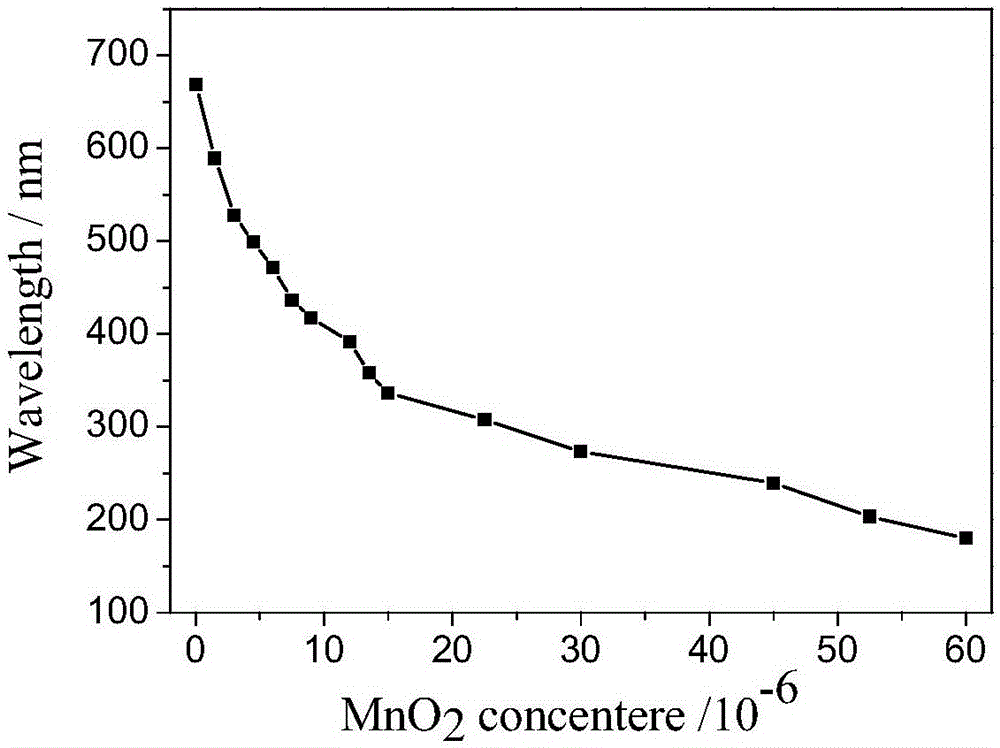
图1A为实施例1中MnO2纳米片猝灭ANS荧光图谱;从上至下MnO2的浓度依次为0mol·L-1、1.5×10-6mol·L-1、3×10-6mol·L-1、4.5×10-6mol·L-1、6×10-6mol·L-1、7.5×10-6mol·L-1、9×10-6mol·L-1、12×10-6mol·L-1、13.5×10-6mol·L-1、15×10-6mol·L-1、22.5×10-6mol·L-1、30×10-6mol·L-1、45×10-6mol·L-1、52.5×10-6mol·L-1、60×10-6mol·L-1;
图1B为实施例1MnO2纳米片猝灭ANS荧光实验中荧光强度与MnO2浓度关系;
图2A为实施例1中随S2-在溶液中浓度的增加ANS/MnO2体系荧光图谱;
从下至上S2-的浓度依次为0mol·L-1、2.5×10-6mol·L-1、5×10-6mol·L-1、10×10-6mol·L-1、17.5×10-6mol·L-1、22.5×10-6mol·L-1、25×10-6mol·L-1、27.5×10-6mol·L-1、32.5×10-6mol·L-1、47.5×10-6mol·L-1、50×10-6mol·L-1;
图2B为实施例1中随S2-在溶液中浓度的增加ANS/MnO2体系荧光强度与S2-浓度关系;
图3为本发明利用MnO2-ANS体系检测S2-原理示意图;
图4为MnO2纳米片紫外吸收光谱与ANS的激发光谱和发射光谱;
图5为荧光增强强度与S2-离子的浓度的线性关系图;F-F0=86.17+9.94C,线性相关系数R2=0.983;F0是步骤(1)测得的荧光强度,F为步骤(2)中加入不同浓度S2-后溶液的荧光强度,C为加入的S2-的终浓度,R2为线性相关系数;线性范围是S2-离子的浓度在0-35×10-6mol·L-1。
具体实施方式
实施例1
一种快速检测硫离子的方法,包括以下步骤:
MnO2纳米片猝灭ANS荧光实验:
取4-氨基-1-萘磺酸钠(简称ANS)0.0245g于100mL容量瓶中,超声分散均匀,ANS浓度为10-3mol·L-1;量取上述溶液100μL,用去离子水稀释至10mL,ANS浓度为10-5mol·L-1,取15只干燥干净的10m比色管,分别加入稀释后的浓度为10-5mol·L-1ANS溶液400μL,往15只比色管中分别加入不同体积初始浓度为1.5×10-3mol·L-1的MnO2纳米片溶液,最后用去离子水稀释至2mL,稀释后ANS的终浓度为2×10-6mol·L-1,MnO2纳米片的终浓度分别为0mol·L-1、1.5×10-6mol·L-1、3×10-6mol·L-1、4.5×10-6mol·L-1、6×10-6mol·L-1、7.5×10-6mol·L-1、9×10-6mol·L-1、12×10-6mol·L-1、13.5×10-6mol·L-1、15×10-6mol·L-1、22.5×10-6mol·L-1、30×10-6mol·L-1、45×10-6mol·L-1、52.5×10-6mol·L-1和60×10-6mol·L-1;混合均匀后静置15min再分别测其荧光强度,荧光猝灭情况如图1A所示,猝灭效果与浓度之间的关系如图1B所示。
从图1A可以看出,2×10-6mol·L-1ANS的溶液在425nm处有很强的荧光,加入MnO2纳米片后,由于二者发生内滤光效应(IFE)和静态猝灭效应(SQE),使ANS溶液的荧光强度急剧猝灭,且ANS溶液的荧光强度随着MnO2纳米片浓度(0~60×10-6mol·L-1)的增加而逐渐降低(如图1A所示),当MnO2纳米片浓度达到52.5×10-6mol·L-1时,猝灭效率高达73.1%。
在采用荧光回升法检测硫离子浓度时,选择MnO2纳米片终浓度为60×10-6mol·L-1,因为此浓度下荧光恢复效果相比其他浓度较好。
具体检测方法:
(1)取稀释后的浓度为10-5mol·L-1的ANS溶液400μL于10mL比色管中,加入80μL 1.5×10-3mol·L-1MnO2纳米片溶液并混合均匀,稀释至2mL,静置反应15min后,测溶液的荧光强度,体系中ANS的终浓度为2×10-6mol·L-1,MnO2纳米片浓度为60×10-6mol·L-1;
(2)取稀释后的浓度为10-5mol·L-1的ANS溶液400μL于10mL比色管中,加入80μL 1.5×10-3mol·L-1MnO2纳米片溶液并混合均匀,静置反应15min后加入不同浓度的Na2S溶液,稀释至2mL,静置2h后测溶液的荧光强度。稀释后,体系中ANS的终浓度为2×10-6mol·L-1,MnO2纳米片终浓度为60×10-6mol·L-1,S2-的终浓度分别为0mol·L-1、2.5×10-6mol·L-1、5×10-6mol·L-1、10×10-6mol·L-1、17.5×10-6mol·L-1、22.5×10-6mol·L-1、25×10-6mol·L-1、27.5×10-6mol·L-1、32.5×10-6mol·L-1、47.5×10-6mol·L-1、50×10-6mol·L-1;荧光回升情况如图2A所示,回升效果与浓度之间的关系如图2B所示;
测得的荧光强度与步骤(1)的荧光强度比较,构建荧光增强强度与S2-离子的浓度线性关系,为F-F0=86.17+9.94C,线性相关系数R2=0.983;
F0是步骤(1)测得的荧光强度,F为步骤(2)中加入不同浓度S2-后溶液的荧光强度,C为加入的S2-的终浓度,R2为线性相关系数。
S2-对ANS/MnO2体系荧光强度的影响,实验结果(如图2A、图2B所示),表明S2-可以使ANS/MnO2荧光强度回升。原因主要是S2-与MnO2纳米片之间发生了氧化还原反应,生成了二价锰离子(Mn2+),使溶液中的MnO2纳米片浓度随着S2-浓度的增加而逐渐降低,从而使ANS/MnO2体系荧光强度增强。当S2-浓度达到50×10-6mol·L-1,荧光回升效率达到55%,检测机理图如图3所示。
(3)取稀释后的浓度为10-5mol·L-1的ANS溶液400μL于10mL比色管中,加入80μL 1.5×10-3mol·L-1MnO2纳米片溶液并混合均匀,静置反应15min后加入硫化物,稀释至2mL,静置2h后测溶液的荧光强度。稀释后,体系中ANS的终浓度为2×10-6mol·L-1,MnO2纳米片终浓度为60×10-6mol·L-1,S2-的终浓度为10×10-6mol·L-1;测得的荧光强度与步骤(1)的荧光强度比较,根据步骤(2)获得的线性关系得到未知浓度的S2-的浓度,为10.21×10-6mol·L-1。
采用加入法回收测定自来水中的硫离子,回收率102.1%,相对标准偏差2.1%。本实验在测定水溶液中硫离子(S2-)浓度的最佳分析条件下,对自来水中的硫离子进行了检测分析。水样品通过0.45mm的微孔膜过滤后再离心分离,实验分析结果如表1所示。
表1用标准加入法检测的自来水样品中硫化物的离子浓度。
为了研究体系荧光猝灭的机理,本实验继续研究了相关的紫外对比图谱(如图4)。实验中,TMA的浓度为2×10-6mol·L-1(分别测此浓度的ANS激发和发射光谱),MnO2纳米片的浓度为1.5×10-3mol·L-1(测此浓度下的紫外吸收光谱图)。从图4中可以看出,MnO2纳米片(图4中A)在380nm处有一个很强的紫外吸收峰,在检测时,之所以有这样高的猝灭效率,是因为ANS的激发光谱(图4中B)和发射光谱(图4中C)刚好与制备的MnO2纳米片紫外吸收光谱重合,二者之间可发生内滤光效应(IFE)和静态猝灭效应(SQE),所以猝灭效率比较高。而当加入S2-后,S2-与MnO2纳米片之间发生了氧化还原反应,生成了二价锰离子(Mn2+),使溶液中的MnO2纳米片浓度随着S2-浓度的增加而逐渐降低,ANS与MnO2纳米片之间内滤光效应(IFE)和静态猝灭效应(SQE)减弱。这便可以解释体系荧光回升的原因。
- 还没有人留言评论。精彩留言会获得点赞!