基于纳米氧化铜测定脲酶的方法与流程
本发明涉及脲酶催化尿素水解产生氨,抑制纳米氧化铜模拟碱性过氧化物酶在碱性条件下催化过氧化氢氧化对羟基苯丙酸形成荧光产物的活性,建立测定脲酶的荧光分析方法,属于分析化学和纳米技术领域。
背景技术:
过氧化物酶主要存在于细胞的过氧化物酶体中,可催化过氧化氢氧化酚类和胺类化合物,继而清除过氧化氢、酚类和胺类毒性的作用。天然过氧化物酶含量少,价格昂贵,容易受外界环境干扰失去催化活性,纳米人工模拟酶由于其结构稳定、经济、易于大规模制备以及可调催化活性等优点,已被广泛用于生物分析和生物技术应用。天然过氧化物酶及其模拟物通常在酸性或中性条件下发挥最佳性能。然而,在碱性条件下进行的研究很少。因此,碱性过氧化物酶模拟物的发现对于实际应用具有重要意义。
脲酶是用于水解尿素以产生氨和二氧化碳的高效催化剂。由于其特异性,临床上已经提出将脲酶通过腹膜透析和血液透析用于肾衰竭患者,去除尿素。此外,脲酶还被用于分析肌酐,精氨酸,IgG,重金属污染物和其他污染物。因此,脲酶的检测对于生物分析应用具有重要意义。
本发明基于纳米氧化铜作为模拟碱性过氧化物酶催化过氧化氢氧化对羟基苯丙酸,结合脲酶催化尿素水解产生氨的反应,提供一种以纳米氧化铜为催化剂测定脲酶的荧光分析方法。
技术实现要素:
本发明的目的是基于纳米氧化铜良好的模拟碱性过氧化物酶活性,结合脲酶可以选择性水解尿素生成氨和二氧化碳,再通过氨抑制纳米氧化铜催化过氧化氢氧化对羟基苯丙酸的过程,减少二聚体荧光产物的生成,提供一种以纳米氧化铜为催化剂测定过脲酶的荧光分析方法。
为了实现上述目的,本发明采用以下技术方案:所述一种以纳米氧化铜为催化剂测定脲酶的荧光分析方法,其特征是首先将尿素、脲酶和磷酸盐缓冲液三者混合在温浴下进行脲酶酶促反应,然后向其中加入对羟基苯丙酸、过氧化氢、纳米氧化铜溶液和磷酸盐缓冲液继续在温浴下进行荧光反应,用荧光分光光度计测定上述荧光反应产物的荧光强度;所述的纳米氧化铜由如下步骤制得:1)取0.02 mol/L的醋酸铜溶液150 ml和0.5 ml冰醋酸加入到装有冷凝管的三颈瓶中,搅拌加热至沸腾;2)快速加入0.04 g/ml的氢氧化钠溶液10 ml,加完后继续搅拌5分钟,得到黑色氧化铜沉淀;3)将反应得到的黑色氧化铜沉淀离心,用无水乙醇洗涤三次,减压干燥,即得纳米氧化铜粉体。
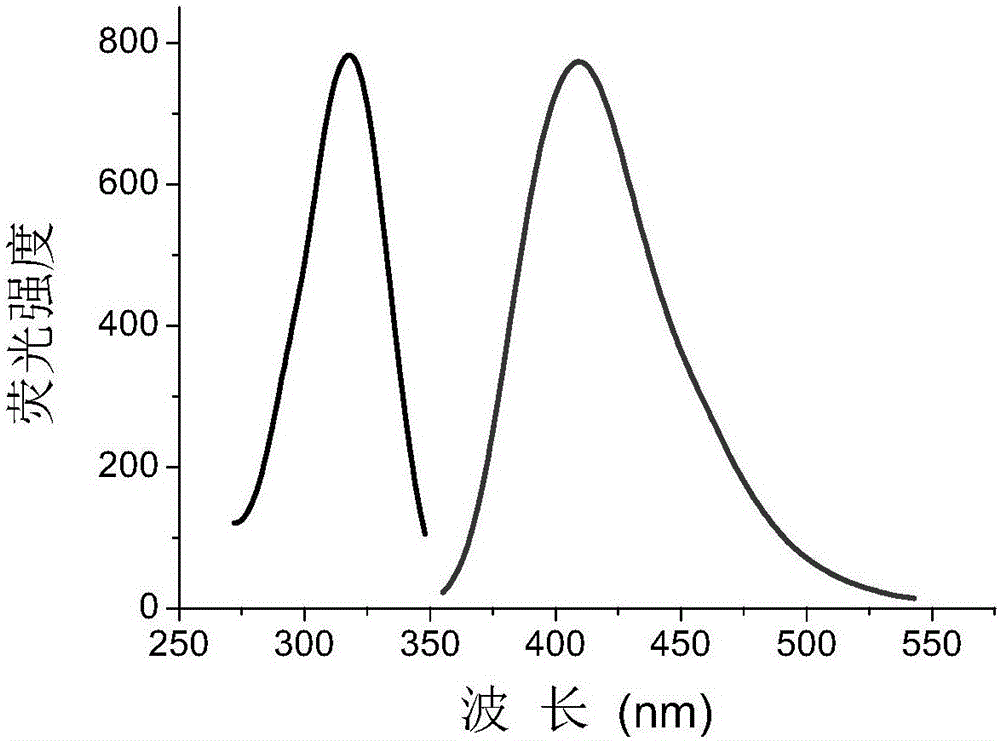
所述的一种以纳米氧化铜为催化剂测定脲酶的荧光分析方法,其特征是荧光反应产物的最大激发波长和发射波长分别为320 nm和409 nm。
脲酶酶促反应体系pH值为7.0,尿素浓度为2.25 mmol/L,反应温度为37 ℃,反应时间为30分钟。
荧光反应体系的pH值为10.25,纳米氧化铜浓度为0.4 mg/L,对羟基苯丙酸浓度为4mmol/L,反应温度为65℃,反应时间为15分钟。
所述的一种以纳米氧化铜为催化剂测定脲酶的荧光分析方法,其特征是将150 µL用浓度为10mmol/L,pH为7.0的磷酸盐缓冲液配制成的浓度为15 mmol/L的尿素溶液和50 µL不同浓度的脲酶溶液混合,混合液在37 ℃温浴水解反应30分钟,随后向混合液中依次加入50 µL浓度为120 mmol/L的过氧化氢溶液,50 µL浓度为80 mmol/L的对羟基苯丙酸,200 µL浓度为2 mg/L的纳米氧化铜和500 µL浓度为100mmol/L、pH为10.25的磷酸盐缓冲溶液中,混合液在65 ℃温浴,15分钟后分别测定其在409 nm处的荧光强度,激发波长为320 nm,以荧光强度差值对脲酶浓度对数值作图得到脲酶标准曲线。
尿酶检测线性范围为0.003~0.04 U/mL,其检测限为2.6 U/L。
本发明利用纳米氧化铜为催化剂测定土壤脲酶含量的荧光分析方法,其特征是它由以下步骤组成:(1)在EP管中分别加入用磷酸盐缓冲液稀释后的尿素和土壤稀释液混合温浴;(2)向上述EP管中加入磷酸盐缓冲液,过氧化氢,对羟基苯丙酸和纳米氧化铜溶液继续温浴;(3)将反应产物置于荧光分光光度计中检测荧光强度,根据脲酶标准曲线测定土壤中脲酶含量;所述的纳米氧化铜由如下步骤制得:1)取0.02 mol/L的醋酸铜溶液150 ml和0.5 ml冰醋酸加入到装有冷凝管的三颈瓶中,搅拌加热至沸腾;2)快速加入0.04 g/ml的氢氧化钠溶液10 ml,加完后继续搅拌5分钟,得到黑色氧化铜沉淀;3)将反应得到的黑色氧化铜沉淀离心,用无水乙醇洗涤三次,减压干燥,即得纳米氧化铜粉体。
所述的一种利用纳米氧化铜为催化剂测定土壤脲酶含量的荧光分析方法,其特征是取5g干燥土壤样品(直径< 2 mm),加入9 mL磷酸缓冲溶液(10 mmoL/L, pH=7.0)和0.2 mL甲苯,充分混匀后,置于6000转/分钟离心20分钟,取上清液进行超滤纯化,得土壤样品溶液;在EP管中分别加入150 µL用浓度为10mmol/L,pH为7.0的磷酸盐缓冲液配制成的浓度为15 mmol/L的尿素溶液和50 µL土壤样品溶液混合,混合液在37 ℃温浴水解反应30分钟,随后向混合液中依次加入50 µL浓度为120 mmol/L的过氧化氢溶液,50 µL浓度为80 mmol/L的对羟基苯丙酸,200 µL浓度为2mg/L的纳米氧化铜溶液和500 µL浓度为100mmol/L、pH为10.25的磷酸盐缓冲溶液中,混合液在65 ℃温浴,15分钟后分别测定其在409 nm处的荧光强度,激发波长为320 nm。
所述的脲酶酶促反应体系pH值优选为7.0,尿素浓度优选为2.25 mmol/L。
所述的脲酶酶促反应温度优选为37 ℃,反应时间优选为30分钟。
所述的荧光反应体系的pH值优选为10.25,纳米氧化铜浓度优选为0.4mg/L,对羟基苯丙酸浓度优选为4mmol/L。
所述的荧光反应温度优选为65℃,反应时间优选为15分钟。
本发明所述的利用纳米氧化铜为催化剂测定脲酶的荧光分析方法,其特征是首先将尿素、脲酶和磷酸盐缓冲液三者混合,混合液放入37℃温浴30分钟进行脲酶酶促反应,然后向其中加入对羟基苯丙酸、过氧化氢、纳米氧化铜和磷酸盐缓冲液继续温浴,放入65 ℃水浴反应15分钟进行荧光反应,生成二聚体荧光产物,用荧光分光光度计测定上述混合液反应产物的荧光强度。
本发明所述的利用纳米氧化铜为催化剂测定脲酶的荧光分析方法,其特征是将150 µL浓度为15 mmol/L的尿素溶液(用浓度为10mmol/L,pH为7.0的磷酸盐缓冲液配制)和50 µL不同浓度的脲酶溶液混合,混合液在37 ℃温浴水解反应30分钟,随后向混合液中依次加入50 µL浓度为120 mmol/L的过氧化氢溶液,50 µL浓度为80 mmol/L的对羟基苯丙酸,200 µL浓度为2mg/L的纳米氧化铜和500 µL浓度为100mmol/L的磷酸盐缓冲溶液(pH 10.25)中,混合液在65 ℃温浴,15分钟后分别测定其在409 nm处的荧光强度,激发波长为320 nm,以荧光强度差值对脲酶浓度对数值作图得到标准曲线以用于测定脲酶。
所述的纳米氧化铜由如下步骤制得:1)取0.02 mol/L的醋酸铜溶液150 ml和0.5 ml冰醋酸加入到装有冷凝管的三颈瓶中,搅拌加热至沸腾;2)快速加入0.04 g/ml的氢氧化钠溶液10 ml,加完后继续搅拌5分钟,得到黑色氧化铜沉淀;3)将反应得到的黑色氧化铜沉淀离心,用无水乙醇洗涤三次,减压干燥,即得纳米氧化铜粉体。
本发明所述的利用纳米氧化铜为催化剂测定土壤中脲酶含量的荧光分析方法,其特征是它由以下步骤组成:(1)在EP管中分别加入用磷酸盐缓冲液稀释后的尿素和土壤样品提取液混合温浴;(2)向上述EP管中加入磷酸盐缓冲液,过氧化氢,对羟基苯丙酸和纳米氧化铜继续温浴;(3)将反应产物置于荧光分光光度计中检测荧光强度,根据脲酶标准曲线测定土壤中脲酶浓度。
所述的在EP管中分别加入150 µL浓度为15 mmol/L的尿素溶液(用浓度为10mmol/L,pH为7.0的磷酸盐缓冲液配制)和50 µL处理后的土壤稀释液混合,混合液在37 ℃温浴水解反应30分钟,随后向混合液中依次加入50 µL浓度为120 mmol/L的过氧化氢溶液,50 µL浓度为80 mmol/L的对羟基苯丙酸,200 µL浓度为2mg/L的纳米氧化铜和500 µL浓度为100mmol/L的磷酸盐缓冲溶液(pH 10.25)中,混合液在65 ℃温浴,15分钟后分别测定其在409 nm处的荧光强度,激发波长为320 nm;所述的纳米氧化铜由如下步骤制得:1)取0.02 mol/L的醋酸铜溶液150 ml和0.5 ml冰醋酸加入到装有冷凝管的三颈瓶中,搅拌加热至沸腾;2)快速加入0.04 g/ml的氢氧化钠溶液10 ml,加完后继续搅拌5分钟,得到黑色氧化铜沉淀;3)将反应得到的黑色氧化铜沉淀离心,用无水乙醇洗涤三次,减压干燥,即得纳米氧化铜粉体。
本发明的技术方案具体步骤如下:
(一)纳米氧化铜的制备:
取醋酸铜溶液和冰醋酸加入到装有冷凝管的三颈瓶中,搅拌加热至沸腾,快速加入氢氧化钠溶液,加完后,继续搅拌后,得到黑色氧化铜。将反应得到的黑色氧化铜立即离心,用无水乙醇洗涤,减压干燥,即得纳米氧化铜粉体。将纳米氧化铜粉体分散于二次蒸馏水中得到棕色纳米氧化铜胶体溶液。
纳米氧化铜具体制备步骤如下:
(1)取0.02 mol/L的醋酸铜溶液150 ml和0.5 ml冰醋酸加入到装有冷凝管的三颈瓶中,搅拌加热至沸腾;
(2)快速加入0.04 g/ml的氢氧化钠溶液10 ml,加完后继续搅拌5分钟,得到黑色氧化铜沉淀;
(3)将反应得到的黑色氧化铜沉淀离心,用无水乙醇洗涤三次,减压干燥,即得纳米氧化铜粉体。
(二)脲酶的测定
首先将尿素、脲酶和磷酸盐缓冲液三者混合,混合液放入37℃温浴30分钟进行脲酶酶促反应,然后向其中加入对羟基苯丙酸、过氧化氢、纳米氧化铜和磷酸盐缓冲液, 65 ℃温浴15分钟,测定其荧光强度,以荧光强度差值对脲酶浓度对数值作图得到标准曲线以用于测定脲酶。
(三)土壤中脲酶的测定
将脲酶替换为稀释后的土壤样品重复步骤二,将所得荧光强度代入标准曲线即可得到土壤中脲酶的含量。
本发明的优点:
本发明利用纳米氧化铜的模拟过氧化物酶特性,成功构建了一种检测脲酶的荧光分析方法。该技术测定脲酶的线性范围为0.003~0.04 U/mL,其检测限为2.6 U/L。本发明具有灵敏度高,样品需求量少,重现性好,成本低等优点,可应用于土壤样品中脲酶的测定。
附图说明
图1为荧光体系的荧光光谱图。
图2为pH值对荧光强度的影响图。
图3为纳米氧化铜浓度对荧光强度的影响图。
图4为对羟基苯丙酸浓度对荧光强度的影响图。
图5为尿素浓度对荧光强度的影响图。
图6为脲酶浓度对荧光强度的影响图。
图7为脲酶的标准曲线图。
具体实施方式
以下通过实施例对本发明做进一步说明,但是本发明不仅限于此。
实例1:
纳米氧化铜具体制备步骤如下:(1)取0.02 mol/L的醋酸铜溶液150 ml和0.5 ml冰醋酸加入到装有冷凝管的三颈瓶中,搅拌加热至沸腾;(2)快速加入0.04 g/ml的氢氧化钠溶液10 ml,加完后继续搅拌5分钟,得到黑色氧化铜沉淀;(3)将反应得到的黑色氧化铜沉淀离心,用无水乙醇洗涤三次,减压干燥,即得直径为6 nm的纳米氧化铜粉体。
实例2:
将50 µL浓度为120 mmol/L的过氧化氢溶液,50 µL浓度为80 mmol/L的对羟基苯丙酸和200 µL浓度为2mg/L的实例1制备的纳米氧化铜溶液加入到700 µL浓度为100mmol/L的磷酸盐缓冲溶液(pH 10.25)中,混合摇匀后置于65℃温浴,15分钟后测定其荧光光谱。如图1所示,荧光产物激发波长为320 nm,发射波长为409 nm。
实例3:
将50 µL浓度为120 mmol/L的过氧化氢溶液,50 µL浓度为80 mmol/L的对羟基苯丙酸和200 µL浓度为2mg/L的实例1制备的纳米氧化铜加入到700 µL浓度为100mmol/L、不同pH的磷酸盐缓冲溶液(pH 9~11)中,混合摇匀后置于65℃温浴,15分钟后测定其在409 nm处的荧光强度(激发波长为320 nm)。如图2所示,荧光强度在pH为10.1~10.3之间达到最大值。
实例4:
将50 µL浓度为120 mmol/L的过氧化氢溶液,50 µL浓度为80 mmol/L的对羟基苯丙酸和200 µL不同浓度的实例1制备的纳米氧化铜溶液(0~5 mg/L)加入到700 µL浓度为100mmol/L的磷酸盐缓冲溶液(pH 10.25)中,混合摇匀后置于65℃温浴,15分钟后测定其在409 nm处的荧光强度(激发波长为320 nm)。如图3所示,荧光强度随混合液中纳米氧化铜浓度增大而增大并在终浓度为0.4 mg/L时达到最大。
实例5:
将50 µL浓度为120 mmol/L的过氧化氢溶液,50 µL不同浓度的对羟基苯丙酸(0~80 mmol/L)和200 µL浓度为2mg/L的实例1制备的纳米氧化铜溶液加入到700 µL浓度为100mmol/L的磷酸盐缓冲溶液(pH 10.25)中,混合摇匀后置于65℃温浴,15分钟后测定其在409 nm处的荧光强度(激发波长为320 nm)。如图4所示,荧光强度随混合液中对羟基苯丙酸浓度增大而增大,在终浓度为3.5 mmol/L时,荧光强度达到最大值。
实例6:
将150 µL不同浓度的尿素溶液(0~15 mmol/L,用浓度为10mmol/L,pH为7.0的磷酸盐缓冲液配制)和50 µL浓度为6 U/mL的脲酶溶液混合,混合液在37 ℃温浴水解反应30分钟,随后向混合液中依次加入50 µL浓度为120 mmol/L的过氧化氢溶液,50 µL浓度为80 mmol/L的对羟基苯丙酸,200 µL浓度为2mg/L的实例1制备的纳米氧化铜溶液和500 µL浓度为100mmol/L的磷酸盐缓冲溶液(pH 10.25)中,混合液在65 ℃温浴,15分钟后分别测定其在409 nm处的荧光强度,激发波长为320 nm,如图5所示,荧光强度差值随混合液中尿素浓度增大而增大,在终浓度为0.75 mmol/L时,荧光强度达到稳定值。
实例7:
将150 µL浓度为15 mmol/L的尿素溶液(用浓度为10mmol/L,pH为7.0的磷酸盐缓冲液配制)和50 µL不同浓度的脲酶溶液(0.04~6 U/mL)混合,混合液在37 ℃温浴水解反应30分钟,随后向混合液中依次加入50 µL浓度为120 mmol/L的过氧化氢溶液,50 µL浓度为80 mmol/L的对羟基苯丙酸,200 µL浓度为2mg/L的实例1制备的纳米氧化铜溶液和500 µL浓度为100mmol/L的磷酸盐缓冲溶液(pH 10.25)中,混合液在65 ℃温浴,15分钟后分别测定其在409 nm处的荧光强度,激发波长为320 nm,如图6所示,荧光强度差值随混合液中脲酶浓度增大而增大,在终浓度为0.1 U/mL时,荧光强度达到稳定值。
实例8:
将150 µL浓度为15 mmol/L的尿素溶液(用浓度为10mmol/L,pH为7.0的磷酸盐缓冲液配制)和50 µL不同浓度的脲酶溶液(0.06~0.8 U/mL)混合,混合液在37 ℃温浴水解反应30分钟,随后向混合液中依次加入50 µL浓度为120 mmol/L的过氧化氢溶液,50 µL浓度为80 mmol/L的对羟基苯丙酸,200 µL浓度为2mg/L的实例1制备的纳米氧化铜溶液和500 µL浓度为100mmol/L的磷酸盐缓冲溶液(pH 10.25)中,混合液在65 ℃温浴,15分钟后分别测定其在409 nm处的荧光强度,激发波长为320 nm,以荧光强度差值对尿素浓度对数值作图得到脲酶标准曲线。如图7所示,荧光强度与脲酶浓度在0.003~0.04 U/mL范围内呈线性关系,检测限为2.6 U/L。
实例9:
取5g干燥土壤样品(直径< 2 mm),加入9 mL磷酸缓冲溶液(10 mmoL/L, pH=7.0)和0.2 mL甲苯,充分混匀后,置于6000转/分钟离心20分钟,取上清液进行超滤纯化,得土壤样品溶液。在EP管中分别加入150 µL浓度为15 mmol/L的尿素溶液(用浓度为10mmol/L,pH为7.0的磷酸盐缓冲液配制)和50 µL土壤样品溶液混合,混合液在37 ℃温浴水解反应30分钟,随后向混合液中依次加入50 µL浓度为120 mmol/L的过氧化氢溶液,50 µL浓度为80 mmol/L的对羟基苯丙酸,200 µL浓度为2mg/L的纳米氧化铜溶液和500 µL浓度为100mmol/L的磷酸盐缓冲溶液(pH 10.25)中,混合液在65 ℃温浴,15分钟后分别测定其在409 nm处的荧光强度,激发波长为320 nm。经实例8所得脲酶标准曲线计算得出土壤样品中脲酶含量,样品回收率95.5~102.9%,相对标准偏差0.44%~1.1%,由此可见本方法可靠适用。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改,等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!