细菌AB5肠毒素蛋白的定性、定量检测方法与流程
本发明涉及膜电喷雾电离质谱的应用,具体地说,涉及一种应用膜电喷雾电离质谱对细菌AB5肠毒素蛋白的定性、定量检测方法。
背景技术:
在世界范围内,肠道感染仍旧在疾病负担的贡献上扮演着重要的角色。由其所致的生产力减低、生活质量下降以及医疗费用的增加,显著的影响了经济发展。可以产生AB5肠毒素的细菌性病原体在肠道感染中占据着重要地位。[1]AB5肠毒素由于包含A和B两个亚单位而得名,其中具有催化作用的A亚单位可以干扰宿主必须生理机能,而B亚单位则负责调节宿主受体的识别。[2]
多种致泄性微生物都可以产生各自特异的AB5肠毒素,例如:霍乱弧菌产生的霍乱毒素(Cholera toxin,Ctx),志贺氏菌产生的经典型志贺毒素(Shiga toxin,Stx),产肠毒素大肠杆菌产生的不耐热肠毒素(heat labile enterotoxin,LT),产志贺毒素大肠杆菌产生的志贺毒素1(Stx1)和志贺毒素2(Stx2)。[3]虽然这些不同来源的AB5肠毒素具有相似的结构骨架,但是他们在识别细胞表面糖受体以及介导细胞内的催化反应方面有所差异。霍乱毒素和不耐热肠毒素主要与分布在小肠上皮细胞膜上的神经节苷脂GM1相结合,导致感染的细胞离子调节失衡,进而促使机体发生严重的腹泻,甚至引起威胁生命的脱水和电解质紊乱。[4,5]志贺毒素包括志贺毒素1和志贺毒素2,则与血管或肾内皮细胞表面表达的鞘磷脂Gb3表现出较强的亲和力,引起对内皮细胞的细胞毒性作用。志贺毒素同样可以导致严重的胃肠感染性疾病,如腹泻和出血性结肠炎,严重者可发展为溶血性尿毒综合征及血栓性血小板减少性紫癜。[6]每年AB5肠毒素的感染危及到数百万人的生命健康,并且造成超过一百万人死亡。[7]由于AB5肠毒素严重的危害性,对临床样品中AB5肠毒素检测的需求日益增加。
目前AB5肠毒素的临床诊断方法主要关注于对其编码基因的检测。例如:聚合酶链式反应(PCR)包括多重PCR和实时荧光定量PCR,[8,9]还有核酸杂交技术等。[10]此外,也有大量针对AB5肠毒素蛋白的检测方法。一些基于免疫学实验的方法,例如:酶联免疫吸附试验(ELISA),[11]微流体生物传感器[12]和脂质体PCR免疫检测。[13]另一些直接检测蛋白的方法,如局域表面等离子体共振(LSPR)[14]和质谱法(MS)。[15]质谱是一种具有诸多优势如高灵敏性、高分辨率和低上样量的强大工具。普通的色谱-质谱联用方法由于具有定量和定性检测痕量待测物的特性,因此被广泛应用于各种领域。[16,17]然而,色谱-质谱联用在样本前处理和色谱分离的过程中极为耗时。随着敞开式电离技术的不断发展,使得质谱具有能够在开放环境下对样品进行直接检测的能力。这些敞开式电离技术,包括实时直接分析质谱(DART),[18]解析电喷雾电离(DESI)[19]和纸喷雾电离(PS)[20]等,[21-25]可以实现在复杂基质下对待测物进行直接检测,同时一定程度上缩短样品前处理过程。
但是,目前的方法存在的问题是样品前处理手段仍旧较为复杂,无法满足在保证高灵敏度的前提下快速定性、定量地实现对AB5肠毒素的检测。
技术实现要素:
为了解决上述技术问题,本发明提供一种具有极高灵敏度且无需样本前处理,可实现对细菌AB5肠毒素蛋白快速定性、定量的检测方法。
为了实现本发明目的,本发明提供一种细菌AB5肠毒素蛋白的定性、定量检测方法,其包括如下步骤:
1)先提取待测样品中的蛋白,得到样品蛋白;
2)将样品蛋白进行酶切;
3)然后采用膜电喷雾质谱法进行AB5肠毒素蛋白特异性肽段的检测,在肽段水平上定性、定量判定AB5肠毒素蛋白编码基因的存在;其中所述AB5肠毒素Ctx的特异性肽段的序列为HDDGYVSTSISLR(如SEQ ID NO.2所示);AB5肠毒素LT的特异性肽段的序列为TPNSIAAISMEN(如SEQ ID NO.3所示);AB5肠毒素Stx1的特异性肽段的序列为MASDEFPSMCPADGR(如SEQ ID NO.5所示);AB5肠毒素Stx2的特异性肽段的序列为AVNEESQPECQITGDRPVIK(如SEQ ID NO.7所示)。
其中,优选的为,所述AB5肠毒素Ctx的特异性肽段为2个特异性肽段,其序列分别为FLDEYQSK(如SEQ ID NO.1所示)、HDDGYVSTSISLR(如SEQ ID NO.2所示)。
AB5肠毒素LT的特异性肽段为2个特异性肽段,其序列分别为TPNSIAAISMEN(如SEQ ID NO.3所示)、ILSYTESMAGK(如SEQ ID NO.4所示)。
AB5肠毒素Stx1的特异性肽段为2个特异性肽段,其序列分别为MASDEFPSMCPADGR(如SEQ ID NO.5所示)、YNDDDTFTVK(如SEQ ID NO.6所示)。
AB5肠毒素Stx2的特异性肽段为2个特异性肽段,其序列分别为AVNEESQPECQITGDRPVIK(如SEQ ID NO.7所示)、YNEDDTFTVK(如SEQ ID NO.8所示)。
其中,为了保证待测样品中AB5细菌毒素的含量,可以先对待测样品进行增菌培养,培养时间一般在1-10小时,以2-6小时为佳。
步骤1)中提取待测样品中的蛋白采用超滤提取方式,具体为:采用超滤管(3kDa)将待测样品上清液进行超滤20min。
对样品进行超滤的目的是对上清液中特定分子量范围的蛋白进行富集。
步骤2)中所述酶切采用微波法进行酶切,所用酶为胰蛋白酶。
所述酶切的方式为:将样品蛋白先在碳酸氢铵溶液中溶解并且加入DTT在高温下反应,然后在IAA存在下在暗处反应;最后加入胰蛋白酶,并且在微波条件下进行酶切而成。
优选的酶切方式为:将样品蛋白在50μL的50mM碳酸氢铵溶液中溶解并且加入5mM DTT在95℃反应5分钟,随后在15mM的IAA存在下在黑暗处反应30分钟。最后使用修饰过的测序级胰蛋白酶按照酶/底物质量比1:50的比例加入胰蛋白酶,并且在700W的微波条件下酶切15min。
步骤3)中采用膜电喷雾质谱法(MESI-MS)进行检测,所用装置为膜电喷雾离子源质谱仪,所述样品蛋白特异性肽段经膜电喷雾离子源使样品蛋白特异性肽段形成喷雾并离子化,然后进入质谱仪入口进行检测。
本发明的膜电喷雾电离装置包括至少一层透析膜,所述的膜电喷雾离子源装置可采用申请号为201410528504.0(发明名称为用于质谱分析的膜电喷雾离子源装置、离子化方法及包含该离子源装置的质谱仪)的发明申请中提及的膜电喷雾离子源装置。
所述膜电喷雾离子源装置,包括:吸水部件;至少一层透析膜,位于所述吸水部件上;导电部件,设置于所述透析膜;其中,所述透析膜具有至少一个尖端。
所述透析膜为多层,依次叠置于所述吸水部件上,且各层透析膜的截留分子量依次增大,距离所述吸水部件最远的透析膜的截留分子量最大。
优选的,所述透析膜为两层,包括第一透析膜和第二透析膜,所述第二透析膜位于所述吸水部件上,所述第一透析膜位于所述第二透析膜上,所述第一透析膜的截留分子量大于所述第二透析膜,所述第一透析膜和所述第二透析膜均包括样品承载部和所述尖端,所述第一透析膜的样品承载部与所述第二透析膜的样品承载部重叠,所述第一透析膜的尖端与所述第二透析膜的尖端相互错开。
本发明所述用于质谱分析的膜电喷雾离子化方法,包括:将至少一层透析膜放于吸水部件上,所述透析膜至少具有一个尖端,使所述透析膜的尖端指向质谱仪进样口;将待测样品置于所述透析膜上;静置一段等待时间后通过一导电部件向所述透析膜施加高压电;向所述透析膜上添加冲洗溶剂;在高电压及所述冲洗溶剂的作用下,所述待测样品形成喷雾并离子化。
所述等待时间为10-40s。向所述透析膜施加2-4kV的高压电。
所述冲洗溶剂为醇、水和甲酸的混合物。其中所述醇、水和甲酸的体积比为(50-70):(50-30):(0.1-0.5)。
二级质谱采用碰撞诱导解离(CID)对AB5肠毒素特异性肽段进行结构解析。母离子采样的质量范围选取2.0m/z,碰撞能量选取25%。
本发明采用膜电喷雾电离质谱检测AB5肠毒素特异性肽段,在肽段水平上间接实现对细菌AB5肠毒素蛋白的定性、定量检测。本发明采用BLAST算法筛选出具有典型意义的4个特异性肽段,膜电喷雾电离质谱可有效去除基质效应(去除酶切引入小分子导致),节省了常规质谱分析流程中的脱盐步骤,极大提高了检测灵敏度,从而缩短了细菌分离株样本的增菌时间,总体上实现了极高灵敏度下对AB5肠毒素的快速检测。
经考察对于高低不同浓度的上述特异性肽段,本发明方法的精密度、准确度、回收率以及线性范围等均令人满意。最终,本发明还将建立的方法对添加了携带或不携带4种AB5肠毒素蛋白编码基因的霍乱弧菌和大肠杆菌的人粪便模拟样本,以及添加或不添加Stx1与Stx2毒素蛋白的人血清模拟样本进行检测,验证方法的灵敏度与准确度。本发明的快速检测方法可以拓展到对其它病原菌的其它外毒素基因的检测。
附图说明
图1为本发明膜电喷雾离子源装置的结构示意图;
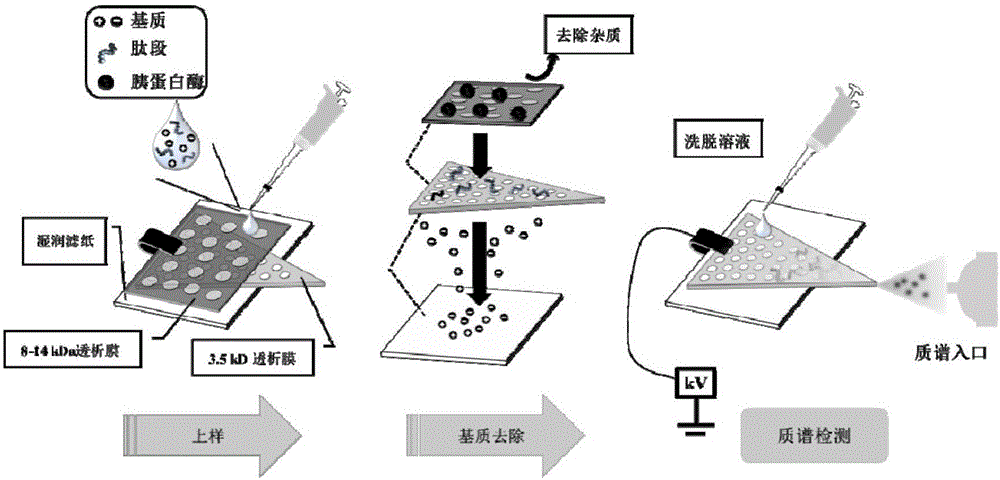
图2为本发明膜电喷雾电离质谱检测流程示意图;
图3A-图3B分别为PCR方法验证菌株携带/不携带细菌毒素基因;
图4A-图4B为合成标准Ctx特异性肽段(1mM)的MESI-MS/MS分析:图4A Ctx来源的多肽(FLDEYQSK)的母子离子对m/z 515.4→769.7;图4B Ctx来源的多肽(HDDGYVSTSISLR)的母子离子对m/z 725.8→1028.4;
图5A-图5B分别为合成标准LT特异性肽段(1mM)的MESI-MS/MS分析:图5A LT来源的多肽(TPNSIAAISMEN)的母子离子对m/z 635.3→615.3;图5B LT来源的多肽(ILSYTESMAGK)的母子离子对m/z 600.6→644.7;
图6A-图6B分别为合成标准Stx1特异性肽段(1mM)的MESI-MS/MS分析:图6A Stx1来源的多肽(MASDEFPSMCPADGR)的母子离子对m/z 807.0→934.1;6B Stx1来源的多肽(YNDDDTFTVK)的母子离子对m/z 607.6→940.9;
图7A-图7B分别为合成标准Stx2特异性肽段(1mM)的MESI-MS/MS分析:图7A Stx2来源的多肽(AVNEESQPECQITGDRPVIK)的母子离子对m/z 738.4→728.4;图7B Stx2来源的多肽(YNEDDTFTVK)的母子离子对m/z 616.6→954.9;
图8为模拟临床样品,采用膜电喷雾质谱法和纸喷雾质谱法特异性肽段HR、特异性肽段TN、特异性肽段MR和特异性肽段AK的标准曲线;
图9A-图9L分别为模拟临床样本对MESI-MS/MS法快速检测细菌毒素蛋白的验证,其中图9A为模拟粪便样品中肽段FK的质谱图,图9B为模拟粪便样品中肽段HR的质谱图,图9C为模拟粪便样品中肽段TN的质谱图,图9D为模拟粪便样品中肽段IK的质谱图,图9E为模拟粪便样品中肽段MR的质谱图,图9F为模拟粪便样品中肽段YKL的质谱图,图9G为模拟粪便样品中肽段AK的质谱图,图9H为模拟粪便样品中肽段YKH的质谱图,图9I图为模拟血清样品中肽段MR的质谱图,图9J为模拟血清样品中肽段YKL的质谱图,图9K为模拟血清样品中肽段AK的质谱图,图9L为模拟血清样品中肽段YKH的质谱图;
图10A-10B分别为对Ctx阳性和阴性样本的主成分分析(PCA)结果和偏最小二乘法-判别分析(PLS-DA)法的VIP(变量重要性在投影中的值)数值图;
图11A-11B分别为对LT阳性和阴性样本的主成分分析(PCA)结果和偏最小二乘法-判别分析(PLS-DA)法的VIP(变量重要性在投影中的值)数值图;
图12A-12B分别为对Stx1阳性和阴性样本的主成分分析(PCA)结果和偏最小二乘法-判别分析(PLS-DA)法的VIP(变量重要性在投影中的值)数值图;
图13A-13B分别为对Stx2阳性和阴性样本的主成分分析(PCA)结果和偏最小二乘法-判别分析(PLS-DA)法的VIP(变量重要性在投影中的值)数值图;
图14为电压对膜电喷雾电离效果的影响。
具体实施方式
下面参考附图来说明本发明的实施例。在本发明的一个附图或一种实施方式中描述的元素和特征可以与一个或更多个其他附图或实施方式中示出的元素和特征相结合。应当注意,为了清楚的目的,附图和说明中省略了与本发明无关的、本领域普通技术人员已知的部件或处理的表示和描述。
下面结合附图对本发明做进一步描述。
1本发明检测所用菌株与试剂
1.1菌株(表1)
表1菌株列表
aND:AB5肠毒素阴性
1.2试剂(表2)
表2试剂列表
2实验方法
2.1细菌培养
细菌AB5肠毒素Ctx基因阳性菌株Vibrio cholerae,细菌毒素Ctx基因阴性菌株Vibrio cholerae,细菌AB5肠毒素LT基因阳性菌株Escherichia coli(ETEC),细菌AB5肠毒素Stx基因阳性菌株Escherichia coli(STEC),细菌AB5肠毒素LT基因、Stx基因阴性菌株Escherichia coli等细菌菌株在Luria-Bertani(LB)培养基中37℃持续振荡培养。LB培养基接种了1:1000稀释的指数期培养(OD600=0.6)的菌株。初始培养浓度大约为1×106CFU·mL-1,记录下OD600,并且提取不同培养时间的蛋白。
2.2PCR检测菌株ctx、lt、stx1、stx2基因
相应的菌株通过PCR方法来确认是否携带ctx、lt、stx1、stx2基因,ctx基因引物包含引物ctx-F:5’-ACAGAGTGAGTACTTTGACC-3’(SEQ ID NO.9所示)和ctx-R:5’-ATACCATCCATATATTTGGGAG-3’(SEQ ID NO.10所示);lt基因引物lt-F:5’-TCTCTATGTGCATACGGAGC-3’(SEQ ID NO.11所示)和lt-R:5’-CCATACTGATTGCCGCAA-3’(SEQ ID NO.12所示);stx1基因引物stx1-F:5’-AAATCGCCATTCGTTGACTACTTCT-3’(SEQ ID NO.13所示)和stx1-R:5’-TGCCATTCTGGCAACTCGCGATGCA-3’(SEQ ID NO.14所示);stx2基因引物stx2-F:5’-CAGTCGTCACTCACTGGTTTCATCAC-3’(SEQ ID NO.15所示)和stx2-R:5’-GGATATTCTCCCCACTCTGACACC-3’(SEQ ID NO.16所示);
扩增程序包含以下过程的30个循环,每个过程为:95℃(30秒),55℃(30秒),72℃(45秒),72℃(8分钟的延伸期)。PCR的扩增产物(774bp),通过琼脂糖凝胶电泳检测并通过ABI PRISM 3730XL测序仪(中国北京)测序。
2.3模拟血清样品的制备
由健康志愿者提供人类血清样本经10倍的纯净水稀释后,直接加入细菌AB5肠毒素Stx1蛋白和细菌AB5肠毒素Stx2蛋白,以备检测。
2.4模拟粪便样品的制备
由健康志愿者提供人类粪便样本,按1:5比例用PBS缓冲液稀释,使其含水量大于85%以模拟水样腹泻粪便。在模拟水样腹泻粪便中加入50μL相应的菌液(~1×108CFU·mL-1)并加入8mL增菌培养基培养2h,以备检测。
2.5蛋白提取和酶切
细菌蛋白或实际样本总蛋白由裂解液超声波提取(7M尿素,2M硫脲,4%CHAPS和1%DTT)。悬浊液16,000g离心15min,然后取上清液通过Bradford法测定蛋白浓度。使用微波法进行蛋白酶切。蛋白样品在50μL的50mM碳酸氢铵溶液中溶解并且加入5mM DTT在95℃反应5min,随后在15mM的IAA存在下在黑暗处反应30分钟。最后使用测序级胰酶按照酶/底物1:50(质量比)的比例加入胰酶,并且在700W的微波下酶切15min。
2.6膜电喷雾电离质谱法(MESI-MS)分析
所有的MESI-MS实验通过Bruker HCT质谱仪(德国Bruker Daltonics有限公司)进行。
所采用膜电喷雾电离装置(MESI),如图1所示,包括:吸水部件1;透析膜2,位于吸水部件1上;导电部件3,设置于透析膜2。导电部件3为向透析膜2施加高压电场的导体,其可以为但不限于金属导电夹子,例如可以为铜导电夹。
透析膜2均具有至少一尖端,即进样端,将该尖端正对质谱仪进样口,并使导电部件3、尖端、质谱仪进样口位于同一直线上,便于在质谱仪进样口实现样品的电喷雾。
透析膜2的尖端可以为一锐角、直角或钝角,其角度优选为40-150°,对透析膜2的具体形状没有限定,其可以为前部具有一尖端,后部呈圆弧形的不规则形状;也可以是规则的三角形,优选为等边三角形,边长可以为5-10mm,优选为7mm。
透析膜2可以为多层,例如两层、三层或更多层,依次叠置于吸水部件1上,且各层透析膜2的截留分子量依次增大,距离吸水部件1最远的透析膜的截留分子量最大。
优选采用包括双层透析膜的电喷雾离子源装置。
采用氮气为干燥气体(流速10L·min-1;温度150℃)。正离子模式,毛细管电压为-1.5kV。如图2所示,膜电喷雾电离质谱装置(MESI)为在一张预湿的滤纸上设置两层透析膜(第一层截留分子量为8-14kDa,第二层为3.5kDa)。第二层透析膜的大小约为边长7mm的三角形。用金属夹将滤纸与膜固定于质谱进样口前端,三角形膜的尖端对准质谱入口,并与之保持约5mm的距离。两微升的待测样品溶液加入到膜上。等待约30s,以便待测溶液滤过透析膜,去除第一层膜并在第二层膜上加上3kV的直流电压。随后加入8μL的洗脱溶液(甲醇:水:甲酸体积比为60:40:0.1)。在高压电场及冲洗洗脱溶液的作用下,待测溶液向透析膜的前端运动,在前端的一角产生样品离子并形成喷雾。
3结果
3.1细菌AB5肠毒素蛋白特异性肽段的选择
细菌AB5肠毒素蛋白Ctx、LT、Stx1、Stx2的理论酶切肽段通过在Exapasy(http://web.expasy.org/peptide_mass/)检索获得。采用BLAST算法验证理论酶切肽段在细菌中没有同源性。特异性肽段的选择需遵循以下几个原则:1)是相应AB5肠毒素蛋白特有的;2)有很高的质谱强度和离子化效率;3)无不稳定的氨基酸和胰蛋白酶漏切位点。
最后,本发明结果筛选确定,Ctx、LT、Stx1、Stx2各有两个特异性肽段进行了合成并应用于下一步实验,Ctx:FLDEYQSK(FK)、HDDGYVSTSISLR(HR);TPNSIAAISMEN(TN)、ILSYTESMAGK(IK);Stx1;MASDEFPSMCPADGR(MR)、YNDDDTFTVK(YKL);Stx2;AVNEESQPECQITGDRPVIK(AK20)、YNEDDTFTVK(YKH)。
3.2膜电喷雾电离质谱法(MESI-MS)检测AB5肠毒素蛋白Ctx、LT、Stx1、Stx2特异性肽段
首先,菌株信息需经过验证。其中,菌株携带或不携带ctx、lt、stx1、stx2基因采用PCR方法确认(图3A-图3B)。
图4为合成标准Ctx特异性肽段(1mM)的MESI-MS/MS分析:图4A Ctx来源的多肽(FLDEYQSK)的母子离子对m/z 515.4→769.7;图4B Ctx来源的多肽(HDDGYVSTSISLR)的母子离子对m/z 725.8→1028.4;这里采用二级质谱(MS/MS)对多肽做进一步的检测,图4A和4B表示,m/z 769.7是肽段FK通过二级质谱得到的y6+离子,m/z 1028.4都是肽段HR通过二级质谱得到的y10+离子,基于此,为了准确检测Ctx蛋白的特异性肽段,选取肽段FK(m/z 515.4→769.7)和HR(m/z 725.8→1028.4)的母离子/子离子对作为分析对象。
图5为合成标准LT特异性肽段(1mM)的MESI-MS/MS分析:图5A LT来源的多肽(TPNSIAAISMEN)的母子离子对m/z 635.3→615.3;图5B LT来源的多肽(ILSYTESMAGK)的母子离子对m/z 600.6→644.7;这里采用二级质谱(MS/MS)对多肽做进一步的检测,图5A和5B表示,m/z 615.3是肽段TN通过二级质谱得到的(y5+Na)+离子,m/z 644.7是肽段IK通过二级质谱得到的(y6+Na)+离子,基于此,为了准确检测LT蛋白的特异性肽段,选取肽段TN(m/z 635.3→615.3)和IK(m/z 600.6→644.7)的母离子/子离子对作为分析对象。
图6为合成标准Stx1特异性肽段(1mM)的MESI-MS/MS分析:图6A Stx1来源的多肽(MASDEFPSMCPADGR)的母子离子对m/z 807.0→934.1;图6B Stx1来源的多肽(YNDDDTFTVK)的母子离子对m/z 607.6→940.9;这里采用二级质谱(MS/MS)对多肽做进一步的检测,图6A和6B表示,m/z 934.1是肽段MR通过二级质谱得到的y9+离子,m/z940.9是肽段YKL通过二级质谱得到的y8+离子,基于此,为了准确检测Stx1蛋白的特异性肽段,选肽段MR(m/z 807.0→934.1)和YKL(m/z 607.6→940.9)的母离子/子离子对作为分析对象。
图7为合成标准Stx2特异性肽段(1mM)的MESI-MS/MS分析:图7A Stx2来源的多肽(AVNEESQPECQITGDRPVIK)的母子离子对m/z 738.4→728.4;图7B Stx2来源的多肽(YNEDDTFTVK)的母子离子对m/z 616.6→954.9;这里采用二级质谱(MS/MS)对多肽做进一步的检测,图7A和7B表示,m/z 728.4是肽段AK通过二级质谱得到的(y13)2+离子,m/z 954.9是肽段YKH通过二级质谱得到的y8+离子,基于此,为了准确检测Stx2蛋白的特异性肽段,选取肽段AK(m/z 738.4→728.4)和YKH(m/z 616.6→954.9)的母离子/子离子对作为分析对象。
MESI-MS使得质谱快速分析具有显著去除基质效应的能力,固而在本发明中,脱盐步骤可省略从而缩短了检测时间。将特异性肽段作为检测目标,间接检测细菌AB5肠毒素蛋白Ctx、LT、Stx1、Stx2而非直接检测细菌AB5肠毒素蛋白Ctx、LT、Stx1、Stx2本身,使得可以巧妙的运用MESI-MS的透析膜去除样本中干扰分析的因素。其中,样品体系内残余的胰蛋白酶可通过第一层透析膜除去(MWCO 8-14kDa)。在胰蛋白酶消化过程中引入的盐和其他小分子可通过第二层透析膜(MWCO 3.5kDa)除去。
3.3方法学验证
本发明将从空白模拟血浆样品与空白模拟粪便样品中提取所得蛋白的酶切肽段作为空白基质,用以考察添加该空白基质合成肽段的标准曲线线性度、LOD和LOQ。
如表3所示,模拟粪便样品中AB5肠毒素蛋白Ctx的2个特异性肽段在5-1000fmol·μL-1的线性范围的相关系数(r2)为0.9932和0.9986。肽段FK和HR的LOD为2fmol·μL-1,LOQ为5fmol·μL-1;
模拟粪便样品中AB5肠毒素蛋白LT的2个特异性肽段在5-1000fmol·μL-1的线性范围的相关系数(r2)为0.9987和0.9971。肽段TN和IK的LOD为2fmol·μL-1,LOQ为5fmol·μL-1;
模拟粪便样品中AB5肠毒素蛋白Stx1的2个特异性肽段在5-1000fmol·μL-1的线性范围的相关系数(r2)为0.9854和0.9979。肽段MR和VKL的LOD为2fmol·μL-1,LOQ为5fmol·μL-1;
模拟粪便样品中AB5肠毒素蛋白Stx2的2个特异性肽段在5-1000fmol·μL-1的线性范围的相关系数(r2)为0.9876和0.9898。肽段AK和YKH的LOD为2fmol·μL-1,LOQ为5fmol·μL-1;
模拟血清样品中AB5肠毒素蛋白Stx1的2个特异性肽段在10-1000fmol·μL-1的线性范围的相关系数(r2)为0.9852和0.9968。肽段MR和VKL的LOD为3fmol·μL-1,LOQ为10fmol·μL-1;
模拟血清样品中AB5肠毒素蛋白Stx2的2个特异性肽段在10-1000fmol·μL-1的线性范围的相关系数(r2)为0.9947和0.9835。肽段AK和YKH的LOD为3fmol·μL-1,LOQ为10fmol·μL-1;
采用质控样本(浓度10、50和200fmol·μL-1的合成肽段)考察方法精密度、准确度和回收率方法学的精密度用相对标准偏差(RSD)评价,准确度通过对每个掺入了空白基质的质控样本,评价计算出的浓度和实际浓度的比率来表征,回收率通过空白基质中已知的肽段量来计算(表4)。
表3模拟粪便样品中特异性肽段的线性范围、最低检出限和最低定量限
aLOD:最低检出限,SNR=5;bLOQ:最低定量限,SNR=15
表4模拟血清样品中特异性肽段的线性范围、最低检出限和最低定量限
aLOD:最低检出限,SNR=5;bLOQ:最低定量限,SNR=15
表5模拟粪便样品中MESI-MS/MS方法学精密度、准确度及回收率(n=5)
表6模拟血清样品中MESI-MS/MS方法学精密度、准确度及回收率(n=5)
由此,本发明采用高低不同浓度的上述特异性肽段,经测定,本发明方法的精密度、准确度、回收率以及线性范围等均满足要求。
3.4统计分析
通过Matlab软件分析模拟环境样本的质核比m/z和相应离子的丰度数据。并且使用SIMCA-P软件进行多元统计。使用主成分分析(PCA)和偏最小二乘法-判别分析(PLS-DA)构建了Ctx、LT、Stx1、Stx2AB5肠毒素蛋白阳性和阴性组的模型。而通过PLS-DA的VIP(变量重要性在投影中的值)值的筛选可以表现出armA阳性和阴性的m/z的显著差异。
3.5和纸喷雾电离质谱法的比较
类似的,纸喷雾(PS)是将2μL的待测样品直接加在三角形层析纸上(规格为底部宽度6mm,高度6mm),在纸后端加4.5kV的直流电压,10μL的洗脱溶剂(甲醇/水/甲酸,50:50:0.1,v/v)加在待测样品处进行喷雾。图8为模拟临床样品,采用膜电喷雾质谱法和纸喷雾质谱法对肽段的标准曲线;如图8显示,膜喷雾具有更低的检测限和信噪比,结果要大大优于纸喷雾的结果。
4模拟临床样品的快速测定
分别添加有Stx1和Stx2毒素蛋白的模拟临床血清样品与分别添加有VC995、VC1119、VC1283、VC2448、VC4480、VC7258、ET002、ET007、ET011、ET019、ET036和10407的模拟临床粪便样品被用于模拟真实的临床检测。血清临床样品的获得是在空白血清添加毒素蛋白;粪便临床样品为空白粪便中添加相应的致病细菌,经过2h的增菌培养。肽段FK、HR、TN、IK、HR、YKL、AK和YKH在相对应的阳性的模拟粪便样品中均被检测到,而在相对应的阴性的模拟粪便样品未检出特异性肽段(图9A-9H),肽段HR、YKL、AK和YKH在相对应的阳性的模拟血清样品中均被检测到,而在相对应的阴性的模拟血清样品未检出特异性肽段(图9I-9L)。
为进一步验证结论,选取16组Ctx阴性和阳性菌株制备的模拟临床粪便样品来进一步确定ctx基因(表1中1-12号)。16组样本中包含8组Ctx阳性样本和8组Ctx阴性样本,随后对MS/MS信号谱图数据进行多元统计分析。如图10A所示,进过主成分分析(PCA),主成分1阐明了菌株数据的53.9%,主成分2阐明了数据的13.9%,通过主成分1和主成分2,阳性样本的MS/MS数据和阴性样本具有显著的差异性,这种差异性能使阳性和阴性样本显著地区分开来。图10B表示的是偏最小二乘法-判别分析(PLS-DA)法的VIP(变量重要性在投影中的值)数值图。以上的结果表明,FK(m/z 515.4)和HR(m/z 725.8)非常适合作为区分两种样本的变量。
选取16组LT阴性和阳性菌株制备的模拟临床粪便样品来进一步确定lt基因(表1中13-18,30-34号)。16组样本中包含8组LT阳性样本和8组LT阴性样本,随后对MS/MS信号谱图数据进行多元统计分析。如图11A所示,进过主成分分析(PCA),主成分1阐明了菌株数据的39.4%,主成分2阐明了数据的10.8%,通过主成分1和主成分2,阳性样本的MS/MS数据和阴性样本具有显著的差异性,这种差异性能使阳性和阴性样本显著地区分开来。图11B表示的是偏最小二乘法-判别分析(PLS-DA)法的VIP(变量重要性在投影中的值)数值图。以上的结果表明,TN(m/z 635.3)和IK(m/z 600.6)非常适合作为区分两种样本的变量。
选取16组Stx1阴性和阳性菌株制备的模拟临床粪便样品来进一步确定stx1基因(表1中19-23,29,30-34号)。16组样本中包含8组Stx1阳性样本和8组Stx1阴性样本,随后对MS/MS信号谱图数据进行多元统计分析。如图12A所示,进过主成分分析(PCA),主成分1阐明了菌株数据的42.4%,主成分2阐明了数据的10.2%,通过主成分1和主成分2,阳性样本的MS/MS数据和阴性样本具有显著的差异性,这种差异性能使阳性和阴性样本显著地区分开来。图12B表示的是偏最小二乘法-判别分析(PLS-DA)法的VIP(变量重要性在投影中的值)数值图。以上的结果表明,MR(m/z 807.0)和YKL(m/z 607.6)非常适合作为区分两种样本的变量。
选取16组Stx2阴性和阳性菌株制备的模拟临床粪便样品来进一步确定stx2基因(表1中24-29,30-34号)。10组样本中包含8组Stx2阳性样本和8组Stx2阴性样本,随后对MS/MS信号谱图数据进行多元统计分析。如图13A所示,进过主成分分析(PCA),主成分1阐明了菌株数据的48.9%,主成分2阐明了数据的15.8%,通过主成分1和主成分2,阳性样本的MS/MS数据和阴性样本具有显著的差异性,这种差异性能使阳性和阴性样本显著地区分开来。图13B表示的是偏最小二乘法-判别分析(PLS-DA)法的VIP(变量重要性在投影中的值)数值图。以上的结果表明,AK(m/z 738.4)和YKH(m/z 616.6)非常适合作为区分两种样本的变量。
5对膜电喷雾电离条件的优化
本发明还对膜电喷雾直流电压的选择进行了实验和讨论。电压优化的范围为1-3kV。电压在低于1kV的条件下,难以形成喷雾;高于3kV,在本发明的条件下容易在空气中产生放电无法形成稳定而有效的喷雾。通过对峰强度的考察,在3kV的条件下可以产生高强度且稳定的喷雾(图14)。
由此可见,本发明对添加了携带或不携带4种AB5肠毒素蛋白编码基因的霍乱弧菌和大肠杆菌的人粪便模拟样本,以及添加或不添加Stx1与Stx2毒素蛋白的人血清模拟样本进行检测发现本方法可达到较高的灵敏度与准确度,而且本发明快速检测方法还可以拓展到对其它病原菌的其它耐药基因的检测。
虽然已经详细说明了本发明及其优点,但是应当理解在不超出由所附的权利要求所限定的本发明的精神和范围的情况下可以进行各种改变、替代和变换。而且,本申请的范围不仅限于说明书所描述的过程、设备、手段、方法和步骤的具体实施例。本领域内的普通技术人员从本发明的公开内容将容易理解,根据本发明可以使用执行与在此所述的相应实施例基本相同的功能或者获得与其基本相同的结果的、现有和将来要被开发的过程、设备、手段、方法或者步骤。因此,所附的权利要求旨在在它们的范围内包括这样的过程、设备、手段、方法或者步骤。
参考文献:
[1]W.A.Petri,Jr.,M.Miller,H.J.Binder,M.M.Levine,R.Dillingham and R.L.Guerrant.Enteric infections,diarrhea,and their impact on function and development.J Clin Invest.2008,118,1277.
[2]L.Johannes and W.Romer.Shiga toxins--from cell biology to biomedical applications.Nat Rev Microbiol.2010,8,105.
[3]T.Beddoe,A.W.Paton,J.Le Nours,J.Rossjohn and J.C.Paton.Structure,biological functions and applications of the AB5toxins.Trends Biochem Sci.2010,35,411.
[4]B.D.Spangler.Structure and function of cholera toxin and the related Escherichia coli heat-labile enterotoxin.Microbiol Rev.1992,56,622.
[5]P.C.Feng and S.P.Reddy.Prevalence and diversity of enterotoxigenic Escherichia coli strains in fresh produce.J Food Prot.2014,77,820.
[6]P.I.Tarr,C.A.Gordon and W.L.Chandler.Shiga-toxin-producing Escherichia coli and haemolytic uraemic syndrome.Lancet.2005,365,1073.
[7]S.Mukhopadhyay and A.D.Linstedt.Retrograde trafficking of AB(5)toxins:mechanisms to therapeutics.J Mol Med(Berl).2013,91,1131.
[8]D.V.Singh,S.R.Isac and R.R.Colwell.Development of a hexaplex PCR assay for rapid detection of virulence and regulatory genes in Vibrio cholerae and Vibrio mimicus.J Clin Microbiol.2002,40,4321.
[9]K.A.Koskela,P.Matero,J.M.Blatny,E.M.Fykse,J.S.Olsen,L.O.Nuotio and S.Nikkari.A multiplatform real-time polymerase chain reaction detection assay for Vibrio cholerae.Diagn Microbiol Infect Dis.2009,65,339.
[10]R.Tozzoli,A.Caprioli,S.Cappannella,V.Michelacci,M.L.Marziano and S.Morabito.Production of the subtilase AB5 cytotoxin by Shiga toxin-negative Escherichia coli.J Clin Microbiol.2010,48,178.
[11]S.S.Karve and A.A.Weiss.Glycolipid binding preferences of Shiga toxin variants.PLoS One.2014,9,e101173.
[12]N.Bunyakul,C.Promptmas and A.J.Baeumner.Microfluidic biosensor for cholera toxin detection in fecal samples.Anal Bioanal Chem.2015,407,727.
[13]J.T.Mason,L.Xu,Z.M.Sheng and T.J.O'Leary.A liposome-PCR assay for the ultrasensitive detection of biological toxins.Nat Biotechnol.2006,24,555.
[14]T.Nagatsuka,H.Uzawa,K.Sato,S.Kondo,M.Izumi,K.Yokoyama,I.Ohsawa,Y.Seto,P.Neri,H.Mori,Y.Nishida,M.Saito and E.Tamiya.Localized surface plasmon resonance detection of biological toxins using cell surface oligosaccharides on glyco chips.ACS Appl Mater Interfaces.2013,5,4173.
[15]J.P.Williams,D.C.Smith,B.N.Green,B.D.Marsden,K.R.Jennings,L.M.Roberts and J.H.Scrivens.Gas phase characterization of the noncovalent quaternary structure of cholera toxin and the cholera toxin B subunit pentamer.Biophys J.2006,90,3246.
[16]K.J.Boggio,E.Obasuyi,K.Sugino,S.B.Nelson,N.Y.Agar and J.N.Agar.Recent advances in single-cell MALDI mass spectrometry imaging and potential clinical impact.Expert Rev Proteomics.2011,8,591.
[17]S.Date,H.Mizuno,N.Tsuyama,T.Harada and T.Masujima.Direct drug metabolism monitoring in a live single hepatic cell by video mass spectrometry.Anal Sci.2012,28,201.
[18]R.B.Cody,J.A.Laramee and H.D.Durst.Versatile new ion source for the analysis of materials in open air under ambient conditions.Anal Chem.2005,77,2297.
[19]Z.Takats,J.M.Wiseman,B.Gologan and R.G.Cooks.Mass spectrometry sampling under ambient conditions with desorption electrospray ionization.Science.2004,306,471.
[20]H.Wang,J.Liu,R.G.Cooks and Z.Ouyang.Paper spray for direct analysis of complex mixtures using mass spectrometry.Angew Chem Int Ed Engl.2010,49,877.
[21]Y.Zheng,X.Zhang,Z.Bai and Z.Zhang.Characterization of the surface properties of MgO using paper spray mass spectrometry.Rapid Commun Mass Spectrom.2016,30 Suppl 1,217.
[22]X.Zhan,Z.Zhao,X.Yuan,Q.Wang,D.Li,H.Xie,X.Li,M.Zhou and Y.Duan.Microwave-induced plasma desorption/ionization source for ambient mass spectrometry.Anal Chem.2013,85,4512.
[23]D.E.Damon,Y.S.Maher,M.Yin,F.P.Jjunju,I.S.Young,S.Taylor,S.Maher and A.K.Badu-Tawiah.2D wax-printed paper substrates with extended solvent supply capabilities allow enhanced ion signal in paper spray ionization.Analyst.2016,141,3866.
[24]J.Liu,H.Wang,N.E.Manicke,J.M.Lin,R.G.Cooks and Z.Ouyang.Development,characterization,and application of paper spray ionization.Anal Chem.2010,82,2463.
[25]Y.Zhang,X.Li,H.Nie,L.Yang,Z.Li,Y.Bai,L.Niu,D.Song and H.Liu.Interface for Online Coupling of Surface Plasmon Resonance to Direct Analysis in Real Time Mass Spectrometry.Anal Chem.2015,87,6505.
SEQUENCE LISTING
<110> 中国疾病预防控制中心传染病预防控制所
<120> 细菌AB5肠毒素蛋白的定性、定量检测方法
<130> YRI20170029
<160> 16
<170> PatentIn version 3.3
<210> 1
<211> 8
<212> PRT
<213> 人工序列
<400> 1
Phe Leu Asp Glu Tyr Gln Ser Lys
1 5
<210> 2
<211> 13
<212> PRT
<213> 人工序列
<400> 2
His Asp Asp Gly Tyr Val Ser Thr Ser Ile Ser Leu Arg
1 5 10
<210> 3
<211> 12
<212> PRT
<213> 人工序列
<400> 3
Thr Pro Asn Ser Ile Ala Ala Ile Ser Met Glu Asn
1 5 10
<210> 4
<211> 11
<212> PRT
<213> 人工序列
<400> 4
Ile Leu Ser Tyr Thr Glu Ser Met Ala Gly Lys
1 5 10
<210> 5
<211> 15
<212> PRT
<213> 人工序列
<400> 5
Met Ala Ser Asp Glu Phe Pro Ser Met Cys Pro Ala Asp Gly Arg
1 5 10 15
<210> 6
<211> 10
<212> PRT
<213> 人工序列
<400> 6
Tyr Asn Asp Asp Asp Thr Phe Thr Val Lys
1 5 10
<210> 7
<211> 20
<212> PRT
<213> 人工序列
<400> 7
Ala Val Asn Glu Glu Ser Gln Pro Glu Cys Gln Ile Thr Gly Asp Arg
1 5 10 15
Pro Val Ile Lys
20
<210> 8
<211> 10
<212> PRT
<213> 人工序列
<400> 8
Tyr Asn Glu Asp Asp Thr Phe Thr Val Lys
1 5 10
<210> 9
<211> 20
<212> DNA
<213> 人工序列
<400> 9
acagagtgag tactttgacc 20
<210> 10
<211> 22
<212> DNA
<213> 人工序列
<400> 10
ataccatcca tatatttggg ag 22
<210> 11
<211> 20
<212> DNA
<213> 人工序列
<400> 11
tctctatgtg catacggagc 20
<210> 12
<211> 18
<212> DNA
<213> 人工序列
<400> 12
ccatactgat tgccgcaa 18
<210> 13
<211> 25
<212> DNA
<213> 人工序列
<400> 13
aaatcgccat tcgttgacta cttct 25
<210> 14
<211> 25
<212> DNA
<213> 人工序列
<400> 14
tgccattctg gcaactcgcg atgca 25
<210> 15
<211> 26
<212> DNA
<213> 人工序列
<400> 15
cagtcgtcac tcactggttt catcac 26
<210> 16
<211> 24
<212> DNA
<213> 人工序列
<400> 16
ggatattctc cccactctga cacc 24
- 还没有人留言评论。精彩留言会获得点赞!