一种微流控芯片、单细胞蛋白定量检测装置和方法与流程
本发明涉及检测技术领域,尤其涉及一种微流控芯片、单细胞蛋白定量检测装置和方法。
背景技术:
蛋白质作为生命体的主要组成成分,主导或参与了几乎所有的生物活动与生物学功能。蛋白质的数量与活性,是反映生命活动变化的最主要指标,与细胞的分化、神经的传导等紧密关联。因此,多种蛋白质分析方法诸如凝胶电泳、免疫分析、色谱与质谱等,被发展应用于细胞过程分子机制的研究、疫苗与药物等。然而这些方法是针对宏观大量蛋白质而发展起来的,需要足够数量的细胞来分析,其最终结果是细胞群体水平的平均结果,这会掩盖潜在的反应过程,使我们错失很多细胞过程中关键分子机制,如胚胎发育的细胞定向分化等。而单细胞水平测得数据的数据更能够反映生命事件的真实情况,具有重要的科学价值。因此,研制高通量单细胞蛋白定量检测分析仪器,在病原生物学、免疫学、血液诊断与干细胞生物学等重大科学研究领域有着迫切的需求。
目前可以定量检测单细胞蛋白的方法主要是流式细胞术和基于微流控技术的蛋白检测方法。
流式细胞术(flowcytometry)是单细胞蛋白分析的主要手段,其原理是通过荧光标记待测蛋白实现单个细胞多参数、快速的定量分析,通过表面荧光分子浓度可控的校准微球可以得到标准曲线,对比标准曲线可以得到蛋白浓度。
微流控技术是指在微观尺寸下控制和检测流体的技术,由于特征尺寸与细胞尺寸相匹配,适合单细胞操纵与特性检测。目前微流控技术与单细胞蛋白分析的结合尚处于起步阶段,现有的检测方法主要有微型流式细胞术、微孔序列、微沟道序列和单细胞蛋白质印迹法。
在实现本发明的过程中,申请人发现上述现有技术存在如下技术缺陷:
流式细胞仪中使用的校准微球只能对细胞膜蛋白进行定量,而在校准微球内部进行荧光分子定量修饰的方法尚不成熟,无法使用传统校准微球方法进行单个细胞内蛋白表达的定量检测。
现有的基于微流控技术的单细胞蛋白检测方法存在通量低,不能检测胞浆蛋白等问题。
技术实现要素:
(一)要解决的技术问题
本发明的主要目的是提供一种微流控芯片、单细胞蛋白定量检测装置以及方法。
(二)技术方案
本发明提供了一种微流控芯片,包括衬底、以及所述衬底上的有机硅材料层,所述衬底和有机硅材料层形成有沟道,所述沟道通入细胞悬液、细胞裂解液、荧光抗体以及油相混合液;所述衬底上还形成有一窗口,在所述沟道中产生包裹有单细胞的油包水型液滴,所述油包水型液滴中的细胞被细胞裂解液裂解,细胞中的蛋白与荧光抗体结合,形成的荧光液滴经过窗口时被检测。
优选地,所述衬底为石英衬底,所述有机硅材料层为聚二甲基硅氧烷层。
本发明还提供了一种单细胞蛋白定量检测装置,包括上述微流控芯片,还包括:压力控制模块、荧光检测模块和中央控制模块;所述压力控制模块对沟道进行流速调节;所述荧光检测模块包括:激光激发组件和荧光采集组件;所述激光激发组件向微流控芯片的窗口发射激光,使沟道内的荧光抗体受激发光;荧光采集组件采集荧光液滴的荧光亮度数据;所述中央控制模块,向压力控制模块和荧光检测模块发送控制信号,并接收荧光检测模块采集的荧光亮度数据,进行数据的处理与分析,得到液滴大小数据,并对比标准曲线得到单细胞内蛋白数量。
本发明还提供了一种微流控芯片的制备方法,用于制备上述微流控芯片,包括:步骤a:制作su-85种子层;步骤b:制作su-825细胞通道层;步骤c:pdms的浇注、翻模,制得pdms器件;步骤d:在石英衬底上溅射铬;步骤e:在溅射有铬的石英衬底上制作az1500掩膜;步骤f:进行腐蚀处理,形成带有铬窗口的石英衬底;步骤g:pdms器件与石英衬底的键合,制成微流控芯片。
本发明还提供了一种单细胞蛋白定量检测方法,使用上述单细胞蛋白定量检测装置检测单细胞蛋白数量,包括:步骤s1:制备荧光抗体;步骤s2:注入油相及水相形成包裹有细胞的液滴,细胞裂解后形成荧光液滴;步骤s3:采集荧光亮度数据;步骤s4:处理荧光亮度数据得到单细胞蛋白数量。
优选地,所述步骤s1制备的荧光抗体为可识别蛋白不同表位的荧光抗体对,其两个抗体分别连接荧光基团a和荧光基团b,荧光集团a为hilytefluortm555,吸收光波峰/发射光波峰=550/566nm,荧光集团b为hilytefluortm647,吸收光波峰/发射光波峰=649/674nm;荧光集团a的发射光特征谱线与荧光集团b的吸收光特征谱线重叠,且当两个抗体与蛋白结合后,荧光集团a和荧光集团b相距10nm以内,发生非放射性的能量转移。
优选地,所述步骤s2包括:将微流控芯片装载于单细胞蛋白定量检测装置;向微流控芯片的沟道通入细胞悬液、细胞裂解液和荧光抗体、以及矿物油和表面活性剂的油相混合液;细胞悬液、细胞裂解液和荧光抗体形成水相混合液,水相混合液在油相混合液的夹流下形成油包水型液滴,且每个油包水型液滴中包含不多于一个细胞,细胞裂解液将细胞裂解,荧光抗体与细胞中的单笔结合形成荧光液滴,荧光液滴接着进入微流控芯片的窗口。
优选地,所述步骤s3包括:所述荧光液滴逐一通过窗口时,激光激发组件发射的激光经窗口激发荧光基团a发光,荧光采集组件检测荧光基团b的荧光亮度数据。
优选地,所述步骤s3还包括:绘制标准曲线,包括:制备一组浓度已知的待测细胞蛋白;将各个浓度的待测细胞蛋白与荧光抗体形成一组乳化液滴,并采集各个乳化液滴的荧光亮度数据,绘制出表示蛋白浓度与荧光亮度关系的标准曲线。
优选地,所述步骤s4包括:计算荧光液滴的长度;设置荧光亮度阈值,将荧光亮度高于所述阈值的荧光液滴作为对象液滴;对照标准曲线中的荧光亮度与蛋白浓度的关系,由对象液滴的荧光亮度值得到对象液滴的蛋白浓度;由对象液滴的蛋白浓度和长度得到单细胞蛋白数量。
(三)有益效果
从上述技术方案可以看出,本发明的微流控芯片、单细胞蛋白定量检测装置以及方法有以下有益效果:
(1)本发明将微流控芯片技术与液滴生成技术、荧光抗体制备技术以及荧光检测技术结合,实现单细胞内蛋白的高通量定量检测,为细胞生物特性的表征提供可靠的装置和方法。
(2)通过设计制作荧光抗体对及设置滤光片,可以有效地防止激发光给检测结果带来的影响,提高了检测精度,减小了检测误差。
(3)使用的倒置荧光显微镜、光电倍增管等设备,可以在传统的生物实验室使用,适应性强,可移植性高,便于实现。
(4)选取石英和聚二甲基硅氧烷等材料,基于微细加工方法进行制备,具有可批量化制造、一次性等特点。
附图说明
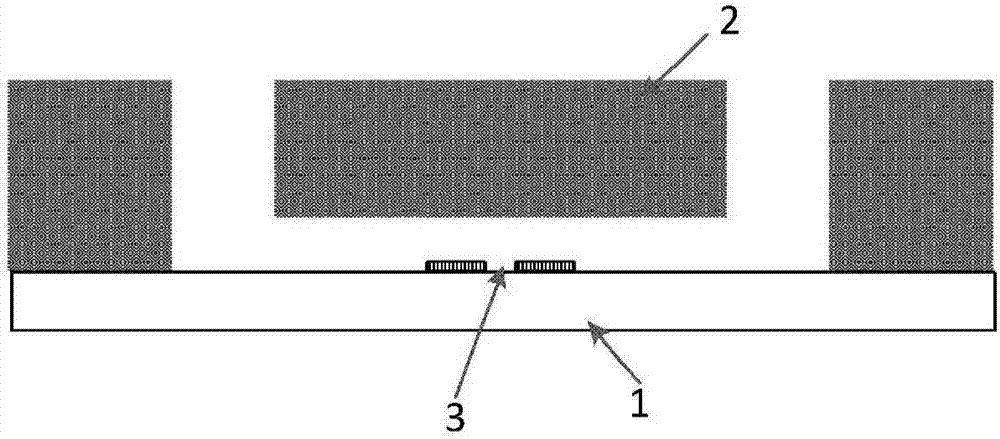
图1a和图1b为本发明实施例的微流控芯片的结构示意图和剖面图;
图2为本发明实施例的单细胞蛋白定量检测装置的结构示意图;
图3为本发明实施例的微流控芯片的制备方法流程图;
图4a至j为图3所述制备方法各步骤对应的芯片结构图;
图5为本发明实施例的单细胞蛋白定量检测方法的流程图;
图6为荧光液体在金属窗口中的时间与荧光亮度关系图。
符号说明
1-石英衬底;2-聚二甲基硅氧烷层;3-金属窗口;4-中央水平沟道;5-垂直沟道;6-侧沟道。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明进一步详细说明。
本发明将微流控芯片技术与液滴生成技术、荧光抗体制备技术以及荧光检测技术结合,提出一种微流控芯片、单细胞蛋白定量检测装置以及方法。本发明实现单个细胞的乳化液滴包裹,细胞裂解,细胞骨架蛋白与荧光标记的抗体结合,结合后荧光的强度由光电倍增管采集,对比基于乳化液滴的荧光亮度标定曲线,定量检测细胞内骨架蛋白的数量。
本发明第一实施例提供了一种微流控芯片,参见图1a和图1b,该芯片具有双层结构,包括石英衬底1、以及形成于石英衬底上的聚二甲基硅氧烷(polydimethylsiloxane,pdms)层2,石英衬底和pdms层形成十字型沟道,十字型沟道包括一中央水平沟道4、两个垂直沟道5和两个侧沟道6。
中央水平沟道入口设置有微注射泵,用于通入细胞悬液。
两个垂直沟道5分别设置于中央水平沟道4两侧并与中央水平沟道4连通,其入口也分别设置有微注射泵,用于通入矿物油和表面活性剂的油相混合液。
两个侧沟道6分别设置于中央水平沟道4与两个垂直沟道5之间,其与中央水平沟道4具有一夹角并与中央水平沟道4连通,其入口也分别设置有微注射泵,其中一个侧沟道通入细胞裂解液,另一个侧沟道通入荧光抗体。
在中央水平沟道的下游段,也就是比垂直沟道更靠近下游侧的位置,石英衬底上还形成有一金属窗口3。
在十字型沟道的十字交叉口处,即中央水平沟道4、侧沟道5和垂直沟道6的交汇处,可产生包裹有单细胞的油包水型液滴。液滴中的细胞被细胞裂解液裂解后,细胞中的骨架蛋白与荧光抗体结合,形成的荧光液滴通过荧光检测区域时,相应的荧光检测装置经金属窗口检测荧光液滴的荧光亮度,从而可以得到单细胞蛋白的数量。
在本发明中,金属窗口的材料可以采用铬,也可以采用其他不透光的非金属材料,或者使用透镜汇聚激光。微流控芯片沟道不限于十字形,也可以采用t型,沟道截面可以为矩形,也可以为梯形、圆形等结构;沟道入口也不局限于圆形,可以是正方形、三角形等。所采用的压力驱动方式不局限于入口用正压推入水油相,可以灵活调整出入口的正负压,另外还可以使用电致驱动装置代替微注射泵。
本发明第二实施例提供了一种单细胞蛋白定量检测装置,参照图2所示,其包括第一实施例所述的微流控芯片,还包括:压力控制模块、荧光检测模块和中央控制模块。
压力控制模块连接中央水平沟道、垂直沟道和侧沟道入口的微注射泵,用于对微注射泵进行控制,实现对各沟道注入液体的流速调节。通过调节水油两相流体的流速,可在十字形沟道中产生大小可控的连续的油包水型液滴,并使其通过金属窗口时被逐一检测。
荧光检测模块包括:激光激发组件和荧光采集组件。其中激光激发组件包括倒置荧光显微镜,该倒置荧光显微镜包括载物台和激光光源,载物台用于放置第一实施例所述的微流控芯片,激光光源用于向微流控芯片发射激光,激光经金属窗口进入沟道,使沟道内的荧光抗体受激发光。该激光光源可以内置于倒置荧光显微镜中,可以采用外置式的激光光源。
荧光采集组件包括:滤光片、光电倍增管和数据采集卡。滤光片位于光电倍增管与微流控芯片的金属窗口之间,用于选择性透光,数据采集卡连接光电倍增管,其中,数据采集卡与光电倍增管之间还包括一信号放大器,用于放大光电倍增管输出的信号。
中央控制模块,向压力控制模块和荧光检测模块发送控制信号,控制压力控制模块和荧光检测模块的操作,并接收荧光检测模块数据采集卡采集的数据,进行数据的处理与分析。
本发明实施例的单细胞蛋白定量检测装置,在中央控制模块的控制下工作。压力控制模块控制各个微注射泵,向中央水平沟道通入细胞悬液,向两个侧沟道分别通入细胞裂解液和荧光抗体,向两个垂直沟道通入矿物油和表面活性剂的油相混合液,在十字型沟道中产生包裹有单细胞的油包水型液滴,油包水型液滴中的细胞被细胞裂解液裂解后,细胞中的骨架蛋白与荧光抗体结合,形成的荧光液滴经过金属窗口。激光光源发射的激光经金属窗口进入沟道激发荧光抗体。
本发明采用的荧光抗体为可识别骨架蛋白不同表位的荧光抗体对,其两个抗体分别连接荧光基团a和荧光基团b。激光光源的激光频率对应于荧光基团a吸收光的特征谱线,在细胞裂解前,在激光的作用下,荧光基团a受激发光,即荧光液滴发射的荧光对应于荧光集团a发射光的特征谱线,该荧光被滤色片滤除,不会被光电倍增管检测到。细胞裂解后,分别连接荧光基团a和荧光基团b的两个抗体结合到骨架蛋白的不同表位,并且荧光集团a和b相距10nm以内。在荧光集团a的激发光的作用下,荧光基团b受激发光,即荧光液滴发射的荧光对应于荧光集团b发射光的特征谱线,该荧光经过滤色片的选择性透过,被光电倍增管检测放大并记录于数据采集卡中,数据采集卡将采集的荧光亮度数据传送至中央控制模块,中央控制模块由荧光亮度得到单细胞蛋白的数量。
本发明采用的荧光抗体为基于荧光共振能量转移的荧光抗体对,例如但不限于以下荧光抗体对:荧光集团a:hilytefluortm555,吸收光波峰/发射光波峰=550/566nm,荧光集团b:hilytefluortm647,吸收光波峰/发射光波峰=649/674nm。
由此可见,本发明实施例的单细胞蛋白定量检测装置,将微流控芯片技术与液滴生成技术、荧光抗体制备技术以及荧光检测技术结合,实现单细胞内蛋白的高通量定量检测,为细胞生物特性的表征提供可靠的装置。通过设计制作荧光抗体对及设置滤光片,可以有效地提高检测精度,减小检测误差。本发明使用的倒置荧光显微镜、光电倍增管等设备,可以在传统的生物实验室使用,适应性强,可移植性高,便于实现。
本发明第三实施例提供了一种微流控芯片的制备方法,参照图3所示,用于制备第一实施例所述的微流控芯片,包括:
步骤a:制作su-85种子层。
载玻片依次在丙酮、乙醇和去离子水中清洗,烘干后表面均匀旋转涂敷一层su-85,曝光形成种子层,见图4a。
步骤b:制作su-825细胞通道层。
在su-85种子层上均匀涂敷一层su-825,使用掩模板对准曝光,见图4b;然后显影,见图4c。
步骤c:pdms的浇注、翻模。
在步骤b制作好的阳模上浇注pdms,见图4d,经固化、翻模得到有压缩沟道的pdms层,在沟道两端打孔,制得pdms器件,见图4e。
步骤d:铬的溅射。
石英衬底依次在丙酮、乙醇和去离子水中清洗,烘干后表面均匀溅射一层铬,见图4f。
步骤e:制作az1500掩膜。
在溅射有铬的石英衬底上均匀涂敷一层az1500,放上掩模板对准曝光,见图4g;然后显影,见图4h。
步骤f:铬窗口的形成。
进行腐蚀处理,被az1500覆盖的部分被保护,没有az1500的区域被腐蚀掉,最后将多余的az1500洗掉,形成带有铬窗口的石英衬底,见图4i。
步骤g:pdms与石英衬底的键合。
将pdms器件清洁后,与石英衬底键合,形成微流控芯片,见图4j。
其中步骤a至c与步骤d至f可以并行进行,分别制备出pdms器件和石英衬底后再执行步骤g;也可以先执行步骤a至c,再执行步骤d至f,或者先执行步骤d至f,再执行步骤a至c,最后再执行步骤g。
本发明选取石英和聚二甲基硅氧烷等材料,基于微细加工方法进行制备,具有可批量化制造、一次性等特点。
本发明第四实施例提供了一种单细胞蛋白定量检测方法,使用如第二实施例所述的单细胞蛋白定量检测装置来检测单细胞蛋白数量,包括:
步骤s1:制备荧光抗体。
制备可识别骨架蛋白不同表位的荧光抗体对,其两个抗体分别连接荧光基团a和荧光基团b。其中荧光集团a的发射光特征谱线与荧光集团b的吸收光特征谱线重叠,且当两个抗体结合到骨架蛋白后,荧光集团a和b相距10nm以内,就会发生非放射性的能量转移。当来自荧光检测模块的激光照射到该荧光抗体后,荧光基团a受激发光,其将自身一部分能量以非辐射方式传递给荧光集团b,荧光集团b的发射光被光电倍增管检测并记录。由于荧光检测模块的激光与荧光集团b的发射光波长相差较远,通过选择合适滤光片,荧光集团a的发射光可以被荧光检测模块的滤色片滤除,避免其对检测结果产生影响。
本发明采用的荧光抗体为基于荧光共振能量转移的荧光抗体对,例如但不限于以下荧光抗体对:荧光集团a:hilytefluortm555,吸收光波峰/发射光波峰=550/566nm,荧光集团b:hilytefluortm647,吸收光波峰/发射光波峰=649/674nm。
步骤s2:注入油相及水相形成包裹有细胞的液滴,细胞裂解后形成荧光液滴。
该步骤包括制备包裹有单细胞的油包水型液滴,其中水相成份包括细胞悬液、细胞裂解液以及荧光抗体,油相成份包括矿物油以及表面活性剂。油包水型液滴中的细胞裂解液将细胞裂解后,荧光抗体与细胞内骨架蛋白结合,形成荧光液滴。
具体来说,
首先,将倒置荧光显微镜连接光电倍增管,并将微流控芯片装载在倒置荧光显微镜的载物台上并固定。确保微流控芯片的沟道完整后,将金属窗口移到倒置荧光显微镜的视野中心位置。
其次,各个微注射泵向中央水平沟道通入细胞悬液,向两个侧沟道分别通入细胞裂解液和荧光抗体,细胞裂解液可以采用十二烷基磺酸钠,向两个垂直沟道通入矿物油和表面活性剂的油相混合液,矿物油和表面活性剂可以采用span80或em90;细胞悬液、细胞裂解液和荧光抗体形成水相混合液,调节微注射泵流速,水相混合液在两侧油相混合液的夹流下在十字型沟道的交叉口后形成稳定的、大小一致的油包水型液滴,且每个油包水型液滴中包含不多于一个细胞,细胞裂解液将细胞进行裂解,荧光抗体与细胞中的蛋白骨架结合,形成荧光液滴,荧光液滴接着进入金属窗口。
其中,细胞裂解液成份不限于十二烷基磺酸钠(sds),也可以使用毛地黄皂苷,强碱naoh等。细胞裂解方式甚至不限于化学裂解,也可以采用电裂解和热裂解。
油相混合液不限于矿物油及所列表面活性剂,也可以使用其他与水互补相溶的液体及相应的表面活性剂,如氟化油和与其对应的表面活性剂pfpe、raindanceea等。
步骤s3:采集荧光亮度数据。
首先,荧光液滴逐一通过金属窗口时,光电倍增管检测其荧光亮度并由数据采集卡记录。
然后,绘制标准曲线。首先制备一组浓度已知的待测细胞蛋白,其次将各个浓度的待测细胞蛋白与荧光抗体形成一组乳化液滴,并采集各个乳化液滴的荧光亮度数据。具体地,将乳化液滴注入中央水平沟道,乳化液滴逐一通过金属窗口时,光电倍增管检测其荧光亮度并由数据采集卡记录,形成荧光亮度与蛋白浓度的标准曲线,从而实现单细胞特定蛋白的量化表征。
步骤s4:处理数据得到单细胞蛋白数量。该步骤是将在线采集的数据在中央控制模块进行处理,并通过对比标准曲线,得到单细胞内骨架蛋白的数量。
具体来说,
首先,计算荧光液滴的长度。通过倒置荧光显微镜得到荧光液滴从刚进入金属窗口到金属窗口被荧光液滴完全覆盖的时间,此时间对应光电倍增管收集到的信号上升时间t上升,金属窗口被荧光液滴完全覆盖到荧光液滴刚要离开金属窗口的时间,此时间对应光电倍增管收集到的信号平台时间t保持,如图6所示,并结合金属窗口宽度w,利用下式得到荧光液滴在沟道内的长度l:
然后,设置荧光亮度阈值,将荧光亮度高于此阈值的荧光液滴作为对象液滴。没有包含细胞的荧光液滴的荧光值很低,与包含有单细胞的荧光液滴的荧光值有明显区别,可以通过设置阈值排除没有包含液滴的数据值。
接着,对照标准曲线中的荧光亮度与蛋白浓度的关系,由对象液滴的荧光亮度值得到荧光液滴的蛋白浓度。
最后,由荧光液滴的蛋白浓度和长度得到单细胞中的蛋白数量。
本发明的检测方法,所使用的荧光抗体不限于荧光共振能量转移荧光对,也可以使用其他激发光与最终发射光波长相差较远的荧光试剂或者荧光试剂对,如铒染料,适配体(aptamer)修饰抗体以及alphalisa等。还可以使用以下荧光抗体:细胞裂解前,供体荧光标记的细胞靶标蛋白抗体和受体荧光标记的竞争性蛋白分子结合,基于荧光能量共振转移的原理,在激光光源的激光作用下,荧光液滴发射受体荧光标记的特征谱线荧光,可以被滤色片滤除。细胞裂解后,待测的靶标蛋白替换受体荧光标记的竞争性蛋白分子,与供体荧光标记的细胞靶标蛋白抗体结合,在激光光源的激光作用下,荧光液滴发射供体荧光标记的特征谱线荧光,经过滤色片的选择性透过,被光电倍增管检测。当使用上述荧光抗体时,绘制标准曲线的具体方式为:使用一组浓度已知的待测细胞靶标蛋白与供体荧光标记的细胞靶标蛋白抗体和受体荧光标记的竞争性细胞蛋白形成乳化液滴,记录乳化液滴的荧光强度,形成荧光强度与靶标蛋白浓度的标准曲线,从而实现单细胞特定蛋白的量化表征。
本发明检测方法的检测对象不限于骨架蛋白,也可以是其他可以被荧光染色的蛋白。通过增加不同类型的配套滤光片、光电倍增管以及荧光抗体,可以同时检测不同波段的荧光信号,做到多个蛋白的同时检测。激发光路与荧光光路不限于特定角度。
由此可见,本发明实施例的单细胞蛋白定量检测方法,将微流控芯片技术与液滴生成技术、荧光抗体制备技术以及荧光检测技术结合,实现单细胞内蛋白的高通量定量检测,为细胞生物特性的表征提供了可靠的检测方法。
至此,已经结合附图对本发明实施例进行了详细描述。依据以上描述,本领域技术人员应当对本发明的微流控芯片、单细胞蛋白定量检测装置和方法有了清楚的认识。
需要说明的是,在附图或说明书正文中,未绘示或描述的实现方式,均为所属技术领域中普通技术人员所知的形式,并未进行详细说明。此外,上述对各元件的定义并不仅限于实施例中提到的各种方式,本领域普通技术人员可对其进行简单地更改或替换,例如:
(1)实施例中提到的方向用语,例如“上”、“下”、“前”、“后”、“左”、“右”等,仅是参考附图的方向,并非用来限制本发明的保护范围;
(2)上述实施例可基于设计及可靠度的考虑,彼此混合搭配使用或与其他实施例混合搭配使用,即不同实施例中的技术特征可以自由组合形成更多的实施例。
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了详细说明,所应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!