蓄电装置用水系电解液和含有该水系电解液的蓄电装置的制作方法
本发明涉及蓄电装置用的水系电解液和含有该水系电解液的蓄电装置。
背景技术:
锂离子二次电池与现有的二次电池相比具有大的理论能量密度,因此广泛用作便携设备、电动车用的电池。现有的锂离子二次电池中,为了实现高能量密度,使用了即使在约4v的电压下也不分解的有机溶剂系的电解液。作为这样的有机溶剂,典型的是主要使用碳酸亚乙酯、碳酸二乙酯等(专利文献1)。
但是,有机溶剂一般为可燃性,特别是在汽车、电力储存用途的大型二次电池中确保安全性成为重要课题。另外,在有机溶剂溶液的离子传导率与水溶液相比极低,迅速的充电·放电特性不充分的方面也成为问题。另一方面,鉴于这样的问题,一直研究使用水溶液作为电解液的水系锂离子二次电池,但水在理论上在1.23v的电压下分解,因此目前为止尚没有实现例如在超过2v这样的高电压下仍能稳定工作的水系锂离子二次电池。
电容器是通过电解液中的离子对电极表面的吸附或脱离而储存电荷或释放电荷的蓄电装置。电容器大致分为在电解液中使用有机溶剂和季铵盐等的有机溶剂系电容器和在电解液的溶剂中使用水的水系电容器。
电容器中储存的电荷量由静电电容和电压的乘积表示。而且,对于水系电容器而言,由于水的耐电压的关系使得电压的上限受到限制,所以为了增大电荷量,一般研究增加静电电容。
实际上,在专利文献2中公开了通过使电容器的电极中使用的活性炭的细孔径和比表面积最佳化而增加静电电容的水系电容器的技术。
但是,如上所述,由于水的耐电压低,所以在高电压下稳定工作的水系电容器的实用化困难。
现有技术文献
专利文献
专利文献1:日本特开平9-22722
专利文献2:日本特开2007-112704
技术实现要素:
因此,本发明的课题在于提供一种锂离子二次电池等二次电池和电容器等蓄电装置中的新型的水系电解液,并且提供一种目前的水系蓄电装置无法实现的在高电压下也能稳定工作的使用水系电解液的蓄电装置。
本发明的发明人等为了解决上述课题进行了深入研究,结果首次发现作为含有高浓度的碱金属盐的水溶液的电解液具有远超于纯水的理论电位窗(稳定电位区域)即1.23v的2v以上的电位窗,并且使用该电解液的水系蓄电装置在高电压下能够可逆地工作,从而完成了本发明。
即,本发明在一个方式中提供如下蓄电装置用电解液:
(1)一种蓄电装置用电解液,含有水作为溶剂,其特征在于,相对于碱金属盐1mol,溶剂的量为4mol以下;
(2)根据上述(1)所述的蓄电装置用电解液,其中,构成上述碱金属盐的阴离子是结构内含有碳原子的有机阴离子;
(3)根据上述(2)所述的蓄电装置用电解液,其中,上述有机阴离子是具有氟烷基的有机阴离子;
(4)根据上述(2)所述的蓄电装置用电解液,其中,上述有机阴离子是双(三氟甲烷磺酰)亚胺阴离子([n(cf3so2)2]-)、双(全氟乙烷磺酰)亚胺阴离子([n(c2f5so2)2]-)和/或(全氟甲烷磺酰)(三氟甲烷磺酰)亚胺阴离子([n(c2f5so2)(cf3so2)]-);
(5)根据上述(2)所述的蓄电装置用电解液,其中,上述有机阴离子是双(三氟甲烷磺酰)亚胺阴离子([n(cf3so2)2]-)、双(全氟乙烷磺酰)亚胺阴离子([n(c2f5so2)2]-)、(全氟乙烷磺酰)(三氟甲烷磺酰)亚胺阴离子([n(c2f5so2)(cf3so2)]-)、cf3so3-和/或c2f5so3-;
(6)根据上述(1)~(5)中任一项所述的蓄电装置用电解液,其中,上述碱金属盐是锂盐或钠盐;
(7)根据上述(1)~(6)中任一项所述的蓄电装置用电解液,其中,上述碱金属盐是两种以上的碱金属盐的组合;
(8)根据上述(1)~(7)中任一项所述的蓄电装置用电解液,其中,上述电解液的电位窗为2v以上;
(9)根据上述(1)~(8)中任一项所述的蓄电装置用电解液,其中,上述蓄电装置为二次电池或电容器;以及
(10)根据上述(1)~(9)中任一项所述的蓄电装置用电解液,其中,上述蓄电装置为锂离子二次电池或钠离子二次电池。
在另一个方式中,本发明提供如下蓄电装置:
(11)一种蓄电装置,具有正极、负极和上述(1)~(10)中任一项所述的蓄电装置用电解液;
(12)根据上述(11)所述的蓄电装置,其中,上述蓄电装置是二次电池或电容器;
(13)根据上述(12)所述的蓄电装置,其中,上述二次电池是锂离子二次电池或钠离子二次电池;
(14)根据上述(11)所述的蓄电装置,其中,上述蓄电装置是二次电池,上述正极含有选自具有锂元素的金属氧化物、聚阴离子系化合物或硫系化合物中的活性物质;
(15)根据上述(11)所述的蓄电装置,其中,上述蓄电装置是二次电池,上述正极含有锰酸锂;
(16)根据上述(11)所述的蓄电装置,其中,上述蓄电装置是二次电池,上述负极含有选自碳材料、金属锂、锂合金、硫系化合物或锂金属氧化物中的活性物质;
(17)根据上述(11)所述的蓄电装置,其中,上述蓄电装置是二次电池,上述负极含有钛酸锂;
(18)根据上述(12)所述的蓄电装置,其中,上述电容器是双电层电容器、锂离子电容器或钠离子电容器;
(19)根据上述(11)所述的蓄电装置,其中,上述蓄电装置是电容器,上述正极和/或上述负极含有活性炭;以及
(20)根据上述(11)所述的蓄电装置,其具备铝制、钛制、不锈钢制、铜制和/或锌制的集电体。
根据本发明,通过使用含有高浓度的碱金属盐,尤其是有机阴离子和碱金属阳离子的碱金属盐的水溶液作为电解液,能够提供对于现有的水系电解液而言困难的在2v以上的高电压下也能稳定工作的使用水系电解液的锂离子二次电池、钠离子二次电池等二次电池或电容器等水系蓄电装置。该电压显著大于现在产生最高电压的水系二次电池即铅蓄电池,可以说由本发明提供的水系二次电池在现有的电池中产生最高的电压。另外,通常水溶液与有机溶液相比离子传导率高,因此可取得能够迅速充电·大电流放电这样的效果。
此外,由于本发明的电解液是使用作为极低廉的溶剂的水与作为现有的电解液中的成分使用的litfsa等有机盐的组合而形成的电解液,因此其成本方面也优异,进而,如后述的实施例所示,作为使用现有的有机电解液的锂离子二次电池、电容器,能够对实用化的电极构成进行应用,因此对其实用化的阻碍极低。
附图说明
图1是表示以5.0mol/l的litfsa水溶液(锂盐:溶剂=1:2.9(摩尔比))为电解液且以工作电极为钛酸锂(lto)时的循环伏安法的测定结果的图。
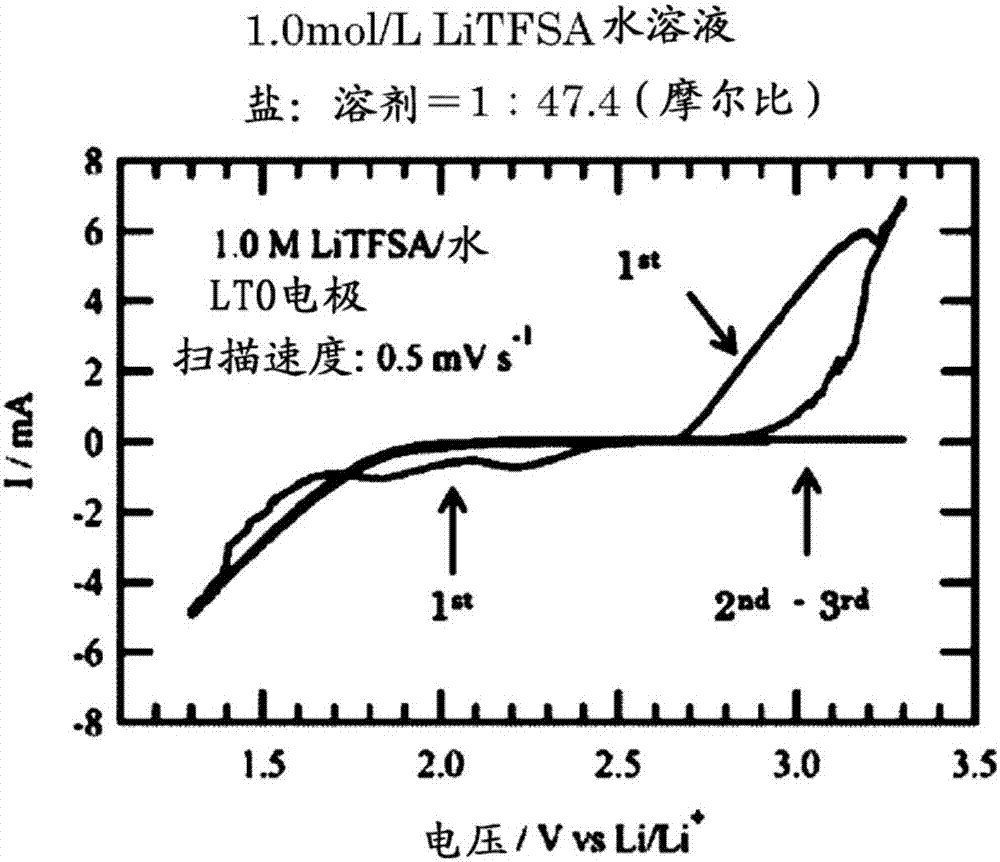
图2是表示以1.0mol/l的litfsa水溶液(锂盐:溶剂=1:47.4(摩尔比))为电解液且以工作电极为钛酸锂(lto)时的循环伏安法的测定结果的图。
图3是表示以3.5mol/l的litfsa水溶液(锂盐:溶剂=1:7.7(摩尔比))为电解液且以工作电极为钛酸锂(lto)时的循环伏安法的测定结果的图。
图4是表示以12.9mol/l的lino3过饱和水溶液(锂盐:溶剂=1:2.5(摩尔比))为电解液且以工作电极为钛酸锂(lto)时的循环伏安法的测定结果的图。
图5是表示以9.0mol/l的lino3饱和水溶液(锂盐:溶剂=1:4.4(摩尔比))为电解液且以工作电极为钛酸锂(lto)时的循环伏安法的测定结果的图。
图6是表示以5.0mol/l的litfsa水溶液(锂盐:溶剂=1:2.9(摩尔比))为电解液且以工作电极为锰酸锂(limn2o4)时的循环伏安法的测定结果的图。
图7是表示以5.13mol/l的litfsa水溶液(盐:水=1:2.7(摩尔比))为电解液且将工作电极设为具备极化电极材料的双电层电容器用电极时的循环伏安法的测定结果的图。
图8是以5.13mol/l的litfsa水溶液(盐:水=1:2.7(摩尔比))为电解液的双电层电容器在电压0~2v范围的充放电曲线。
图9是以5.13mol/l的litfsa水溶液(盐:水=1:2.7(摩尔比))为电解液的双电层电容器在电压0~2.2v范围的充放电曲线。
图10是以1.0mol/l的litfsa水溶液(盐:水=1:47.4(摩尔比))为电解液的双电层电容器在调节处理阶段的充放电曲线。
图11是表示以5.25mol/l的litfsa水溶液(盐:水=1:2.4(摩尔比))为电解液的双电层电容器在各电流和各电压范围的每次充放电的容量的图。
图12是以5.25mol/l的litfsa水溶液(盐:水=1:2.4(摩尔比))为电解液的双电层电容器在电流100ma/g、电压范围0~2.7v下的充放电曲线。
图13是以5.25mol/l的litfsa水溶液(盐:水=1:2.4(摩尔比))为电解液的双电层电容器在电流100ma/g、电压范围0~2.5v下的充放电曲线。
图14是表示对以5.25mol/l的litfsa水溶液(盐:水=1:2.4(摩尔比))为电解液的双电层电容器以电流100ma/g、电压范围0~2.5v反复进行100次充放电时的充放电次数(循环数)与容量的关系的图。
图15是表示以5.25mol/l的litfsa水溶液(盐:水=1:2.4(摩尔比))为电解液且以工作电极为铝箔时的循环伏安法测定结果的图。
图16是以纵轴为(水的摩尔数)/(碱金属盐摩尔数)、以横轴为litfsa与碱金属盐的摩尔比的关于“8-1.litfsa和libeta在水中的溶解度”的图。
图17是以纵轴为(水的摩尔数)/(碱金属盐摩尔数)、以横轴为litfsa与碱金属盐的摩尔比的关于“8-2.litfsa和cf3so3li在水中的溶解度”的图。
图18是表示“8-3.电位窗的确认”中的循环伏安法的测定结果的图。
图19是表示使用电解液no.4的三电极式电化学电池1~3的循环伏安法的测定结果的图。
图20是对使用电解液no.4的锂离子二次电池进行1.7v~2.8v的范围的充放电时的每次充放电循环的容量的图。
图21是对使用含有5.2mol/l的litfsa的水溶液(盐:溶剂=1:2.5(摩尔比))作为电解液的锂离子二次电池进行1.7v~2.8v的范围的充放电时的每次充放电循环的容量的图。
图22是对使用电解液no.4的锂离子二次电池进行2.4v~3.4v的范围的充放电时的每次充放电循环的容量的图。
图23是对使用电解液no.11的锂离子二次电池进行1.7v~2.8v的范围的充放电时的每次充放电循环的容量的图。
图24是对使用电解液no.11的锂离子二次电池进行2.4v~3.4v的范围的充放电时的每次充放电循环的容量的图。
图25是“9.拉曼光谱”中的各试样的拉曼光谱。
具体实施方式
以下,对本发明的实施方式进行说明。本发明的范围不局限于这些说明,除以下的例示以外,在不损害本发明的主旨的范围也可以适当地变更来实施。
1.电解液
(1)溶剂
本发明的蓄电装置用电解液(以下,有时简称为“本发明的电解液”。)的特征在于,为水系电解液。因此,本发明的蓄电装置用电解液中使用的主溶剂为水。但是,也可以将溶剂设为含有水和其它的非水溶剂的混合溶剂。这样的非水溶剂是可溶于水的溶剂,例如,可举出甲醇等醇类、以及丙酮、乙腈、二甲基亚砜、或碳酸二甲酯、碳酸甲乙酯、碳酸二乙酯、碳酸亚乙酯、碳酸亚丙酯等碳酸酯类等非质子性极性溶剂。即使在上述混合溶剂的情况下,也优选水的比例以体积比计为90%以上。
(2)碱金属盐
本发明的蓄电装置用电解液中使用的碱金属盐优选为锂盐、钠盐,但也可以使用镁等属于第2族的金属的盐。碱金属盐的阳离子种只要根据使用本发明的电解液的蓄电装置的电荷担载体的种类选择即可。例如,二次电池为锂离子二次电池时优选锂盐,二次电池为钠离子二次电池时优选钠盐。另外,也可以使用组合了2种以上的碱金属盐的混合物。
构成该碱金属盐的阴离子优选为结构内含有碳原子的有机阴离子。
作为有机阴离子,优选为由下述通式(1)~通式(3)表示的阴离子。
(r1so2)(r2so2)n-通式(1)
(r1、r2各自独立地选自烷基或卤素取代烷基中。r1和r2也可以相互键合而形成环。)
r3so3-通式(2)
(r3选自烷基或卤素取代烷基中。)
r4co2-通式(3)
(r4选自烷基或卤素取代烷基中。)
在上述通式(1)~通式(3)中,烷基或卤素取代烷基的碳原子数n优选为1~6,更优选为1~3,进一步优选为1~2。作为卤素取代烷基的卤素,优选为氟。卤素取代烷基中的卤素取代个数为原本的烷基的氢的个数以下。
r1~r4分别由以下通式(1-1)表示。
cnhafbclcbrdie通式(1-1)
(n为1以上的整数。a、b、c、d、e为0以上的整数。满足2n+1=a+b+c+d+e。)
在通式(1-1)中,从耐氧化性的观点考虑,a优选较小,更优选a=0,最优选2n+1=b。
作为有机阴离子,优选具有氟烷基的有机阴离子。例如,优选为双(三氟甲烷磺酰)亚胺阴离子(tfsa;[n(cf3so2)2]-)、双(全氟乙烷磺酰)亚胺阴离子(beta;[n(c2f5so2)2]-)、(全氟乙烷磺酰)(三氟甲烷磺酰)亚胺阴离子([n(c2f5so2)(cf3so2)]-)。
因此,作为该碱金属盐的具体例,可举出双(三氟甲烷磺酰)亚胺锂(litfsa)、双(全氟乙烷磺酰)亚胺锂(libeta)、(全氟乙烷磺酰)(三氟甲烷磺酰)亚胺锂、双(三氟甲烷磺酰)亚胺钠(natfsa)、双(全氟乙烷磺酰)亚胺钠(nabeta)和(全氟乙烷磺酰)(三氟甲烷磺酰)亚胺钠。
作为其它优选有机阴离子,可例示cf3so3-、c2f5so3-、cf3co2-、c2f5co2-。
作为其它碱金属盐的具体例,可例示cf3so3li、c2f5so3li、cf3co2li、c2f5co2li、cf3so3na、c2f5so3na、cf3co2na、c2f5co2na。
另外,本发明的蓄电装置用电解液的特征在于,含有高浓度的碱金属盐。由此,即使是以往水系电解液中无法可逆地工作的电极构成,也能够实现产生高电压的二次电池等蓄电装置。上述电解液中的碱金属盐与溶剂的混合比是相对于碱金属盐1mol,溶剂为4mol以下,优选为3.5mol以下。对于溶剂量的下限,只要不发生该碱金属盐的析出等地进行正极·负极中的电化学反应就没有特别限制,例如,相对于碱金属盐1mol,溶剂可以为1mol以上,相对于碱金属盐1mol,溶剂优选为2mol以上。本发明的蓄电装置用电解液通过使用上述高浓度的碱金属盐而具有超过纯水的电位窗(稳定电位区域)的电位窗,优选具有2v以上的电位窗。
进而,根据本说明书的记载,作为本发明的电解液的另一个方式,也可以把握一种含有水作为溶剂的蓄电装置用电解液,其中,相对于碱金属盐1mol,水的量为4mol以下。
除上述碱金属盐以外,也可以含有在该技术领域公知的支持电解质。对于这样的支持电解质,例如在二次电池为锂离子二次电池时,可举出选自lipf6、libf4、liclo4、lino3、licl、li2so4和li2s等以及它们的任意组合中的电解质。
(3)其它成分
另外,本发明的蓄电装置用电解液以提高其功能等为目的也可以根据需要含有其它成分。作为其它成分,例如,可举出以往公知的过充电防止剂、脱氧剂、用于改善高温保存后的容量维持特性和循环特性的特性改善助剂。
该电解液含有过充电防止剂时,电解液中的过充电防止剂的含量优选为0.01~5质量%。通过使电解液含有0.1质量%以上的过充电防止剂,更容易抑制因过充电所致的蓄电装置的破裂·起火,能够更稳定地使用蓄电装置。
作为用于改善高温保存后的容量维持特性、循环特性的特性改善助剂,例如,可举出琥珀酸酐、戊二酸酐、马来酸酐、柠康酸酐、戊烯二酸酐、衣康酸酐、二甘醇酸酐、环己烷二甲酸酐、环戊烷四甲酸二酐、苯基琥珀酸酐等羧酸酐;亚硫酸亚乙酯、1,3-丙烷磺内酯、1,4-丁烷磺内酯、甲烷磺酸甲酯、白消安、环丁砜、环丁烯砜、二甲基砜、二苯砜、甲基苯基砜、二丁基二硫醚、二环己基二硫醚、四甲基秋兰姆单硫化物、n,n-二甲基甲磺酰胺、n,n-二乙基甲磺酰胺等含硫化合物等。这些特性改善助剂可以单独使用1种,也可以并用2种以上。电解液含有特性改善助剂时,电解液中的特性改善助剂的含量优选为0.01~5质量%。
2.蓄电装置
本发明的蓄电装置具备正极和负极以及本发明的电解液。作为蓄电装置,可例示二次电池、电容器。
(1)负极
作为本发明的蓄电装置中的负极,可以采用在该技术领域公知的电极构成。例如,蓄电装置为锂离子二次电池时,可举出含有能够电化学地吸留·放出锂离子的负极活性物质的电极。作为这样的负极活性物质,可以使用公知的锂离子二次电池用负极活性物质,例如,可举出天然石墨(石墨)、高取向性石墨(highlyorientedpyrolyticgraphite;hopg)、非晶碳等碳质材料。进而,作为其它例子,可举出锂金属、或如含有锂元素的合金或金属氧化物、金属硫化物、金属氮化物这样的金属化合物。例如,作为具有锂元素的合金,例如可举出锂铝合金、锂锡合金、锂铅合金、锂硅合金等。另外,作为具有锂元素的金属氧化物,例如可举出钛酸锂(li4ti5o12等)等。另外,作为含有锂元素的金属氮化物,例如可举出锂钴氮化物、锂铁氮化物、锂锰氮化物等。进而,也可例示硫系化合物。此外,负极中也可以使用铁、锌等金属。这些负极活性物质可以单独使用1种,也可以并用2种以上。其中,作为锂离子二次电池的情况的负极活性物质,优选为钛酸锂。
蓄电装置为钠离子二次电池时,可以使用含有能够电化学地吸留·放出钠离子的负极活性物质的电极,例如,可以使用钠金属、或如含有钠元素的合金或金属氧化物、金属硫化物、金属氮化物这样的金属化合物代替上述锂金属等。
蓄电装置为双电层电容器时,负极中含有极化电极材料。作为极化电极材料,只要为通常的双电层电容器中使用的极化电极材料即可,可例示由各种原料制造的活性炭。活性炭优选为比表面积大的活性炭。
蓄电装置为锂离子电容器或钠离子电容器时,负极中含有能够吸留和放出锂离子或钠离子的材料。作为该材料,可例示天然石墨或人造石墨等含有石墨的材料。另外,也可以使用插入和脱离锂离子等阳离子而以恒定电位显示氧化还原容量的钛酸锂等材料。负极活性物质中使用不含锂的材料时,可以向负极或正极添加金属锂、含有大量锂的化合物,使用由它们将锂预掺杂到负极活性物质的物质。
蓄电装置为二次电池时,上述负极可以是仅含有负极活性物质的负极,也可以是除负极活性物质以外还含有导电性材料和粘结材料(粘合剂)中的至少一者,且作为负极混合材料以附着于负极集电体的形态存在的负极。例如,负极活性物质为箔状时,可以设为仅含有负极活性物质的负极。另一方面,负极活性物质为粉末状时,可以设为具有负极活性物质和粘结材料(粘合剂)的负极。作为使用粉末状的负极活性物质形成负极的方法,可以使用刮刀法、利用压接挤压的成型方法等。蓄电装置为电容器时也是同样的。
作为导电性材料,例如,可以使用碳材料,金属纤维等导电性纤维,铜、银、镍、铝等金属粉末,聚苯撑衍生物等有机导电性材料。作为碳材料,可以使用石墨、软碳、硬碳、炭黑、科琴黑、乙炔黑、石墨、活性炭、碳纳米管、碳纤维等。另外,也可以使用将含有芳香环的合成树脂、石油沥青等煅烧而得的介孔碳。
作为粘结剂,例如,可优选使用聚偏二氟乙烯(pvdf)、聚四氟乙烯(ptfe)、乙烯四氟乙烯(etfe)等氟系树脂、或聚乙烯、聚丙烯等。作为负极集电体,可以使用以铜、镍、铝、锌、钛、铂、不锈钢等金属为主体的棒状体、板状体、箔状体、网状体等。
(2)正极
作为本发明的蓄电装置的正极,可以使用在该技术领域公知的电极构成。例如,蓄电装置为锂离子二次电池时,作为正极活性物质,可举出钴酸锂(licoo2)、锰酸锂(limn2o4)、镍酸锂(linio2)、lini0.5mn1.5o4等含有1种以上的过渡金属的含锂的过渡金属氧化物,过渡金属硫化物,金属氧化物,磷酸铁锂(lifepo4)或焦磷酸铁锂(li2fep2o7)等含有1种以上的过渡金属的含锂的聚阴离子系化合物,硫系化合物(li2s)等。该正极也可以含有导电性材料、粘结剂。
另外,作为正极活性物质,也可以采用氧、氧化锂等含有氧的金属盐。而且,具备该正极活性物质的正极可以含有促进该正极活性物质中的氧的氧化还原反应的催化剂。作为优选的正极活性物质,可例示过量地含有锂的过渡金属氧化物(该过渡金属例如为锰、钴、铁、镍、铜)。另外,为了制成用于使大气中的氧高效地氧化还原而获得容量的反应场,也可以在正极内使用活性炭等高比表面积材料。
蓄电装置为钠离子二次电池时,同样地也可以使用公知的正极活性物质。
蓄电装置为电容器时,正极含有极化电极材料。作为极化电极材料,只要采用负极中说明的物质即可。另外,极化电极材料可以使用如多并苯等导电性高分子、2,2,6,6-四甲基哌啶-n-氧基(tempo)这样的通过阴离子的吸附脱附而使容量变大的氧化还原电容器中使用的材料。另外,也可以含有插入和脱离锂离子等阳离子而以3v以上的恒定电位显示氧化还原容量的尖晶石结构的锰酸锂、橄榄石结构的磷酸铁锂等材料。
作为导电性材料和粘结剂(粘合剂),可以使用与上述负极同样的导电性材料和粘结剂(粘合剂)。
作为促进氧的氧化还原反应的催化剂,可以使用mno2、fe2o3、nio、cuo、pt、co等。另外,作为粘结剂(粘合剂),可以使用与上述负极同样的粘合剂。
作为正极集电体,可以使用以镍、铝、钛、铂、不锈钢等金属为主体的棒状体、板状体、箔状体、网状体等。另外,正极活性物质为氧时,作为正极集电体,为了提高氧的扩散,使用筛网(栅网)状金属、海绵状(发泡)金属、冲孔金属(パンチドメタル)、膨胀金属(エクスパンディドメタル)等多孔体。金属例如为铜、镍、铝、不锈钢等。
(3)间隔件
作为本发明的蓄电装置中使用的间隔件,只要是具有电分离正极层和负极层的功能的物质就没有特别限定,例如可举出由聚乙烯(pe)、聚丙烯(pp)、聚酯、纤维素、聚酰胺等树脂形成的多孔片材,无纺布、玻璃纤维无纺布等无纺布等多孔绝缘材料等。
(4)形状等
本发明的蓄电装置的形状只要能够收纳正极、负极和电解液就没有特别限定,例如,可举出圆筒型、硬币型、平板型、层压型等。
另外,收纳蓄电装置的壳体可以是大气开放型的壳体,也可以是密闭型的壳体。
应予说明,对正极活性物质为氧的空气电池的情况进行说明,大气开放型的电池壳体是具有大气能够出入的通风口且大气能够与正极接触的电池壳体。另一方面,电池壳体作为密闭型电池壳体,优选在密闭型电池壳体中设置气体(空气)的供给管和排出管。此时,供给·排出的气体优选为干燥气体,其中,优选氧浓度高,更优选为纯氧(99.99%)。另外,优选放电时提高氧浓度,充电时降低氧浓度。
应予说明,本发明的电解液和二次电池适合于作为二次电池的用途,但不排除作为一次电池使用的情况。
实施例
以下,利用实施例对本发明进行更详细的说明,但本发明不限于这些实施例。
1.负极材料中的电化学行为的测定(循环伏安法)
为了证实本发明的电解液对负极的应用性,使用5.0mol/l的含有双(三氟甲烷磺酰)亚胺锂(litfsa)的水溶液(盐:溶剂=1:2.9(摩尔比))作为电解液进行循环伏安法而研究电流变化。测定是使用具备作为工作电极的钛酸锂(lto)、作为对电极的铂和作为参比电极的ag/agcl(饱和kcl)的三电极式电化学电池进行。电位区域设为1.5~3.5v,扫描速度设为0.5mv/秒。将得到的结果示于图1。
如图1所示,将litfsa:水=1:2.9这样的含有高浓度的litfsa的水溶液作为电解液,即使在进行循环伏安法测定直至5次循环为止的情况下,也可得到可逆的氧化还原行为。这证实了以往水系电解液中没有可逆工作的报告例的lto通过使用含有高浓度的碱金属盐的水系电解液能够可逆地工作。其结果表明了本发明的电解液中还原侧的稳定性显著提高,可使用具有锂金属基准2v以下的反应电位的负极。
作为比较例,使用以litfsa的浓度为1.0mol/l(盐:溶剂=1:47.4(摩尔比)和3.5mol/l(盐:溶剂=1:7.7(摩尔比))的电解液,除此之外,在同样的条件下进行循环伏安法测定,将其结果示于图2和图3。其结果,在这些低浓度条件下,无法得到如图1那样的可逆的氧化还原行为。
另外,将电解液中使用的盐变成无机盐lino3,使用12.9mol/l的水溶液(锂盐:溶剂=1:2.5(摩尔比))作为电解液(过饱和状态)作为使用,除此之外,在同样的条件下进行循环伏安法测定。将其结果示于图4。尽管与图1同样地含有锂盐:溶剂=1:2.5(摩尔比)这样的高浓度的锂盐,但使用无机盐时,得不到可逆的氧化还原行为。
进而,使用几乎为饱和状态的9.0mol/l的lino3水溶液(锂盐:溶剂=1:4.4(摩尔比))作为电解液,除此之外,在同样的条件下进行循环伏安法测定。将其结果示于图5。使用无机盐时,即使使锂盐成为高浓度达到饱和状态,也得不到可逆的氧化还原行为。
2.正极材料中的电化学行为的测定(循环伏安法)
接下来,为了证实本发明的电解液对正极的应用性,使用将工作电极设为锰酸锂(limn2o4)且具备作为对电极的铂和作为参比电极的ag/agcl(饱和kcl)的三电极式电化学电池,进行与图1同样的循环伏安法测定。电位区域设为3.6~4.7v,扫描速度设为0.5mv/秒。将得到的结果示于图6。
根据图6的结果可知,即使在进行循环伏安法测定直至10次循环为止的情况下,也显示可逆的氧化还原行为。由该结果证实了通过使用本发明的电解液,即使是水系,使用锂金属基准4v左右的锰酸锂作为正极的二次电池也能够工作。
3.电解液的离子传导率
测定作为本发明的电解液的5.0mol/l的litfsa水溶液(盐:溶剂=1:2.9(摩尔比))的离子传导率。使用具备对置型的铂电极的两电极式的电化学电池进行交流阻抗测定(直流电压:0v,交流电压振幅5mv),由10khz下的电阻值评价离子传导率。所用的电化学电池使用以氯化钾水溶液为标准电解液预先测定了电池常数的电池。其结果,在25℃得到11.8ms/cm、在30℃得到13.8ms/cm的值。这表明含有高浓度的litfsa盐的水溶液具有与有机溶剂同等程度的传导率。
由以上所示的结果可知,本发明的水系电解液具有远超于纯水的理论电位窗即1.23v的2v以上的电位窗(对li/li+),对于正极和负极这两者,能够可逆地反应。这些结果证实了通过使用本发明的电解液,能够实现产生以往不可能的2v以上的高电压的水系锂离子二次电池(或水系钠离子二次电池)。
4.极化电极材料中的电化学行为的测定(循环伏安法)
为了证实本发明的电解液对极化电极材料的应用性,使用含有5.13mol/l的litfsa的水溶液(盐:水=1:2.7(摩尔比))作为电解液,进行循环伏安法测定,研究电流变化。测定是使用具备作为工作电极的具备活性炭作为极化电极材料的双电层电容器用电极(宝泉株式会社制)、作为对电极的铂和作为参比电极的ag/agcl(饱和kcl)的三电极式电化学电池进行。电位区域以相对于标准氢电极的电压计为-1.7v~0.8v的范围和以相对于标准氢电极的电压计为-0.5v~1.1v的范围。扫描速度设为5mv/秒。将得到的结果示于图7。图7的横轴为相对于标准氢电极的电压。
如图7所示,在还原电位侧直至-1.2v附近没有产生急剧的电流变化,在氧化电位侧直至1v附近没有产生急剧的电流变化。因此,能够确认电位窗的范围为2.2v左右。
5.双电层电容器评价-1
制造以下构成的双电层电容器,按照以下条件进行试验。
正极:具备以86质量%含有活性炭的混合材料层和al箔的双电层电容器用电极(宝泉株式会社制:混合材料层的密度为0.63g/cm3。)
负极:具备以86质量%含有活性炭的混合材料层和al箔的双电层电容器用电极(宝泉株式会社制:混合材料层的密度为0.63g/cm3。)
电解液:含有5.13mol/l的litfsa的水溶液(盐:水=1:2.7(摩尔比))
条件:对双电层电容器在电流10ma/g的条件下以电压0~1v的范围进行10次充放电,将其作为调节处理。对调节处理后的双电层电容器在电流10ma/g的条件下反复进行50次电压0~2v范围的充放电。另外,对调节处理后的双电层电容器在电流10ma/g的条件下反复进行50次电压0~2.2v的范围的充放电。
图8中示出电压0~2v范围的充放电曲线,图9中示出电压0~2.2v范围的充放电曲线。根据图8和图9的充放电曲线,若反复充放电,则观察到若干的容量下降,但即使经过50次的充放电,也没有观察到显示电解液的分解行为的曲线的紊乱。这证实了本发明的电解液不仅能够胜任在2v的电容器中的使用,也能够胜任在2.2v的电容器中的使用。
作为比较例,制造使用含有1.0mol/l的litfsa的水溶液(盐:水=1:47.4(摩尔比))的双电层电容器,在上述条件下进行试验。但是,如图10所示,在调节处理的阶段的第3次充电时,比较例的电解液显示分解行为,电容器本身膨胀,因此中止了上述电容器的试验。认为比较例的电容器发生了水的分解。
6.双电层电容器评价-2
制造以下构成的双电层电容器,按照以下条件进行试验。
正极:具备以86质量%含有活性炭的混合材料层和al箔的双电层电容器用电极(宝泉株式会社制:混合材料层的密度为0.63g/cm3。)
负极:具备以86质量%含有活性炭的混合材料层和al箔的双电层电容器用电极(宝泉株式会社制:混合材料层的密度为0.63g/cm3。)
电解液:含有5.25mol/l的litfsa的水溶液(盐:水=1:2.4(摩尔比))
条件:对双电层电容器在电流10ma/g的条件下以电压0~1v的范围进行10次充放电,将其作为调节处理。对调节处理后的双电层电容器在以下所示的各电流下分别反复进行5次各电压范围的充放电。
电流:100ma/g、500ma/g、1000ma/g、2000ma/g、约3500ma/g,
电压范围:0~2.3v、0~2.4v、0~2.5v、0~2.6v、0~2.7v
图11中将在各电流和各电压范围下的电容器的每次充放电的容量制成图而示出。另外,图12中示出在电流100ma/g、电压范围0~2.7v下的电容器的充放电曲线,图13中示出在电流100ma/g、电压范围0~2.5v下的电容器的充放电曲线。
由图11和图12可知,即使是在最大2.7v的电压下电容器也能发挥功能。即,可以说本发明的电解液能够胜任在至少到2.7v的电容器中使用。另外,在图11中,若将100ma/g下的容量在各电压范围进行比较,则电压范围越宽容量越大。因此,可以说利用相对于现有的水溶液能够大幅度增大电压的本发明的电解液能够大幅度增大电容器中储存的电荷量。进而,在图11中,使电流增大时的容量降低尤其在电压范围0~2.5v以下的电压范围内较小,因此可以说本发明的电解液至少到2.5v为止具有优异的倍率特性。
图14中示出对调节处理后的双电层电容器以电流100ma/g、电压范围0~2.5v反复进行100次充放电时的充放电次数(循环数)与容量的关系。根据图14的结果,证实了具备本发明的电解液的电容器即使在与有机溶剂系电容器同等的电压即2.5v的条件下,也能够稳定地维持容量且反复进行充放电。
7.铝腐蚀性评价
为了评价本发明的电解液的铝腐蚀性,使用含有5.25mol/l的litfsa的水溶液(盐:水=1:2.4(摩尔比))作为电解液,进行循环伏安法,研究电流变化。作为工作电极,使用4片面积1cm2、厚度15μm的铝箔重叠而成的物质。测定是使用具备上述工作电极、作为对电极的铂和作为参比电极的ag/agcl(饱和kcl)的三电极式电化学电池进行。电位区域以相对于标准氢电极的电压计设为-1.0v~1.2v的范围。扫描速度设为5mv/秒。将得到的结果示于图15。图15的横轴为相对于标准氢电极的电压。
由图15可知,在还原侧几乎没有电流流动。可以说即使在铝的存在下,只要在上述电压的范围内,本发明的电解液所含的水就不会分解。根据图15,在氧化侧观察到产生若干的电流,但随着循环伏安法的循环的重叠,电流值收敛在一定的值。认为该电流是由铝的氧化引起的,另外,可以说由于收敛了电流值,所以铝的氧化是暂时的。综合考察这些结果,可以说即使在铝的存在下本发明的电解液也不会过多腐蚀铝,能够使用。
8.确认多个碱金属盐的并用效果
8-1.litfsa和libeta在水中的溶解度
向按照表1记载的摩尔比称量的碱金属盐中缓慢加入水,进行加热搅拌,制备作为室温下的碱金属盐的饱和水溶液的电解液no.1~no.7。电解液no.1~no.7均为本发明的电解液。将以纵轴为(水的摩尔数)/(碱金属盐摩尔数)、以横轴为litfsa与碱金属盐的摩尔比的图示于图16。
[表1]
根据表1和图16的结果可知,并用了多个碱金属盐的饱和水溶液与单独的碱金属盐的饱和水溶液相比,水的量较少。
8-2.litfsa和cf3so3li在水中的溶解度
向按照表2记载的摩尔比称量的碱金属盐中缓慢加入水,进行加热搅拌,制备作为室温下的碱金属盐的饱和水溶液的电解液no.8~no.14。电解液no.8~no.14均为本发明的电解液。将以纵轴为(水的摩尔数)/(碱金属盐摩尔数)、以横轴为litfsa与碱金属盐的摩尔比的图示于图17。
[表2]
根据表2和图17的结果可知,并用了多个碱金属盐的饱和水溶液与单独的碱金属盐的饱和水溶液相比,水的量较少。
8-3.确认电位窗
使用以下三电极式电化学电池对电解液no.4进行循环伏安法测定,确认其电位窗。测定温度设为25℃,扫描速度设为0.1mv/秒。应予说明,电解液no.4中的碱金属盐的浓度为5.05mol/l。
工作电极和对电极:铂
参比电极:ag/agcl(饱和kcl)
作为比较例,用上述方法进行使用含有1.0mol/l的litfsa的水溶液(盐:水=1:47.4(摩尔比))的三电极式电化学电池的循环伏安法测定。
将以上结果示于图18。根据图18的结果,算出电解液no.4的电位窗为3.2v。另外,可知与比较例相比,电解液no.4的从响应电流的上升位置读取的电位窗在氧化侧向高电位侧扩大,在还原侧向低电位侧扩大,并且,尤其是氧化侧向高电位侧的扩大明显。再次确认了本发明的电解液的电位窗大。进而,根据图18,可以说从响应电流的上升位置的电位到先前的电位的响应电流的增加率在电解液no.4中平缓。可以说在超过电位窗的氧化侧和还原侧的电位下,本发明的电解液的分解的程度被抑制。
8-4.正极材料和负极材料中的电化学行为的测定
分别制造使用电解液no.4的以下的三电极式电化学电池1~3,对这些电池进行循环伏安法测定。测定温度设为25℃,扫描速度设为0.1mv/秒。
<三电极式电化学电池1>
工作电极:由含有85质量%的li4ti5o12、5质量%的pvdf和10质量%的乙炔黑的负极混合材料层及zn制的集电体构成的电极
对电极:由含有85质量%的limn2o4、10质量%的pvdf和5质量%的乙炔黑的混合材料层及ti制的集电体构成的电极
参比电极:ag/agcl(饱和kcl)
<三电极式电化学电池2>
工作电极:由含有85质量%的licoo2、9质量%的pvdf和6质量%的乙炔黑的正极混合材料层及ti制的集电体构成的电极
对电极:由含有85质量%的limn2o4、10质量%的pvdf和5质量%的乙炔黑的混合材料层及ti制的集电体构成的电极
参比电极:ag/agcl(饱和kcl)
<三电极式电化学电池3>
工作电极:由含有80质量%的lini0.5mn1.5o4、15质量%的pvdf和5质量%的乙炔黑的正极混合材料层及ti制的集电体构成的电极
对电极:由含有85质量%的limn2o4、10质量%的pvdf和5质量%的乙炔黑的混合材料层及ti制的集电体构成的电极
参比电极:ag/agcl(饱和kcl)
作为比较例,用上述各方法进行使用含有1.0mol/l的litfsa的水溶液(盐:水=1:47.4(摩尔比))的三电极式电化学电池1~3的循环伏安法测定。
使用电解液no.4的三电极式电化学电池1~3均显示了可逆的氧化还原行为。另一方面,比较例的三电极式电化学电池1和3均没有显示可逆的氧化还原行为。将使用电解液no.4的三电极式电化学电池1~3的循环伏安法测定结果示于图19。根据图19,可以说证实了即使在使用lini0.5mn1.5o4等以锂金属基准5v左右反应的材料作为正极的情况下,使用电解液no.4的二次电池也能够可逆地工作。
8-5.金属腐蚀性评价
为了评价本发明的电解液的金属腐蚀性,利用使用电解液no.4的以下构成的三电极式电化学电池进行线性扫描伏安法,研究氧化侧或还原侧的电流变化。测定温度设为25℃,扫描速度设为0.1mv/秒。
工作电极:pt、ti、不锈钢、cu、zn或al
对电极:铂
参比电极:ag/agcl(饱和kcl)
对于工作电极为pt、ti或不锈钢的电池,使其负荷氧化侧的电位。对于工作电极为pt、ti、cu、zn或al的电池,使其负荷还原侧的电位。
根据响应电流的产生电位,明确了本发明的电解液的存在下的氧化侧的金属的稳定性是ti>pt≈不锈钢的顺序。另外,明确了本发明的电解液的存在下的还原侧的金属的稳定性是al>zn>ti>cu>pt的顺序。
基于本评价和“7.铝腐蚀性评价”的结果,可以说在高电位下驱动的蓄电装置的正极集电体优选为ti、al,在低电位下驱动的蓄电装置的负极集电体优选为al、zn、ti、cu。
8-6.具备正极活性物质和负极活性物质的二次电池评价
制造使用电解液no.4的以下构成的硬币型锂离子二次电池,进行25℃、10c、1.7v~2.8v的范围的充放电。
正极:由含有85质量%的licoo2、9质量%的pvdf和6质量%的乙炔黑的正极混合材料层及ti制的集电体构成的电极
负极:由含有85质量%的li4ti5o12、5质量%的pvdf和10质量%的乙炔黑的负极混合材料层及zn制的集电体构成的电极
间隔件:厚度420μm的玻璃纤维制无纺布(whatmangf/f)
可确认即使反复进行充放电循环,上述锂离子二次电池也会可逆地工作。值得一提的只观察到容量稍有降低。将每次充放电循环的容量的图示于图20。
作为电解液,使用含有5.2mol/l的litfsa的水溶液(盐:溶剂=1:2.5(摩尔比)),除此之外,制造与上述同样构成的硬币型锂离子二次电池。对该锂离子二次电池在与上述同样的条件下进行充放电。能够确认虽然观察到容量降低,但即使反复进行充放电循环,上述锂离子二次电池也能够可逆地工作。将每次充放电循环的容量的图示于图21。
根据图20和图21的容量的推移的结果,可以说并用了多个碱金属盐的电解液与使用了单独的碱金属盐的电解液相比,取得显著优异的效果。
作为比较例,制造使用含有1.0mol/l的litfsa的水溶液(盐:水=1:47.4(摩尔比))作为电解液的硬币型锂离子二次电池,进行上述评价。然而,该锂离子二次电池中无法进行正常的充放电。推断电解液进行了分解。
进而,作为比较例,制造使用含有litfsa和libeta的水溶液(盐:水=1:50(摩尔比)、litfsa:libeta=7:3(摩尔比))作为电解液的硬币型锂离子二次电池,进行上述评价。然而,该锂离子二次电池也无法进行正常的充放电。推断电解液进行了分解。
8-7.具备正极活性物质和负极活性物质的二次电池评价2
制造使用电解液no.4的以下构成的硬币型锂离子二次电池,进行25℃、10c、2.4v~3.4v的范围的充放电。
正极:由含有80质量%的lini0.5mn1.5o4、15质量%的pvdf和5质量%的乙炔黑的正极混合材料层及ti制的集电体构成的电极
负极:由含有85质量%的li4ti5o12、5质量%的pvdf和10质量%的乙炔黑的负极混合材料层及zn制的集电体构成的电极
间隔件:厚度420μm的玻璃纤维制无纺布(whatmangf/f)
能够确认即使反复进行充放电循环,上述锂离子二次电池也能够可逆地工作。图22中示出每次充放电循环的容量的图。
8-8.具备正极活性物质和负极活性物质的二次电池评价3
制造使用电解液no.11的以下构成的硬币型锂离子二次电池,进行25℃、10c、1.7v~2.8v的范围的充放电。
正极:由含有85质量%的licoo2、9质量%的pvdf和6质量%的乙炔黑的正极混合材料层及ti制的集电体构成的电极
负极:由含有85质量%的li4ti5o12、5质量%的pvdf和10质量%的乙炔黑的负极混合材料层及al制的集电体构成的电极
间隔件:厚度420μm的玻璃纤维制无纺布(whatmangf/f)
能够确认即使反复进行充放电循环,上述锂离子二次电池也能够可逆地工作。图23中示出每次充放电循环的容量的图。图23的每次充放电循环中的标绘点(プロット)是上侧的标绘点为充电容量,下侧的标绘点为放电容量。
8-9.具备正极活性物质和负极活性物质的二次电池评价4
制造使用电解液no.11的以下构成的硬币型锂离子二次电池,进行25℃、10c、2.4v~3.4v的范围的充放电。
正极:由含有80质量%的lini0.5mn1.5o4、15质量%的pvdf和5质量%的乙炔黑的正极混合材料层及ti制的集电体构成的电极
负极:由含有85质量%的li4ti5o12、5质量%的pvdf和10质量%的乙炔黑的负极混合材料层及al制的集电体构成的电极
间隔件:厚度420μm的玻璃纤维制无纺布(whatmangf/f)
能够确认即使反复进行充放电循环,上述锂离子二次电池也能够可逆地工作。图24中示出每次充放电循环的容量的图。图24的每次充放电循环中的标绘点是上侧的标绘点为充电容量,下侧的标绘点为放电容量。
9.拉曼光谱
将电解液no.4(盐:水=1:2(摩尔比))、含有4mol/l的litfsa的水溶液(盐:水=1:5.7(摩尔比))、含有1mol/l的litfsa的水溶液(盐:水=1:47.4(摩尔比))或水作为试样,用拉曼光谱法进行分析。将各试样的拉曼光谱示于图25。
由图25可知,随着相对于碱金属盐1mol的水的摩尔量减少,来自水的峰向高波数侧位移,且变得尖锐。可以说在电解液no.4中,几乎全部的水为与碱金属盐配位的状态。
一般而言,来自化合物的水合物中的水的峰会被观察到为较尖锐的峰。于是,由于观察到来自本发明的电解液的水的峰尖锐,所以也可以解释成本发明的电解液是含有碱金属盐的水合物的显示流动性的状态的电解液。
10.考察
根据以上试验结果,可以说在优选的本发明的电解液中,几乎全部的水与碱金属盐配位,没有与碱金属盐配位的水极少。而且,认为与碱金属盐配位的水在微观上是水的氧的非共价电子对与碱金属盐的碱金属离子配位的状态。这里,可以说由于碱金属离子与水的氧的非共价电子对的配位状态,使氧的非共价电子对稳定化。换言之,推断氧的非共价电子对的homo的能级降低。认为由于该homo的能级的降低,使得本发明的电解液所含的水分子的耐氧化性能显著提高,其结果,本发明的电解液显示了宽范围的电位窗。
另外,如图19所示,通常为1.55v的钛酸锂的氧化还原电位在本发明的电解液的存在下向高电位侧位移。认为该理由如下。
首先,认为在本发明的电解液的存在下,具备钛酸锂的负极中发生由以下化学式表示的氧化还原反应。
这里,在上述氧化还原反应中,构建着眼于电解液成分的能斯特方程式,如下。
e=e0-(rt/f)ln(ah2on/a[li(h2o)n])
e:负极电位
e0:由电解液以外的因素决定的负极电位
r:气体常数
t:绝对温度
f:法拉第常数
ah2o:h2o的活度
a[li(h2o)n]:[li(h2o)n]+的活度
可以说本发明的电解液与现有的水系电解液相比,没有与碱金属离子配位的水的量较少。因此,推断具备本发明的电解液的二次电池与具备现有的水系电解液的二次电池相比,ah2o的值较小。因此,具备本发明的电解液的二次电池与具备现有的水系电解液的二次电池相比,(rt/f)ln(ah2on/a[li(h2o)n])的值变小,能斯特方程式的e成为与具备现有的水系电解液的二次电池的负极电位相比高的值。
另外,可以说在优选的本发明的电解液中,没有与碱金属离子配位的水的量比与碱金属离子配位的水的量少。因此,推断在具备优选的本发明的电解液的二次电池中,ah2o的值比a[li(h2o)n]的值小。因此,在具备优选的本发明的电解液的二次电池中,(rt/f)ln(ah2on/a[li(h2o)n])<0,上述能斯特方程式的e成为与具备现有的水系电解液的二次电池的负极电位相比高的值。
以上,对本发明的具体方式进行了详细说明,但这些只不过是例示,不限定专利申请要求保护的范围。另外,专利申请要求保护的范围所记载的发明包括对以上例示的具体方式进行各种变更的变更方式。
- 还没有人留言评论。精彩留言会获得点赞!