用于脂肪源性干细胞临床即用型活性保存方法与流程
本发明涉及短时间运输储存过程中最佳的保存温度及最适合的细胞保存介质,特别涉及一种用于脂肪源性干细胞临床即用型活性保存方法。
背景技术:
脂肪源性干细胞在临床的应用中短期储存方法关系到细胞治疗的效果和安全性,细胞产品从制备完毕到治疗使用前的这一时间段(包括细胞产品的运输)保持细胞产品仍处于活力最佳状态或进入人体后能发挥较好的治疗效果。有关文献报道关于细胞体外保存技术主要包括4℃非冷冻保存、程控降温液氮(196℃)保存、-80℃直接冷冻保存。冻存细胞的方法主要集中在关于细胞的长期保存,但不管是直接-196℃液氮保存,还是“慢冻快融”技术冷冻保存都需要加入冷冻保护剂来减少细胞“胞内冰晶形成”等冷冻伤害,因为低温冻存细胞会导致细胞膜不可逆性的破坏(Saragusty J,Arav A.Current progress in oocyte and embryo cryopreservation by slow freezing and vitrification[J].Reproduction,2011,141(1):1-19.),而多数的冷冻保护剂对人体是有毒性的,所以并不适合用于临床实践中。4℃是可移植脂肪存放的最佳温度,保存24h内脂肪细胞活性基本不变(Daisuke Matsumoto,M.D,Tomokuni Shigeura,M.S,Katsujiro Sato,M.D.Influences of Preservation at Various Temperatures on Liposuction Aspirates[J].Plastic and Reconstructive Surgery.2007,120(6):1510-1517.)(陈苑雯,钟鸿展,刘宏伟.颗粒脂肪体外处理方法对其存活质量影响的研究进展[J].中国美容医学,2013,22(1):204-207.)。因此在获取抽脂组织中,我们将脂肪收集在低温收集装置中,4℃条件下无菌低温保存。细胞体外生存环境越接近自身细胞原始生长环境则最能维持细胞活性,因此临床上多选择一些对人体有益或无害的输注液体作为干细胞治疗的介质。在我们前期的探索研究工作中,我们猜测血清或是PRP可能是较好的保存介质(李朦,刘宏伟.不同保存方法对“临床即用型”脂肪源性干细胞活性影响的评估[J].中国美容医学,2013,25(4):100-103.),因此何种来源的保存介质极度显现安全问题。即用型脂肪源性干细胞最佳保存介质需具备无免疫源性,且制备简易,符合临床使用规范及经济效益。
技术实现要素:
为了克服现有技术的缺点与不足,本发明的目的在于提供一种用于脂肪源性干细胞临床即用型活性保存方法。
细胞产品安全和正确的应用于临床,必须满足外在条件及内在因素各方面的要求,包括细胞提取的环境、细胞保存的条件等方面,首先细胞必须在符合cGMP标准的实验室或者临床生产体系下完成,然后在细胞分离后细胞必须保存在完全无菌且最适合ADSCs存活的环境下保存,直至安全的用于人体,才能保证手术的安全性和成功率。然而根据现阶段的国情、大多数的医疗机构的条件和人才储备来看,能够符合上述要求的临床机构甚少,这就存在手术和细胞处理可能不在同一个空间或区域内完成,因而涉及到细胞运输期间及使用前的短期保存问题,即“即用型”ADSCs临床用产品的准备问题。临床治疗过程有其特殊性,如病人抽脂后出现不适,医院器械、设备故障或其它原因不能及时使用细胞产品,那么在治疗前这段时间怎样保存才能即保持了ADSCs的最佳活性又便于安全有效的使用细胞产品是值得研究的问题。对于即用型ADSCs临床运用研究中,细胞存活率及细胞活力是细胞治疗的关键,在细胞产品从符合GMP标准的实验室环境下提取之后,在其被分离后而未使用时或在运输过程中,将细胞保存在能保证其安全性、疗效性的温度及细胞保存介质悬液中,即细胞的短期储存更具有实际的临床意义。我们经试验反复验证设计研制出ADSCs在运输或短时间储存过程中最佳的保存温度及最适合的细胞保存介质。
本发明的目的在于将细胞保存在能保证其安全性、疗效性的温度及细胞保存介质悬液中,即细胞的短期储存更具有实际的临床意义。
本发明的目的通过下述技术方案实现:
一种用于脂肪源性干细胞临床即用型活性保存方法,包括如下步骤:
将脂肪源性干细胞悬浮于10±0.5%(v/v)无免疫源性人源性血清(HumanSerum,HS)或人富血小板血浆(Platelet-rich plasma,PRP)中,4℃静置保存。
所述的脂肪源性干细胞悬浮液的浓度为105~106个/mL;
所述的保存的时间优选为2~4h。
具有包括如下步骤:
(1)脂肪源性干细胞分离及温度、细胞保存液分组:
①取6例25~40岁女性大腿、腹部脂肪抽吸术的脂肪组织,用相同0.1%胶原酶消化和离心的方法提取脂肪源性干细胞,以同样细胞密度种植并传代培养,得到P2代细胞;
②取生长良好的P2代细胞,每培养瓶以PBS洗涤后用1mL 0.25%胰蛋白酶后,置37℃温箱消化5min,加入3mL PBS缓冲液稀释,以300g离心10min,弃上清,加入1mL PBS缓冲液,轻轻吹打后细胞计数板进行计数,并记录;
③在超净台中准备14支试管,每一管分别以5×105细胞密度悬浮于1.8mL生理盐水中,放入4℃冰箱备用;
④取7支ADSCs的试管,于管上标记0~6号,离心去上清,分别依次序加入0.5mL生理盐水、0.5mL生理盐水、0.5mL 10%(v/v)无免疫源性人源性血清(HumanSerum,HS)、0.5mL 10%(v/v)人PRP、0.5mL生理盐水、0.5mL 10%(v/v)无免疫源性人源性血清、0.5mL 10%(v/v)人PRP。1~3号管放于室温下(25~28℃)静置保存,4~6号管放入4℃冰箱静置保存。
(2)不同保存温度及保存介质条件下ADSC存活率及生长情况:
①取0号管立即进行流式细胞仪存活细胞数量检测,作为对照组。轻轻摇晃试管,混合均匀,将500μL的细胞悬液转移至流式试管中,加入5μL/mg.mL-1PPI,轻轻吹打后避光染色10min,采用AnnexinV-FITC/PI双染色检测,根据实际情况调节电子体积(EV)及侧向散射光(SS)的值使细胞群位于合适的位置,并分别调节EV图及SS图中Counting的范围去除碎片干扰,再根据PI的荧光强度(FL3)设定死活细胞范围,并保存程序为CHOcellcounting,读取数据。细胞计数为SS图的统计值,细胞存活率为FL3图的统计值,记录结果。
②在细胞分别保存2h、4h、6h之后,对各组细胞按同样方法进行流式细胞仪存活细胞数量的检测,并将各组细胞计数和细胞存活率的统计图转换成柱状示意图,并记录比较结果。
(3)不同保存温度及保存介质条件下ADSCs增殖能力检测:
①取0号管细胞,在分离之后立即进行CCK8细胞增殖能力检测,作为对照组。取多个96孔培养板,按细胞密度为10000细胞分别种植于96孔板中,放置37℃恒温培养箱中培养。24h后待细胞贴壁,取出一个96孔板,去除培养液后PBS洗涤,每孔加入100μL细胞培养液,再每孔依次加入1μL CCK8配制液;轻轻摇晃96孔板混匀,放入37℃恒温箱中直至培养液为橘红色,即可上酶标仪(波长450nm)检测,读取每个孔光吸收值,并记录结果。
②其他各组,分别在细胞保存2h、4h、6h时取各组细胞以上述方法进行检测,根据各组种植时间,每日重复检测步骤直至培养至1周;以时间为横坐标,吸光值为纵坐标绘制各组细胞生长曲线及比较各组差异。
本发明的机理是:本发明是适用于即用型ADSCs临床治疗运用技术中,细胞存活率及细胞活力是细胞治疗的关键,在细胞产品从符合GMP标准的实验室环境下提取之后,在其被分离后而未使用时或在运输过程中,将细胞保存在能保证其安全性、疗效性的温度及细胞保存介质悬液中,这使得细胞的短期储存更具有实际的临床意义。ADSCs在运输或短时间储存过程中最佳的保存温度及最适合的细胞保存介质,使临床即用型ADSCs在使用于人体之前保持最佳细胞活力,提高临床脂肪源性干细胞应用的有效性及安全性,以便自体脂肪源性干细胞的临床应用及临床技术的推广。
脂肪源性干细胞(SVF/ADSCs)作为成体干细胞家族成员具有来源丰富、取材容易、增殖迅速、多项分化潜能、低免疫原性和免疫调节作用,在再生医学领域展现了广阔的应用前景,并作为一种新的细胞产品或新技术用于临床研究及治疗。由于临床治疗的特点和需要,作为细胞产品从制备完毕到治疗使用前的这一时间段(包括细胞产品的运输)如何保持细胞产品仍处于活力最佳状态或进入人体后能发挥较好的治疗效果,同时对于移植入人体的ADSCs我们对其安全性、细胞存活力及增殖能力要求更高,所以除了温度影响,细胞保存介质的选择或配制也是储存的关键因素,必须考虑到它对细胞安全性和疗效性的影响,并且必须符合临床的使用规范标准。文献报道体外长期保持细胞活性合适的温度是﹣80℃或﹣196℃低温保存,但低温冻存细胞需加入带有毒性的冷冻保护剂以免导致细胞膜不可逆性的破坏。根据细胞产品临床运用需要,我们寻找出一种ADSCs被提取后即将使用前或运输过程中的短时间内能够维持细胞最佳生物学活性的保存方法,以确保细胞在用于人体治疗之前处于最佳状态,进入人体靶器官后发挥较好治疗作用。本临床即用型细胞产品保存方法具有符合临床规范,经济、简便、且能较好保持细胞活性的优点。它的推广使用可提高细胞产品临床运用的有效性及安全性,具有极大的经济和社会效益。
本发明相对于现有技术具有如下的优点及效果:
(1)全血及PRP中PLT计数:
全血PLT计数为(3.09±0.5)×105个/μL,PRP中PLT计数为(17.1±1.5)×105个/μL,其PLT浓度约为全血的5倍多。
(2)不同保存温度及保存介质条件下ADSC存活率结果:
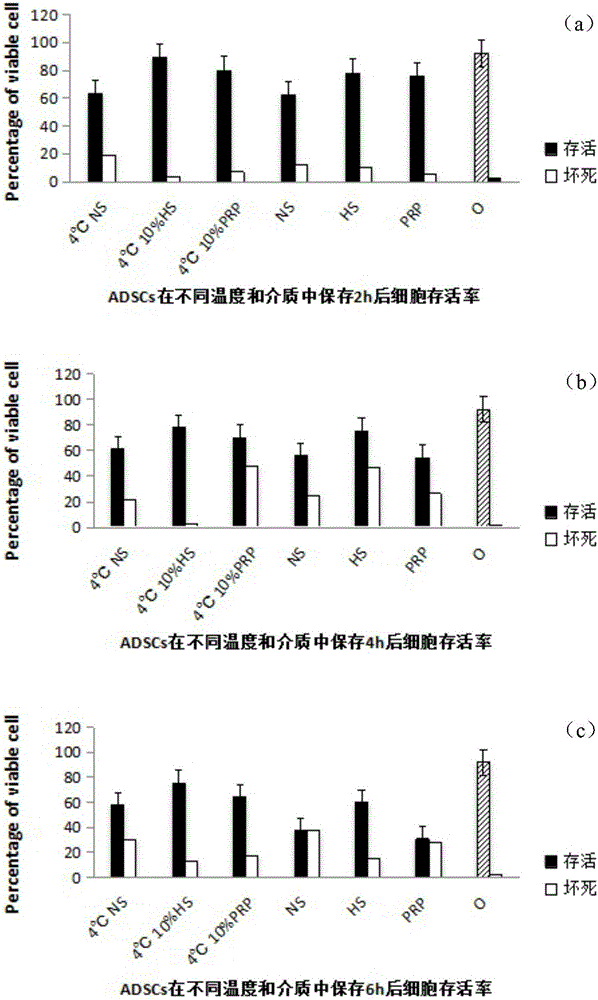
对照组的细胞流式细胞结果显示(图1):正常存活细胞占全部細胞的92.16%,死亡细胞仅占2.60%,早期凋亡、晚期凋亡各占0.75%和4.49%。各组ADSCs随保存时间的延长,细胞存活率呈进行性下降。比较室温及4℃的细胞存活率,6h内各时间段各组细胞存活率均有明显差异(P<0.05),4℃条件下保存细胞存活率均较高,细胞死亡及凋亡率均较低,有明显优势。不同溶液下保存2h后各组细胞存活率均有小幅度下降,但都维持在65%以上,坏死细胞不超过20%,以4℃10%(v/v)无免疫源性人源性血清组为最佳(P<0.05),几乎接近对照组,细胞存活率89.18%,细胞死亡率4.06%,细胞凋亡率6.75%左右;其次是4℃10%hPRP组,正常细胞在80%以上。当细胞保存4小时后,相对保存两小时后的细胞存活率都有所下降(P<0.05),4℃10%hHS组细胞存活率仍最高,占总细胞量77.87%,较保存2小时时细胞存活率下降但死亡细胞变化不大,主要为细胞早期凋亡的增加。4℃与室温下同一介质下差别最大的为hPRP(P<0.05),由4℃时存活率为70.15%,室温下细胞存活率只有54.21%。细胞保存6h后各组间均有明显差异(P<0.05),4℃10%hHS组细胞存活率虽有下降但变化不明显,细胞存活率仍有75.41%,其他各组细胞存活率均明显下降,细胞死亡及凋亡明显增加,室温下10%hPRP组细胞存活率仅剩30.70%。由此可见,如果要保证细胞存活率在80%以上和极低细胞坏死率,应在细胞提取后2h内尽快使用细胞,尽量不要超过4h,短时间内保存在4℃10%hHS条件下最佳。
(3)不同保存温度及保存介质条件下ADSCs增殖能力检测:
经过CCK8细胞增殖实验的结果显示(图2):各组ADSCs增殖能力均随保存时间递增而减弱,4℃与室温下细胞增殖情况有明显差异,同种保存溶液在4℃条件下保存的各组细胞增殖能力均高于室温下(P<0.05);细胞保存2h与4h后4℃10%hPRP组与对照组最相近(P>0.05),甚至在保存2h后的细胞增殖能力明显超过对照组细胞;4℃10%HS组虽然不及4℃10%hPRP组细胞增值力明显上升,但与对照组相比无明显差异(P>0.05),4℃10%hPRP但随时间增长,4℃10%hPRP组呈下降趋势,直至保存6h后与4℃10%hHS组相近,均与对照组有明显差异(P<0.05),而4℃10%hHS组虽然在保存2h和6h后不及对照组细胞增殖能力强,但相比4℃10%hPRP较稳定。由此可见,为了保持细胞最佳增殖能力应尽量在细胞提取后4h内使用,并尽量保存在4℃条件下,4℃10%hHS和4℃10%hPRP对ADSCs短期保存的增殖能力均有促进作用。
附图说明
图1是不同介质中的ADSCs保存在室温和4℃条件下2h、4h、6h内细胞变化图。
图2是ADSCs在不同温度和介质中保存2h、4h、6h内细胞增殖变化图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1
一种用于脂肪源性干细胞临床即用型活性保存方法,具有包括如下步骤:
(1)脂肪源性干细胞分离及温度、细胞保存液分组:
①取6例25~40岁女性大腿、腹部脂肪抽吸术的脂肪组织,用相同0.1%胶原酶消化和离心的方法提取脂肪源性干细胞,以同样细胞密度种植并传代培养,得到P2代细胞;
②取生长良好的P2代细胞,每培养瓶以PBS洗涤后用1mL 0.25%胰蛋白酶后,置37℃温箱消化5min,加入3mL PBS缓冲液稀释,以300g离心10min,弃上清,加入1mL PBS缓冲液,轻轻吹打后细胞计数板进行计数,并记录;
③在超净台中准备14支试管,每一管分别以5×105细胞密度悬浮于1.8mL生理盐水中,放入4℃冰箱备用;
④取7支ADSCs的试管,于管上标记0~6号,离心去上清,分别依次序加入0.5mL生理盐水、0.5mL生理盐水、0.5mL 10%(v/v)无免疫源性人源性血清(HumanSerum,HS)、0.5mL10%(v/v)人PRP、0.5mL生理盐水、0.5mL 10%(v/v)无免疫源性人源性血清、0.5mL 10%(v/v)人PRP。1~3号管放于。室温下(25~28℃)静置保存,4~6号管放入4℃冰箱静置保存。
(2)不同保存温度及保存介质条件下ADSC存活率及生长情况:
①取0号管立即进行流式细胞仪存活细胞数量检测,作为对照组。轻轻摇晃试管,混合均匀,将500μL的细胞悬液转移至流式试管中,加入5μL/mg.mL-1PPI,轻轻吹打后避光染色10min,采用AnnexinV-FITC/PI双染色检测,根据实际情况调节电子体积(EV)及侧向散射光(SS)的值使细胞群位于合适的位置,并分别调节EV图及SS图中Counting的范围去除碎片干扰,再根据PI的荧光强度(FL3)设定死活细胞范围,并保存程序为CHOcellcounting,读取数据。细胞计数为SS图的统计值,细胞存活率为FL3图的统计值,记录结果。
②在细胞分别保存2h、4h、6h之后,对各组细胞按同样方法进行流式细胞仪存活细胞数量的检测,并将各组细胞计数和细胞存活率的统计图转换成柱状示意图,并记录比较结果。
(3)不同保存温度及保存介质条件下ADSCs增殖能力检测:
①取0号管细胞,在分离之后立即进行CCK8细胞(BestBio-贝博)增殖能力检测,作为对照组。取多个96孔培养板,按细胞密度为10000细胞分别种植于96孔板中,放置37℃恒温培养箱中培养。24h后待细胞贴壁,取出一个96孔板,去除培养液后PBS洗涤,每孔加入100μL细胞培养液(细胞培养液为DMEM培养液,Sigma公司),再每孔依次加入1μL CCK8配制液;轻轻摇晃96孔板混匀,放入37℃恒温箱中直至培养液为橘红色,即可上酶标仪(波长450nm)检测,读取每个孔光吸收值,并记录结果。
②其他各组,分别在细胞保存2h、4h、6h时取各组细胞以上述方法进行检测,根据各组种植时间,每日重复检测步骤直至培养至1周;以时间为横坐标,吸光值为纵坐标绘制各组细胞生长曲线及比较各组差异。
试验结果如下:
(1)全血及PRP中PLT计数:
全血PLT计数为(3.09±0.5)×105个/μL,PRP中PLT计数为(17.1±1.5)×105个/μL,其PLT浓度约为全血的5倍多。
(2)不同保存温度及保存介质条件下ADSC存活率结果:
对照组的细胞流式细胞结果显示(图1):正常存活细胞占全部細胞的92.16%,死亡细胞仅占2.60%,早期凋亡、晚期凋亡各占0.75%和4.49%。各组ADSCs随保存时间的延长,细胞存活率呈进行性下降。比较室温及4℃的细胞存活率,6h内各时间段各组细胞存活率均有明显差异(P<0.05),4℃条件下保存细胞存活率均较高,细胞死亡及凋亡率均较低,有明显优势。不同溶液下保存2h后各组细胞存活率均有小幅度下降,但都维持在65%以上,坏死细胞不超过20%,以4℃10%(v/v)无免疫源性人源性血清(hHS)组为最佳(P<0.05),几乎接近对照组,细胞存活率89.18%,细胞死亡率4.06%,细胞凋亡率6.75%左右;其次是4℃10%人PRP(hPRP)组,正常细胞在80%以上。当细胞保存4小时后,相对保存两小时后的细胞存活率都有所下降(P<0.05),4℃10%hHS组细胞存活率仍最高,占总细胞量77.87%,较保存2小时时细胞存活率下降但死亡细胞变化不大,主要为细胞早期凋亡的增加。4℃与室温下同一介质下差别最大的为hPRP(P<0.05),由4℃时存活率为70.15%,室温下细胞存活率只有54.21%。细胞保存6h后各组间均有明显差异(P<0.05),4℃10%hHS组细胞存活率虽有下降但变化不明显,细胞存活率仍有75.41%,其他各组细胞存活率均明显下降,细胞死亡及凋亡明显增加,室温下10%hPRP组细胞存活率仅剩30.70%。由此可见,如果要保证细胞存活率在80%以上和极低细胞坏死率,应在细胞提取后2h内尽快使用细胞,尽量不要超过4h,短时间内保存在4℃10%hHS条件下最佳。
(3)不同保存温度及保存介质条件下ADSCs增殖能力检测:
经过CCK8细胞增殖实验的结果显示(图2):各组ADSCs增殖能力均随保存时间递增而减弱,4℃与室温下细胞增殖情况有明显差异,同种保存溶液在4℃条件下保存的各组细胞增殖能力均高于室温下(P<0.05);细胞保存2h与4h后4℃10%hPRP组与对照组最相近(P>0.05),甚至在保存2h后的细胞增殖能力明显超过对照组细胞;4℃10%HS组虽然不及4℃10%hPRP组细胞增值力明显上升,但与对照组相比无明显差异(P>0.05),4℃10%hPRP但随时间增长,4℃10%hPRP组呈下降趋势,直至保存6h后与4℃10%hHS组相近,均与对照组有明显差异(P<0.05),而4℃10%hHS组虽然在保存2h和6h后不及对照组细胞增殖能力强,但相比4℃10%hPRP较稳定。由此可见,为了保持细胞最佳增殖能力应尽量在细胞提取后4h内使用,并尽量保存在4℃条件下,4℃10%hHS和4℃10%hPRP对ADSCs短期保存的增殖能力均有促进作用。
良好的细胞保存条件和细胞保存微环境决定了ADSCs的活性,当坏死细胞和凋亡细胞增多时,细胞释放毒素相应增多,细胞微环境会被破坏,细胞存活率及活性随之减弱,引起更多的细胞坏死或停止生长。细胞凋亡一般由生理或病理性因素引起,而细胞坏死则主要因为缺氧造成,在短期保存或运输过程中,细胞保存温度和保存介质溶液是构成细胞生存微环境的主要因素。通过本实验可以看出,制备完毕的临床即用性ADSCs短时间内保存在4℃的细胞活力明显比室温条件下保存更强。4℃是临床最常用的低温保存方法,不仅操作简单、无需特殊的仪器设备,相对比较其他低温保存,不需要涉及添加冷冻保护剂、细胞复苏等特殊操作,避免了引起细胞毒性反应或细胞膜不可逆性破坏,更减少了细胞污染的风险,综合比较各保存温度,4℃是最适合临床使用型细胞保存的温度,更能维持其相对稳定的微环境,从而减慢了细胞凋亡和坏死的速度,尽可能维持了细胞的活性。而在4℃保存条件下,细胞存活率、增殖能力最佳的一组细胞保存介质是10%HS溶液,其次是10%PRP溶液,两者皆比临床使用的生理盐水溶液组强。10%HS和10%PRP溶液的确是短期保存临床即用性ADSCs的保存介质较为合适的选择,相对比较10%HS略占优势的原因,可能是对于细胞的微环境来说,血清的成分更接近细胞生长的必需成分,使细胞的活力更稳定;而PRP被激活后释放出的生长因子可能使ADSCs在很短时间内细胞生长迅速,增殖能力短时间内达到高峰,但作用持续时间不长,ADSCs过早的消耗能量,提早衰老导致细胞凋亡率的增加,造成细胞迅速生长甚至衰老,从而凋亡细胞增多,保存时间一长细胞微环境被破坏,加速细胞死亡,再加上ADSCs体外培养属于贴壁生长传代的细胞,而临床用细胞存放的状态处于悬浮状态以至于细胞无法稳定、有规律的生长、增殖,总括而言,10%HS溶液比10%PRP溶液作为细胞保存介质更稳定,而且HS的配制较PRP简单,用血量较少,不需要经过多次离心,减少感染风险,临床也更用以实现,所以用10%HS溶液作为临床即用性脂肪源性干细胞的保存介质更为合适。那么如果在临床即用型脂肪源性干细胞需要运输或短期内保存时,将ADSCs保存在4℃下10%(v/v)无免疫源性人源性血清的保存介质溶液中是目前较佳的选择。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!