高纯度甜菊醇糖苷的制作方法
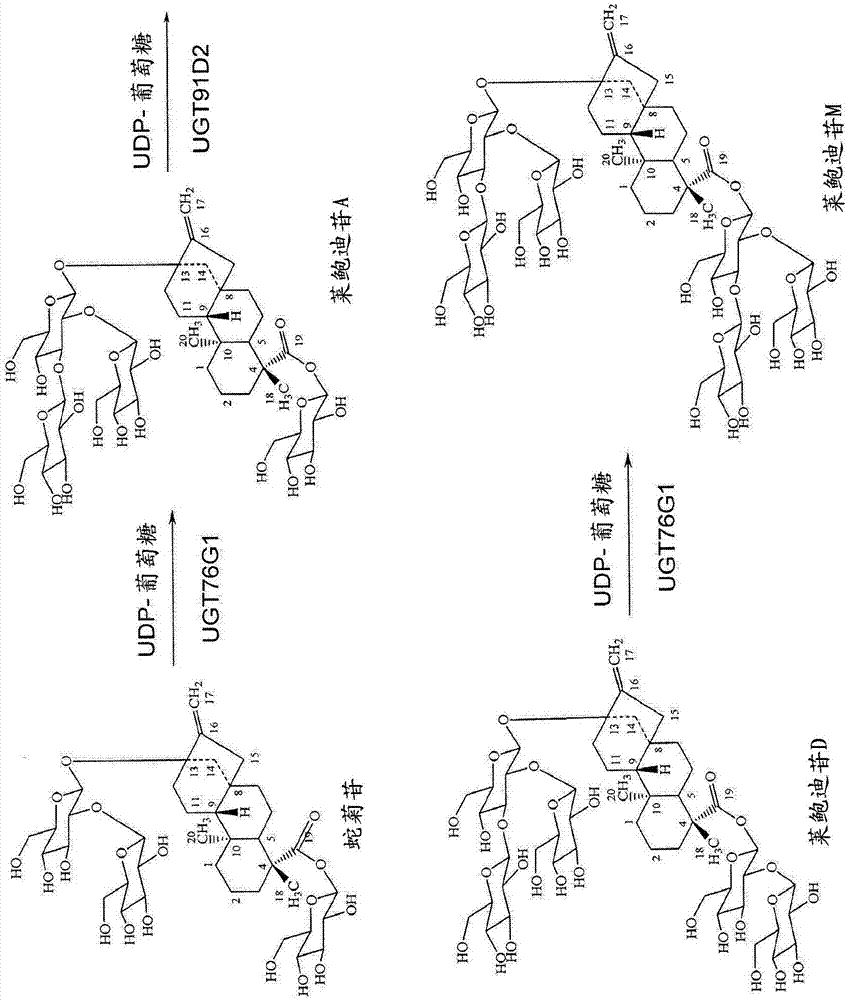
本发明涉及用于制备包含甜菊醇糖苷的组合物的生物催化方法,所述组合物包括高度纯化的甜菊醇糖苷组合物。本发明还涉及新的甜菊醇糖苷、及其分离方法和新甜菊醇糖苷的用途。发明背景高强度甜味剂具有高于蔗糖甜度水平许多倍的甜度水平。它们基本上是无热量的并且通常用于低热和减热产品中,包括食品和饮料。高强度甜味剂不会引起升糖反应,这使其适用于针对糖尿病和其他对控制碳水化合物摄入感兴趣的人群的产品中。甜菊醇糖苷是一类在甜菊(steviarebaudianabertoni)的叶中发现的化合物,甜菊是南美某些地区土生土长的菊科(asteraceae)(菊科(compositae))多年生灌木。它们在结构上通过单碱基甜菊醇来表征,因位置c13和c19的碳水化合物残基的存在而不同。它们在甜菊叶中累积,构成总干重的大约10%-20%。基于干重,在甜菊叶中发现的四种主要的糖苷通常包括蛇菊苷(9.1%)、莱鲍迪苷a(3.8%)、莱鲍迪苷c(0.6-1.0%)和杜克苷a(0.3%)。其他已知甜菊醇糖苷包括莱鲍迪苷b、c、d、e、f和m、甜菊醇双苷(steviolbioside)和悬钩子苷(rubusoside)。尽管用于从甜菊制备甜菊醇糖苷的方法是已知的,但这些方法中的许多不适用于商业使用。因此,对简单、有效且经济的用于制备包含甜菊醇糖苷的组合物的方法仍然存在需求,所述组合物包括高度纯化的甜菊醇糖苷组合物。另外,对于新的甜菊醇糖苷及其制备和分离方法仍然存在需求。发明概述本发明提供了用于制备包含靶甜菊醇糖苷的组合物的生物催化方法,通过将包含有机底物的起始组合物与微生物和/或生物催化剂接触,由此产生包含靶甜菊醇糖苷的组合物。起始组合物包含有机化合物。在一个实施方案中,起始组合物选自多元醇和各种碳水化合物。靶甜菊醇糖苷可以是任何甜菊醇糖苷。在一个实施方案中,靶甜菊醇糖苷是甜菊醇单苷(steviolmonoside)、甜菊醇双苷、悬钩子苷、杜克苷b、杜克苷a、莱鲍迪苷b、莱鲍迪苷g、蛇菊苷、莱鲍迪苷c、莱鲍迪苷f、莱鲍迪苷a、莱鲍迪苷i、莱鲍迪苷e、莱鲍迪苷h、莱鲍迪苷l、莱鲍迪苷k、莱鲍迪苷j、莱鲍迪苷m、莱鲍迪苷m2、莱鲍迪苷d、莱鲍迪苷d2、莱鲍迪苷n、莱鲍迪苷o或合成的甜菊醇糖苷。在一个实施方案中,靶甜菊醇糖苷是蛇菊苷。在另一个实施方案中,靶甜菊醇糖苷是莱鲍迪苷a。在再另一个实施方案中,靶甜菊醇糖苷是莱鲍迪苷d。在再另一个实施方案中,靶甜菊醇糖苷是莱鲍迪苷m。微生物可以是包含至少一种适用于将起始组合物转化成靶甜菊醇糖苷的生物催化剂的任何微生物。生物催化剂可以位于微生物表面上和/或微生物内部。生物催化剂包括甜菊醇生物合成酶和udp-葡糖基转移酶(ugt),或其具有高于75%氨基酸序列同一性的变体。在一个实施方案中,甜菊醇生物合成酶包括甲羟戊酸(mva)途径酶。在另一个实施方案中,甜菊醇生物合成酶包括非-甲羟戊酸-2-c-甲基-d-赤藓醇-4-磷酸途径(mep/doxp)酶。在一个实施方案中,甜菊醇生物合成酶选自香叶基香叶基二磷酸合成酶、柯巴基(copalyl)二磷酸合成酶、贝壳杉烯合成酶、贝壳杉烯氧化酶、异贝壳杉烯酸13-羟化酶(kah)、甜菊醇合成酶、脱氧木酮糖5-磷酸合成酶(dxs)、d-1-脱氧木酮糖5-磷酸还原异构酶(dxr)、4-二磷酸胞苷(cytidyl)-2-c-甲基-d-赤藓醇合成酶(cms)、4-二磷酸胞苷-2-c-甲基-d-赤藓醇激酶(cmk)、4-二磷酸胞苷-2-c-甲基-d-赤藓醇2,4-环二磷酸合成酶(mcs)、1-羟基-2-甲基-2(e)-丁烯基4-二磷酸合成酶(hds)、1-羟基-2-甲基-2(e)-丁烯基4-二磷酸还原酶(hdr)、乙酰乙酰基-coa硫解酶、截短的hmg-coa还原酶、甲羟戊酸激酶、磷酸甲羟戊酸激酶、甲羟戊酸焦磷酸脱羧酶、细胞色素p450还原酶等。udp-葡糖基转移酶可以是任一种能够将至少一个葡萄糖单体添加至甜菊醇和或甜菊醇糖苷底物来提供靶甜菊醇糖苷的udp-葡糖基转移酶。微生物可以是任一种合适的微生物。在一个实施方案中,微生物可以是例如大肠杆菌(e.coli)、酵母属(saccharomycessp.)、曲霉属(aspergillussp.)、毕赤酵母属(pichiasp.)、芽孢杆菌属(bacillussp.)、耶氏酵母属(yarrowiasp.)。在另一个实施方案中,udp-葡糖基转移酶是合成的。在一个实施方案中,udp-葡糖基转移酶选自ugt74g1、ugt85c2、ugt76g1、ugt91d2或其具有高于75%氨基酸序列同一性的变体。在一个实施方案中,udp-葡糖基转移酶是任一种能够将至少一个葡萄糖单体添加至悬钩子苷形成蛇菊苷的udp-葡糖基转移酶。在特定实施方案中,udp-葡葡糖基转移酶是ugt91d2或与ugt91d2具有高于75%氨基酸序列同一性的ugt91d2变体。在一个实施方案中,udp-葡糖基转移酶是任一种能够将至少一个葡萄糖单体添加至蛇菊苷形成莱鲍迪苷a的udp-葡糖基转移酶。在特定实施方案中,udp-葡葡糖基转移酶是ugt76g1或与ugt76g1具有高于75%氨基酸序列同一性的ugt76g1变体。在另一个实施方案中,udp-葡糖基转移酶是任一种能够将至少一个葡萄糖单体添加至莱鲍迪苷a形成莱鲍迪苷d的udp-葡糖基转移酶。在特定实施方案中,udp-葡葡糖基转移酶是ugt91d2或与ugt91d2具有高于75%氨基酸序列同一性的ugt91d2变体。在再另一个实施方案中,udp-葡糖基转移酶是任一种能够将至少一个葡萄糖单体添加至莱鲍迪苷d形成莱鲍迪苷m的udp-葡糖基转移酶。在特定实施方案中,udp-葡葡糖基转移酶是ugt76g1或与ugt76g1具有高于75%氨基酸序列同一性的ugt76g1变体。在再另一个实施方案中,udp-葡糖基转移酶是任一种能够将至少一个葡萄糖单体添加至莱鲍迪苷i形成莱鲍迪苷m的udp-葡糖基转移酶。在特定实施方案中,udp-葡葡糖基转移酶是ugtsl或与ugtsl具有高于75%氨基酸序列同一性的ugtsl变体。在再另一个实施方案中,udp-葡糖基转移酶是任一种能够将至少一个葡萄糖单体添加至莱鲍迪苷e形成莱鲍迪苷m的udp-葡糖基转移酶。在特定实施方案中,udp-葡葡糖基转移酶是ugt76g1或与ugt76g1具有高于75%氨基酸序列同一性的ugt76g1变体。任选地,本发明的方法进一步包括再循环udp来提供udp-葡萄糖。在一个实施方案中,所述方法包括通过提供再循环催化剂和再循环底物来再循环udp,使得使用催化量的udp-葡糖基转移酶和udp-葡萄糖来进行甜菊醇糖苷底物变成靶甜菊醇糖苷的生物转化(图3)。在一个实施方案中,再循环催化剂是蔗糖合成酶。在一个实施方案中,再循环底物是蔗糖。任选地,本发明的方法进一步包括纯化包含靶甜菊醇糖苷的组合物。可以通过任何合适的方法,如,例如,结晶、通过膜分离、离心、提取、色谱分离或这些方法的组合,来纯化包含靶甜菊醇糖苷的组合物。在一个实施方案中,纯化产生包含基于无水基础高于约80%重量的靶甜菊醇糖苷的组合物。在另一个实施方案中,纯化产生包含高于约90%重量的靶甜菊醇糖苷的组合物。在特定实施方案中,组合物包含高于约95%重量的靶甜菊醇糖苷。靶甜菊醇糖苷可以是任何多晶形或无定形形式,包括水解物、溶剂化物、无水物或其组合。本发明还提供了包含通过所公开的方法制备的组合物的消费产品。合适的消费品包括,但不限于,食品、饮料、药物组合物、烟草制品、营养保健品组合物、口服卫生组合物和化妆品组合物。本发明还提供新的甜菊醇糖苷rebd2和rebm2,其分别是rebd和rebm的异构体。在一个实施方案中,提供了分离并纯化的rebd2。在另一个实施方案中,提供了分离并纯化的rebm2。rebd2和rebm2也存在于本文中公开的任一种消费品中。在特定实施方案中,提供了包含rebd2和/或rebm2的饮料。本文中还提供了制备rebd2和rebm2的方法。两者都是在reba至rebd的生物转化过程中形成的。认为rebm2从原位rebd2的生物转化形成。本文中还提供了通过具有β-1,6-葡糖苷酶活性的酶,选择性水解rebd2和/或rebm2中的1,6-β-糖苷键的方法。在一个实施方案中,为了选择性水解rebd2和/或rebm2中的1,6-β-糖苷键,至少一种酶选自糖苷酶(nc-iubmbec3.2.1.)、葡糖苷酶、葡聚糖酶、isolase(011410;nationalenzymecompany,usa)、aromase(gly0151441;amanoenzyme,日本)、柚皮苷酶(nah0550102;amanoenzyme,日本)、纤维素酶(例如,来自里氏木霉(trichodermareesei)atcc26921的纤维素酶;sigmac2730)、纤维二糖酶(例如,来自米曲霉(aspergillusniger)的纤维二糖酶,sigmac6105)、viscozymel(sigmav2010)等。在一个实施方案中,本发明是用于制备包含rebd2的组合物的方法,其包括:(a)将包含reba的起始组合物与能够将reba转化成rebd2的酶、udp-葡萄糖和任选的udp-葡萄糖再循环酶接触,以产生包含rebd2的组合物,和(b)分离包含rebd2的组合物。在另一个实施方案中,本本发明是用于制备包含rebm的组合物的方法,其包括:(a)将包含rebd的起始组合物与能够将rebd转化成rebm的酶、udp-葡萄糖和任选的udp-葡萄糖再循环酶接触,以产生包含rebm的组合物,和(b)分离包含rebm的组合物。在再一个实施方案中,本发明是用于制备包含rebm的组合物的方法,其包括:(a)将包含reba的起始组合物与能够将reba转化成rebd的酶、udp-葡萄糖和任选的udp-葡萄糖再循环酶接触,以产生包含rebd的组合物,和(b)任选地,分离包含rebd的组合物,(c)将包含rebd的组合物与能够将rebd转化成rebm的酶、udp-葡萄糖和任选的udp-葡萄糖再循环酶接触,以产生包含rebm的组合物,和(d)分离包含rebm的组合物。组合物可以进一步被纯化,以提供基于干基具有高于约95%总量的纯度的rebd或rebm。附图简述包括附图来提供本发明的进一步理解。附图说明了本发明的实施方案并且与描述一起用于解释本发明实施方案的原理。图1显示了rebm的结构。图2显示了从蛇菊苷生物催化生产rebm。图3显示了使用酶ugt76g1以及伴随经由蔗糖合成酶的udp至udp葡萄糖的再循环,从蛇菊苷生物催化生产reba。图4显示了rebm的ir谱。图5显示了如实施例14中详述的,从rebd生物催化生产rebm的产物的hplc色谱。具有24.165分钟停留时间的峰对应于未处理的rebd。具有31.325分钟停留时间的峰对应于rebm。图6显示了通过生物催化从rebd产生的纯化rebm的hplc色谱。图7显示了rebm标准品的hplc色谱。图8显示了rebm标准品以及从rebd的生物转化纯化的rebm的共同注入的hplc色谱。图9显示了rebm标准品以及从rebd生物合成后纯化的rebm的1hnmr谱的重叠。图10显示了从rebd生物催化产生后纯化的rebm的hrms谱。图11显示了半合成甜菊醇糖苷混合物的lc-ms分析,批号cb-2977-106,显示出tic(a)、1.8分钟处的峰的ms(b)、4.1分钟处的rebm2峰的ms(c)、6.0分钟处的rebd峰的ms(d)、7.7分钟处的rebd2峰的ms(e)、9.4分钟处的峰的ms(f)、15.2分钟处的莱鲍迪苷a峰的ms(g)、16.5分钟处的峰的ms(h)和18.3分钟处的峰的ms(i)。图12显示了半合成甜菊醇糖苷混合物的痕迹,批号cb-2977-106。色谱网格线不均匀,因为检测器在注入后14分钟重新校准。图13显示了半合成甜菊醇糖苷混合物的hplc分析,批号cb-2977-106(a)、分离的rebm2(b)、分离的rebd(c)和分离的rebd2(d)。图14显示了rebd2的1hnmr谱(500mhz,吡啶-d5)。图15显示了rebd2的13cnmr谱(125mhz,吡啶-d5)。图16显示了rebd2的13cnmr谱(125mhz,吡啶-d5)的展开。图17显示了rebd2的1h-1hcosy谱(500mhz,吡啶-d5)。图18显示了rebd2的hsqc-dept谱(500mhz,吡啶-d5)。图19显示了rebd2的hmbc谱。图20显示了rebd2的hmbc谱(500mhz,吡啶-d5)的展开。图21显示了rebm2的1hnmr谱(500mhz,d2o)。图22显示了rebm2的13cnmr谱(500mhz,d2o/tsp)。图23显示了rebm2的13cnmr谱(125mhz,d2o/tsp)的展开。图24显示了rebm2的1h-1hcosy谱(500mhz,d2o)。图25显示了rebm2的hsqc-dept谱(500mhz,d2o)。图26显示了rebm2的hmbc谱(500mhz,d2o)。图27显示了rebm2的hmbc谱(500mhz,d2o)的展开。图28显示了针对实施例47中进行的分析的hplc色谱。图29显示了针对实施例47中进行的分析的hplc色谱。图30显示了实施例47中进行的lc-cad分析。图31显示了如实施例47中所述的esi-tof质谱。图32显示了如实施例47中所述的质谱。图33显示了如实施例47中所述的ms/ms谱。图34显示了如实施例47中所述的ms/ms谱。图35显示了如实施例47中所述的1hnmr的结果。图36显示了如实施例47中所述的1hnmr的结果。图37显示了如实施例47中所述的1hnmr的结果。图38显示了如实施例47中所述的13cnmr的结果。图39显示了如实施例47中所述的13cnmr的结果。图40显示了如实施例47中所述的1h-1hcosy的结果。图41显示了如实施例47中所述的hsqc-dept的结果。图42显示了如实施例47中所述的hmbc的结果。图43显示了如实施例47中所述的hmbc的结果。图44显示了如实施例47中所述的noesy的结果。图45显示了如实施例47中所述的noesy的结果。图46显示了如实施例47中所述的1dtocsy的结果。图47显示了如实施例47中所述的1dtocsy的结果。图48显示了如实施例47中所述的1dtocsy的结果。图49显示了如实施例47中所述的1dtocsy的结果。图50显示了如实施例47中所述的1dtocsy的结果。图51显示了hplc(cad)图,该图显示了蛇菊苷转化成莱鲍迪苷a。图52显示了hplc(cad)图,该图显示了莱鲍迪苷d转化成莱鲍迪苷m。图53a-e显示了hplc色谱,该色谱显示了实施例20的hplc测试结果。图54显示了hplc色谱,该色谱显示了实施例21的hplc测试结果。图55a-e显示了hplc色谱,该色谱显示了实施例22的hplc测试结果。图56a-b显示了hplc色谱,该色谱显示了实施例23的hplc测试结果。图57a-b显示了lc-ms色谱,该色谱显示了实施例24的lc-ms测试结果。图58显示了图,该图显示了实施例25的反应特征。图59a-b显示了hplc色谱,该色谱显示了实施例28的hplc测试结果。图60a-b显示了hplc色谱,该色谱显示了实施例29的hplc测试结果。图61显示了hplc色谱,该色谱显示了实施例30的hplc测试结果。图62显示了ls-ms色谱,该色谱显示了实施例31的ls-ms测试结果。图63a-c显示了hplc色谱,该色谱显示了实施例32的hplc测试结果。图64显示了hplc色谱,该色谱显示了实施例35的hplc测试结果。图65显示了hplc色谱,该色谱显示了实施例37的hplc测试结果。图66显示了图,该图显示了实施例43的hplc结果。图67显示了图,该图显示了实施例46的反应特征。图68a-f显示了实施例49的反应特征。图69a-c显示了图,该图显示了实施例50的hplc结果。图70a-d显示了实施例51的反应特征图。图71显示了实施例52的反应特征图。图72a显示了实施例54的反应特征图。图72b显示了hplc色谱,该色谱显示了实施例54的hplc分析。图73a显示了实施例55的反应特征图。图73b显示了hplc色谱,该色谱显示了实施例55的hplc分析。图74a显示了实施例56的反应特征图。图74b显示了hplc色谱,该色谱显示了实施例56的hplc分析。图75a显示了实施例57的反应特征图。图75b显示了hplc色谱,该色谱显示了实施例57的hplc分析。图76a显示了实施例58的反应特征图。图76b显示了hplc色谱,该色谱显示了实施例58的hplc分析。详述本发明提供了用于制备包含靶甜菊醇糖苷的组合物的生物催化方法,通过将包含有机底物的起始组合物与微生物接触,由此产生包含靶甜菊醇糖苷的组合物。本发明的一个目的是提供用于从起始组合物制备甜菊醇糖苷的有效生物催化方法,所述甜菊醇糖苷特别是蛇菊苷、rebe、reba、rebd、rebd2、rebm和rebm2。如本文中使用的,“生物催化”或“生物催化的”是指使用天然或遗传工程化的生物催化剂,如细胞、蛋白酶,对有机化合物进行单个或多个步骤的化学转化。生物催化包括发酵、生物合成和生物转化方法。分离的酶和完整细胞生物催化方法都是本领域已知的。生物催化剂蛋白酶可以是天然产生的蛋白或是重组蛋白。本文中所列的所有序列,包括任何核酸或氨基酸序列,包括与本文中所述的核酸或氨基酸序列具有>75%、>80%、>90%、>95%、>96%、>97%、>98%或>99%序列同一性的变体。如本文中使用的,术语“甜菊醇糖苷”是指甜菊醇的糖苷,包括但不限于天然产生的甜菊醇糖苷,例如,甜菊醇单苷、甜菊醇双苷、悬钩子苷、杜克苷b、杜克苷a、莱鲍迪苷b、莱鲍迪苷g、蛇菊苷、莱鲍迪苷c、莱鲍迪苷f、莱鲍迪苷a、莱鲍迪苷i、莱鲍迪苷e、莱鲍迪苷h、莱鲍迪苷l、莱鲍迪苷k、莱鲍迪苷j、莱鲍迪苷m、莱鲍迪苷d、莱鲍迪苷m2、莱鲍迪苷d2、莱鲍迪苷n、莱鲍迪苷o,合成甜菊醇糖苷,例如,酶糖基化的甜菊醇糖苷,及其组合。甜菊醇及其糖苷的化学结构(glc=葡萄糖)起始组合物如本文中使用的,“起始组合物”是指含有一种或多种包含至少一个碳原子的有机化合物的任何组合物(通常是水溶液)。在一个实施方案中,起始组合物选自多元醇和各种碳水化合物。术语“多元醇”是指含有超过一个羟基基团的分子。多元醇可以是分别含有2、3和4个羟基基团的二元醇、三元醇或四元醇。多元醇还可以含有超过四个羟基基团,如戊元醇、己元醇、庚元醇等,其分别含有5、6或7个羟基基团。另外,多元醇还可以是糖醇、多元醇(polyhydricalcohol)或多元醇(polyalcohol),其是碳水化合物的还原形式,其中羰基基团(醛或酮,还原糖)已经还原成伯或叔羟基基团。多元醇的实例包括,但不限于,赤藓醇、麦芽糖醇、甘露糖醇、山梨糖醇、乳糖醇、木糖醇、木糖醇、异麦芽酮糖醇、丙二醇、丙三醇、苏糖醇、半乳糖醇、氢化异麦芽酮糖、还原的异麦芽低聚糖、还原的木糖低聚糖、还原的龙胆-低聚糖、还原的麦芽糖糖浆、还原的葡萄糖糖浆、氢化淀粉水解物、多羟糖醇(polyglycitol)和糖醇或任何其他能够被还原的碳水化合物。术语“碳水化合物”是指通式(ch2o)n(其中n为3-30)的被多个羟基基团取代的醛或酮化合物,及其寡聚物和聚合物。本发明的碳水化合物另外可以在一个或多个位置被取代或脱氧。如本文中使用的,碳水化合物包括未修饰的碳水化合物、碳水化合物衍生物、取代的碳水化合物和修饰的碳水化合物。如本文中使用的,短语“碳水化合物衍生物”、“取代的碳水化合物”和“修饰的碳水化合物”是同义的。修饰的碳水化合物表示其中已经添加、去除或取代至少一个原子或其组合的任何碳水化合物。因此,碳水化合物衍生物或取代的碳水化合物包括取代和未取代的单糖、双糖、低聚糖和多糖。碳水化合物衍生物或取代的碳水化合物任选可以在任何相应的c-位置脱氧,和/或被一个或多个部分取代,所述部分如氢、卤素、卤代烷基、羧基、酰基、酰基氧、氨基、酰胺、羧基衍生物、烷基氨基、二烷基氨基、芳基氨基、烷氧基、芳氧基、硝基、氰基、磺基、巯基、亚氨基、磺酰基、硫基、亚磺酰基、氨磺酰基、烷氧羰基、甲酰胺、膦酰基、次膦酰基、磷酰基、膦基、硫酯、硫醚、肟基、肼基、氨基甲酰、磷酸基、膦酸基(phosphonato),或任何其他可行的官能团,只要碳水化合物衍生物或取代的碳水化合物起到改善甜味剂组合物的甜味的作用。根据本发明可以使用的碳水化合物的实例包括,但不限于,塔格糖、海藻糖、半乳糖、鼠李糖、各种环糊精、环状低聚糖、各种类型的麦芽糖糊精、葡聚糖、蔗糖、葡萄糖、核酮糖、果糖、苏糖、阿拉伯糖、木糖、来苏糖、阿洛糖、阿卓糖、甘露糖、艾杜糖、乳糖、麦芽糖、转化糖、异海藻糖、新海藻糖、异麦芽酮糖、赤藓糖、脱氧核糖、古洛糖、艾杜糖、塔罗糖、赤藓酮糖、木酮糖、阿洛酮糖、松二糖、纤维二糖、支链淀粉、葡糖胺、甘露糖胺、岩藻糖、葡糖醛酸、葡糖酸、葡糖酸-内酯、阿比可糖、半乳糖胺、甜菜低聚糖、异麦芽低聚糖(异麦芽糖、异麦芽三糖、潘糖等)、低聚木糖(木三糖、木二糖等)、木糖封端的低聚糖、龙胆低聚糖(龙胆二糖、龙胆三糖、龙胆四糖等)、山梨糖、黑曲霉低聚糖、帕拉金糖低聚糖、果糖低聚糖(蔗果三糖、真菌四糖等)、麦芽四糖醇、麦芽三糖醇、麦芽低聚糖(麦芽三糖、麦芽四糖、麦芽戊糖、麦芽己糖、麦芽庚糖等)、淀粉、菊粉、菊粉-低聚糖、乳果糖、蜜二糖、蜜三糖、核糖、异构化液体糖(如高果糖玉米糖浆)、偶联糖和大豆低聚糖。另外,本文中使用的碳水化合物可以是d-或l-构型。起始组合物可以是合成的或纯化的(部分或完全)、商业上可获得的或制得的。在一个实施方案中,起始组合物是甘油。在另一个实施方案中,起始组合物是葡萄糖。在再另一个实施方案中,起始组合物是蔗糖。在再另一个实施方案中,起始组合物是淀粉。在另一个实施方案中,起始组合物是麦芽糖糊精。在另一个实施方案中,起始组合物是甜菊醇糖苷。如本文中所述的,起始组合物的有机化合物用作用于生产靶甜菊醇糖苷的底物。靶甜菊醇糖苷本发明方法的靶甜菊醇糖苷可以是通过本文中公开的方法制备的任一种甜菊醇糖苷。在一个实施方案中,靶甜菊醇糖苷选自甜菊醇单苷、甜菊醇双苷、悬钩子苷、杜克苷b、杜克苷a、莱鲍迪苷b、莱鲍迪苷g、蛇菊苷、莱鲍迪苷c、莱鲍迪苷f、莱鲍迪苷a、莱鲍迪苷i、莱鲍迪苷e、莱鲍迪苷h、莱鲍迪苷l、莱鲍迪苷k、莱鲍迪苷j、莱鲍迪苷m、莱鲍迪苷m2、莱鲍迪苷d、莱鲍迪苷d2、莱鲍迪苷n、莱鲍迪苷o或其他甜菊醇糖苷。在一个实施方案中,靶甜菊醇糖苷是蛇菊苷。在另一个实施方案中,靶甜菊醇糖苷是reba。在再另一个实施方案中,靶甜菊醇糖苷是rebe。在再另一个实施方案中,靶甜菊醇糖苷是rebd。在再另一个实施方案中,靶甜菊醇糖苷是rebd2。在进一步的实施方案中,靶甜菊醇糖苷是rebm。在再另一个实施方案中,靶甜菊醇糖苷是rebm2。靶甜菊醇糖苷可以是任一种聚合或无定形形式,包括水解物、溶剂化物、无水或其组合。在一个实施方案中,本发明是用于生产rebd的生物催化方法。在再另一个实施方案中,本发明是用于生产rebd2的生物催化方法。在再另一个实施方案中,本发明是用于生产rebm的生物催化方法。在更多实施方案中,本发明是用于生产rebm2的生物催化方法。在一个实施方案中,本发明是用于生产rebi的生物催化方法。在再另一个实施方案中,本发明是用于生产rebe的生物催化方法。任选地,本发明的方法进一步包括从起始组合物中分离靶甜菊醇糖苷。可以通过任何合适的方法,如,例如,结晶、通过膜分离、离心、提取、色谱分离或这些方法的组合,来分离靶甜菊醇糖苷。在特定实施方案中,本文中所述的方法获得高度纯化的靶甜菊醇糖苷组合物。如本文中使用的,术语“高度纯化的”是指基于无水基础具有高于约80%重量的靶甜菊醇糖苷的组合物。在一个实施方案中,高度纯化的靶甜菊醇糖苷组合物基于无水基础含有高于约90%重量的靶甜菊醇糖苷,如,例如,基于干基,高于约91%、高于约92%、高于约93%、高于约94%、高于约95%、高于约96%、高于约97%、高于约98%或高于约99%靶甜菊醇糖苷含量。在一个实施方案中,当靶甜菊醇糖苷是rebm时,本文中所述的方法提供了基于干基具有高于约90%重量的rebm含量的组合物。在另一个特定的实施方案中,当靶甜菊醇糖苷是rebm时,本文中所述的方法提供了基于干基包含高于约95%重量的rebm含量的组合物。在另一个实施方案中,当靶甜菊醇糖苷是rebm2时,本文中所述的方法提供了基于干基具有高于约90%重量的rebm2含量的组合物。在另一个特定的实施方案中,当靶甜菊醇糖苷是rebm2时,本文中所述的方法提供了基于干基包含高于约95%重量的rebm2含量的组合物。在再另一个实施方案中,当靶甜菊醇糖苷是rebd时,本文中所述的方法提供了基于干基高于约90%重量的rebd含量的组合物。在另一个特定的实施方案中,当靶甜菊醇糖苷是rebd时,本文中所述的方法提供了基于干基包含高于约95%重量的rebd含量的组合物。在再另一个实施方案中,当靶甜菊醇糖苷是rebd2时,本文中所述的方法提供了基于干基高于约90%重量的rebd2含量的组合物。在另一个特定的实施方案中,当靶甜菊醇糖苷是rebd2时,本文中所述的方法提供了基于干基包含高于约95%重量的rebd2含量的组合物。在进一步的实施方案中,当靶甜菊醇糖苷是reba时,本文中所述的方法提供了基于干基高于约90%重量的reba含量的组合物。在另一个特定的实施方案中,当靶甜菊醇糖苷是reba时,本文中所述的方法提供了基于干基包含高于约95%重量的reba含量的组合物。在再进一步的实施方案中,当靶甜菊醇糖苷是rebe时,本文中所述的方法提供了基于干基高于约90%重量的rebe含量的组合物。在另一个特定的实施方案中,当靶甜菊醇糖苷是rebe时,本文中所述的方法提供了基于干基包含高于约95%重量的rebe含量的组合物。在一个实施方案中,当靶甜菊醇糖苷是rebi时,本文中所述的方法提供了基于干基高于约90%重量的rebi含量的组合物。在另一个特定的实施方案中,当靶甜菊醇糖苷是rebi时,本文中所述的方法提供了基于干基包含高于约95%重量的rebi含量的组合物。在再进一步的实施方案中,当靶甜菊醇糖苷是蛇菊苷时,本文中所述的方法提供了基于干基高于约90%重量的蛇菊苷含量的组合物。在另一个特定的实施方案中,当靶甜菊醇糖苷是蛇菊苷时,本文中所述的方法提供了基于干基包含高于约95%重量的蛇菊苷含量的组合物。微生物在本发明的一个实施方案中,将微生物与起始组合物接触,以产生包含靶甜菊醇糖苷的组合物。微生物可以是具有适用于将起始组合物转化成靶甜菊醇糖苷的生物催化剂的任何微生物。这些生物催化剂在微生物的基因组内被编码。在一个实施方案中,微生物可以是,例如,大肠杆菌(e.coli)、酵母属(saccharomycessp.)、曲霉属(aspergillussp.)、毕赤酵母属(pichiasp.)、芽孢杆菌属(bacillussp.)、耶氏酵母属(yarrowiasp.)等。生物催化剂可以位于微生物细胞的表面上和/或微生物细胞的内部。可以从微生物分离出生物催化剂并用于将起始组合物转化成靶甜菊醇糖苷。可以通过本领域已知的任何方式,包括但不限于微生物细胞的裂解、离心、过滤,来实现所述分离。可以从微生物提取生物催化剂(胞外酶)并用于将起始组合物转化成靶甜菊醇糖苷。在一个实施方案中,生物催化剂是甜菊醇生物合成酶和udp-糖基转移酶(ugt),或其具有高于75%氨基酸序列同一性的变体。甜菊醇生物合成可以是任何甜菊醇生物合成酶,或其具有高于75%氨基酸序列同一性的变体。在一个实施方案中,甜菊醇生物合成酶包括甲羟戊酸(mva)途径酶,或其具有高于75%氨基酸序列同一性的变体。在另一个实施方案中,甜菊醇生物合成酶包括非-甲羟戊酸2-c-甲基-d-赤藓醇-4-磷酸途径(mep/doxp)酶,或其具有高于75%氨基酸序列同一性的变体。在一个实施方案中,甜菊醇生物合成酶选自香叶基香叶基二磷酸合成酶、柯巴基二磷酸合成酶、贝壳杉烯合成酶、贝壳杉烯氧化酶、异贝壳杉烯酸13-羟化酶(kah)、甜菊醇合成酶、脱氧木酮糖5-磷酸合成酶(dxs)、d-1-脱氧木酮糖5-磷酸还原异构酶(dxr)、4-二磷酸胞苷-2-c-甲基-d-赤藓醇合成酶(cms)、4-二磷酸胞苷-2-c-甲基-d-赤藓醇激酶(cmk)、4-二磷酸胞苷-2-c-甲基-d-赤藓醇2,4-环二磷酸合成酶(mcs)、1-羟基-2-甲基-2(e)-丁烯基4-二磷酸合成酶(hds)、1-羟基-2-甲基-2(e)-丁烯基4-二磷酸还原酶(hdr)、乙酰乙酰基-coa硫解酶、截短的hmg-coa还原酶、甲羟戊酸激酶、磷酸甲羟戊酸激酶、甲羟戊酸焦磷酸脱羧酶、细胞色素p450还原酶等,或其具有高于75%氨基酸序列同一性的变体。udp-葡糖基转移酶可以是能够将至少一个葡萄糖单体添加至甜菊醇和或甜菊醇糖苷底物来提供靶甜菊醇糖苷的任何udp-葡糖基转移酶。在一个实施方案中,微生物是游离的。在另一个实施方案中,微生物是固定的。例如,微生物可以固定于从无机或有机材料制得的固体支持物上。适用于固定微生物的固体支持物的非限制性实例包括衍化的纤维素或玻璃、陶瓷、金属氧化物或膜。例如,微生物可以通过共价连接、吸附、交联、包埋或包胶,固定于固体支持物。在一个实施方案中,微生物在水性介质中,所述水性介质包含水和选自碳源、能源、氮源、微量元素、维生素、磷酸核苷、二磷酸核苷、三磷酸核苷、有机盐和无机盐、有机酸和矿物酸、碱等的各种成分。碳源包括甘油、葡萄糖、二氧化碳、碳酸盐、碳酸氢盐。氮源可以包括硝酸盐、亚硝酸盐、氨基酸、肽、蛋白胨或蛋白质。在特定实施方案中,所述介质包含缓冲剂。合适的缓冲剂包括,但不限于,pipes缓冲剂、醋酸盐缓冲剂和磷酸盐缓冲剂。在特定实施方案中,所述介质包含磷酸缓冲液。在一个实施方案中,所述介质还可以包括有机溶剂。在一个实施方案中,udp-葡糖基转移酶是能够将至少一个葡萄糖单体添加至悬钩子苷,由此产生蛇菊苷的任何udp-葡糖基转移酶。udp-葡糖基转移酶可以是例如ugt91d2或与ugt91d2具有高于75%氨基酸序列同一性的ugt91d2变体。在另一个实施方案中,udp-葡糖基转移酶是能够将至少一个葡萄糖单体添加至悬钩子苷,由此产生莱鲍迪苷e的任何udp-葡糖基转移酶。udp-葡糖基转移酶可以是例如ugtsl2或与ugtsl2具有高于75%氨基酸序列同一性的ugtsl2变体。在再另一个实施方案中,udp-葡糖基转移酶是能够将至少一个葡萄糖单体添加至莱鲍迪苷e,由此产生莱鲍迪苷d的任何udp-葡糖基转移酶。udp-葡糖基转移酶可以是例如ugt76g1或与ugt76g1具有高于75%氨基酸序列同一性的ugt76g1变体。在再一个实施方案中,udp-葡糖基转移酶是能够将至少一个葡萄糖单体添加至蛇菊苷,由此产生莱鲍迪苷a的任何udp-葡糖基转移酶。udp-葡糖基转移酶可以是例如ugt76g1或与ugt76g1具有高于75%氨基酸序列同一性的ugt76g1变体。在再另一个实施方案中,udp-葡糖基转移酶是能够将至少一个葡萄糖单体添加至莱鲍迪苷a,由此产生莱鲍迪苷d和/或莱鲍迪苷d2和/或莱鲍迪苷m2的任何udp-葡糖基转移酶。udp-葡糖基转移酶可以是例如ugt91d2或ugtsl2或其与ugt91d2或ugtsl2具有高于75%氨基酸序列同一性的变体。在再一个实施方案中,udp-葡糖基转移酶是能够将至少一个葡萄糖单体添加至莱鲍迪苷i,由此产生莱鲍迪苷m的任何udp-葡糖基转移酶。udp-葡糖基转移酶可以是例如ugtsl或与ugtsl具有高于75%氨基酸序列同一性的ugtsl变体。在再一个实施方案中,udp-葡糖基转移酶是能够将至少一个葡萄糖单体添加至莱鲍迪苷e,由此产生莱鲍迪苷m的任何udp-葡糖基转移酶。udp-葡糖基转移酶可以是例如ugt76g1或与ugt76g1具有高于75%氨基酸序列同一性的ugt76g1变体。在另一个实施方案中,udp-葡糖基转移酶能够添加至少一个葡萄糖单体,以产生靶甜菊醇糖苷,与选自以下geninfo识别号列表的至少一种酶具有高于75%氨基酸序列同一性,优选选自表1中呈现的组,并且更优选选自表2中呈现的组。表1表2gi编号登录号来源460409128xp.004249992.1番茄460386018xp.004238697.1番茄460409134xp.004249995.1番茄460410132xp.004250485.1番茄460410130xp.004250484.1番茄460410128xp.004250483.1番茄460378310xp.004234916.1番茄209954733bag80557.1枸杞209954725bag80553.1枸杞在再另一个实施方案中,udp-葡糖基转移酶是能够将至少一个葡萄糖单体添加至莱鲍迪苷d,由此产生莱鲍迪苷m和/或莱鲍迪苷m2的任何udp-葡糖基转移酶。udp-葡糖基转移酶可以是例如ugt76g1或与ugt76g1具有高于75%氨基酸序列同一性的ugt76g1变体。任选地,本发明的方法进一步包括再循环udp,以提供udp-葡萄糖。在一个实施方案中,所述方法包括通过提供再循环催化剂来再循环udp,即,能够udp-葡萄糖生产过剩的生物催化剂,并再循环底物,使得使用催化量的udp-葡糖基转移酶和udp-葡萄糖进行底物甜菊醇糖苷转化成靶甜菊醇糖苷(图3)。在一个实施方案中,udp-葡萄糖再循环催化剂是蔗糖合成酶。在一个实施方案中,再循环底物是蔗糖。任选地,本发明的方法进一步包括水解rebd2和/或rebm2中的1,6-β-糖苷键。在一个实施方案中,所述方法包括通过提供β-葡糖苷酶水解rebd2和/或rebm2中的1,6-β-糖苷键。在一个实施方案中,与udp-再循环生物催化剂和ugt一起提供β-葡糖苷酶,以最小化最终反应混合物中的rebd2和/或rebm2的含量并最大化rebm的产量。在特定实施方案中,为了最小化最终反应混合物中的rebd2和/或rebm2含量和最大化rebm的产量,与udp-再循环催化剂ugt76g1和ugtsl2或其与ugt76g1或ugtsl2具有高于75%氨基酸序列同一性的变体一起提供β-葡糖苷酶。任选地从所得到的组合物中纯化靶甜菊醇糖苷。可以通过任何合适的方法来实现从反应介质中纯化靶甜菊醇糖苷,以提供高度纯化的靶甜菊醇糖苷组合物。合适的方法包括结晶、通过膜分离、离心、提取(液相或固相)、色谱分离、hplc(制备性或分析),或这些方法的组合。化合物和方法本发明还提供了分离和高度纯化的rebd2。rebd2是rebd的异构体并具有以下结构:13-[(2-o-β-d-吡喃葡糖基-3-o-β-d-吡喃葡糖基-β-d-吡喃葡糖基)氧]等效-16-贝壳杉烯-19-酸(ent-kaur-16-en-19-oicacid)-[(6-o-β-d-吡喃葡糖基-β-d-吡喃葡糖基)酯]在另一个实施方案中,本发明提供了基于无水基础具有高于约95%重量纯度的rebd2,如,例如,高于约96%重量、高于约97%重量、高于约98%重量或高于约99%重量。在再另一个实施方案中,本发明在甜菊醇糖苷混合物中提供了具有高于约95%重量纯度的rebd2,如,例如,高于约96%重量、高于约97%重量、高于约98%重量或高于约99%重量。本发明还提供了包含rebd2的组合物。在一个实施方案中,本发明提供了用于制备rebd2的方法,包括:a.将包含reba的起始组合物与能够将reba转化成rebd2的酶、udp-葡萄糖和任选的udp-葡萄糖再循环酶接触,以产生包含rebd2的组合物;和b.分离包含rebd2的组合物。在一些实施方案中,能够将reba转化成rebd2的酶是udp-葡糖基转移酶,如,例如,ugt91d2、ugtsl、ugtsl_sc、ugtsl2(gino.460410132版本xp_004250485.1)、gino.460409128(ugtsl)版本xp_004249992.1、gino.115454819版本np_001051010.1、gino.187373030版本acd03249.1、gino.222619587版本eee55719.1、gino.297795735版本xp_002865752.1或eugt11。能够将reba转化成rebd2的酶可以是固定的或以重组微生物的形式来提供。在一个实施方案中,酶是固定的。在另一个实施方案中,以重组微生物的形式来提供酶。在一个实施方案中,微生物是游离的。在另一个实施方案中,微生物是固定的。例如,微生物可以固定于由无机或有机材料制成的固体支持物上。适用于固定微生物的固体支持物的非限制性实例包括衍化的纤维素或玻璃、陶瓷、金属氧化物或膜。微生物可以例如,通过共价连接、吸附、交联、包埋或包胶,固定于固体支持物上。合适的微生物包括,但不限于,大肠杆菌、酵母属、曲霉属、毕赤酵母属、芽孢杆菌属、耶氏酵母属。在一个实施方案中,微生物在水性介质中,所述水性介质包含水和选自碳源、能源、氮源、微量元素、维生素、磷酸核苷、二磷酸核苷、三磷酸核苷、有机盐和无机盐、有机酸和矿物酸、碱等的各种成分。碳源包括甘油、葡萄糖、二氧化碳、碳酸盐、碳酸氢盐。氮源可以包括硝酸盐、亚硝酸盐、氨基酸、肽、蛋白胨或蛋白质。在特定实施方案中,所述介质包含缓冲剂。合适的缓冲剂包括,但不限于,pipes缓冲剂、醋酸盐缓冲剂和磷酸盐缓冲剂。在特定实施方案中,所述介质包含磷酸盐缓冲液。在一个实施方案中,所述介质还可以包括有机溶剂。在特定实施方案中,酶是能够将reba转化成rebd2的udp-葡糖基转移酶并且包含在大肠杆菌中。在更特别的实施方案中,酶选自ugt91d2、ugtsl、ugtsl_sc、ugtsl2(gino.460410132版本xp_004250485.1)、gino.460409128(ugtsl)版本xp_004249992.1、gino.115454819版本np_001051010.1、gino.187373030版本acd03249.1、gino.222619587版本eee55719.1、gino.297795735版本xp_002865752.1或eugt11,并且包含在大肠杆菌中。在再更特别的实施方案中,酶是ugtsl2并且包含在大肠杆菌中。可以通过任何合适的方法来实现从反应介质中分离rebd2,以提供包含rebd2的组合物。合适的方法包括,但不限于,裂解、结晶、通过膜分离、离心、提取(液相或固相)、色谱分离、hplc(制备性或分析),或这些方法的组合。在特定的实施方案中,可以通过裂解和离心来实现分离。在一些实施方案中,分离可以获得基于无水基础低于约95%重量的rebd2纯度,并且组合物可以含有例如甜菊醇糖苷和/或残余的反应产物。可以将包含rebd2的组合物进一步纯化,来提供高度纯化的rebd2,即,基于无水基础具有高于约95%重量纯度的rebd2。在一些实施方案中,可以将包含rebd2的组合物进一步纯化,以提供基于无水基础具有高于约96%、高于约97%、高于约98%或高于约99%重量纯度的rebd2。可以通过本领域技术人员已知的任何方式来实现纯化,所述方式包括但不限于,结晶、通过膜分离、离心、提取(液相或固相)、色谱分离、hplc(制备性或分析),或这些方法的组合。在特定实施方案中,使用hplc来纯化rebd2。在更特别的实施方案中,使用半制备性hplc来纯化rebd2。例如,可以使用两步半制备性hplc纯化。第一步利用c18柱,使用含有a(水中25%mecn)和b(水中30%mecn)的移动相,所述移动相具有以下梯度:时间(分钟)%a%b0.0-5.01000202080252080301000第二步利用相同的柱和条件,但只使用等度移动相:水中20%mecn。本领域技术人员将认识到特定的柱、移动相、注射体积和其他hplc参数可以改变。在一个实施方案中,本发明提供了分离和高度纯化的rebm2。rebm2是rebm的异构体并具有以下结构:(13-[(2-o-β-d-吡喃葡糖基-3-o-β-d-吡喃葡糖基-β-d-吡喃葡糖基)氧]等效-16-贝壳杉烯-19-酸[(2-o-β-d-吡喃葡糖基-6-o-β-d-吡喃葡糖基-β-d-吡喃葡糖基)酯])在另一个实施方案中,本发明提供了基于无水基础具有高于约95%重量纯度的rebm2,如,例如,高于约96%重量、高于约97%重量、高于约98%重量或高于约99%重量。在再另一个实施方案中,本发明在甜菊醇糖苷混合物中提供了具有高于约95%重量纯度的rebm2,如,例如,高于约96%重量、高于约97%重量、高于约98%重量或高于约99%重量。在再另一个实施方案中,本发明在甜菊提取物中提供了具有高于约95%重量纯度的rebm2,如,例如,高于约96%重量、高于约97%重量、高于约98%重量或高于约99%重量。本发明还提供了包含rebm2的组合物。已经发现了在reba生物转化成rebd的过程中产生rebm2。如上所述,reba生物转化成rebd还产生了rebd2。因此,在一个实施方案中,本发明提供了用于制备rebm2的方法,包括:a.将包含reba和/或rebd2的起始组合物与能够将reba和/或rebd2转化成rebm2的酶、udp-葡萄糖和任选的udp-葡萄糖再循环酶接触,以产生包含rebm2的组合物;和b.分离包含rebm2的组合物。不希望受理论的束缚,当前认为途径从reba转化成rebd2开始,接着是rebd2转化成rebm2。因此,在一个实施方案中,本发明提供了一种用于制备rebm2的方法,包括:a.将包含rebd2的起始组合物与能够将rebd2转化成rebm2的酶、udp-葡萄糖和任选的udp-葡萄糖再循环酶接触,以产生包含rebm2的组合物;和b.分离包含rebm2的组合物。在再另一个实施方案中,用于制备rebm2的方法包括:a.将包含reba的起始组合物与能够将reba转化成rebd2的酶、udp-葡萄糖和任选的udp-葡萄糖再循环酶接触,以产生包含rebd2的组合物;b.任选地,分离包含rebd2的组合物;c.将包含rebd2的起始组合物与能够将rebd2转化成rebm2的酶、udp-葡萄糖和任选的udp-葡萄糖再循环酶接触,以产生包含rebm2的组合物;和d.分离包含rebm2的组合物。酶可以是udp-葡糖基转移酶,如,例如,ugt91d2、ugtsl、ugtsl_sc、ugtsl2(gino.460410132版本xp_004250485.1)、gino.460409128(ugtsl)版本xp_004249992.1、gino.115454819版本np_001051010.1、gino.187373030版本acd03249.1、gino.222619587版本eee55719.1、gino.297795735版本xp_002865752.1或eugt11。酶可以是固定的或在重组微生物中。在一个实施方案中,酶是固定的。在另一个实施方案中,酶在重组微生物中。在一个实施方案中,微生物是游离的。在另一个实施方案中,微生物是固定的。例如,微生物可以固定于由无机或有机材料制成的固体支持物上。适用于固定微生物的固体支持物的非限制性实例包括衍化的纤维素或玻璃、陶瓷、金属氧化物或膜。微生物可以例如,通过共价连接、吸附、交联、包埋或包胶,固定于固体支持物上。合适的微生物包括,但不限于,大肠杆菌、酵母属、曲霉属、毕赤酵母属、芽孢杆菌属、耶氏酵母属。在一个实施方案中,微生物在水性介质中,所述水性介质包含水和选自碳源、能源、氮源、微量元素、维生素、磷酸核苷、二磷酸核苷、三磷酸核苷、有机盐和无机盐、有机酸和矿物酸、碱等的各种成分。碳源包括甘油、葡萄糖、二氧化碳、碳酸盐、碳酸氢盐。氮源可以包括硝酸盐、亚硝酸盐、氨基酸、肽、蛋白胨或蛋白质。在特定实施方案中,所述介质包含缓冲剂。合适的缓冲剂包括,但不限于,pipes缓冲剂、醋酸盐缓冲剂和磷酸盐缓冲剂。在特定实施方案中,所述介质包含磷酸盐缓冲液。在一个实施方案中,所述介质还可以包括有机溶剂。在特定实施方案中,酶是能够将reba和/或rebd2转化成rebm2的udp-葡糖基转移酶并且包含在大肠杆菌中。在更特别的实施方案中,酶选自ugt91d2、ugtsl、ugtsl_sc、ugtsl2(gino.460410132版本xp_004250485.1)、gino.460409128(ugtsl)版本xp_004249992.1、gino.115454819版本np_001051010.1、gino.187373030版本acd03249.1、gino.222619587版本eee55719.1、gino.297795735版本xp_002865752.1或eugt11并且包含在大肠杆菌中。在再更特别的实施方案中,酶是ugtsl2并且包含在大肠杆菌中。可以通过任何合适的方法来实现从反应介质中分离rebm2,以提供包含rebm2的组合物。合适的方法包括,但不限于,裂解、结晶、通过膜分离、离心、提取(液相或固相)、色谱分离、hplc(制备性或分析),或这些方法的组合。在特定的实施方案中,可以通过裂解和离心来实现分离。在一些实施方案中,分离可以获得基于无水基础低于约95%重量的rebm2纯度,并且组合物可以含有例如甜菊醇糖苷和/或残余的反应产物。可以将包含rebm2的组合物进一步纯化,来提供高度纯化的rebm2,即,基于无水基础具有高于约95%重量纯度的rebm2。在一些实施方案中,可以将包含rebm2的组合物进一步纯化,以提供基于无水基础具有高于约96%、高于约97%、高于约98%或高于约99%重量纯度的rebm2。可以通过本领域技术人员已知的任何方式来实现纯化,所述方式包括但不限于,结晶、通过膜分离、离心、提取(液相或固相)、色谱分离、hplc(制备性或分析),或这些方法的组合。在特定实施方案中,使用hplc来纯化rebm2。在更特别的实施方案中,使用半制备性hplc来纯化rebm2。例如,可以使用两步半制备性hplc纯化。第一步利用c18柱,使用含有a(水中25%mecn)和b(水中30%mecn)的移动相,所述移动相具有以下梯度:时间(分钟)%a%b0.0-5.01000202080252080301000第二步利用相同的柱和条件,但只使用等度移动相:水中20%mecn。本领域技术人员将认识到特定的柱、移动相、注射体积和其他hplc参数可以改变。根据本发明制备的纯化甜菊醇糖苷可以用于各种消费品中,所述消费品包括但不限于食品、饮料、药物组合物、烟草制品、营养保健品组合物、口腔卫生组合物和化妆品组合物。本发明获得的高纯度rebm,具有1291.29的分子量,c56h90o33的分子式,cas注册号1220616-44-3,并且结构呈现于图1中,是白色和无味的粉末形式。当与10%蔗糖溶液相比时,化合物甜度比糖甜约200倍。红外吸收光谱显示于图4中。纯的rebm化合物的其他特性包括249-250℃的熔点和50%乙醇中[α]d25-19.0°的比旋(c=1.0)。rebm在水中的溶解度为大约0.3%,并且随着温度的提高而提高。rebm溶于甲醇、乙醇、正丙醇和异丙醇的稀溶液中。然而,其不溶于丙酮、苯、氯仿和醚。根据本发明获得的rebm是热和ph稳定的。根据本发明获得的高度纯化的靶糖苷,特别是rebd、rebd2、rebm和/或rebm2,可以“按原样”使用或结合其他甜味剂、香精和食品成分使用。香精的非限制性实例包括酸橙、柠檬、橙子、水果、香蕉、葡萄、梨、菠萝、芒果、苦杏仁、可乐、肉桂、糖、棉花糖和香草香精。其他食品成分的非限制性实例包括香精、酸化剂、有机酸和氨基酸、着色剂、填充剂、改性淀粉、树胶、质构剂、防腐剂、抗氧化剂、乳化剂、稳定剂、增稠剂和胶凝剂。根据本发明获得的高度纯化的靶糖苷,特别是rebd、rebd2、rebm和/或rebm2,可以制成各种聚合形式,包括但不限于,水解物、溶剂化物、无水、无定形形式和/或其混合物。根据本发明获得的高度纯化的靶甜菊醇糖苷,特别是rebd、rebd2、rebm和/或rebm2,可以作为高强度天然甜味剂掺入食品、饮料、药物组合物、化妆品、口香糖、餐桌上用的产品、谷类、乳制品、牙膏和其他口腔组合物等中。作为增甜化合物的高度纯化的靶甜菊醇糖苷,特别是rebd、rebd2、rebm和/或rebm2,可以作为唯一的甜味剂来使用,或可以与其他天然产生的高强度甜味剂一起使用,如蛇菊苷、reba、rebb、rebc、rebd、rebe、rebf、甜菊醇双苷、杜克苷a、悬钩子苷、罗汉果苷、甜味蛋白、新橙皮苷二氢查耳酮、甘草酸及其盐、索马甜、紫苏糖、pernandulcin、mukurozioside、白元参苷、糙苏苷-i、二甲基-六氢芴-二羧酸、abrusoside、巴西甘草甜素、carnosifloside、甜茶树苷、pterocaryoside、polypodosidea、巴西红木素、hernandulcin、phillodulcin、菝葜苷、根皮苷、三叶苷、二氢黄酮醇、二氢榭皮素-3-醋酸盐、新落新妇苷(neoastilibin)、反式-肉桂醛、莫纳甜及其盐、selligueaina、苏木精、莫内林、水龙骨甜素、pterocaryosidea、pterocaryosideb、马槟榔甜素、pentadin、改味糖蛋白、仙茅甜蛋白、neoculin、绿原酸、西那林、罗汉果甜味剂、罗汉果苷v、赛门苷等等在特定的实施方案中,rebd2和/或rebm2可以与甜味剂组合物一起使用,所述甜味剂组合物包含选自reba、rebb、rebd、nsf-02、罗汉果苷v、赤藓醇及其组合物的化合物。高度纯化的靶甜菊醇糖苷,特别是rebd、rebd2、rebm和/或rebm2,也可以结合合成的高强度甜味剂来使用,所述合成的高强度甜味剂如三氯蔗糖、安赛蜜钾、阿斯巴甜、阿力甜、糖精、橘皮苷二氢查耳酮、环己基氨基磺酸盐、纽甜、甘素、suosanadvantame、其盐等。此外,高度纯化的靶甜菊醇糖苷,特别是rebd、rebd2、rebm和/或rebm2,可以结合天然甜味剂遏制剂来使用,所述天然甜味剂遏制剂如匙羹藤酸、勿甜素、ziziphin、lactisole等等。rebd、rebd2、rebm和/或rebm2也可以结合各种鲜味(umami)增强剂。rebd、rebd2、rebm和/或rebm2可以与鲜味和甜味氨基酸混合,所述氨基酸如谷氨酸盐、天冬氨酸、甘氨酸、丙氨酸、苏氨酸、脯氨酸、丝氨酸、谷氨酸酯、赖氨酸和色氨酸。高度纯化的靶甜菊醇糖苷,特别是rebd、rebd2、rebm,可以结合一种或多种选自碳水化合物、多元醇、氨基酸及其相应的盐、聚氨基酸及其相应的盐、糖酸及其相应的盐、核苷酸、有机酸、无机酸、有机盐(包括有机酸盐和有机碱盐)、无机盐、苦味化合物、风味剂和风味成分、涩味化合物、蛋白质或蛋白质水解产物、表面活性剂、乳化剂、黄酮类化合物、醇、聚合物及其组合物的添加剂来使用。高度纯化的靶甜菊醇糖苷,特别是rebd、rebd2、rebm和/或rebm2,可以结合多元醇或糖醇来使用。术语“多元醇”是指含有超过一个羟基基团的分子。多元醇可以是各自含有2、3和4个羟基基团的二元醇、三元醇或四元醇。多元醇还可以含有超过四个羟基基团,如戊醇、己醇、庚醇等,其各自含有5、6或7个羟基基团。另外,多元醇还可以是碳水化合物还原形式的糖醇、多元醇或多醇,其中羰基基团(醛或酮,还原糖)已经还原成伯或仲羟基基团。多元醇的实例包括,但不限于,赤藓醇、麦芽糖醇、甘露糖醇、山梨糖醇、乳糖醇、木糖醇、肌醇、异麦芽酮糖醇、丙二醇、甘油、苏糖醇、半乳糖醇、氢化异麦芽酮糖、还原的异麦芽糖寡糖、还原的木糖寡糖、还原的龙胆低聚糖、还原的麦芽糖糖浆、还原的葡萄糖糖浆、氢化淀粉水解产物、多羟糖醇和糖醇,或任何其他能够被还原且没有不利地影响甜味剂组合物味道的碳水化合物。高度纯化的靶甜菊醇糖苷,特别是rebd、rebd2、rebm和/或rebm2,可以结合减热甜味剂,如d-塔格糖、l-糖、l-山梨糖、l-阿拉伯糖等等。高度纯化的靶甜菊醇糖苷,特别是rebd、rebd2、rebm和/或rebm2,还可以结合各种碳水化合物。术语“碳水化合物”通常是指通式(ch2o)n(其中n为3-30)的被多个羟基基团取代的醛或酮化合物,及其低聚物和聚合物。本发明的碳水化合物可以另外在一个或多个位置被取代或脱氧。本文中使用的碳水化合物包括未修饰的碳水化合物、碳水化合物衍生物、取代的碳水化合物和修饰的碳水化合物。本文中使用的短语“碳水化合物衍生物”、“取代的碳水化合物”和“修饰的碳水化合物”是同义的。修饰的碳水化合物表示任何碳水化合物,其中至少一个原子已经被添加、去除或取代,或其组合。因此,碳水化合物衍生物或取代的碳水化合物包括取代和未取代的单糖、双糖、低聚糖和多糖。碳水化合物或取代的碳水化合物任选可以是在任何相应的c-位置脱氧的,和/或被一个或多个部分取代,所述部分如氢、卤素、卤代烷基、羧基、酰基、酰基氧、氨基、酰胺、羧基衍生物、烷基氨基、二烷基氨基、芳基氨基、烷氧基、芳氧基、硝基、氰基、磺基、巯基、亚氨基、磺酰基、硫基、亚磺酰基、氨磺酰基、烷氧羰基、甲酰胺、膦酰基、次膦酰基、磷酰基、膦基、硫酯、硫醚、肟基、肼基、氨基甲酰、磷、膦酸基,或任何其他可行的官能团,只要碳水化合物衍生物或取代的碳水化合物起到改善甜味剂组合物的甜味的作用。根据本发明可以使用的碳水化合物的实例包括,但不限于,阿洛酮糖、松二糖、阿罗糖、塔格糖、海藻糖、半乳糖、鼠李糖、各种环糊精、环状低聚糖、各种类型的麦芽糖糊精、葡聚糖、蔗糖、葡萄糖、核酮糖、果糖、苏糖、阿拉伯糖、木糖、来苏糖、阿洛糖、阿卓糖、甘露糖、艾杜糖、乳糖、麦芽糖、转化糖、异海藻糖、新海藻糖、异麦芽酮糖、赤藓糖、脱氧核糖、古洛糖、艾杜糖、塔罗糖、赤藓酮糖、木酮糖、阿洛酮糖、松二糖、纤维二糖、支链淀粉、葡糖胺、甘露糖胺、岩藻糖、葡糖醛酸、葡糖酸、葡糖酸-内酯、阿比可糖、半乳糖胺、甜菜低聚糖、异麦芽低聚糖(异麦芽糖、异麦芽三糖、潘糖等)、低聚木糖(木三糖、木二糖等)、木糖封端的低聚糖(xylo-terminatedoligosaccharides)、龙胆低聚糖(龙胆二糖、龙胆三糖、龙胆四糖等)、山梨糖、黑曲霉低聚糖、帕拉金糖低聚糖、果糖低聚糖(蔗果三糖、真菌四糖等)、麦芽四糖醇、麦芽三糖醇、麦芽低聚糖(麦芽三糖、麦芽四糖、麦芽戊糖、麦芽己糖、麦芽庚糖等)、淀粉、菊粉、菊粉-低聚糖(inulo-oligosaccharide)、乳果糖、蜜二糖、蜜三糖、核糖、异构化液体糖(如高果糖玉米糖浆)、偶联糖和大豆低聚糖。另外,本文中使用的碳水化合物可以是d-或l-构型。根据本发明获得的高度纯化的靶甜菊醇糖苷,特别是rebd、rebd2、rebm和/或rebm2,可以结合各种生理活性物质或功能性成分来使用。功能性成分通常归成如类胡萝卜素、膳食纤维、脂肪酸、皂苷、抗氧化剂、营养保健品、黄酮类化合物、异硫氰酸酯、苯酚、植物甾醇(plantsterol)和甾烷醇(stanol)(植物甾醇(phytosterol)和植物甾烷醇(phytostanol));多元醇;益生元;益生菌;植物雌激素;大豆蛋白;硫化物/硫醇;氨基酸;蛋白质;维生素和矿物质这样的类别。功能性成分还可以基于其健康益处来归类,如心血管、胆固醇-降低和抗炎。示例性功能性成分提供于wo2013/096420中,将其内容由此按引用并入。根据本发明获得的高度纯化的靶甜菊醇糖苷,特别是rebd、rebd2、rebm和/或rebm2,可以用作高强度甜味剂,以产生具有改善的味道特征的零热量、减热或糖尿病饮料和食品。其还可以用于其中不能使用糖的饮料、食品、药品和其他产品中。此外,高度纯化的靶甜菊醇糖苷,特别是rebd、rebd2、rebm和/或rebm2,不仅可以用作用于专用于人食用的饮料、食品和其他产品的甜味剂,也可以用于具有改善的特征的动物饲料和草料中。其中高度纯化的靶甜菊醇糖苷(特别是rebd、rebd2、rebm和/或rebm2)可以用作增甜化合物的消费品的实例包括,但不限于,含醇饮料,如伏特加、葡萄酒、啤酒、利口酒和清酒等;天然汁液;清凉饮料;碳酸软饮料;低热饮料;零热量饮料;减热饮料和食品;酸奶饮品;速溶汁液;速溶咖啡;粉末类型的速溶饮料;罐头产品;糖浆;发酵的大豆酱;酱油;醋;沙拉酱;蛋黄酱;番茄酱;咖喱;汤;速溶肉汤;粉末状酱油;粉末状醋;各种类型的饼干;米饼;克力架;面包;巧克力;焦糖;糖果;口香糖;果冻;布丁;果脯和腌制蔬菜;鲜奶油;果酱;桔子酱;花酱;奶粉;冰淇淋;果汁冰糕;包装在瓶中的蔬菜和水果;罐装和煮沸的豆;在甜味酱汁中煮沸的肉和食品;农业蔬菜食品;海产品;火腿;香肠;鱼火腿;鱼香肠;鱼酱;油炸鱼产品;干燥的海产品;冷冻食品;腌制的海藻;腌制的肉;番茄;药品;等等。原则上,其可以具有无限的应用。在如食品、饮料、药品、化妆品、餐桌上用的产品和口香糖这些产品的制造过程中,可以使用常规方法,如混合、捏合、溶解、酸浸、渗透、渗滤、喷洒、雾化、灌输和其他方法。此外,根据本发明获得的高度纯化的靶甜菊醇糖苷,特别是rebd、rebd2、rebm和/或rebm2,可以以干的形式或液体形式来使用。在一个实施方案中,提供了包含rebd2的餐桌上用的甜味剂。在另一个实施方案中,提供了包含rebm2的餐桌上用的甜味剂。可以在食品热处理之前或之后,加入高度纯化的靶甜菊醇糖苷。高度纯化的靶甜菊醇糖苷(特别是rebd、rebd2、rebm和/或rebm2)的含量取决于使用目的。如以上讨论的,可以单独加入或结合其他化合物。本发明还涉及使用rebd2增强饮料甜度。本发明还涉及包含rebm2增强饮料甜度。因此,本发明提供了包含甜味剂和作为甜味增强剂的rebd2和/或rebm2的饮料,其中rebd2和/或rebm2以等于或低于其各自的甜度感知阈值的浓度存在。如本文中使用的,术语“甜味增强剂”是指能够增强或加强组合物(如饮料)中的甜味感知的化合物。术语“甜味增强剂”与术语“甜味增效剂”、“甜度增效剂”、“甜度增大剂”和“甜度强化剂”同义。如本文中概括使用的术语“甜味识别阈值浓度”是人味觉可感知的甜味化合物的最低已知浓度,通常为约1.0%蔗糖当量(1.0%se)。通常,当以等于或低于给定的甜味增强剂的甜味识别阈值浓度存在时,甜味增强剂可以增强或加强甜味剂的甜味,而自身没有提供任何可感知的甜味;然而,甜味增强剂自身在高于其甜味识别阈值浓度的浓度下可以提供甜味。甜味识别阈值浓度对于特定的增强剂是特异性的,并且可以基于饮料基质而改变。可以通过品尝测试递增浓度的给定增强剂直至检测到给定饮料基质中高于1.0%蔗糖当量,来容易地测定甜味识别阈值浓度。提供约1.0%蔗糖当量的浓度被认为是甜味识别阈值。在一些实施方案中,甜味剂以约0.5%至约12%重量,如,例如,约1.0%重量、约1.5%重量、约2.0%重量、约2.5%重量、约3.0%重量、约3.5%重量、约4.0%重量、约4.5%重量、约5.0%重量、约5.5%重量、约6.0%重量、约6.5%重量、约7.0%重量、约7.5%重量、约8.0%重量、约8.5%重量、约9.0%重量、约9.5%重量、约10.0%重量、约10.5%重量、约11.0%重量、约11.5%重量或约12.0%重量的量存在于饮料中。在特定实施方案中,甜味剂以约0.5%至约10%,如,例如,约2%至约8%、约3%至约7%或约4%至约6%重量的量存在于饮料中。在特定实施方案中,甜味剂以约0.5%至约8%重量的量存在于饮料中。在另一个特定的实施方案中,甜味剂以约2%至约8%重量的量存在于饮料中。在一个实施方案中,甜味剂是传统的热量甜味剂。合适的甜味剂包括,但不限于,蔗糖、果糖、葡萄糖、高果糖玉米糖浆和高果糖淀粉糖浆。在另一个实施方案中,甜味剂是赤藓醇。在再另一个实施方案中,甜味剂是稀有糖。合适的稀有糖包括,但不限于,d-阿洛糖、d-阿洛酮糖、l-核糖、d-塔格糖、l-葡萄糖、l-果糖、l-阿拉伯糖、d-松二糖、d-明串珠菌二糖及其组合。考虑了甜味剂可以单独使用,或结合其他甜味剂使用。在一个实施方案中,稀有糖是d-阿洛糖。在更特别的实施方案中,d-阿洛糖以约0.5%至约10%重量,如,例如,约2%至约8%的量存在于饮料中。在另一个实施方案中,稀有糖是d-阿洛酮糖。在更特别的实施方案中,d-阿洛酮糖以约0.5%至约10%重量,如,例如,约2%至约8%的量存在于饮料中。在再另一个实施方案中,稀有糖是d-核糖。在更特别的实施方案中,d-核糖以约0.5%至约10%重量,如,例如,约2%至约8%的量存在于饮料中。在再另一个实施方案中,稀有糖是d-塔格糖。在更特别的实施方案中,d-塔格糖以约0.5%至约10%重量,如,例如,约2%至约8%的量存在于饮料中。在进一步的实施方案中,稀有糖是l-葡萄糖。在更特别的实施方案中,l-葡萄糖以约0.5%至约10%重量,如,例如,约2%至约8%的量存在于饮料中。在一个实施方案中,稀有糖是l-果糖。在更特别的实施方案中,l-果糖以约0.5%至约10%重量,如,例如,约2%至约8%的量存在于饮料中。在另一个实施方案中,稀有糖是l-阿拉伯糖。在更特别的实施方案中,l-阿拉伯糖以约0.5%至约10%重量,如,例如,约2%至约8%的量存在于饮料中。在再另一个实施方案中,稀有糖是d-松二糖。在更特别的实施方案中,d-松二糖以约0.5%至约10%重量,如,例如,约2%至约8%的量存在于饮料中。在再另一个实施方案中,稀有糖是d-明串珠菌二糖。在更特别的实施方案中,d-明串珠菌二糖以约0.5%至约10%重量,如,例如,约2%至约8%的量存在于饮料中。与不存在甜味增强剂的相应饮料相比时,以等于或低于其甜味识别阈值的浓度添加甜味增强剂提高了包含甜味剂和甜味增强剂的饮料检测到的蔗糖当量。此外,在不存在任何甜味剂的情况中,可以通过超过含有相同浓度的至少一种甜味增强剂的溶液的可检测甜度的量来提高甜度。因此,本发明还提供了一种用于增强包含甜味剂的饮料的甜度方法,包括提供包含甜味剂的饮料并添加选自rebd2、rebm2或其组合的甜味增强剂,其中rebd2和rebm2以等于或低于其甜味识别阈值的浓度存在。将等于或低于甜味识别阈值浓度的rebd2和/或rebm2加入含有甜味剂的饮料中,可以将检测到的蔗糖当量从1.0%提高至约5.0%,如,例如,约1.0%、约1.5%、约2.0%、约2.5%、约3.0%、约3.5%、约4.0%、约4.5%或约5.0%。以下实施例说明了本发明针对制备高度纯化的靶甜菊醇糖苷(特别,rebd、rebd2、rebm和/或rebm2)的优选实施方案。应当理解本发明不限于实施例中所列的材料、比例、条件和程序,其只是说明性的。实施例1ugt76g1的体内产生将ncoi和ndei限制位点添加至genbank登录号no.aar06912.1中所述的初始核酸序列中。密码子优化后,获得了以下的核酸序列:ccatggcccatatggaaaacaaaaccgaaaccaccgttcgtcgtcgtcgccgtattattctgtttccggttccgtttcagggtcatattaatccgattctgcagctggcaaatgtgctgtatagcaaaggttttagcattaccatttttcataccaattttaacaaaccgaaaaccagcaattatccgcattttacctttcgctttattctggataatgatccgcaggatgaacgcattagcaatctgccgacacatggtccgctggcaggtatgcgtattccgattattaacgaacatggtgcagatgaactgcgtcgtgaactggaactgctgatgctggcaagcgaagaagatgaagaagttagctgtctgattaccgatgcactgtggtattttgcacagagcgttgcagatagcctgaatctgcgtcgtctggttctgatgaccagcagcctgtttaactttcatgcacatgttagcctgccgcagtttgatgaactgggttatctggatccggatgataaaacccgtctggaagaacaggcaagcggttttccgatgctgaaagtgaaagatatcaaaagcgcctatagcaattggcagattctgaaagaaattctgggcaaaatgattaaacagaccaaagcaagcagcggtgttatttggaatagctttaaagaactggaagaaagcgaactggaaaccgtgattcgtgaaattccggcaccgagctttctgattccgctgccgaaacatctgaccgcaagcagcagcagcctgctggatcatgatcgtaccgtttttcagtggctggatcagcagcctccgagcagcgttctgtatgttagctttggtagcaccagcgaagttgatgaaaaagattttctggaaattgcccgtggtctggttgatagcaaacagagctttctgtgggttgttcgtccgggttttgttaaaggtagcacctgggttgaaccgctgccggatggttttctgggtgaacgtggtcgtattgttaaatgggttccgcagcaagaagttctggcacacggcgcaattggtgcattttggacccatagcggttggaatagcaccctggaaagcgtttgtgaaggtgttccgatgatttttagcgattttggtctggatcagccgctgaatgcacgttatatgagtgatgttctgaaagtgggtgtgtatctggaaaatggttgggaacgtggtgaaattgcaaatgcaattcgtcgtgttatggtggatgaagaaggtgaatatattcgtcagaatgcccgtgttctgaaacagaaagcagatgttagcctgatgaaaggtggtagcagctatgaaagcctggaaagtctggttagctatattagcagcctgtaataactcgag使用ndei和xhoi克隆位点合成基因并亚克隆至pet30a+载体中后,通过电穿孔将ugt76g1_pet30a+质粒引入大肠杆菌b121(de3)和大肠杆菌ec100中。将获得的细胞生长于存在卡那霉素的皮氏培养皿中并且选择合适的克隆,使其在液体lb培养基中生长(锥形烧瓶)。将作为冷冻保护剂的甘油加入悬浮液中,并且将400μl等份试样储存在-20℃和-80℃。将含有pet30a+_ugt76g1质粒的大肠杆菌bl21(de3)的储存等份试样融化并且加入30ml的lbgkp培养基(20g/lluria肉汤lennox;50mmpipes缓冲液ph7.00;50mm磷酸盐缓冲液ph7.00;2.5g/l葡萄糖和50mg/l卡那霉素)中。使这个培养物在135rpm和30℃下振荡8小时。生产培养基含有60g/l过夜表达已配制好的tb培养基(novagen)、10g/l甘油和50mg/l卡那霉素。使培养基在20℃下搅拌,同时取样测量od和ph。培养物获得显著生长并且获得了良好的od。40小时后,通过离心收集细胞并冷冻,产生12.7g细胞湿重。通过添加bugbustermaster混合物(novagen)进行裂解并且通过离心收集裂解产物并保持冷冻。使用融化的裂解产物进行活性测试。实施例2ugt76g1的体外生产使用来自promega的s30t7高产量表达系统试剂盒。将4μg来自大肠杆菌ec100的ugt76g1_pet30a+质粒与80μls30premixplus混合并加入72μls30t7提取物。加入无核酸酶水,以获得200μl的总体积,并且将所得到的溶液在30℃下孵育2小时。将180μl用于催化测试反应中。实施例3ugt91d2的体外生产将ncoi和ndei限制侧添加至如genbank登录号ace87855.1中所述的初始核酸序列。密码子优化后,获得以下核酸序列:ccatggcacatatggcaaccagcgatagcattgttgatgatcgtaaacagctgcatgttgcaacctttccgtggctggcatttggtcatattctgccgtatctgcagctgagcaaactgattgcagaaaaaggtcataaagtgagctttctgagcaccacccgtaatattcagcgtctgagcagccatattagtccgctgattaatgttgttcagctgaccctgcctcgtgttcaagaactgccggaagatgccgaagcaaccaccgatgttcatccggaagatattccgtatctgaaaaaagcaagtgatggtctgcagccggaagttacccgttttctggaacagcatagtccggattggatcatctatgattatacccattattggctgccgagcattgcagcaagcctgggtattagccgtgcacattttagcgttaccaccccgtgggcaattgcatatatgggtccgagcgcagatgcaatgattaatggtagtgatggtcgtaccaccgttgaagatctgaccacccctccgaaatggtttccgtttccgaccaaagtttgttggcgtaaacatgatctggcacgtctggttccgtataaagcaccgggtattagtgatggttatcgtatgggtctggttctgaaaggtagcgattgtctgctgagcaaatgctatcatgaatttggcacccagtggctgccgctgctggaaaccctgcatcaggttccggttgttccggtgggtctgctgcctccggaagttccgggtgatgaaaaagatgaaacctgggttagcatcaaaaaatggctggatggtaaacagaaaggtagcgtggtttatgttgcactgggtagcgaagttctggttagccagaccgaagttgttgaactggcactgggtctggaactgagcggtctgccgtttgtttgggcatatcgtaaaccgaaaggtccggcaaaaagcgatagcgttgaactgccggatggttttgttgaacgtacccgtgatcgtggtctggtttggaccagctgggcacctcagctgcgtattctgagccatgaaagcgtttgtggttttctgacccattgtggtagcggtagcattgtggaaggtctgatgtttggtcatccgctgattatgctgccgatttttggtgatcagccgctgaatgcacgtctgctggaagataaacaggttggtattgaaattccgcgtaatgaagaagatggttgcctgaccaaagaaagcgttgcacgtagcctgcgtagcgttgttgttgaaaaagaaggcgaaatctataaagccaatgcacgtgaactgagcaaaatctataatgataccaaagtggaaaaagaatatgtgagccagttcgtggattatctggaaaaaaacacccgtgcagttgccattgatcacgaaagctaatgactcgag使用ncoi和xhoi克隆位点合成基因并亚克隆至pet30a+后,通过电穿孔,将ugt91d2_pet30a+引入大肠杆菌ec100中。在卡那霉素存在下,使获得的细胞生长并且选择合适的克隆,使其在液体lb培养基中生长(锥形烧瓶)。将作为冷冻保护剂的甘油加入悬浮液中,并且将400μl等份试样储存在-20℃和-80℃。将来自promega的s30t7高产量蛋白表达系统试剂盒用于蛋白质的体外合成。将4μgugt91d2-pet30a+质粒与80μls30premixplus混合并加入72μls30t7提取物。加入无核酸酶水,以获得200μl的总体积,并且将所得到的溶液在30℃下孵育2小时。将5μl用于sds-page分析,同时将剩余的45μl用于催化测试反应中。实施例4使用体内产生的ugt76g1的催化反应反应的总体积为5.0ml,具有以下组成:50mm磷酸钠缓冲液ph7.2,3mmmgcl2,2.5mmudp-葡萄糖,0.5mm蛇菊苷和500μlugt76g1融化的裂解产物。在135rpm的轨道振荡器上在30℃下运行反应。对于每个样品,用40μl2nh2so4和420μl甲醇/水(6/4)骤冷460μl反应混合物。立即将样品离心并且在通过hplc(cad)分析前保持在10℃。hplc表明蛇菊苷几乎完全转化成莱鲍迪苷a,如图51中所示的。实施例5使用体外产生的ugt91d2的催化反应反应的总体积为0.5ml,具有以下组成:50mm磷酸钠缓冲液ph7.2,3mmmgcl2,3.8mmudp-葡萄糖,0.1mm莱鲍迪苷a和180μl体外产生的ugt91d2。在135rpm的轨道振荡器上在30℃下运行反应。对于每个样品,用45μl2nh2so4和405μl60%meoh骤冷450μl反应混合物。离心后,通过hplc(cad)分析上清液。hplc表明了在120小时后,4.7%的莱鲍迪苷a转化成莱鲍迪苷d。实施例6使用体外产生的ugt76g1的催化反应反应的总体积为2ml,具有以下组成:50mm磷酸钠缓冲液ph7.2,3mmmgcl2,3.8mmudp-葡萄糖,0.5mm莱鲍迪苷d和180μl体外产生的ugt76g1。在135rpm的轨道振荡器上在30℃下运行反应。对于每个样品,用40μl2nh2so4和360μl60%meoh骤冷400μl反应混合物。离心后,通过hplc(cad)分析上清液。hplc表明了在120小时后,80%的莱鲍迪苷d转化成莱鲍迪苷m,如图52中所示的。对于实施例7至12,使用了以下缩写:lbgkp培养基:20g/lluria肉汤lennox;50mmpipes缓冲液ph7.00;50mm磷酸盐缓冲液ph7.00;2.5g/l葡萄糖和50mg/l卡那霉素或氨苄青霉素lb培养基:(20g/lluria肉汤lennox)实施例7通过pet30a+质粒和bl21(de3)表达菌株制备的ugt76g1的制备和活性将pet30a+_ugt76g1质粒转化至bl21(de3)表达菌株(lucigene.express电感受态细胞)中。在卡那霉素的存在下,将获得的细胞生长于皮氏培养皿中的lb琼脂上。选择合适的克隆并使其在含有卡那霉素的液体lbgkp培养基中生长。加入甘油并将400μl等份试样储存在-20℃和-80℃下。将储存等份试样融化并且加入30ml的lbgkp培养基中。使这个培养物在30℃下振荡8小时,并随后用于接种400ml含有60g/l“过夜表达已配制好的tb培养基”(novagen,参照71491-5)、10g/l甘油和50mg/l卡那霉素的生产培养基。使培养基在20℃下搅拌,同时取样测量od(600nm)和ph。40小时后,通过离心收集细胞并冷冻。获得的细胞湿重为10.58g。通过添加8.1ml“bugbustermaster混合物”(novagen,参照71456)和3.5ml水来裂解3.24g获得的沉淀。通过离心收集裂解产物并保持冷冻。实施例8通过pet30a+质粒和tuner(de3)表达菌株制备的ugt76g1的制备和活性通过热休克处理,将pet30a+_ugt76g1质粒转化至tuner(de3)表达菌株(novagentunertm(de3)感受态细胞)中。在卡那霉素的存在下,将获得的细胞生长于皮氏培养皿中的lb琼脂上。选择合适的克隆并使其在含有卡那霉素的液体lbgkp培养基中生长。加入甘油并将400μl等份试样储存在-20℃和-80℃下。将储存等份试样融化并且加入100ml含有50mg/l卡那霉素的lb培养基中。使这个培养物在30℃下振荡15小时。将4.4ml这种培养物用于接种200ml含有lb的生产培养基。使该培养基在37℃下搅拌,直至获得0.9的od(600nm),此后,加入400μl100mmiptg溶液,并且使培养基在30℃下搅拌4小时。通过离心收集细胞并冷冻。获得的细胞湿重为1.38g。通过添加4.9ml“bugbustermaster混合物”(novagen,参照71456)和2.1ml水来裂解获得的沉淀。通过离心收集裂解产物并保持冷冻。实施例9通过pmal质粒和bl21表达菌株制备的ugt76g1的制备和活性使用nde1和sal1克隆位点,将合成的ugt76g1基因亚克隆至pmal质粒后,通过热休克处理,将pmal_ugt76g1质粒转化至bl21表达菌株(newenglandbiolabsbl21感受态大肠杆菌)中。在氨苄青霉素的存在下,将获得的细胞生长于皮氏培养皿中的lb琼脂上。选择合适的克隆并使其在含有氨苄青霉素的液体lbgkp培养基中生长。加入甘油并将400μl等份试样储存在-20℃和-80℃下。将储存等份试样融化并且加入30ml的lbgkp培养基中。使这个培养物在30℃下振荡8小时,并随后用于接种400ml含有60g/l“过夜表达已配制好的tb培养基”(novagen,参照71491-5)、10g/l甘油和50mg/l氨苄青霉素的生产培养基。使培养基在20℃下搅拌,同时取样测量od和ph。40小时后,通过离心收集细胞并冷冻。获得的细胞湿重为5.86g。通过添加9.6ml“bugbustermaster混合物”(novagen,参照71456)和4.1ml水来裂解2.74g获得的沉淀。通过离心收集裂解产物并保持冷冻。实施例10通过pmal质粒和arcticexpress表达菌株制备的ugt76g1的制备和活性通过热休克处理,将pmal_ugt76g1质粒转化至articexpress表达菌株(agilentarcticexpress感受态细胞)中。在氨苄青霉素和遗传霉素的存在下,将获得的细胞生长于皮氏培养皿中的lb琼脂上。选择合适的克隆并使其在含有氨苄青霉素和遗传霉素的液体lbgkp培养基中生长。加入甘油并将400μl等份试样储存在-20℃和-80℃下。将储存等份试样融化并且加入30ml的lbgkp培养基(含有氨苄青霉素和遗传霉素)中。使这个培养物在30℃下振荡8小时,并随后用于接种400ml含有60g/l“过夜表达已配制好的tb培养基”(novagen,参照71491-5)、10g/l甘油和50mg/l氨苄青霉素的生产培养基。使培养基在12℃下搅拌,同时取样测量od(600nm)和ph。68小时后,通过离心收集细胞并冷冻。获得的细胞湿重为8.96g。通过添加8.73ml“bugbustermaster混合物”(novagen,参照71456)和3.79ml水来裂解2.47g获得的沉淀。通过离心收集裂解产物并保持冷冻。实施例11通过pcoldiii质粒和arcticexpress表达菌株制备的ugt76g1的制备和活性使用nde1和xho1克隆位点,将合成的ugt76g1基因亚克隆至pcoldiii质粒后,通过热休克处理,将pcoldiii_ugt76g1质粒转化至arcticexpress表达菌株(agilentarcticexpress感受态细胞)中。在氨苄青霉素和遗传霉素的存在下,将获得的细胞生长于皮氏培养皿中的lb琼脂上。选择合适的克隆并使其在含有氨苄青霉素和遗传霉素的液体lbgkp培养基中生长。加入甘油并将400μl等份试样储存在-20℃和-80℃下。将储存等份试样融化并且加入30ml的lbgkp培养基(含有氨苄青霉素和遗传霉素)中。使这个培养物在30℃下振荡8小时,并随后用于接种400ml含有60g/l“过夜表达已配制好的tb培养基”(novagen,参照71491-5)、10g/l甘油和50mg/l卡那霉素的生产培养基。使培养基在12℃下搅拌,同时取样测量od(600nm)和ph。63小时后,通过离心收集细胞并冷冻。获得的细胞湿重为6.54g。通过添加9.8ml“bugbustermaster混合物”(novagen,参照71456)和4.2ml水来裂解2.81g获得的沉淀。通过离心收集裂解产物并保持冷冻。实施例12通过pcoldiii质粒和origami2(de3)表达菌株制备的ugt76g1的制备和活性通过热休克处理,将pcoldiii_ugt76g1质粒转化至origami2(de3)表达菌株(novagenorigamitm2(de3)感受态细胞)中。在氨苄青霉素的存在下,将获得的细胞生长于皮氏培养皿中的lb琼脂上。选择合适的克隆并使其在含有氨苄青霉素的液体lbgkp培养基中生长。加入甘油并将400μl等份试样储存在-20℃和-80℃下。将储存等份试样融化并且加入30ml的lbgkp培养基(含有氨苄青霉素)中。使这个培养物在30℃下振荡8h,并随后用于接种400ml含有60g/l“过夜表达已配制好的tb培养基”(novagen,参照71491-5)、10g/l甘油和50mg/l卡那霉素的生产培养基。使培养基在12℃下搅拌,同时取样测量od(600nm)和ph。68小时后,通过离心收集细胞并冷冻。获得的细胞湿重为2.53g。通过添加6.0ml“bugbustermaster混合物”(novagen,参照71456)和1.9ml水来裂解1.71g获得的沉淀。通过离心收集裂解产物并保持冷冻。实施例13活性的测定使用50mmph7.2的磷酸钠缓冲液中的0.5mm底物、2.5mmudp-葡萄糖和3mmmgcl2,使用500μl融化的裂解产物,用于将蛇菊苷转化成莱鲍迪苷a以及将莱鲍迪苷d转化成莱鲍迪苷m,以5ml规模进行了活性测试。取样并通过hplc分析。针对不同ugt76g1制备物的结果概括于下表中。*注释按照每ml裂解产物来提及蛇菊苷和莱鲍迪苷m的转化活性。在30℃和ph7.2下,在1小时中,1u将转化1μmol底物。实施例14用于莱鲍迪苷d转化成莱鲍迪苷m的50ml规模反应将5ml实施例12的裂解产物用于50ml规模的莱鲍迪苷d转化成莱鲍迪苷m。反应介质由50mm磷酸钠缓冲液ph7.2、3mmmgcl2、2.5mmudp-葡萄糖和0.5mm莱鲍迪苷d组成。使反应在30℃下振荡90小时后,加入50ml乙醇,并将所得到的混合物在-20℃下振荡1小时。在5000g下离心10分钟后,通过超滤(vivaflowmwco30000)纯化上清液。获得78ml透过液,并用9ml乙醇稀释9ml截留物,并再次接受超滤(vivaflowmwco30000)。获得另外的14ml滤液,将其与第一个透过液合并。将合并的透过液在30℃下减压浓缩,直至获得32ml澄清溶液。产品混合物的hplc痕迹显示于图5中。在配备了双泵、自动取样机和恒温柱室的agilent1200系列上进行hplc。所述方法是等度的,使用由70%水(0.1%甲酸):30%乙腈的移动相。流速为0.1μl/分钟。使用的柱为phenomenexprodigy5μods(3)100a;250×2mm。柱温维持在40℃。注入体积为20-40μl。实施例15使用pmal质粒和bl21表达菌株的ugt91d2的制备使用nde1和sal1克隆位点,将合成的ugt91d2基因亚克隆至pmal质粒后,通过热休克处理,将pmal_ugt91d2质粒转化至bl21表达菌株(newenglandbiolabsbl21感受态大肠杆菌)中。在氨苄青霉素的存在下,将获得的细胞生长于皮氏培养皿中的lb琼脂上。选择合适的克隆并使其在含有氨苄青霉素的液体lbgkp培养基中生长。加入甘油并将400μl等份试样储存在-20℃和-80℃下。将储存等份试样融化并且加入30ml的lbgkp培养基中。使这个培养物在30℃下振荡8小时,并随后用于接种400ml含有60g/l“过夜表达已配制好的tb培养基”(novagen,参照71491-5)、10g/l甘油和50mg/l氨苄青霉素的生产培养基。使培养基在20℃下搅拌,同时取样测量od和ph。40小时后,通过离心收集细胞并冷冻。获得的细胞湿重为12.32g。通过添加7.7ml“bugbustermaster混合物”(novagen,参照71456)和3.2ml水来裂解2.18g获得的沉淀。通过离心收集裂解产物并直接用于活性测试。实施例16使用pmal质粒和arcticexpress表达菌株的ugt91d2的制备通过热休克处理,将pmal_ugt91d2质粒转化至arcticexpress表达菌株(agilentarcticexpress感受态细胞)中。在氨苄青霉素和遗传霉素的存在下,将获得的细胞生长于皮氏培养皿中的lb琼脂上。选择合适的克隆并使其在含有氨苄青霉素和遗传霉素的液体lbgkp培养基中生长。加入甘油并将400μl等份试样储存在-20℃和-80℃下。将储存等份试样融化并且加入30ml的lbgkp培养基(含有氨苄青霉素和遗传霉素)中。使这个培养物在30℃下振荡8小时,并随后用于接种400ml含有60g/l“过夜表达已配制好的tb培养基”(novagen,参照71491-5)、10g/l甘油和50mg/l氨苄青霉素的生产培养基。使培养基在20℃下搅拌16小时,接着在12℃下再搅拌50小时,同时取样测量od(600nm)和ph。通过离心收集细胞并冷冻。获得的细胞湿重为15.77g。通过添加9.0ml“bugbustermaster混合物”(novagen,参照71456)和3.8ml水来裂解2.57g获得的沉淀。通过离心收集裂解产物并直接用于活性测试。实施例17使用pet30a+质粒和tuner(de3)表达菌株的ugt91d2的制备通过热休克处理,将pet30a+_ugt91d2质粒转化至tuner(de3)表达菌株(novagentunertm(de3)感受态细胞)中。在卡那霉素素的存在下,将获得的细胞生长于皮氏培养皿中的lb琼脂上。选择合适的克隆并使其在含有卡那霉素的液体lbgkp培养基中生长。加入甘油并将400μl等份试样储存在-20℃和-80℃下。将储存等份试样融化并且加入100ml含有50mg/l卡那霉素的lb培养基中。使这个培养物在30℃下振荡15小时。将6.2ml这种培养物用于接种500ml含有lb的生产培养基。使该培养基在37℃下搅拌,直至获得0.9的od(600nm),此后,加入500μl100mmiptg溶液(培养基中的iptg浓度为100μm),并且使培养基在30℃下搅拌4小时。通过离心收集细胞并冷冻。获得的细胞湿重为4.02g。通过添加6.8ml“bugbustermaster混合物”(novagen,参照71456)和2.8ml水来裂解1.92g获得的沉淀。通过离心收集裂解产物并直接用于活性测试。实施例18使用pet30a+质粒和arcticexpress表达菌株的ugt91d2的制备通过热休克处理,将pet30a+_ugt91d2质粒转化至arcticexpress(de3)表达菌株(agilentarcticexpress感受态细胞)中。在氨苄青霉素和遗传霉素的存在下,将获得的细胞生长于皮氏培养皿中的lb琼脂上。选择合适的克隆并使其在含有氨苄青霉素和遗传霉素的液体lbgkp培养基中生长。加入甘油并将400μl等份试样储存在-20℃和-80℃下。将储存等份试样融化并且加入30ml的lbgkp培养基(含有氨苄青霉素和遗传霉素)中。使这个培养物在30℃下振荡8小时,并随后用于接种400ml含有60g/l“过夜表达已配制好的tb培养基”(novagen,参照71491-5)、10g/l甘油和50mg/l氨苄青霉素的生产培养基。使培养基在20℃下搅拌16小时,接着在12℃下再搅拌50小时,同时取样测量od(600nm)和ph。60小时后,通过离心收集细胞并冷冻。获得的细胞湿重为16.07g。通过添加11.4ml“bugbustermaster混合物”(novagen,参照71456)和4.8ml水来裂解3.24g获得的沉淀。通过离心收集裂解产物并直接用于活性测试。实施例19ugt91d2体内制备物的活性测定使用50mm磷酸钠缓冲液ph7.2中的0.5mm底物、2.5mmudp-葡萄糖和3mmmgcl2,使用1000μl裂解产物用于悬钩子苷转化成蛇菊苷,以5ml规模进行活性测试。取样并通过hplc分析。针对不同ugt91d2制备物的结果概括于下表中。*注释:按照每ml裂解产物来提及活性。在30℃和ph7.2下,在1小时中,1u将转化1μmol底物。实施例20用于莱鲍迪苷a至莱鲍迪苷d转化的其他酶从公众数据库鉴定了以下的udp-葡糖基转移酶基因,通过dna2.0合成并随后在pet30a+载体中亚克隆。微量滴定平板位置基因名称内部参照reba转化成rebdc908201a1gi115454819_np_001051010.1s115n01a1有活性c908201g2gi187373030_acd03249.1s115n01g2有活性c908201a7gi460409128_xp_004249992.1s115n05a7有活性c912666e1gi222619587_eee55719.1s115n06e1有活性c912666c2gi297795735_xp_002865752.1s115n06c2有活性氨基酸序列如下:>gi|115454819|ref|np_001051010.1|os03g0702500[粳稻日本晴(oryzasativajaponicagroup)]mddahssqsplhvvifpwlafghllpcldlaerlaarghrvsfvstprnlarlppvrpelaelvdlvalplprvdglpdgaeatsdvpfdkfelhrkafdglaapfsafldtacaggkrpdwvladlmhhwvalasqergvpcamilpcsaavvassapptessadqreaivrsmgtaapsfeakrateefategasgvsimtrysltlqrsklvamrscpelepgaftiltrfygkpvvpfgllpprpdgargvskngkhdaimqwldaqpaksvvyvalgseapmsadllrelahgldlagtrflwamrkpagvdadsvlpagflgrtgerglvttrwapqvsilahaavcaflthcgwgsvveglqfghplimlpilgdqgpnarilegrklgvavprndedgsfdrggvagavravvveeegktffanarklqeivadrereercidefvqhltswnelknnsdgqyp>gi|187373030|gb|acd03249.1|udp-葡糖基转移酶[糙伏毛燕麦(avenastrigosa)]mavkdeqqsplhillfpflapghlipiadmaalfasrgvrctilttpvnaaiirsavdrandafrgsdcpaidisvvpfpdvglppgvengnaltspadrlkffqavaelrepfdrfladnhpdavvsdsffhwstdaaaehgvprlgflgssmfagscnestlhnnpletaaddpdalvslpglphrvelrrsqmmdpkkrpdhwallesvnaadqksfgevfnsfhelepdyvehyqttlgrrtwlvgpvalaskdmagrgstsarspdadsclrwldtkqpgsvvyvsfgtlirfspaelhelargldlsgknfvwvlgragpdssewmpqgfadlitprgdrgfiirgwapqmlilnhralggfvthcgwnstlesvsagvpmvtwprfadqfqneklivevlkvgvsigakdygsgienhdvirgeviaesigklmgsseesdaiqrkakdlgaearsavenggssyndvgrlmdelmarrssvkvgediiptndgl>gi|460409128|ref|xp_004249992.1|predicted:花青素-3-o-糖苷2-o-糖苷葡糖醛酸基转移酶样[番茄(solanumlycopersicum)]mspklhkelffhslykktrsnhtmatlkvlmfpflayghispylnvakkladrgfliyfcstpinlkstiekipekyadsihlielhlpelpqlpphyhttnglppnlnqvlqkalkmskpnfskilqnlkpdlviydilqrwakhvaneqnipavklltsgaavfsyffnvlkkpgvefpfpgiylrkieqvrlsemmsksdkekeledddddddllvdgnmqimlmstsrtieakyidfctaltnwkvvpvgppvqdlitndvddmelidwlgtkdenstvfvsfgseyflskedmeevafalelsnvnfiwvarfpkgeernledalpkgflerigergrvldkfapqprilnhpstggfishcgwnsamesidfgvpiiampmhldqpmnarlivelgvaveivrdddgkihrgeiaetlkgvitgktgeklrakvrdisknlktirdeemdaaaeeliqlcrngn>gi|222619587|gb|eee55719.1|假定蛋白osj_04191[粳稻日本晴(oryzasativajaponicagroup)]mhvvmlpwlafghilpfaefakrvarqghrvtlfstprntrrlidvppslagrirvvdiplprvehlpehaeatidlpsndlrpylrraydeafsrelsrllqetgpsrpdwvladyaaywapaaasrhgvpcaflslfgaaalcffgpaetlqgrgpyaktepahltavpeyvpfpttvafrgnearelfkpslipdesgvsesyrfsqsiegcqlvavrsnqefepewlellgelyqkpvipigmfpppppqdvagheetlrwldrqepnsvvyaafgsevkltaeqlqrialgleaselpfiwafrappdagdgdglpggfkervngrgvvcrgwvpqvkflahasvggflthagwnsiaeglangvrlvllplmfeqglnarqlaekkvavevardeddgsfaandivdalrrvmvgeegdefgvkvkelakvfgddevndryvrdflkclseykmqrqg>gi|297795735|ref|xp_002865752.1|udp-葡糖醛酸基/udp-葡糖基转移酶家族蛋白[琴叶拟南芥(arabidopsislyrata)琴叶亚种]mddkkeevmhiamfpwlamghllpflrlskllaqkghkisfistprnilrlpklpsnlsssitfvsfplpsisglppssessmdvpynkqqslkaafdllqpplteflrlsspdwiiydyashwlpsiakelgiskaffslfnaatlcfmgpssslieesrstpedftvvppwvpfkstivfryhevsryvektdedvtgvsdsvrfgytidgsdavfvrscpefepewfsllqdlyrkpvfpigflppviedddddttwvrikewldkqrvnsvvyvslgteaslrreeltelalgleksetpffwvlrnepqipdgfeervkgrgmvhvgwvpqvkilshesvggflthcgwnsvvegigfgkvpiflpvlneqglntrllqgkglgvevlrderdgsfgsdsvadsvrlvmiddageeirekvklmkglfgnmdeniryvdelvgfmrndessqlkeeeeeddcsddqssevssetdekelnldlkeekrrisvykslssefddyvanekmg在含有质粒的微滴定平板中接收测试的质粒,所述质粒作为冻干固体在每个分开的孔中。质粒的悬浮。向每个孔中,加入24μl超纯无菌水,并且将微滴定平板在室温下振荡30分钟。随后,将平板在4℃下孵育1小时。通过上下吸移,进一步混合每个孔的内容物。使用1μl悬浮液,通过qubit2.0分析进行质粒定量。测定的质粒含量为:微量滴定平板位置内部参照[质粒]ng/μlc908201a1s115n01a132.8c908201g2s115n01g241.0c908201a7s115n05a756.6c912666e1s115n06e164.0c912666c2s115n06c231.4用质粒转化感受态细胞。从-80℃的冰箱中取出化学感受态ec100细胞的等份试样并且储存在冰上。使细胞在冰上融化10分钟。将10μl上述质粒溶液的稀释液加入1.5ml的无菌微管中(使得用50pgdna转化每个细胞)并且储存在冰上。将100μl化学感受态细胞加入每个微管中。在冰上孵育化学感受态细胞质粒混合物20分钟后,进行了42℃下30秒的热休克。在冰上再进行孵育2分钟。向每个微管中,加入300μlsoc培养基,并将所得到的混合物转移至无菌的15ml试管中。在37℃下孵育1小时,同时在135rpm下振荡,将混合物涂布在含有50μg/ml卡那霉素的固体luria肉汤培养基上。使皮氏培养皿在37℃下孵育16小时。甘油中的储液的制备和质粒的纯化。向50ml无菌falcon试管中,加入10ml含有50μg/ml卡那霉素的luria肉汤培养基。给培养基接种从上述皮氏培养皿中分离的克隆,并使培养物在37℃下孵育16小时,同时在135rpm下振荡。向含有300μl60%无菌甘油溶液的1.5ml的无菌微管中,加入600μl培养物。将储液储存在-80℃。将剩余的培养物在10℃下,在5,525g下,离心10分钟,并且除去上清液后,将沉淀物储存在冰上。根据qiagenqiaprepspinminiprep试剂盒(参照:27106)纯化所产生的质粒,并且在260nm下测量了质粒产量。将质粒溶液储存在4℃。如下测定了质粒含量:微量滴定平板位置测试的内部参照[质粒]ng/μlc908201a1s115n01a1115.7c908201g2s115n01g2120.4c908201a7s115n05a7293.8c912666e1s115n06e1126.1c912666c2s115n06c298.8酶的体外表达。根据promegas30t7高产量蛋白表达系统(参照:l1110)试剂盒,将18μl质粒溶液(含有大约1.5μg质粒)用于体外表达。如下产生了表达培养基:将制备的表达培养基混合物加入质粒溶液中并且使溶液在30℃下孵育3小时,同时每45分钟混合该混合物。将5μl混合物冷冻,同时将剩余的用于针对莱鲍迪苷a转化成莱鲍迪苷d的催化测试。针对莱鲍迪苷a转化成莱鲍迪苷d的催化测试。将430μl含有0.5mm莱鲍迪苷a、3mmmgcl2、50mm磷酸盐缓冲剂(ph7.2)和2.5mmudp-葡萄糖的反应混合物加入1.5ml无菌微管中。加入52μl酶表达培养基并使所得到的混合物在30℃下反应24小时。在2小时、16小时和24小时后取出125μl样品并加入115μl60%甲醇和10μl2nh2so4中。将骤冷的样品在rt下在18,000g下离心2分钟。将200μl转移至hplc小瓶中并分析。hplc分析。如下进行hplc测试:装置仪器条件柱温55℃检测uv205nm;bw400nmcad检测分析持续时间15分钟注入的体积10μl流速1ml/分钟移动相梯度方案时间(分钟)含有0.04%醋酸的水%甲醇%0406082575102575114060154060以下提供了hplc测试结果并显示于图53a-e中:酶s115n05a7对于reba转化成rebd具有最高活性(大约22.4%)。至少三种酶产生了显著含量的未知糖苷(标记为rebunk;之后鉴定为rebd2)连同rebd。实施例21体外产生的eugt11的活性通过dna2.0合成了专利申请wo/2013/022989a2中所述的eugt11基因并随后在pet30a+载体中亚克隆。氨基酸序列如下:>gi|41469452|gb|aas07253.1|推定的udp-葡糖醛酸基和udp葡糖基转移酶[粳稻日本晴(oryzasativajaponicagroup)]eugt11酶来自专利申请wo/2013/022989a2mhvvicpllafghllpcldlaqrlacghrvsfvstprnisrlppvrpslaplvsfvalplprveglpngaesthnvphdrpdmvelhlrafdglaapfseflgtacadwvmptssaprqtlssnihrnssrpgtpapsgrllcpitphsntleraaeklvrssrqnararsllaftspplpyrdvfrsllglqmgrkqlniahetngrrtgtlplnlcrwmwkqrrcgklrpsdvefntsrsneaispigaslvnlqsiqspnpravlpiassgvravfigrartstptpphakparsaaprahrppssvmdsgysssyaaaagmhvvicpwlafghllpcldlaqrlasrghrvsfvstprnisrlppvrpalaplvafvalplprveglpdgaestndvphdrpdmvelhrrafdglaapfseflgtacadwvivdvfhhwaaaaalehkvpcammllgsahmiasiadrrleraetespaaagqgrpaaaptfevarmklirtkgssgmslaerfsltlsrsslvvgrscvefepetvpllstlrgkpitflglmpplhegrredgedatvrwldaqpaksvvyvalgsevplgvekvhelalglelagtrflwalrkptgvsdadllpagfeertrgrgvvatrwvpqmsilahaavgaflthcgwnstieglmfghplimlpifgdqgpnarlieaknaglqvarndgdgsfdregvaaairavaveeesskvfqakakklqeivadmacheryidgfiqqlrsykd在含有质粒的微滴定平板中接收测试的质粒,所述质粒作为冻干固体在每个分开的孔中。质粒的悬浮。向每个孔中,加入24μl超纯无菌水,并且将微滴定平板在室温下振荡30分钟。随后,将平板在4℃下孵育1小时。通过上下吸移,进一步混合每个孔的内容物。使用1μl悬浮液,通过qubit2.0分析进行质粒定量。测定的质粒含量为:微量滴定平板位置试验的内部参照[质粒]ng/μlc912666g4s115n08g419.2用质粒转化感受态细胞。从-80℃的冰箱中取出化学感受态ec100细胞的等份试样并且储存在冰上。使细胞在冰上融化10分钟。将10μl上述质粒溶液的稀释液加入1.5ml的无菌微管中(使得用50pgdna转化每个细胞)并且储存在冰上。将100μl化学感受态细胞加入每个微管中。在冰上孵育化学感受态细胞/质粒混合物20分钟后,进行了42℃下30秒的热休克。在冰上再进行孵育2分钟。向每个微管中,加入300μlsoc培养基,并将所得到的混合物转移至无菌的15ml试管中。在37℃下孵育1小时,同时在135rpm下振荡,将混合物涂布在含有50μg/ml卡那霉素的固体luria肉汤培养基上。使皮氏培养皿在37℃下孵育16小时。甘油中的储液的制备和质粒的纯化。向50ml无菌falcon试管中,加入10ml含有50μg/ml卡那霉素的luria肉汤培养基。给培养基接种从上述皮氏培养皿分离的克隆,并使培养物在37℃下孵育16小时,同时在135rpm下振荡。向含有300μl60%无菌甘油溶液的1.5ml的无菌微管中,加入600μl培养物。将储液储存在-80℃。将剩余的培养物在10℃下,在5,525g下,离心10分钟,并且除去上清液后,将沉淀物储存在冰上。根据qiagenqiaprepspinminiprep试剂盒(参照:27106)纯化所产生的质粒,并且在260nm下测量了质粒产量。将质粒溶液储存在4℃。如下测定了质粒含量:微量滴定平板位置测试的内部参照[质粒]ng/μlc912666g4s115n08g438.4eugt11的体外表达。根据promegas30t7高产量蛋白表达系统(参照:l1110)试剂盒,将18μl稀释的质粒溶液(含有大约1.5μg质粒)用于体外表达。产生了表达培养基,如下:将制备的表达培养基混合物加入质粒溶液中并且使溶液在30℃下孵育3小时,同时每45分钟混合该混合物。将5μl混合物冷冻,同时将剩余的用于针对莱鲍迪苷a转化成莱鲍迪苷d的催化测试。针对莱鲍迪苷a转化成莱鲍迪苷d的催化测试。将430μl含有0.5mm莱鲍迪苷a、3mmmgcl2、50mm磷酸盐缓冲剂(ph7.2)和2.5mmudp-葡萄糖的反应混合物加入1.5ml无菌微管中。加入52μl酶表达培养基并使所得到的混合物在30℃下反应24小时。在2小时、16小时和24小时后取出125μl样品并加入115μl60%甲醇和10μl2nh2so4中。将骤冷的样品在rt下在18,000g下离心2分钟。将200μl转移至hplc小瓶中并分析。hplc分析。按照实施例20中所述的进行hplc测试。hplc测试结果显示于图54中。实施例22酶的体内生产在体内产生了实施例20中所述的酶。通过热休克,将含有对应于酶的基因的pet30a+载体引入大肠杆菌bl21(de3)中。在卡那霉素的存在下,将获得的细胞生长于皮氏培养皿中,并选择合适的克隆,使其在液体lb培养基中(锥形烧瓶)生长。将作为冷冻保护剂的甘油加入悬浮液中并将400μl等份试样储存在-20℃和-80℃下。将含有pet30a+_ugt质粒的大肠杆菌bl21(de3)的储存等份试样融化并且加入30ml的lbgkp培养基(20g/lluria肉汤lennox;50mmpipes缓冲液ph7.00;50mm磷酸盐缓冲液ph7.00;2.5g/l葡萄糖和50mg/l卡那霉素)中。使这个培养物在135rpm和30℃下振荡8小时。生产培养基含有60g/l过夜表达已配制好的tb培养基(novagen)、10g/l甘油和50mg/l卡那霉素。将预培养物加入400ml的这种培养基中,并使溶液在20℃下搅拌,同时取样测量od和ph。培养物获得显著生长并且获得了良好的od。40小时后,通过离心收集细胞并冷冻。以下提及了以下的细胞湿重(cww)产量。gi编号版本cww115454819np_001051010.19.2g187373030acd03249.17.4g460409128xp_004249992.16.8g222619587eee55719.17.5g297795735xp_002865752.18.8g通过添加bugbustermaster混合物(novagen)进行裂解,通过离心收集裂解产物,并新鲜使用。活性的测定。使用50mmph7.2的磷酸钠缓冲液中的0.5mm底物、2.5mmudp-葡萄糖和3mmmgcl2,使用1,000μl融化的裂解产物,用于转化莱鲍迪苷a,以5ml规模进行了活性测试。取样并通过hplc分析。hplc分析。按照实施例20中所述的进行了hplc测试。以下提供了针对不同的酶的结果并显示于图55a-e中。gi编号版本45小时后的转化rebd选择性115454819np_001051010.11.1%100%187373030acd03249.10.8%100%460409128xp_004249992.162.1%43.6%222619587eee55719.12.9%未检测到rebd297795735xp_002865752.10.0%未检测到rebd实施例23糖苷的鉴定通过lc-ms另外测试代表gino.460409128的反应混合物,特别是实施例20的样品“12400s115n05a7t24h130627aba”(下文称为s115n05a7)和实施例22的样品“12400s129n04t45h130712aba”(下文称为s129n04),来鉴定未知的糖苷。使用了agilent1200系列hplc系统,其配备了双泵(g1312b)、自动取样机(g1367d)、恒温柱室(g1316b)、dad检测仪(c1315c),连接agilent6110amsd,并与“lc/msdchemstation”软件配合。仪器条件移动相梯度方案时间(分钟)a(%):甲酸0.1%b(%):乙腈075258.5752510.0712916.57030在3.5分钟的lcms系统上观察到的化合物对应于样品“s115n05a7”(实施例20)中的化合物“未知@4.508”和样品“s129n04”(实施例22)中的化合物“未知@rt4.526”。lcms数据表明这种化合物在其结构中具有六个葡糖苷残基(c56h90o33),并且发现了是rebm的异构体,命名为rebm2(对于讨论,参见实施例40)。而在7.6分钟的lcms上观察到的化合物对应于样品“s115n05a7”(实施例20)中的化合物“rebunk”和样品“s129n04”(实施例22)中的化合物“rebunk”。lcms数据表明“rebunk”在其结构中具有五个葡糖苷残基(c50h80o28),并且发现了是rebd的异构体,命名为rebd2(对于讨论,参见实施例39)。以下提供了这些化合物的比例和lcms色谱。实施例24糖苷的鉴定连同purecirclesdnbhd(马来西亚)生产的甜菊叶提取物“mld1”,通过lc-ms另外测试了代表gino.460409128的反应混合物,特别是实施例22的样品“12400s129n04t45h130712aba”(下文称为s129n04),来测定天然出现的s129n04糖苷。图57a-b中的测试表明实施例23中在3.5分钟的lcms系统上观察到的化合物(c56h90o33;之后证实为rebm2)和实施例23中在7.6分钟的lcms系统上观察到的化合物(c50h80o28;rebunk;之后证实为rebd2)出现在甜菊植物的提取物中。实施例25莱鲍迪苷e转化成莱鲍迪苷d反应的总体积为5.0ml,具有以下组成:100mm磷酸钾缓冲液ph7.5,3mmmgcl2,2.5mmudp-葡萄糖,0.5mm莱鲍迪苷e和500μlugt76g1融化的裂解产物(ugt76g1基因在pet30a+载体中克隆并在大肠杆菌bl21(de3)中表达)。在135rpm的轨道振荡器上在30℃下运行反应。为了取样,用30μl2nh2so4和270μl甲醇/水(6/4)骤冷300μl反应混合物。立即将样品离心并且在通过hplc(cad检测)分析前保持在10℃。获得了图58中显示的反应特征,对应于莱鲍迪苷e完全转化成莱鲍迪苷d。实施例26用于将莱鲍迪苷d转化成莱鲍迪苷m的ugt76g1的定向进化从genbank(aar06912.1)中所述的ugt76g1的氨基酸序列开始,鉴定了在各种氨基酸位置的不同突变,所述突变可以改变将莱鲍迪苷d(rebd)转化成莱鲍迪苷m(rebm)的酶的活性。这种通过dna2.0proteingpstm策略设计的突变列表随后用于合成96个含有这些突变中的3、4或5个的变体基因,所述突变对于在大肠杆菌中的表达是密码子优化的。将基因在pet30a+质粒中亚克隆并用于大肠杆菌bl21(de3)化学感受态细胞的转化。在卡那霉素的存在下,将获得的细胞在皮氏培养皿中的固体lb培养基中生长。选择合适的克隆,使其在试管中的液体lb培养基中生长。将作为冷冻保护剂的甘油加入悬浮液中并将400μl等份试样储存在-20℃和-80℃下。将含有pet30a+_ugt76g1var质粒的大肠杆菌bl21(de3)的这些储存等份试样融化并且加入lbgkp培养基中(20g/lluria肉汤lennox;50mmpipes缓冲液ph7.00;50mm磷酸盐缓冲液ph7.00;2.5g/l葡萄糖和50mg/l卡那霉素)。使这个培养物在135rpm和30℃下在96微滴定平板中振荡8小时。用50μl上述培养物接种3.95ml含有60g/lovernightexpresstm已配制好的tb培养基10g/l甘油和50mg/l卡那霉素的生产培养基。在48深孔平板中,使所得到的培养物在20℃下搅拌。培养物获得显著生长并获得了良好的od(600nm;1cm)。44小时后,通过离心收集细胞并冷冻。通过将master混合物加入融化的细胞中来进行裂解,并通过离心收集裂解产物。用100μl新鲜裂解产物进行了活性测试,所述裂解产物加入50mm磷酸盐缓冲液ph7.2中的莱鲍迪苷d(终浓度0.5mm)、mgcl2(终浓度3mm)和udp-葡萄糖(终浓度2.5mm)的溶液中。使反应在30℃下运行并且在2、4、7和24小时后取样,使用以上针对莱鲍迪苷d转化成莱鲍迪苷m所述的分析方法,通过hplc(cad检测)来测定转化和初始速率。结果显示于下表中。*突变如下注释:初始氨基酸-位置-新氨基酸:例如,位置33的丙氨酸突变成甘氨酸注释为a33g。实施例27ugtsl2的体内产生ugtsl2(gi_460410132/xp_004250485.1)氨基酸序列:matnlrvlmfpwlayghispflniakqladrgfliylcstrinlesiikkipekyadsihlielqlpelpelpphyhttnglpphlnptlhkalkmskpnfsrilqnlkpdlliydvlqpwaehvaneqnipagklltscaavfsyffsfrknpgvefpfpaihlpevekvkireilakepeeggrldegnkqmmlmctsrtieakyidyctelcnwkvvpvgppfqdlitndadnkelidwlgtkhenstvfvsfgseyflskedmeevafalelsnvnfiwvarfpkgeernledalpkgflerigergrvldkfapqprilnhpstggfishcgwnsamesidfgvpiiampihndqpinaklmvelgvaveivrdddgkihrgeiaetlksvvtgetgeilrakvreisknlksirdeemdavaeeliqlcrnsnksk通过热休克,将含有ugtsl2基因的pet30a+载体引入大肠杆菌b121(de3)中。在卡那霉素的存在下,将获得的细胞生长于皮氏培养皿中,并选择合适的克隆,使其在液体lbg培养基中(锥形烧瓶)生长。将作为冷冻保护剂的甘油加入悬浮液中并将400μl等份试样储存在-20℃和-80℃下。将含有pet30a+_ugtsl2质粒的大肠杆菌bl21(de3)的储存等份试样融化并且加入30ml的lbgkp培养基中(20g/lluria肉汤lennox;50mmpipes缓冲液ph7.00;50mm磷酸盐缓冲液ph7.00;2.5g/l葡萄糖和50mg/l卡那霉素)。使这个培养物在135rpm和30℃下振荡8小时。生产培养基含有60g/l过夜表达已配制好的tb培养基(novagen)、10g/l甘油和50mg/l卡那霉素。将预培养物加入200ml的这种培养基中,并使溶液在20℃下搅拌,同时取样测量od和ph。培养物获得显著生长并且获得了良好的od。40小时后,通过离心收集细胞并冷冻,获得6.22g细胞湿重。通过添加bugbustermaster混合物(novagen)对1.4g细胞进行裂解,通过离心收集裂解产物并新鲜使用。实施例28用ugtsl和ugtsl2将蛇菊苷转化成莱鲍迪苷e的活性的测定根据实施例22制得了ugtsl,并根据实施例27制得了ugtsl2。使用50mmph7.2的磷酸钠缓冲液中的0.5mm底物、2.5mmudp-葡萄糖和3mmmgcl2,使用600μl的裂解产物,用于蛇菊苷的转化,以3ml规模进行了活性测试。取样并通过hplc分析。hplc分析。按照实施例20中所述的进行了hplc测试。以下提供了针对不同的酶的结果和相应色谱并显示于图59a-b中。注释:1基于蛇菊苷的初始浓度实施例29用ugtsl和ugtsl2将悬钩子苷转化成莱鲍迪苷e的活性的测定根据实施例22制得了ugtsl,并根据实施例27制得了ugtsl2。使用50mmph7.2的磷酸钠缓冲液中的0.5mm底物、2.5mmudp-葡萄糖和3mmmgcl2,使用600μl的裂解产物,用于悬钩子苷的转化,以3ml规模进行了活性测试。取样并通过hplc分析。按照实施例20中所述的进行了hplc测试。以下提供了针对不同的酶的结果和相应色谱并显示于图60a-b中。注释:1基于悬钩子苷的初始浓度实施例30用ugtsl2将莱鲍迪苷a转化成莱鲍迪苷d的活性的测定根据实施例27制得了ugtsl2。使用50mmph7.2的磷酸钠缓冲液中的0.5mm底物、2.5mmudp-葡萄糖和3mmmgcl2,使用60μl的裂解产物,用于莱鲍迪苷a的转化,以3ml规模进行了活性测试。取样并通过hplc分析。按照实施例20中所述的进行了hplc测试。以下提供了23小时反应后的结果和相应色谱并显示于图61中。注释:1基于莱鲍迪苷a的初始浓度实施例31蛇菊苷的鉴定连同purecirclesdnbhd(马来西亚)生产的甜菊叶提取物“mld1”,通过lc-ms分析了根据实施例30制备并孵育45小时的反应混合物,来测定天然形成的糖苷的出现。使用了agilent1200系列hplc系统,其配备了双泵(g1312b)、自动取样机(g1367d)、恒温柱室(g1316b)、dad检测仪(g1315c),连接agilent6110amsd,并与“lc/msdchemstation”软件配合。仪器条件移动相梯度方案时间(分钟)a(%):甲酸0.1%b(%):乙腈07525307525336832756832图62中所示的测试表明了在11.77分钟的lc-ms系统上观察到的化合物与实施例23中3.5分钟的化合物相同(c56h90o33;之后证实为rebm2),在26.64分钟观察到的化合物与实施例23中7.6分钟的化合物相同(c50h80o28;rebunk;之后证实为rebd2)。在13.96分钟观察到了rebx的其他异构体,在25.06分钟观察到了rebd的另一种异构体形式。所有观察到的化合物都出现在甜菊提取物中。实施例32ugtlb的体内制备和活性测定ugtlb(gi_209954733/bag80557.1)氨基酸序列mgtevtvhkntlrvlmfpwlayghispflnvakklvdrgfliylcstainlkstikkipekysdsiqlielhlpelpelpphyhttnglpphlnhtlqkalkmskpnfskilqnlkpdlviydllqqwaegvaneqnipavklltsgaavlsyffnlvkkpgvefpfpaiylrknelekmsellaqsakdkepdgvdpfadgnmqvmlmstsriieakyidyfsglsnwkvvpvgppvqdpiaddademelidwlgkkdenstvfvsfgseyflskedreeiafglelsnvnfiwvarfpkgeeqnledalpkgflerigdrgrvldkfapqprilnhpstggfishcgwnsvmesvdfgvpiiampihldqpmnarlivelgvaveivrddygkihreeiaeilkdviagksgenlkakmrdisknlksirdeemdtaaeeliqlcknspklk通过热休克,将含有ugtlb基因的pet30a+载体引入大肠杆菌b121(de3)中。在卡那霉素的存在下,将获得的细胞生长于皮氏培养皿中,并选择合适的克隆,使其在液体lb培养基中(锥形烧瓶)生长。将作为冷冻保护剂的甘油加入悬浮液中并将400μl等份试样储存在-20℃和-80℃下。将含有pet30a+_ugtlb质粒的大肠杆菌bl21(de3)的储存等份试样融化并且加入30ml的lbgkp培养基中(20g/lluria肉汤lennox;50mmpipes缓冲液ph7.00;50mm磷酸盐缓冲液ph7.00;2.5g/l葡萄糖和50mg/l卡那霉素)。使这个培养物在135rpm和30℃下振荡8小时。生产培养基含有60g/l过夜表达已配制好的tb培养基(novagen)、10g/l甘油和50mg/l卡那霉素。将预培养物加入200ml的这种培养基中,并使溶液在20℃下搅拌,同时取样测量od和ph。培养物获得显著生长并且获得了良好的od。40小时后,通过离心收集细胞并冷冻,获得5.7g细胞湿重。通过添加6mlbugbustermaster混合物(novagen)对1.2g细胞进行裂解,通过离心收集裂解产物并新鲜使用。用ugtlb将蛇菊苷转化成菜鲍迪苷e的活性的测定使用50mmph7.2的磷酸钠缓冲液中的0.5mm底物、2.5mmudp-葡萄糖和3mmmgcl2,使用600μl的裂解产物,用于蛇菊苷的转化,以3ml规模进行了活性测试。取样并通过hplc分析。相应色谱描绘于图63a中。注释:1基于蛇菊苷的初始浓度用ugtlb将悬钩子苷转化成莱鲍迪苷e的活性的测定使用50mmph7.2的磷酸钠缓冲液中的0.5mm底物、2.5mmudp-葡萄糖和3mmmgcl2,使用600μl的裂解产物,用于悬钩子苷的转化,以3ml规模进行了活性测试。取样并通过hplc分析。相应色谱描绘于图63b中。注释:1基于悬钩子苷的初始浓度用ugtlb将莱鲍迪苷a转化成莱鲍迪苷d的活性的测定使用50mmph7.2的磷酸钠缓冲液中的0.5mm底物、2.5mmudp-葡萄糖和3mmmgcl2,使用600μl的裂解产物,用于莱鲍迪苷a的转化,以3ml规模进行了活性测试。取样并通过hplc分析。反应23小时后的相应色谱描绘于图63c中。注释:1基于莱鲍迪苷a的初始浓度实施例33用ugtsl、ugtsl2和ugtlb的悬钩子苷和蛇菊苷转化的反应产物的测定以实施例28相似的方式进行了用ugtsl和ugtsl2的蛇菊苷转化,并以实施例29相似的方式进行了用ugtsl和ugtsl2的悬钩子苷转化。以实施例32相似的方式进行了用ugtlb的悬钩子苷和蛇菊苷的转化。通过lcms分析了反应混合物来测定所有反应产物。悬钩子苷转化产物蛇菊苷转化产物可以看到在悬钩子苷转化产物中,除了蛇菊苷、rebe和rebd,存在至少3种另外的具有804分子量的化合物。这些化合物的停留时间与rebb不匹配,已知其与蛇菊苷具有相同的分子量。因为这些化合物与蛇菊苷具有相同的分子量,可以认为这些新的甜菊醇糖苷是蛇菊苷的异构体。另一方面,在蛇菊苷转化产物中,除了rebe和rebd,存在至少3种另外的具有966分子量的化合物。这些化合物的停留时间与reba不匹配,已知其与rebe具有相同的分子量。因为这些化合物与reba和rebe具有相同的分子量,可以认为这些新的甜菊醇糖苷是reba(rebe)的异构体。实施例34酿酒酵母(s.cerevisiae)中ugt76g1的体内产生ugt76g1[甜菊](gi_37993653/gb-aar06912.1)menktettvrrrrriilfpvpfqghinpilqlanvlyskgfsitifhtnfnkpktsnyphftfrfildndpqderisnlpthgplagmripiinehgadelrrelellmlaseedeevsclitdalwyfaqsvadslnlrrlvlmtsslfnfhahvslpqfdelgyldpddktrleeqasgfpmlkvkdiksaysnwqilkeilgkmikqtkassgviwnsfkeleeseletvireipapsfliplpkhltasssslldhdrtvfqwldqqppssvlyvsfgstsevdekdfleiarglvdskqsflwvvrpgfvkgstwveplpdgflgergrivkwvpqqevlahgaigafwthsgwnstlesvcegvpmifsdfgldqplnarymsdvlkvgvylengwergeianairrvmvdeegeyirqnarvlkqkadvslmkggssyesleslvsyissl上述氨基酸序列对于在酿酒酵母中的表达是密码子优化的。此外,在atg起始密码子前,添加酵母共有序列aacaca。使用hindiii和xbai限制位点,在pyes2载体中亚克隆合成基因。将pyes2_ugt76g1_sc载体用于转化化学感受态酿酒酵母invsc1细胞(invitrogen)。将细胞生长于含有2%葡萄糖缺少尿嘧啶的固体合成最小培养基上,并且挑选单个克隆并使其在缺少尿嘧啶的液体合成最小培养基(含有2%葡萄糖的sc-u)中生长。离心后,用sc-u(含有2%葡萄糖)和60%甘油/水悬浮细胞。将等份试样储存在-80℃,并且将一个等份试样用于起始在sc-u(含有2%葡萄糖)中的培养,在30℃下持续43小时。将这个培养物的一部分离心并悬浮于孵育培养基(含有2%半乳糖的sc-u)中,在30℃下持续19小时30分钟。通过离心获得细胞并用五体积的cellytictmy细胞裂解试剂(sigma)裂解。将裂解产物直接用于活性测试(ugt76g1_sc)。实施例35ugt76g1_sc用于将莱鲍迪苷d转化成莱鲍迪苷m的活性的测定根据实施例34制得了ugt76g1_sc。使用50mmph7.2的磷酸钠缓冲液中的0.5mm底物、2.5mmudp-葡萄糖和3mmmgcl2,使用200μl的裂解产物,用于莱鲍迪苷d的转化,以2ml规模进行了活性测试。取样并通过hplc分析。相应色谱描绘于图64中。酶内部参照莱鲍迪苷d转化1(反应时间)莱鲍迪苷m选择性1ugt76g1_sc85%(21小时)100%注释:1基于莱鲍迪苷d的初始浓度实施例36酿酒酵母中ugtsl的体内产生ugtsl[番茄](gi_460409128/xp_004249992.1)mspklhkelffhslykktrsnhtmatlkvlmfpflayghispylnvakkladrgfliyfcstpinlkstiekipekyadsihlielhlpelpqlpphyhttnglppnlnqvlqkalkmskpnfskilqnlkpdlviydilqrwakhvaneqnipavklltsgaavfsyffnvlkkpgvefpfpgiylrkieqvrlsemmsksdkekeledddddddllvdgnmqimlmstsrtieakyidfctaltnwkvvpvgppvqdlitndvddmelidwlgtkdenstvfvsfgseyflskedmeevafalelsnvnfiwvarfpkgeernledalpkgflerigergrvldkfapqprilnhpstggfishcgwnsamesidfgvpiiampmhldqpmnarlivelgvaveivrdddgkihrgeiaetlkgvitgktgeklrakvrdisknlktirdeemdaaaeeliqlcrngn上述氨基酸序列对于在酿酒酵母中的表达是密码子优化的。此外,在atg起始密码子前,添加酵母共有序列aacaca。使用hindiii和xbai限制位点,在pyes2载体中亚克隆合成基因。将pyes2_ugtsl_sc载体用于转化化学感受态酿酒酵母invsc1细胞(invitrogen)。将细胞生长于含有2%葡萄糖缺少尿嘧啶的固体合成最小培养基上,并且挑选单个克隆并使其在缺少尿嘧啶的液体合成最小培养基(含有2%葡萄糖的sc-u)中生长。离心后,用sc-u(含有2%葡萄糖)和60%甘油/水悬浮细胞。将等份试样储存在-80℃,并且将一个等份试样用于起始在sc-u(含有2%葡萄糖)中的培养,在30℃下持续43小时。将这个培养物的一部分离心并悬浮于孵育培养基(含有2%半乳糖的sc-u)中,在30℃下持续19小时30分钟。通过离心获得细胞并用五体积的cellytictmy细胞裂解试剂(sigma)裂解。将裂解产物直接用于活性测试(ugtsl_sc)。实施例37ugtsl_sc用于将莱鲍迪苷a转化成莱鲍迪苷d的活性的测定根据实施例36制得了ugtsl_sc。使用50mmph7.2的磷酸钠缓冲液中的0.5mm底物、2.5mmudp-葡萄糖和3mmmgcl2,使用200μl的裂解产物,用于莱鲍迪苷a的转化,以2ml规模进行了活性测试。取样并通过hplc分析。相应色谱描绘于图65中。酶内部参照莱鲍迪苷a转化1(反应时间)莱鲍迪苷d选择性1ugtsl_sc46%(4h.)42%注释:1基于莱鲍迪苷a的初始浓度实施例38莱鲍迪苷m的分离实施例14的产物混合物的量不足以通过制备性hplc方法来分离。因此,使用一系列注入的分析性hplc来分离混合物的组分。根据以上实施例14中所述的方法进行了分离,以提供对应于图5的hplc痕迹中的两个主峰:级分a(停留时间24.165分钟)和级分b(停留时间31.325分钟)。级分a的停留时间与rebd一致,表明是来自生物转化反应的未反应起始材料。纯化的级分b的停留时间(图6)与rebm一致,表明了从rebd的成功生物转化。通过共同注入纯化的级分b与rebm标准品(获自purecircle,图7中显示的rebm标准品的hplc痕迹)来证实级分b中作为rebm收集的材料的性质。发现级分b和rebm标准品都在相同的停留时间洗脱(图8),表明级分b是rebm。通过nmr和hrms也分开证实了级分b作为rebm的性质。为了取样,在旋转蒸发仪下浓缩级分b,冷冻干燥以及在40℃下干燥40小时。将nmr样品溶解于氘代吡啶(c5d5n)中并使用标准脉冲顺序在varianunityplus600mhz仪器上获取了质谱。将级分b的nmr谱与rebm的nmr谱相比。两个谱的重叠(图9)显示了级分b的峰与rebm的一致性。以下显示了rebm的nmr分配表:c5d5na-c中莱鲍迪苷m的1h和13cnmr谱数据a基于cosy、hmqc和hmbc关联进行分配;b化学位移值以δ(ppm)计;c耦合常数以hz计。用配备了以正离子模式运行的电喷雾电离源的waterspremier四极杆时间飞行(q-tof)质谱仪产生了hrms(图10)。将样品溶解于甲醇中并在2:2:1的甲醇:乙腈:水中洗脱,并使用舱内注射泵通过输注引入。通过m/z1313.5265的[m+na]+加合物证实了rebm的存在,其对应于c56h90o33的分子式。实施例39rebd2的分离和表征粗反应样品。根据实施例22,用ugtsl(gi#460409128)制备用于分离的批号cb-2977-106的样品。hplc分析。使用waters2695alliance系统进行了初步hplc分析,使用以下方法:phenomenexsynergihydro-rp,4.6×250mm,4μm(p/n00g-4375-e0);柱温:55℃;移动相a:水中0.0284%醋酸铵(nh4oac)和0.0116%醋酸(hoac);移动相b:乙腈(mecn);流速:1.0ml/分钟;注入体积:10μl。通过uv(210nm)和cad来检测。梯度:时间(分钟)%a%b0.0-8.5752510.0712916.5703018.5-24.5663426.5-29.0485231-373070387525用以下方法进行了半制备性纯化级分的分析:watersatlantisdc18,4.6×100mm,5μm(p/n186001340);移动相a:水中25%mecn;移动相b:水中30%mecn;流速:1.0ml/分钟;注入体积:10μl。通过cad来检测。梯度:时间(分钟)%a%b0.0-5.01000202080252080301000lc-ms。使用以负离子模式运行的waters3100质量检测仪,在watersautopurificationhplc/ms系统上进行了半合成甜菊醇糖苷混合物的初步分析。使用以下方法进行了样品的分析:phenomenexsynergihydro-rp,4.6×250mm,4μm(p/n00g-4375-e0);柱温:55℃;移动相a:水中0.0284%nh4oac和0.0116%hoac;移动相b:mecn;流速:1.0ml/分钟;注入体积:10μl。通过uv(210nm)和msd(-esim/z500-2000)来检测。梯度条件如上所列。通过hplc的分离。以两步进行了纯化。以下概述了用于半制备性纯化的第一种方法。柱:watersatlantisdc18,30×100mm,5μm(p/n186001375);移动相a:水中25%mecn;移动相b:水中30%mecn;流速:45ml/分钟;注入载量:20ml水中溶解的160mg。通过uv来检测(205nm)。时间(分钟)%a%b0.0-5.01000202080252080301000第二次纯化使用了相同的柱和条件,但使用了等度移动相:水中20%mecn。从天然提取物纯化。以三步进行了纯化。以下概括了用于制备性纯化的第一种方法。主要过程:waterssymmetryc18,50×250mm,7μm(p/nwat248000);等度移动相:水中50%甲醇(meoh),含有0.05%hoac;流速:85ml/分钟;注入载量:溶解于50ml移动相中的6g粗提物。通过uv(210nm)来检测。靶分析物洗脱后,用水中85%meoh冲洗柱。第二种方法:waterssymmetryshieldrp18,50×250mm,7μm(p/nwat248000);等度移动相:水中20%mecn;流速:100ml/分钟;注入载量:溶解于30ml水中的0.5g第一级分。通过uv(210nm)来检测。第三种方法:waterssymmetryshieldrp18,50×250mm,7μm(p/nwat248000);等度移动相:水中20%mecn;流速:100ml/分钟;注入载量:溶解于30ml水中的0.5g第二级分。通过uv(210nm)来检测。ms和ms/ms。用配备了电喷雾电离源的watersqtofpremier质谱仪来产生ms和ms/ms数据。通过负esi分析样品。用h2o:乙腈(1:1)稀释样品50倍并使用舱内注射泵经由输注引入。将样品稀释,以产生良好的s/n,其出现在0.01mg/ml的合适浓度下。nmr。通过将1-2mg溶解于150μl吡啶-d5中制备了样品并且在具有2.5mm逆检测探头的brukeravance500mhz仪器上获取了nmr数据,使用。1hnmr谱参照残余溶剂信号(对于吡啶-d5,δh8.74和δc150.35)。结果和讨论分离和纯化。对根据实施例22使用ugtsl(gi#460409128)制备的批号cb-2977-106的甜菊醇糖苷混合物进行了分离。使用上述的方法,通过lc-ms分析了所述材料,并且结果提供于图11中。感兴趣的靶峰在tic色谱图中的7.7分钟。这个峰的质谱提供了m/z1127.6的[m-h]-。所提供的样品是使用以上提供的第一种方法条件以单次注入(160mg)初步制备的。这种方法将所述材料分成糖苷的“极性”和“非极性”混合物。然后使用以上的第二步条件再次处理“极性”混合物。半制备性hplc痕迹提供于图12中。从这个半制备性集合,分离了具有纯度>99%的化合物(cad,auc)。级分分析提供于图13中。纯化后,通过在35℃下的旋转蒸发来浓缩合并的级分并冻干。获得大约1-2mg,用于表征。质谱。通过灌输样品获得的esi-tof质谱显示了m/z1127.4709的[m-h]-。[m-h]-离子的质量与分子式c50h80o28非常一致(计算为c50h79o28:1127.4758,误差:-4.3ppm)。ms数据证实了具有分子式c50h80o28的1128道尔顿的名义质量。ms/ms谱(选择m/z1127.5的[m-h]-离子,用于分裂)表明了m/z641.3187、479.2655和317.2065处的两个葡萄糖单体的丢失和三个葡萄糖部分的按序丢失。nmr光谱测定。进行了一系列包括1hnmr(图14)、13cnmr(图15和16)、1h-1hcosy(图17)、hsqc-dept(图18)、hmbc(图19和20)和1d-tocsy的nmr实验,以允许化合物的分配。1h、1h-1hcosy、1h-13chsqc-dept和1h-13chmbcnmr数据表明了糖苷的中心核是双萜。在1h和1h-13chsqc-dept谱中观察到的五个异头质子的存在证实了结构中的五个糖单体。1h-13chsqc-dept谱中δc69.9处的亚甲基13c共振表明了结构中1→6糖键的存在。使用1h-13chmbc和1d-tocsy关联分配了糖单体的键。来自δh1.29的甲基质子与δc177.7的羰基的hmbc关联允许分配叔甲基基团之一(c-18)以及c-19并且提供了用于分配剩余的糖苷配基的起始点。来自甲基质子(h-18)与δc38.9、45.0和57.8的碳的其他hmbc关联允许c-3、c-4和c-5的分配。1h-13chsqc-dept数据的分析表明δc38.9的碳是亚甲基基团,而δc57.8的碳是次甲基,其分别被分配为c-3和c-5。剩下的δc45.0的碳,其在hsqc-dept谱中没有显示出关联,被分配为季碳,c-4。使用hsqc-dept数据来分配c-3(δh0.98和2j.36)和c-5(δh1.04)的1h化学位移。h-3质子之一(δh0.98)和δh1.43的质子之间的cosy关联允许分配h-2质子中的一个,其转而显示出与分配为c-1的δh0.75的质子的关联。随后基于其他的cosy和hsqc-dept关联来分配针对c-1和c-2的剩余1h和13c化学位移并概括于下表中。1h和13cnmr(500和125mhz,吡啶-d5),rebd2的分配在δh1.30观察到的其他叔甲基单峰显示出与c-1和c-5的hmbc关联并且被分配为c-20。甲基质子显示出与季碳(δc40.3)和次甲基碳(δc54.5)(其分别被分配为c-10和c-9)另外的hmbc关联。h-5(δh1.04)与δh1.92和2.43之间的cosy关联随后允许分配h-6质子,其转而显示出与分配为c-7的δh1.22和1.30的质子的关联。随后从hsqc-dept数据测定了针对c-6(δc22.7)和c-7(δc42.2)的13c化学位移。h-9(δh0.88)与δh1.65和1.69的质子之间的cosy关联允许分配h-11质子,其转而显示出与分配为h-12质子的δh1.99和2.25的质子的cosy关联。随后将hsqc-dept数据用于分配c-11(δc21.1)和c-12(δc37.5)。来自h-12质子(δh2.25)与δc87.1和154.7的碳的hmbc关联分别允许分配c-13和c-16。在δh5.01和5.64观察到的烯烃质子显示出与c-13的hmbc关联并被分配为c-17(经由hsqc-dept,δc105.2)。烯烃质子h-17和次甲基质子h-9显示出与分配为c-15的δc48.3的碳的hmbc关联。来自h-9与δc44.5的亚甲基碳的另外的hmbc关联随后允许c-14的分配。使用hsqc-dept数据分配了c-14(δh1.80和2.65)和c-15(δh1.31和2.04)的1h化学位移。以下提供了用于分配糖苷配基区域的关键hmbc和cosy关联:1h-13chsqc-dept数据的分析证实了五个异头质子的存在。三个异头质子在1hnmr谱中的δh6.02(δc96.1)、5.57(δc105.3)和5.34(δc105.3)处得到了充分的分辨。通过1h-13chsqc-dept数据鉴定了在δh5.04(δc105.6)和5.07(δc98.7)观察到的剩余的两个异头质子,其在1h谱中被溶剂(hod)共振遮掩了。在δh6.02观察到的异头质子显示出与c-19的hmbc关联,这表明了其对应于glci的异头质子。相似地,在δh5.07观察到异头质子显示出与c-13的hmbc关联,允许其被分配为glcii的异头质子。glci异头质子(δh6.02)显示出与被分配为glcih-2的δh4.07的质子的cosy关联,glcih-2转而显示出与δh4.22(glcih-3)的质子的cosy关联,glcih-3显示出与δh4.12(glcih-4)的质子的cosy关联。由于数据重叠,cosy谱没有允许h-5或h-6质子的分配。因此,使用几个不同的混合时间,使用glci异头质子的选择性照射,进行了一系列的1d-tocsy实验。除了证实了针对glcih-2至h-4的分配,1d-tocsy数据显示出分配为glcih-5的δh4.04的质子和分配为glcih-6质子之一的δh4.68的质子。后一个质子也用于1d-tocsy实验。使用几个不同混合时间的h-6的选择性照射也证实了glcih-1至h-5的分配以及h-6(δh4.30)的剩余亚甲基质子。使用1h-13chsqc-dept数据测定了针对glcic-2(δc74.2)、c-3(δc79.1)、c-4(δc72.1)、c-5(δc78.5)和c-6(δc69.9)的13c化学位移的分配,以完成glci的分配。此外,1h-13chsqc-dept谱中δc69.9的亚甲基13c共振的存在表明了结构中glci的1→6糖键。四个剩余的未分配葡萄糖部分中,一个基于1h-13chsqc-dept、hmbc和1d-tocsy关联被分配为glci的c-6的取代基。hsqc-dept谱中δc69.9的亚甲基13c共振的相对低场位移表明了glci的1→6糖键。δh5.04观察到的异头质子显示出与glcic-6的hmbc关联并被分配为glcv的异头质子。相似地,glci的亚甲基质子表明了与glcv的异头碳的hmbc关联,证实了glci和glcv之间1→6糖键的存在。glcv异头质子显示出与分配为glcvh-2的δh4.00的质子的cosy关联,glcvh-2转而显示出与δh4.22(glcvh-3)的质子的cosy关联。由于数据重叠,cosy谱没有允许基于glcvh-3的cosy关联来分配glcvh-4。然而,在hmbc谱中,glcvh-3显示出与glcvc-5(δc78.9)的关联。在hsqc-dept中,glcvc-5显示出与δh3.89(glcvh-5)的关联。glcvh-5显示出与δh4.21,4.37和4.48的cosy关联。在hsqc-dept谱中,δh4.21显示出与δc71.4(glcvh-4)的关联,而δh4.37和4.48显示出与δc63.1的关联并分别被分配为glcvh-6a和h-6b。使用1h-13chsqc-dept数据确定了针对glcvc-2(δc75.7)和c-3(δc79.1)的13c化学位移的分配,以完成glcv的分配。针对c-19的糖苷的1h和13c化学位移的概述显示于下表中:1h和13cnmr(500和125mhz,吡啶-d5),rebd2c-19糖苷的分配*异头质子被溶剂(hdo)共振遮掩。因此,没能测定耦合常数值。#1h和13c值在位置glc1-3、glcv-3和glciv-3之间可以交换。以下提供了用于分配c-19糖苷的关键hmbc、cosy和1d-tocsy关联的概述。以相似的方式进行了glcii的分配。glcii异头质子(δh5.07)显示出与分配为glciih-2的δh4.37的质子的cosy关联,glciih-2转而显示出与δh4.18(glciih-3)的质子的cosy关联。这后一质子显示出与δh3.88(glciih-4)的质子的其他关联,其也显示出与δh3.79(glciih-5)的质子的cosy关联。glciih-5还显示出与glciih-6质子(δh4.08和4.46)的cosy关联。使用hsqc-dept数据测定了针对glciic-2(δc81.3)、c-3(δc88.4)、c-4(δc71.1)、c-5(δc77.9)和c-6(δc63.2)的13c化学位移的分配。来自glciih-3至c-2和c-4以及还来自glciih-4至c-2和c-5的hmbc关联证实了以上进行的分配。glciih-4至glciic-6的其他hmbc关联进一步支持完成glcii的分配。基于hmbc关联,将剩余两个未分配的葡萄糖部分分配为glcii的c-2和c-3的取代基。在δh5.57观察到的异头质子显示出与glciic-2的hmbc关联并且被分配为glciii的异头质子。在δh5.34观察到的异头质子显示出与glciic-3的hmbc关联并且被分配为glciv的异头质子。还观察到了来自glciih-2与glciii的异头碳以及来自glciih-3与glciv的异头碳的相互hmbc关联。glciii的异头质子(δh5.57)显示出与分配为glciiih-2的δh4.19的质子的cosy关联。由于数据重叠,cosy谱没有允许h-3至h-6质子的分配。因此,使用几个不同的混合时间,使用glciii异头质子的选择性照射,进行了一系列的1d-tocsy实验。除了证实针对glciiih-2的分配,1d-tocsy数据显示δh4.24(glciiih-3)、δh4.27(glciiih-4)和δh3.94(glciiih-5)的质子。一旦使用1d-tocsy数据分配h-4,将来自h-4与h-5以及转而与h-6的cosy关联用于分配h-6。在cosy谱中,glciiih-4显示出与glciiih-5的关联,其转而显示出分别与glciiih-6a和h-6b的δh4.41和4.50的cosy关联。然后使用1h-13chsqc-dept关联确定针对glciiic-2(δc76.8)、c-3(δc78.9)、c-4(δc72.4)、c-5(δc78.8)和c-6(δc63.5)的13c化学位移,以完成glciii的分配。glciv(δh5.34)的异头质子显示出与分配为glcivh-2的δh4.06的质子的cosy关联。由于数据重叠,cosy谱没有允许h-3至h-6质子的分配。因此,使用几个不同的混合时间,使用glciv异头质子的选择性照射,进行了一系列的1d-tocsy实验。除了证实针对glcivh-2的分配,1d-tocsy数据显示δh4.22(glcivh-3)、δh4.18(glcivh-4)和δh4.10(glcivh-5)的质子。一旦使用1d-tocsy数据分配h-4,将来自h-4与h-5以及转而与h-6的cosy关联用于分配h-6。在cosy谱中,glcivh-4显示出与glcivh-5的关联,其转而显示出分别与glcivh-6a和h-6b的δh4.32和4.58的cosy关联。然后使用1h-13chsqc-dept关联确定针对glcivc-2(δc75.8)、c-3(δc78.9)、c-4(δc72.0)、c-5(δc79.3)和c-6(δc62.9)的13c化学位移,以完成glciv的分配。针对c-13的糖苷的1h和13c化学位移的概述显示于下表中:1h和13cnmr(500和125mhz,吡啶-d5),rebd2c-13糖苷的分配以下提供了用于分配c-13糖苷的关键hmbc、cosy和1d-tocsy关联的概述:nmr和ms分析允许以下所示结构的全部分配。化合物的化学名称是13-[(2-o-β-d-吡喃葡糖基-3-o-β-d-吡喃葡糖基-β-d-吡喃葡糖基)氧]等效-16-贝壳杉烯-19-酸-[(6-o-β-d-吡喃葡糖基-β-d-吡喃葡糖基)酯](莱鲍迪苷d2或rebd2)。所述化合物是莱鲍迪苷d的异构体。实施例40rebm2的分离和表征粗反应样品。根据实施例22,用ugtsl(gi#460409128)制备用于分离的批号cb-2977-106的样品。hplc分析。使用waters2695alliance系统进行了初步hplc分析,使用以下方法:phenomenexsynergihydro-rp,4.6×250mm,4μm(p/n00g-4375-e0);柱温:55℃;移动相a:水中0.0284%醋酸铵(nh4oac)和0.0116%醋酸(hoac);移动相b:乙腈(mecn);流速:1.0ml/分钟;注入体积:10μl。通过uv(210nm)和cad来检测。梯度:时间(分钟)%a%b0.0-5.01000202080252080301000用以下方法进行了半制备性纯化级分的分析:watersatlantisdc18,4.6×100mm,5μm(p/n186001340);移动相a:水中25%mecn;移动相b:水中30%mecn;流速:1.0ml/分钟;注入体积:10μl。通过cad来检测。梯度:时间(分钟)%a%b0.0-8.5752510.0712916.5703018.5-24.5663426.5-29.0485231-373070387525lc-ms。使用以负离子模式运行的waters3100质量检测仪,在watersautopurificationhplc/ms系统上进行了半合成甜菊醇糖苷混合物的初步分析。使用以下方法进行了样品的分析:phenomenexsynergihydro-rp,4.6×250mm,4μm(p/n00g-4375-e0);柱温:55℃;移动相a:水中0.0284%nh4oac和0.0116%hoac;移动相b:mecn;流速:1.0ml/分钟;注入体积:10μl。通过uv(210nm)和msd(-esim/z500-2000)来检测。梯度条件如上所列。通过hplc的分离。以两步进行了纯化。以下概述了用于半制备性纯化的第一种方法。柱:watersatlantisdc18,30×100mm,5μm(p/n186001375);移动相a:水中25%mecn;移动相b:水中30%mecn;流速:45ml/分钟;注入载量:20ml水中溶解的160mg。通过uv来检测(205nm)。梯度:时间(分钟)%a%b0.0-5.01000202080252080301000第二次纯化使用了相同的柱和条件,但使用了等度移动相:水中20%mecn。ms和ms/ms。用配备了电喷雾电离源的watersqtofpremier质谱仪来产生ms和ms/ms数据。通过负esi分析样品。用h2o∶mecn(1∶1)稀释样品50倍并使用舱内注射泵经由输注引入。将样品稀释,以产生良好的s/n,其出现在0.01mg/ml的合适浓度下。nmr。通过将~1.0mg溶解于150μld2o中制备了样品并且在具有2.5mm逆检测探头的brukeravance500mhz仪器上获取了nmr数据。1hnmr和13cnmr谱分别参照残余溶剂信号hdo(δh4.79ppm)和tsp(δc0.00ppm)。结果和讨论分离和纯化。对根据实施例22使用ugtsl(gi#460409128)制备的批号cb-2977-106的甜菊醇糖苷混合物进行了分离。使用上述的方法(图11),通过lc-ms分析了所述材料。感兴趣的靶峰在tic色谱图中的4.1分钟。这个峰的质谱提供了m/z1289.7的[m-h]-。所提供的样品是使用以上提供的第一种方法条件以单次注入(160mg)初步制备的。这种方法将所述材料分成糖苷的“极性”和“非极性”混合物。然后使用以上的第二步条件再次处理“极性”混合物。半制备性hplc痕迹显示于图12中。从这个半制备性集合,分离了具有纯度>99%的峰(cad,auc)。级分分析提供于图13中。纯化后,通过在35℃下的旋转蒸发来浓缩合并的级分并冻干。获得大约1mg。质谱。通过灌输样品cc-00300获得的esi-tof质谱显示了m/z1289.5266的[m-h]-。[m-h]-离子的质量与预期为rebm2的分子式c56h90o33非常一致(计算为c56h89o33:1289.5286,误差:-1.6ppm)。ms数据证实了cc-00300具有分子式c56h90o33的1290道尔顿的名义质量。ms/ms谱(选择m/z1289.5的[m-h]-离子,用于分裂)表明了m/z803.3688的三个葡萄糖单体的丢失以及m/z641.3165、479.2633和317.2082的三个葡萄糖部分的按序丢失。nmr光谱测定。进行了一系列包括1hnmr(图21)、13cnmr(图22和23)、1h-1hcosy(图24)、hsqc-dept(图25)、hmbc(图26和27)和1d-tocsy的nmr实验,以允许rebm2的分配。1h、1h-1hcosy、1h-13chsqc-dept和1h-13chmbcnmr数据表明了糖苷的中心核是双萜。在1h和1h-13chsqc-dept谱中观察到的六个异头质子的存在证实了结构中的六个糖单体。1h-13chsqc-dept谱中δc70.9处的亚甲基13c共振表明了结构中1→6糖键的存在。使用1h-13chmbc和1d-tocsy关联分配了糖单体的键。来自δh1.29的甲基质子与δc181.5的羰基的hmbc关联允许分配叔甲基基团之一(c-18)以及c-19并且提供了用于分配剩余的糖苷配基的起始点。来自甲基质子(h-18)与δc39.8、43.7和59.2的碳的其他hmbc关联允许c-3、c-4和c-5的分配。1h和1h-13chsqc-dept数据的分析表明δc39.8的碳是亚甲基基团,而δc59.2的碳是次甲基,其分别被分配为c-3和c-5。剩下的δc43.7的碳,其在hsqc-dept谱中没有显示出关联,被分配为季碳,c-4。使用hsqc-dept数据来分配c-3(δh1.16和2.28)和c-5(δh1.24)的1h化学位移。h-3质子之一(δh1.16)和δh1.49的质子之间的cosy关联允许分配h-2质子中的一个,其转而显示出与分配为c-1的δh0.92的质子的关联。随后基于其他的cosy和hsqc-dept关联来分配针对c-1和c-2的剩余1h和13c化学位移并概括于下表中。1hnmr(500mhz,d2o)和13cnmr(125mhz,d2o/tsp),rebm2糖苷配基的分配在δh0.92观察到的其他叔甲基单峰显示出与c-1和c-5的hmbc关联并且被分配为c-20。甲基质子显示出与季碳(δc42.4)和次甲基(δc55.5)(其分别被分配为c-10和c-9)另外的hmbc关联。h-5(δh1.24)与δh1.73和1.94之间的cosy关联随后允许分配h-6质子,其转而显示出与分配为c-7的δh1.49和1.56的质子的关联。随后从hsqc-dept数据测定了针对c-6(δc24.4)和c-7(δc44.2)的13c化学位移。h-9(δh1.09)与δh1.66和1.70的质子之间的cosy关联允许分配h-11质子,其转而显示出与分配为h-12质子的δh1.60和2.00的质子的cosy关联。随后将hsqc-dept数据用于分配c-11(δc22.6)和c-12(δc39.9)。在δh4.98和5.16观察到的烯烃质子显示出与c-13(δc90.9)的hmbc关联并被分配为c-17(经由hsqc-dept,δc107.0)。烯烃质子h-17显示出与分配为c-15的δc49.4的碳的hmbc关联。来自h-9与δc46.9的亚甲基碳的另外的hmbc关联随后允许c-14的分配。使用hsqc-dept数据分配了c-14(δh1.53和2.21)和c-15(δh2.15和2.18)的1h化学位移。以下提供了用于分配糖苷配基区域的关键hmbc和cosy关联的概述:1h-13chsqc-dept数据的分析证实了六个异头质子的存在。三个异头质子在1hnmr谱中的δh5.65(δc95.5)、4.92(δc104.9)和4.50(δc105.7)处得到了充分的分辨。在δh4.85(δc98.4)、4.84(δc105.0)和4.83(δc105.3)观察到的剩余的三个异头质子被1h谱中的残余溶剂共振重叠了。在δh5.65观察到的异头质子显示出与c-19的hmbc关联,这表明了其对应于glci的异头质子。相似地,在δh4.85观察到异头质子显示出与c-13的hmbc关联,允许其被分配为glcii的异头质子。glci异头质子(δh5.65)显示出与分配为glcih-2的δh3.96的质子的cosy关联,glcih-2转而显示出与δh3.89(glcih-3)的质子的cosy关联,glcih-3显示出与δh3.71(glcih-4)的质子的cosy关联。由于数据重叠,cosy谱没有允许h-5或h-6质子的分配。因此,使用几个不同的混合时间,使用glci异头质子的选择性照射,进行了一系列的1d-tocsy实验。除了证实了针对glcih-2至h-4的分配,1d-tocsy数据显示出分配为glcih-5的δh3.73的质子和分配为glcih-6质子之一的δh4.15的质子。后一个质子也用于1d-tocsy实验。使用几个不同混合时间的h-6的选择性照射也证实了glcih-1至h-5的分配以及h-6(δh4.00)的剩余亚甲基质子。使用1h-13chsqc-dept数据确定了针对glcic-2(δc80.5)、c-3(δc79.0)、c-4(δc71.5)、c-5(δc79.0)和c-6(δc70.9)的13c化学位移的分配,以完成glci的分配。此外,1h-13chsqc-dept谱中δc70.9的亚甲基13c共振的存在表明了结构中glci的1→6糖键。两个未分配的葡萄糖部分基于hmbc关联被分配为glci的c-2和c-6的取代基。δh4.83观察到的异头质子显示出与glcic-2的hmbc关联并被分配为glcv的异头质子。δh4.50观察到的异头质子显示出与glcic-6的hmbc关联并被分配为glcvi的异头质子。还观察到了来自glcih-2与glcv的异头质子和来自glcih-6与glcvi的异头质子的相互hmbc关联。glcv的异头质子(δh4.83)显示出与分配为glcvh-2的δh3.32的质子的cosy关联。glcvh-2转而显示出与δh3.51(glcvh-3)的质子的cosy关联。这后一质子显示出与δh3.38(glcvh-4)的质子的其他关联。h-4也显示出与δh3.55(glcvh-5)的cosy关联,而glcvh-5转而显示出与glcvh-6质子(δh3.76和3.97)的cosy关联。使用hsqc-dept数据确定了针对glcvc-2(δc78.5)、c-3(δc78.7)、c-4(δc72.9)、c-5(δc78.8)和c-6(δc63.6)的13c化学位移的分配。来自glcvh-3与c-2和c-4以及还来自glcvh-4与c-3和c-6的hmbc关联证实了以上进行的分配,以完成glcv的分配。基于1h-13chsqc-dept和hmbc关联,将另一个葡萄糖部分分配为glci的c-6的取代基。hsqc-dept谱中δc70.9的glci的亚甲基13c共振的相对低场位移表明glci的1→6糖键。在δh4.50观察到的异头质子显示出与glcic-6的hmbc关联并且被分配为glcvi的异头质子。相似地,glci的亚甲基质子显示出与glcvi的异头碳的hmbc关联,并且这证实了glci与glcvi之间的1→6糖键的存在。glcvi异头质子显示出与分配为glcvih-2的δh3.33的质子的cosy关联,glcvih-2转而显示出与δh3.49的质子(glcvih-3)的cosy关联。由于数据重叠,cosy谱没有允许基于cosy关联分配glcvh-4至h-6。因此,使用几个不同的混合时间,使用glcvi异头质子的选择性照射,进行了一系列的1d-tocsy实验。除了证实了针对glcvih-2至h-3的分配,1d-tocsy数据显示了δh3.45(glcvih-4)和δh3.48(glcvih-5)的质子以及分配为glcvih-6质子的δh3.92和3.94的质子。使用1h-13chsqc-dept数据确定了针对glcvic-2(δc78.1)、c-3(δc78.6)、c-4(δc72.3)、c-5(δc78.8)和c-6(δc64.1)的13c化学位移的分配,以完成glcvi的分配。针对c-19的糖苷的1h和13c化学位移的概述显示于下表中:rebm2糖苷的hnmr(500mhz,d2o)和13cnmr(125mhz,d2o/tsp)分配*1h和13c值可以与下表的glciv-1交换。以下提供了用于分配c-19糖苷区域的关键hmbc、cosy和1d-tocsy关联的概述:rebm2糖苷的1hnmr(500mhz,d2o)和13cnmr(125mhz,d2o/tsp)分配以相似的方式进行了glcii的分配。glcii异头质子(δh4.85)显示了与分配为glciih-2的δh3.75的质子的cosy关联,glciih-2转而显示出与δh3.98的质子(glciih-3)的cosy关联。这后一质子显示出与δh3.54的质子(glciih-4)的其他关联。h-4还显示出与δh3.96的质子(glciih-5)的cosy关联。glciih-5还显示出与glciih-6质子(δh3.77和3.45)的cosy关联。使用hsqc-dept数据确定了针对glciic-2(δc81.7)、c-3(δc88.0)、c-4(δc71.3)、c-5(δc80.5)和c-6(δc63.6)的13c化学位移的分配。来自glciih-3与c-2和c-4以及还来自glciih-4与c-3和c-6的hmbc关联证实了以上进行的分配,以完成glcii的分配。剩余的两个未分配葡萄糖部分基于hmbc关联被分配为glcii的c-2和c-3的取代基。在δh4.92观察到的异头质子显示出与glciic-2的hmbc关联并且被分配为glciii的异头质子。在δh4.84观察到的异头质子显示出与glciic-3的hmbc关联并且被分配为glciv的异头质子。还观察到了glciih-2与glciii异头碳之间以及glciih-3与glciv的异头碳之间的相互hmbc关联。glciii的异头质子(δh4.92)显示出与分配为glciiih-2的δh3.32的质子的cosy关联。由于数据重叠,cosy谱没有允许h-3至h-6质子的分配。因此,使用几个不同的混合时间,使用glciii异头质子的选择性照射,进行了一系列的1d-tocsy实验。除了证实了针对glciiih-2的分配,1d-tocsy数据显示了δh3.51(glciiih-3)、δh3.26(glciiih-4)和δh3.44(glciiih-5)的质子。一旦使用1d-tocsy数据分配了h-4,将来自h-4与h-5并且转而与h-6的cosy关联用于分配h-6。在cosy谱中,glciiih-4显示出与glciiih-5的关联,glciiih-5转而显示出分别与δh3.94和3.75的glciiih-6a和glciiih-6b的cosy关联。使用1h-13chsqc-dept关联确定了针对glciiic-2(δc76.3)、c-3(δc78.8)、c-4(δc73.3)、c-5(δc78.8)和c-6(δc64.4)的13c化学位移,以完成glciii的分配。显示出与δh3.41的质子的cosy关联的glciv(δh4.84)的异头质子被分配为glcivh-2,其转而显示出与δh3.46的质子(glcivh-3)的cosy关联。这后一质子显示出与δh3.45的质子(glcivh-4)的其他关联,glcivh-4还显示出与δh3.75的质子(glcivh-5)的cosy关联。glcivh-5还显示出与glcivh-6质子(δh3.55和3.78)的cosy关联。使用hsqc-dept数据确定了针对glcivc-2(δc76.1)、c-3(δc78.8)、c4(δc72.5)、c-5(δc81.7)和c-6(δc65.8)的13c化学位移的分配。来自glcivh-3与c-4和c-5以及还来自glcivh-4与c-3和c-6的hmbc关联证实了以上进行的分配,以完成glciv的分配。针对c-13的糖苷的1h和13c化学位移的概述显示于下表中:rebm2糖苷的1hnmr(500mhz,d2o)和13cnmr(125mhz,d2o/tsp)分配以下提供了用于分配c-13糖苷区域的关键hmbc、cosy和1d-tocsy关联的概述:nmr和ms分析允许以下所示结构的全部分配。化合物的化学名称是13-[(2-o-β-d-吡喃葡糖基-3-o-β-d-吡喃葡糖基-β-d-吡喃葡糖基)氧]等效-16-贝壳杉烯-19-酸-[(2-o-β-d-吡喃葡糖基-6-o-β-d-吡喃葡糖基-β-d-吡喃葡糖基)酯](莱鲍迪苷m2或rebm2)。所述化合物是莱鲍迪苷m的异构体。实施例41ugt76g1用于将莱鲍迪苷d转化成莱鲍迪苷x的定向进化(第2轮)选择来自第一轮ugt76g1定向进化的最有活性克隆(参见实施例26含有突变q266e_p272a_r334k_g348p_l379g的ugt76g1var94)作为用于第2轮的基线克隆。建立了含有来自第一轮不同鉴定的正突变和通过dna2.0proteingpstm策略获得的新突变的53个突变列表。随后将这个突变列表用于设计各自含有3个不同突变的92个变体基因。针对在大肠杆菌中的表达密码子优化后,合成基因,在pet30a+质粒中亚克隆并用于大肠杆菌bl21(de3)化学感受态细胞的转化。在卡那霉素的存在下,将获得的细胞在皮氏培养皿的固体lb培养基上生长。选择合适的克隆并使其在试管中的液体lb培养基中生长。将作为冷冻保护剂的甘油加入悬浮液中并将400μl等份试样储存在-20℃和-80℃下。将这些含有pet30a+_utg76g1var质粒的大肠杆菌bl21(de3)的储存等份试样融化并且加入lbgkp培养基(20g/lluria肉汤lennox;50mmpipes缓冲液ph7.00;50mm磷酸盐缓冲液ph7.00;2.5g/l葡萄糖和50mg/l卡那霉素)中。使这个培养物在30℃下在96微量滴定平板中振荡8小时。用50μl上述培养物接种3.95ml含有60g/lovernightexpresstm已配制好的tb培养基10g/l甘油和50mg/l卡那霉素的生产培养基。在48深孔平板中,使所得到的培养物在20℃下搅拌。培养物获得了显著生长并且获得了良好的od(600nm)。44小时后,通过离心收集细胞并冷冻。通过将master混合物加入融化的细胞中来进行裂解,并通过离心收集裂解产物。用加入50mm磷酸盐缓冲液ph7.2中的莱鲍迪苷d(终浓度0.5mm)、mgcl2(终浓度3mm)和udp-葡萄糖(终浓度2.5mm)的溶液中的100μl新鲜裂解产物来进行活性测试。使反应在30℃下运行并且在2、4、7和24小时后取样,使用以上针对莱鲍迪苷d转化成莱鲍迪苷x所述的分析方法,通过hplc(cad检测)来测定转化和初始速率。平行地,用基线克隆第1轮-var94进行了实验。将针对这个基线克隆的22小时后的转化和初始速率限定为100%并且针对第2轮克隆的标准化转化和初始速率描绘于下表中:*突变如下注释:参照基因-初始氨基酸-位置-新氨基酸:例如,对于来自第一轮ugt76g1定向进化的变体94,位置33的丙氨酸突变成甘氨酸注释为round1-var94(a33g)。这些结果的建模允许获得每个突变的作用的分级。确定以下突变对于活性是有益的:s42a、f46i、i190l、s274g、i295m、k303g、f314s、k316r、k393r、v394i、i407v、n409k、n409r、q425e、q432e、s447a、s456l。实施例42atsus的体内生产atsus>gi|79328294|ref|np_001031915.1|蔗糖合成酶1[拟南芥]manaermitrvhsqrerlnetlvsernevlallsrveakgkgilqqnqiiaefealpeqtrkkleggpffdllkstqeaivlppwvalavrprpgvweylrvnlhalvveelqpaeflhfkeelvdgvkngnftleldfepfnasiprptlhkyigngvdflnrhlsaklfhdkesllpllkflrlhshqgknlmlsekiqnlntlqhtlrkaeeylaelksetlyeefeakfeeiglergwgdnaervldmirllldlleapdpctletflgrvpmvfnvvilsphgyfaqdnvlgypdtggqvvyildqvraleiemlqrikqqglnikprililtrllpdavgttcgerlervydseycdilrvpfrtekgivrkwisrfevwpyletytedaavelskelngkpdliignysdgnlvasllahklgvtqctiahalektkypdsdiywkklddkyhfscqftadifamnhtdfiitstfqeiagsketvgqyeshtaftlpglyrvvhgidvfdpkfnivspgadmsiyfpyteekrrltkfhseieellysdvenkehlcvlkdkkkpilftmarldrvknlsglvewygkntrlrelanlvvvggdrrkeskdneekaemkkmydlieeyklngqfrwissqmdrvrngelyryicdtkgafvqpalyeafgltvveamtcglptfatckggpaeiivhgksgfhidpyhgdqaadtladfftkckedpshwdeiskgglqrieekytwqiysqrlltltgvygfwkhvsnldrlearrylemfyalkyrplaqavplaqdd将atsus的合成基因针对大肠杆菌中的表达密码子优化并使用ndei和xhoi限制位点在pet30a+质粒中亚克隆。将含有atsus的pet30a+载体用于转化电感受态大肠杆菌b121(de3)细胞。在卡那霉素的存在下,将获得的细胞生长于皮氏培养皿中,并选择合适的克隆,使其在液体lb培养基中生长(锥形烧瓶)。将作为冷冻保护剂的甘油加入悬浮液中并将400μl等份试样储存在-20℃和-80℃下将含有pet30a+_atsus质粒的大肠杆菌bl21(de3)的储存等份试样融化并且加入30mllbgkp培养基(20g/lluria肉汤lennox;50mmpipes缓冲液ph7.00;50mm磷酸盐缓冲液ph7.00;2.5g/l葡萄糖和50mg/l卡那霉素)。使这个培养物在135rpm和30℃下振荡8小时。生产培养基含有60g/l过夜表达已配制好的tb培养基(novagen)、10g/l甘油和50mg/l卡那霉素。将预培养物加入800ml这个培养基中,并且使溶液在20℃下搅拌,同时取样来测量od和ph。培养物获得了良好的生长并获得了良好的od。40h后,通过离心收集细胞并冷冻,以获得30.1g的细胞湿重。用1.0ml的50mmtris缓冲液ph7.5中的200mg细胞的细胞悬浮液,通过fastprep(mpbiomedicals,裂解基质b,速度6.0,3×40秒钟)进行了裂解。通过离心收集裂解产物并新鲜使用。实施例43使用ugtsl2、ugt76g1-r1-f12和atsus,用原位制备的udp-葡萄糖,将莱鲍迪苷a转化成莱鲍迪苷x使用磷酸钾缓冲液(50mm终浓度,ph7.5)中的100mm蔗糖、3mm的mgcl2、0.25mmudp和0.5mm莱鲍迪苷a,以1ml规模进行了反应。通过添加15μlugtsl2(参见实施例27)裂解产物(2u/ml)、150μlugt76g1var94(参见实施例26)(2.5u/ml)和15μlatsus(参见实施例42)(400u/ml),来启动反应。用10μl2nh2so4和115μl60%甲醇骤冷125μl样品后,反应接着是hplc。21小时反应时间后,获得了68%莱鲍迪苷x和26%莱鲍迪苷m2,如图66中所示。实施例44ugt76g1用于将莱鲍迪苷d转化成莱鲍迪苷x的定向进化(第3轮)选择来自第二轮的ugt76g1定向进化的最有活性克隆(参见实施例41含有突变s42a_f46i_i407v的第2轮_ugt76g1var66)作为用于第3轮的基线克隆。建立了含有从第二轮不同鉴定的正突变和通过dna2.0proteingpstm策略获得的30个新突变的56个突变列表。将这个突变列表随后用于设计各自含有3或4个不同突变的92个变体基因。针对在大肠杆菌中的表达密码子优化后,合成基因,在pet30a+质粒中亚克隆并用于大肠杆菌bl21(de3)化学感受态细胞的转化。在卡那霉素的存在下,将获得的细胞在皮氏培养皿的固体lb培养基上生长。选择合适的克隆并使其在试管中的液体lb培养基中生长。将作为冷冻保护剂的甘油加入悬浮液中并将400μl等份试样储存在-20℃和-80℃下。将这些含有pet30a+_ugt76g1var质粒的大肠杆菌bl21(de3)的储存等份试样融化并且加入lbgkp培养基(20g/lluria肉汤lennox;50mmpipes缓冲液ph7.00;50mm磷酸盐缓冲液ph7.00;2.5g/l葡萄糖和50mg/l卡那霉素)中。使这个培养物在30℃下在96微量滴定平板中振荡8小时。用50μl上述培养物接种3.95ml含有60g/lovernightexpresstm已配制好的tb培养基10g/l甘油和50mg/l卡那霉素的生产培养基。在48深孔平板中,使所得到的培养物在20℃下搅拌。培养物获得了显著生长并且获得了良好的od(600nm)。44小时后,通过离心收集细胞并冷冻。通过将master混合物加入融化的细胞中来进行裂解,并通过离心收集裂解产物。用加入50mm磷酸盐缓冲液ph7.2中的莱鲍迪苷d(终浓度0.5mm)、mgcl2(终浓度3mm)和udp-葡萄糖(终浓度2.5mm)的溶液中的100μl新鲜裂解产物来进行活性测试。使反应在30℃下运行并且在1、2、4、6和22小时后取样,使用以上针对莱鲍迪苷d转化成莱鲍迪苷x所述的分析方法,通过hplc(cad检测)来测定转化和初始速率。平行地,用基线克隆第2轮-var66进行了实验。将针对这个基线克隆的22小时后的转化和初始速率限定为100%并且针对第3轮克隆的标准化转化和初始速率描绘于下表中:*突变如下注释:参照基因-初始氨基酸-位置-新氨基酸:例如,对于来自第二轮ugt76g1定向进化的变体66,位置190的异亮氨酸突变成亮氨酸注释为第2轮-var66(i190l)。这些结果的建模允许获得每个突变的作用的分级。确定以下突变对于活性是有益的:i46l、i295m、s119a、s274g、k334r、f314s、k303g、k316r、k393r、i190l、q425e、q432e、n138g、v394i、f182l、v407i、a272p、v264c、e449d、a352g。实施例45ugtsl2用于将莱鲍迪苷a转化成莱鲍迪苷d的定向进化(第1轮)从天然酶ugtsl2(gi_460410132)开始,建立了含有从第一轮不同鉴定的正突变和通过dna2.0proteingpstm策略获得的新突变的60个突变列表。将这个突变列表随后用于设计各自含有3个不同突变的92个变体基因。针对在大肠杆菌中的表达密码子优化后,合成基因,在pet30a+质粒中亚克隆并用于大肠杆菌bl21(de3)化学感受态细胞的转化。在卡那霉素的存在下,将获得的细胞在皮氏培养皿的固体lb培养基上生长。选择合适的克隆并使其在试管中的液体lb培养基中生长。将作为冷冻保护剂的甘油加入悬浮液中并将400μl等份试样储存在-20℃和-80℃下。将这些含有pet30a+_ugtsl2var质粒的大肠杆菌bl21(de3)的储存等份试样融化并且加入lbgkp培养基(20g/lluria肉汤lennox;50mmpipes缓冲液ph7.00;50mm磷酸盐缓冲液ph7.00;2.5g/l葡萄糖和50mg/l卡那霉素)中。使这个培养物在30℃下在96微量滴定平板中振荡8小时。用50μl上述培养物接种3.95ml含有60g/lovernightexpresstm已配制好的tb培养基10g/l甘油和50mg/l卡那霉素的生产培养基。在48深孔平板中,使所得到的培养物在20℃下搅拌。培养物获得了显著生长并且获得了良好的od(600nm)。44小时后,通过离心收集细胞并冷冻。通过将master混合物加入融化的细胞中来进行裂解,并通过离心收集裂解产物。用加入50mm磷酸盐缓冲液ph7.2中的莱鲍迪苷d(终浓度0.5mm)、mgcl2(终浓度3mm)和udp-葡萄糖(终浓度2.5mm)的溶液中的100μl新鲜裂解产物来进行活性测试。使反应在30℃下运行并且在2、4、6和22小时后取样,使用以上针对莱鲍迪苷a转化成莱鲍迪苷d所述的分析方法,通过hplc(cad检测)来测定转化和初始速率。平行地,用基线克隆ugtsl2进行了实验。将针对这个基线克隆的初始速率限定为100%。作为克隆特异性的指示,在100%udp-葡萄糖转化下测定了莱鲍迪苷m2含量,并且在50%udp-葡萄糖转化下测定了莱鲍迪苷d2含量。其中将udp葡萄糖转化限定为:([rebd]/[reba]0)+([rebd2]/[reba]0)+2*([rebm2]/[reba]0)。下表中描述了100%udp-葡萄糖转化下的标准化初始速率、莱鲍迪苷m2含量和50%udp-葡萄糖转化下的莱鲍迪苷d2含量。*突变如下注释:参照基因-初始氨基酸-位置-新氨基酸:例如,对于ugtsl2,位置240的异亮氨酸突变成亮氨酸,注释为ugtsl2(i240l)这些结果的建模允许获得每个突变的作用的分级。确定以下突变对于活性是有益的:l276a、t392a、q27r、n278g、t329v、a341v、i333l、g387e、h247p、m354l、a285v、v270i、n325s、i240l、f253y、a285l、i352v。确定以下突变对于较低的莱鲍迪苷m2形成是有益的:q27r、n325s、g387e、i333l、h247p、t329i、r312l、t199s、e259g、s334t、i131v、a285l、i389l、l393v、v254l、n339s、i345l、t245r。实施例46使用ugt76g1将莱鲍迪苷a转化成莱鲍迪苷i使用ugt76g1-r1-f12(也称为ugt76g1var94)进行了反应(参见实施例26))。反应总体积为40ml,具有以下组成:50mm磷酸钠缓冲液ph7.5,3mmmgcl2,2.5mmudp-葡萄糖,0.5mm莱鲍迪苷a和4mlugt76g1-1-f12裂解产物(2.5u/ml)。在135rpm的轨道振荡器上在30℃下运行反应。为了取样,用10μl2nh2so4和115μl甲醇/水(7/3)骤冷125μl反应混合物。立即将样品离心并且在通过lc-ms分析前保持在10℃。使用了agilent1200系列hplc系统,其配备了双泵(g1312b)、自动取样机(g1367d)、恒温柱室(g1316b)、dad检测仪(c1315c),连接agilent6110amsd,并与“lc/msdchemstation”软件配合。仪器条件移动相梯度方案时间(分钟)a(%):甲酸0.1%b(%):乙腈076248.5762410.0712916.57030获得了图67a中显示的反应特征:42小时反应后,用20ml乙醇骤冷20ml的反应混合物并用于结构说明。以相似的方式,针对莱鲍迪苷a转化成莱鲍迪苷i,测试了ugt76g1定向进化第2轮(ugt76g1-r2-b9,以上鉴定为“第2轮-var66”,参见实施例41)和第3轮(ugt76g1-r3-g3,以上鉴定为“第3轮-var21”,参见实施例44)的最佳克隆以及天然ugt76g1(参见实施例26),并且测定了图67b中显示的活性。实施例47rebi的分离和表征粗反应样品。根据实施例46,用ugt76g1制备用于分离的批号cb-2977-198的样品。hplc分析。使用waters2695alliance系统进行了初步hplc分析,使用以下方法:phenomenexsynergihydro-rp,4.6×250mm,4μm(p/n00g-4375-e0);柱温:55℃;移动相a:水中0.0284%nh4oac和0.0116%醋酸;移动相b:乙腈(mecn);流速:1.0ml/分钟;注入体积:10μl。通过uv(210nm)和cad来检测。梯度:时间(分钟)%a%b0.0-8.5752510.0712916.5703018.5-24.5663426.5-29.0485231-373070387525通过hplc分离。使用watersatlantisdc18(30×100mm,5μm,p/n186001375)柱进行了纯化,使用80:20水/mecn的等度移动相条件。将流速保持在45ml/分钟并且注入载量为180mg。将检测仪波长设定在210nm。使用watersatlantisdc18(4.6×150mm,5μm,p/n186001342)柱,进行了级分的分析;移动相a:水;移动相b:mecn;流速:1ml/分钟;等度移动相条件:75:25a/b,持续30分钟。ms和ms/ms。用配备了电喷雾电离源的micro质谱仪的watersqt产生了ms和ms/ms。通过负esi分离了样品。用h2o:mecn(1:1)将样品稀释至0.25mg/ml的浓度并且经由流动注入引入,用于ms数据获取。将样品进一步稀释至0.01mg/ml,产生良好的s/n,以针对ms/ms调整,并通过直接输注来获取。将碰撞能量设定为60v,以获取ms/ms数据,其由于分子的性质,具有提高的碎片离子峰。nmr。通过将~1.0mg溶解于180μl吡啶-d5+tms中来制备样品,并且在brukeravance500mhz仪器上获取nmr数据,使用2.5mm反向探头或5mm宽频带探头。在rensselaerpolytechnicinstitute,分别使用其具有5mm冷冻探头的brukeravance600mhz和800mhz仪器,获取了13c和hmbcnmr数据。将1h和13cnmr谱参照tms共振(δh0.00ppm和δc0.0ppm)。使用批号cb-2977-198的半合成甜菊醇糖苷混合物,进行了rebi的分离。按照以上所述的,通过hplc分析了所述材料。在大约17min的停留时间(tr),观察到了rebi峰,如图28中所示。结果和讨论按照以上所述的,从反应粗制物分离了rebi峰,并显示于图29中。将分离的级分合并并冻干。如使用上述方法的lc-cad证实的,终产物的纯度为91%(图30)。提供了大约1mg的rebi,用于分光镜和光谱分析。质谱。通过灌输rebi的样品获取的esi-tof质谱显示出m/z1127.4741的[m-h]-(图31)。[m-h]-离子的质量与预期为rebi的分子式c50h79o28非常一致(计算为c50h79o28:1127.4758,误差:-1.5ppm)(图32)。ms数据证实了rebi具有分子式c50h80o28的1128道尔顿的名义质量。rebi的ms/ms谱(选择m/z1127.4的[m-h]-离子,用于分裂)表明了m/z803.5301的两个糖单体的丢失,然而使用30v碰撞能量没有显示出其他分裂(图33)。应用较高的碰撞能量时(60v)(图34),没有观察到亲本离子,但从m/z803.5301观察到m/z641.4488、479.3897和317.3023的三个糖单体的按序丢失。nmr光谱测定。进行了一系列包括1hnmr(图35-37)、13cnmr(图38-39)、1h-1hcosy(图40)、hsqc-dept(图41)、hmbc(图42-43)、noesy(图44-45)和1d-tocsy(图46-50)的nmr实验,以允许rebi的分配。在300k获取的rebi的1hnmr谱中(图35),异头质子之一被水共振完全遮掩。因此,在较低温度(292k)下获取了样品的1hnmr谱,以移出水共振,并且在该温度下,足以分辩异头质子(图36-37)。因此,在292k下获取了rebi的所有其他nmr数据。1d和2dnmr数据表明了糖苷的中心核是双萜。来自δh1.22的甲基质子与δc176.9的羰基的hmbc关联允许分配叔甲基基团之一(c-18)以及c-19并且提供了用于分配剩余的糖苷配基的起始点。来自甲基质子(h-18)与δc38.5、44.0和57.2的碳的其他hmbc关联允许c-3、c-4和c-5的分配。1h-13chsqc-dept数据的分析表明δc38.5的碳是亚甲基基团,而δc57.2的碳是次甲基,其分别被分配为c-3和c-5。剩下的δc44.0的碳,其在hsqc-dept谱中没有显示出关联,被分配为季碳,c-4。使用hsqc-dept数据来分配c-3(δh1.02和2.35)和c-5(δh1.03)的1h化学位移。h-3质子之一(δh1.02)和δh1.44的质子之间的cosy关联允许分配h-2质子中的一个,其转而显示出与分配为h-1的δh0.74的质子的关联。随后基于其他的cosy和hsqc-dept关联来分配针对c-1和c-2的剩余1h和13c化学位移并概括于下表中。1h和13cnmr(500和150mhz,吡啶-d5),莱鲍迪苷i糖苷配基的分配在δh1.26观察到的其他叔甲基单峰显示出与c-1和c-5的hmbc关联并且被分配为h-20。甲基质子显示出与季碳(δc39.8)和次甲基碳(δc54.1)(其分别被分配为c-10和c-9)另外的hmbc关联。h-5(δh1.03)与δh1.90和2.33之间的cosy关联随后允许分配h-6质子,其转而显示出与分配为h-7的δh1.29和1.31的质子的关联。随后从hsqc-dept数据测定了针对c-6(δc22.2)和c-7(δc41.7)的13c化学位移。h-9(δh0.88)与δh1.67和1.70的质子之间的cosy关联允许分配h-11质子,其转而显示出与分配为h-12质子的δh1.98和2.28的质子的cosy关联。随后将hsqc-dept数据用于分配c-11(δc20.5)和c-12(δc37.3)。在δh5.02和5.67观察到的烯烃质子显示出与δc86.7(c-13)的季碳的hmbc关联并被分配为h-17(经由hsqc-dept,δc104.8)。次甲基质子h-9显示出分别与分配为c-8、c-14和c-15的δc42.3、44.3和47.6的碳的hmbc关联。使用hsqc-dept数据分配了c-14(δh1.78和2.59)和c-15(δh2.04)的1h化学位移。来自h-9与c-11和h-12与c-9的其他hmbc关联进一步证实了以上进行的分配。从h-14与δc154.0的季碳观察到的hmbc关联允许c-16的分配,以完成中心核的分配。将noesy谱中观察到的关联用于分配中心双萜核的相对立体化学。在noesy谱中,在h-14和h-20之间观察到了noe关联,表明h-14和h-20位于环的同一面上。相似地,在h-9和h-5以及h-5和h-18之间观察到了noe关联。没有观察到h-9和h-14之间的noe关联。因此noesy数据表明h-5、h-9和h-18与h-14和h-20比较在环的相对面上,如下图中呈现的。这些数据因此表明在糖基化步骤过程中保留了中心核中的相对立体化学。针对rebi的1h-13chsqc-dept的分析证实了五个异头质子的存在。所有五个异头质子在292k下获取的谱中在δh6.14(δc95.3)、5.57(δc104.6)、5.38(δc104.7)、5.29(δc105.0)和5.06(δc98.0)都能分辨。另外,所有五个异头质子具有大的耦合(7.7hz-8.2hz),表明它们具有β-构造。在δh6.14观察到的异头质子显示出与c-19的hmbc关联,这表明了其对应于glci的异头质子。相似地,在δh5.06观察到的异头质子显示了与c-13的hmbc关联,允许其分配为glcii的异头质子。glci异头质子(δh6.14)显示出与分配为glcih-2的δh4.18的质子的cosy关联。由于数据重叠,cosy谱没有允许分配h-3或h-4。因此,使用几个不同的混合时间,使用glci异头质子的选择性照射,进行了一系列的1dtocsy实验(图46)。除了证实了针对glcih-2的分配,tocsy数据显示出分别分配为h-3、h-4和h-5的δh4.27、4.25和3.93的质子。在tocsy谱中δh4.37观察到的质子被分配为glcih-6质子之一。基于来自h-5与δh4.27的cosy关联,分配了δh4.27的其他h-6亚甲基质子。使用hsqc-dept数据分配了针对glcic-2(δc72.5)、c-3(δc89.4)、c-4(δc69.2)、c-5(δc78.2-78.8)和c-6(δc61.7)的13c化学位移。来自h-1与c-3和h-4与c-6的hmbc关联进一步证实了以上进行的分配,以完成glci的分配。在四个剩余未分配的葡萄糖部分中,基于hmbc关联,将一个分配为glci的c-3的取代基。在δh5.29观察到的异头质子显示出与glcic-3的hmbc关联并且被分配为glcv的异头质子。还观察到了来自glcih-3与glcv的异头碳的相互hmbc关联。下表显示了针对c-19的糖苷的1h和13c化学位移的概述:莱鲍迪苷ic-19糖苷的1h和13cnmr(500和150mhz,吡啶-d5)分配78.2-78.8范围中的五个碳共振(78.16、78.47、78.50、78.55和78.77),因此化学位移不能明确地分配。以下提供了用于分配c-19糖苷区的关键hmbc和cosy关联的概述。glcv的异头质子(δh5.29)显示出与分配为glcvh-2的δh4.04的质子的cosy关联。随后使用hsqc-dept数据来分配glcvc-2(δc75.3或75.5)。由于数据重叠,cosy谱没有允许分配剩余的质子。因此,使用几个不同的混合时间,使用glcv异头质子的选择性照射,进行了一系列的1dtocsy实验(图47)。除了证实了针对glcvh-2的分配,tocsy数据允许分配glcvh-3(δh4.27)、h-4(δh4.12)和h-5(δh4.05)。在tocsy谱中δh4.56观察到的质子被分配为glcvh-6质子之一。基于来自h-5与δh4.26的cosy关联,分配了δh4.26的其他h-6亚甲基质子。使用hsqc-dept数据分配了针对glcvc-3(δc78.2-78.6)、c-4(δc71.5或71.6)、c-5(δc78.5或78.6)和c-6(δc62.3或62.4)的13c化学位移,以完成glcv的分配。以相似的方式进行了glcii的分配。glcii异头质子(δh5.06)显示出与分配为glciih-2的δh4.34的质子的cosy关联,其转而显示出与δh4.20(glciih-3)的质子的cosy关联,glciih-3显示出与δh3.97(glciih-4)的质子的其他关联,glciih-4还显示出与δh3.80(glciih-5)的质子的cosy关联。h-5显示出与分配为h-6的δh4.18和4.49的质子的其他cosy关联。还使用几个不同的混合时间,使用glcii异头质子的选择性照射,进行了一系列的1dtocsy实验(图48)。tocsy数据证实了以上的质子分配。针对glciic-2(δc80.2)、c-3(δc87.5)、c-4(δc70.1)、c-5(δc77.6)和c-6(δc62.5)的13c化学位移的分配是基于hsqc-dept数据。来自glciih-3与c-2和c-4以及还来自glciih-4与c-3、c-5和c-6的hmbc关联证实了以上进行的分配,以完成glcii的分配。基于hmbc关联,将剩余的两个未分配的葡萄糖部分分配为glcii的c-2和c-3的取代基。在δh5.57观察到的异头质子显示出与glciic-2的hmbc关联并且被分配为glciii的异头质子。在δh5.38观察到的异头质子显示出与glciic-3的hmbc关联并且被分配为glciv的异头质子。还观察到了来自glciih-2与glciii的异头碳以及来自glciih-3与glciv的异头碳的相互hmbc关联。glciii的异头质子(δh5.57)显示出与分配为glciiih-2的δh4.21的质子的cosy关联。然后使用hsqc-dept数据来分配glciiic-2(δc76.3)。由于数据重叠,cosy谱没有允许分配剩余的质子。因此,使用几个不同的混合时间,使用glciii异头质子的选择性照射,进行了一系列的1dtocsy实验(图49)。除了证实了针对glciiih-2的分配,tocsy数据允许分配glciiih-3(δh4.27)、h-4(δh4.25)和h-5(δh3.94)。在tocsy谱中δh4.41和δh4.53观察到的质子被分配为glciiih-6质子。使用hsqc-dept数据分配了针对c-3(δc78.2-78.6)、c-4(δc72.1)、c-5(δc78.2-78.8)和c-6(δc63.1)的13c化学位移。来自h-5与δc63.1的碳的hmbc关联进一步证实了glciiic-6的分配,以完成glciii的分配。glciv的异头质子(δh5.38)显示出与分配为glcivh-2的δh4.01的质子的cosy关联。然后使用hsqc-dept数据来分配glcivc-2(δc75.3或75.5)。由于数据重叠,cosy谱没有允许分配剩余的质子。因此,使用几个不同的混合时间,使用glciv异头质子的选择性照射,进行了一系列的1dtocsy实验(图50)。除了证实了针对glcivh-2的分配,1dtocsy数据允许分配h-3(δh4.28)、h-4(δh4.11)、h-5(δh4.13)和h-6(δh4.25和4.58)。δh4.25的质子还显示出与δh4.58的cosy关联,证实了这些质子术语h-6。使用hsqc-dept数据分配了针对c-3(δc78.2-78.6)、c-4(δc72.1)、c-5(δc78.2-78.6)和c-6(δc62.3或62.4)的13c化学位移。来自h-4与c-6和h-5与c-1的hmbc关联进一步证实了glcivc-6的分配,以完成glciv的分配。以下显示了发现的针对c-13的糖苷的1h和13c化学位移的概述:莱鲍迪苷ic-13糖苷的1h和13cnmr(500和150mhz,吡啶-d5)分配78.2-78.8范围中的五个碳共振(78.16、78.47、78.50、78.55和78.77),因此化学位移不能明确地分配。以下提供了用于分配c-13糖苷区的关键hmbc和cosy关联的概述。莱鲍迪苷i,rebi的nmr和ms分析允许结构的全部分配,如以下所示。化合物的名称是13-[(2-o-β-d-吡喃葡糖基-3-o-β-d-吡喃葡糖基)-β-d-吡喃葡糖基)氧]等效-16-贝壳杉烯-19-酸[(3-o-β-d-吡喃葡糖基)-β-d-吡喃葡糖基)酯]。实施例48ugtsl2用于将莱鲍迪苷a转化成莱鲍迪苷d的定向进化(第2轮)取天然酶ugtsl2(gi_460410132)作为基线,建立了23个突变的列表,其含有来自第一轮的针对活性不同鉴定的正突变(实施例45)和通过dna2.0proteingpstm策略获得的新突变。将这个突变列表随后用于设计各自含有3个不同突变的46个变体基因。针对在大肠杆菌中的表达密码子优化后,合成基因,在pet30a+质粒中亚克隆并用于大肠杆菌bl21(de3)化学感受态细胞的转化。在卡那霉素的存在下,将获得的细胞在皮氏培养皿的固体lb培养基上生长。选择合适的克隆并使其在试管中的液体lb培养基中生长。将作为冷冻保护剂的甘油加入悬浮液中并将400μl等份试样储存在-20℃和-80℃下。将这些含有pet30a+_ugtsl2var质粒的大肠杆菌bl21(de3)的储存等份试样融化并且加入lbgkp培养基(20g/lluria肉汤lennox;50mmpipes缓冲液ph7.00;50mm磷酸盐缓冲液ph7.00;2.5g/l葡萄糖和50mg/l卡那霉素)中。使这个培养物在30℃下在96微量滴定平板中振荡8小时。用50μl上述培养物接种3.95ml含有60g/lovernightexpresstm已配制好的tb培养基10g/l甘油和50mg/l卡那霉素的生产培养基。在48深孔平板中,使所得到的培养物在20℃下搅拌。培养物获得了显著生长并且获得了良好的od(600nm)。44小时后,通过离心收集细胞并冷冻。通过将master混合物加入融化的细胞中来进行裂解,并通过离心收集裂解产物。为了测量变体将莱鲍迪苷a转化成莱鲍迪苷d的活性,将100μl新鲜裂解产物加入50mm磷酸盐缓冲液ph7.2中的莱鲍迪苷a(终浓度0.5mm)、mgcl2(终浓度3mm)和udp-葡萄糖(终浓度2.5mm)的溶液中。使反应在30℃下运行并且在2、4、6和22小时后取样,使用以上针对莱鲍迪苷a转化成莱鲍迪苷d所述的分析方法,在hplc分析(cad)后,测定初始速率。平行地,对于最有活性的克隆,将100μl新鲜裂解产物加入50mm磷酸盐缓冲液ph7.2中的莱鲍迪苷d(终浓度0.5mm)、mgcl2(终浓度3mm)和udp-葡萄糖(终浓度2.5mm)的溶液中。使反应在30℃下运行并且在2、4、6和22小时后取样,针对莱鲍迪苷d转化,在hplc分析(cad检测)后,测定初始速率。除了新变体,还使用基线克隆ugtsl2进行了两个实验。将针对这个基线克隆的莱鲍迪苷a或莱鲍迪苷d转化的初始速率限定为100%。将每个克隆的活性与基线克隆ugtsl2相比限定为标准化活性,而每个克隆的特异性表述为针对莱鲍迪苷a和莱鲍迪苷d转化的初始速率之间的比例。莱鲍迪苷a转化的标准化速率以及莱鲍迪苷a和莱鲍迪苷d转化的初始速率之间的比例描述于下表中。*突变如下注释:参照基因-初始氨基酸-位置-新氨基酸:例如,对于ugtsl2,位置240的异亮氨酸突变成亮氨酸注释为ugtsl2(i240l)。nd表示未测定。这些结果的建模允许获得每个突变的作用的分级。确定以下突变对于活性是有益的:n325s、g387e、a285v、i333l、v270i、q27r、n278g、l393v、s258t、a341v、h247p和t392a。确定以下突变对于提高莱鲍迪苷a和莱鲍迪苷d转化的初始速率之间的比例是有益的:v270i、t392a、t329v、l276a、l393v、a341v和s255c。实施例49β-葡糖苷酶用于将莱鲍迪苷m2转化成莱鲍迪苷d的用途针对莱鲍迪苷m2的水解,测试了不同的β-葡糖苷酶。靶是选择性地水解(1→6)糖苷键,以获得莱鲍迪苷d。所需的一般反应方案如下:首先,对参照底物4-硝基苯基-β-d-吡喃葡糖苷测试了选定的β-葡糖苷酶,以测定活性。基于测定的活性,将使用的酶量计算为莱鲍迪苷m2水解中使用的单位。测试的β-葡糖苷酶描述于下表中:*isolase(011410;nationalenzymecompany,usa);aromase(gly0151441;amanoenzyme,日本);柚皮苷酶(nah0550102;amanoenzyme,日本),来自里氏木霉(trichodermareesei)atcc26921的纤维素酶(sigmac2730);来自黑曲霉(aspergillusniger)的纤维二糖酶(sigmac6105);viscozymel(sigmav2010)测试条件如下:在含有15mm醋酸钠缓冲液(ph4.5)和1mm莱鲍迪苷m2的10ml总体积下,在30℃下进行了反应。通过添加酶启动反应。在0、0.5、1、1.5、2、2.5、3和3.3小时后,获取625μl的反应混合物样品并且用575μl80%甲醇和50μl2nh2so4的混合物骤冷。使用上述的分析方法,通过hplc分析(cad检测),分析了样品。使用不同β-葡糖苷酶的这些反应的反应特征显示于图68a-f中。可以推断橙皮苷酶和cwd催化了莱鲍迪苷d2和莱鲍迪苷a的形成,这分别表明了(1→2)键糖解和(1→6)键糖解。可以认为这些酶对于莱鲍迪苷m2的转化是非选择性的。isolase、纤维素酶tr和纤维二糖酶as对于莱鲍迪苷m2转化成莱鲍迪苷d((1→6)糖苷键的水解)具有明确的选择性,而aromase对于莱鲍迪苷m2的转化具有低的整体活性。实施例50在isolase、纤维素酶tr和纤维二糖酶as的存在下,莱鲍迪苷的稳定性为了评价isolase、纤维素tr和纤维二糖酶as对莱鲍迪苷m2的选择性,在以下条件下,测试了作为底物的莱鲍迪苷a、莱鲍迪苷d和莱鲍迪苷m:在含有15mm醋酸钠缓冲液(ph4.5)和1mm莱鲍迪苷a、莱鲍迪苷d或莱鲍迪苷m的10ml总体积下,在30℃下,将反应进行了超过24小时。通过添加酶启动了反应。在0、0.5、1、1.5、2、2.5、3和3.3小时后,获取625μl的反应混合物样品并且用575μl80%甲醇和50μl2nh2so4的混合物骤冷。通过hplc分析了样品。获得了图69a-c中显示的结果。可以观察到在isolase、纤维素tr和纤维二糖酶as的存在下,没有观察到莱鲍迪苷a、莱鲍迪苷d和莱鲍迪苷m的显著转化。实施例51用于将莱鲍迪苷a转化成莱鲍迪苷m的四种酶反应研究了将isolase、纤维素tr或纤维二糖酶as引入使用ugtsl2、ugt76g1-1r-f12和atsus的莱鲍迪苷a转化成莱鲍迪苷m的一罐反应中的影响。使用了以下反应条件:没有使用和使用添加的β-葡糖苷酶的实验的结果显示于图70a-d中。可以看到添加纤维二糖酶as阻断了反应并且纤维素酶tr的添加对反应特征没有影响。然而,将isolase加入反应混合物中对反应中形成的莱鲍迪苷m的质量具有积极作用。加入isolase时,观察到了差不多20%的增加。与没有添加β-葡糖苷酶的反应相比,将isolase加入反应中时,莱鲍迪苷m2含量大约低10%和莱鲍迪苷i含量大约低15%。通过优化反应参数和isolase的含量,可以实现rebm产量的进一步改善以及rebm2和rebi含量的降低。实施例52β-葡糖苷酶用于将莱鲍迪苷i转化成莱鲍迪苷a的用途对于将莱鲍迪苷i水解成莱鲍迪苷a,测试了三种β-葡糖苷酶。靶是选择性地水解(1→6)糖苷键,以获得莱鲍迪苷d。所需的一般反应方案如下:对参照底物4-硝基苯基-β-d-吡喃葡糖苷测试了选定的β-葡糖苷酶,以测定活性。基于测定的活性,将使用的酶量计算为莱鲍迪苷i水解中使用的单位。测试的β-葡糖苷酶描述于下表中:*isolase(011410;nationalenzymecompany,usa);来自里氏木霉(trichodermareesei)atcc26921的纤维素酶(sigmac2730);来自黑曲霉(aspergillusniger)的纤维二糖酶(sigmac6105)测试条件如下。在含有15mm醋酸钠缓冲液(ph4.5)和1mm莱鲍迪苷i的2ml总体积下,在30℃下进行了反应。通过添加酶启动反应。在0、1.5、2.5和18小时后,获取125μl的反应混合物样品并且用115μl80%甲醇和10μl2nh2so4的混合物骤冷。使用上述的分析方法,通过hplc分析(cad检测)分析了样品。使用莱鲍迪苷i的不同β-葡糖苷酶的反应特征描绘于图71中所示的图中。可以观察到所有三种测试的β-葡糖苷酶都转化了莱鲍迪苷i。唯一的产物是莱鲍迪苷a。实施例53ugtsl2用于将莱鲍迪苷a转化成莱鲍迪苷d的定向进化(第3轮)取天然酶ugtsl2(gi_460410132)作为基线,制备了在第2轮过程中鉴定了13个突变的列表(实施例48)和通过dna2.0proteingpstm策略获得的12个新突变的列表。将这个突变列表随后用于设计各自含有1至8个不同突变的46个变体基因。针对在大肠杆菌中的表达密码子优化后,合成基因,在pet30a+质粒中亚克隆并用于大肠杆菌bl21(de3)化学感受态细胞的转化。在卡那霉素的存在下,将获得的细胞在皮氏培养皿的固体lb培养基上生长。选择合适的克隆并使其在试管中的液体lb培养基中生长。将作为冷冻保护剂的甘油加入悬浮液中并将400μl等份试样储存在-20℃和-80℃下。将这些含有pet30a+_ugtsl2var质粒的大肠杆菌bl21(de3)的储存等份试样融化并且加入lbgkp培养基(20g/lluria肉汤lennox;50mmpipes缓冲液ph7.00;50mm磷酸盐缓冲液ph7.00;2.5g/l葡萄糖和50mg/l卡那霉素)中。使这个培养物在30℃下在96微量滴定平板中振荡8小时。用50μl上述培养物接种3.95ml含有60g/lovernightexpresstm已配制好的tb培养基10g/l甘油和50mg/l卡那霉素的生产培养基。在48深孔平板中,使所得到的培养物在20℃下搅拌。培养物获得了显著生长并且获得了良好的od(600nm)。44小时后,通过离心收集细胞并冷冻。通过将master混合物加入融化的细胞中来进行裂解,并通过离心收集裂解产物。为了测量变体将莱鲍迪苷a转化成莱鲍迪苷d的活性,将100μl新鲜裂解产物加入50mm磷酸盐缓冲液ph7.2中的莱鲍迪苷a(终浓度0.5mm)、mgcl2(终浓度3mm)和udp-葡萄糖(终浓度2.5mm)的溶液中。使反应在30℃下运行并且在2、4、6和22小时后取样,使用以上针对莱鲍迪苷a转化成莱鲍迪苷d所述的分析方法,在hplc分析(cad检测)后,测定初始速率。平行地,将100μl新鲜裂解产物加入50mm磷酸盐缓冲液ph7.2中的莱鲍迪苷d(终浓度0.5mm)、mgcl2(终浓度3mm)和udp-葡萄糖(终浓度2.5mm)的溶液中。使反应在30℃下运行并且在2、4、6和22小时后取样,在hplc分析(cad检测)后,针对莱鲍迪苷d转化,测定初始速率。除了用于这一轮的新变体,还使用基线克隆ugtsl2进行了两个实验。将针对这个基线克隆的莱鲍迪苷a或莱鲍迪苷d转化的初始速率限定为100%。将每个克隆的活性与基线克隆ugtsl2相比限定为标准化活性,而每个克隆的特异性表述为针对莱鲍迪苷a和莱鲍迪苷d转化的初始速率之间的比例。莱鲍迪苷a转化的标准化速率以及莱鲍迪苷a和莱鲍迪苷d转化的初始速率之间的比例描述于下表中。*突变如下注释:参照基因-初始氨基酸-位置-新氨基酸:例如,对于ugtsl2,位置240的异亮氨酸突变成亮氨酸注释为ugtsl2(i240l)。nd表示未测定。这些结果的建模允许获得每个突变的作用的分级。确定以下突变对于活性是有益的:n130g、h247p、f253y、v270i、l276a、a285i、a285v、k301e、a341v、t392a、k408r、i412l。确定以下突变对于提高莱鲍迪苷a和莱鲍迪苷d转化的初始速率之间的比例是有益的:i203l、s255c、i333l、a341v、h357y、l393v、k408r、i412l。实施例54莱鲍迪苷a至莱鲍迪苷m的一罐式、四种酶转化将10ml含有5.0mm莱鲍迪苷a、0.25mmudp、2mmmgcl2、100mm蔗糖、50mm磷酸钾缓冲液ph7.5、2.5u的ugtsl2-r3-d2(ugtsl2-第3轮-var12,参见实施例53)、25u的ugt76g1-r3-g3(ugt76g1-第3轮-var21,参见实施例44)、25u的atsus和5u的的反应混合物通过0.2μm滤器过滤至无菌烧瓶中。将所得到的反应混合物在30℃下温和振荡65小时。在无菌条件下以规律的间隔获取125μl的反应混合物样品并用10μl2nh2so4和765μl50%甲醇骤冷。离心后,通过hplc分析了200μl上清液。获得了图72a中所示的反应特征。48小时反应后的hplc分析显示于图72b中。实施例55莱鲍迪苷a至莱鲍迪苷m的一罐式、四种酶转化将10ml含有10.0mm莱鲍迪苷a、0.50mmudp、3mmmgcl2、100mm蔗糖、50mm磷酸钾缓冲液ph7.5、5.0u的ugtsl2-r3-d2(ugtsl2-第3轮-var12,参见实施例53)、50u的ugt76g1-r3-g3(ugt76g1-第3轮-var21,参见实施例44)、50u的atsus和10u的的反应混合物通过0.2μm滤器过滤至无菌烧瓶中。将所得到的反应混合物在30℃下温和振荡66小时。在无菌条件下以规律的间隔获取125μl的反应混合物样品并用10μl2nh2so4和765μl50%甲醇骤冷。离心后,通过hplc分析了200μl上清液。获得了图73a中所示的反应特征。48小时反应后的hplc分析显示于图73b中。实施例56莱鲍迪苷a至莱鲍迪苷m的一罐式、四种酶转化将50ml含有10.0mm莱鲍迪苷a、0.5mmudp、4mmmgcl2、100mm蔗糖、50mm磷酸钾缓冲液ph7.5、25u的ugtsl2-r3-d2(ugtsl2-第3轮-var12,参见实施例53)、250u的ugt76g1-r3-g3(ugt76g1-第3轮-var21,参见实施例44)、250u的atsus和50u的的反应混合物通过0.2μm滤器过滤至无菌烧瓶中。将所得到的反应混合物在35℃下温和振荡95小时。在无菌条件下以规律的间隔获取125μl的反应混合物样品并用10μl2nh2so4和765μl50%甲醇骤冷。离心后,通过hplc分析了200μl上清液。反应结束时,反应混合物变成了细悬液。悬浮液的过滤以及残余物和滤液的hplc分析表明滤液中的rebm含量为79%并且固体中的rebm含量为97%。获得了图74a中所示的反应特征。95小时后反应混合物的hplc显示于图74b中。实施例57莱鲍迪苷a至莱鲍迪苷m的一罐式、四种酶转化(6.5小时后添加ugt76g1和isolase)将含有莱鲍迪苷a、udp、mgcl2、蔗糖、磷酸钾缓冲液ph7.5、ugtsl2-r3-d2(ugtsl2-第3轮-var12,参见实施例53)和atsus通过0.2μm滤器过滤至无菌烧瓶中。将所得到的反应混合物在35℃下温和振荡6.5小时。加入ugt76g1-r3-g3(ugt76g1-第3轮-var21,参见实施例44)和将反应混合物通过0.2μm滤器过滤至无菌烧瓶中并在35℃下温和振荡89小时。反应混合物的终体积为50ml并且试剂和酶的终浓度如下:10.0mm莱鲍迪苷a、0.5mmudp、4mmmgcl2、100mm蔗糖、50mm磷酸钾缓冲液ph7.5、25u的ugtsl2-r3-d2、250u的ugt76g1-r3-g3、250u的atsus和50u的在无菌条件下以规律的间隔获取125μl的反应混合物样品并用10μl2nh2so4和765μl50%甲醇骤冷。离心后,通过hplc分析了200μl上清液。获得了图75a中所示的反应特征。95小时后反应混合物的hplc显示于图75b中。实施例58莱鲍迪苷a至莱鲍迪苷m的一罐式、四种酶转化(6.5小时后添加ugt76g1和isolase)将含有莱鲍迪苷a、udp、mgcl2、蔗糖、磷酸钾缓冲液ph7.5、ugtsl2-r3-d2(ugtsl2-第3轮-var12,参见实施例53)和atsus通过0.2μm滤器过滤至无菌烧瓶中。将所得到的反应混合物在35℃下温和振荡6.5小时。加入ugt76g1-r3-g3(ugt76g1-第3轮-var21,参见实施例44)和将反应混合物通过0.2μm滤器过滤至无菌烧瓶中并在35℃下温和振荡89小时。反应混合物的终体积为50ml并且试剂和酶的终浓度如下:10.0mm莱鲍迪苷a、0.5mmudp、4mmmgcl2、100mm蔗糖、50mm磷酸钾缓冲液ph7.5、25u的ugtsl2-r3-d2、250u的ugt76g1-r3-g3、250u的atsus和25u的在无菌条件下以规律的间隔获取125μl的反应混合物样品并用10μl2nh2so4和765μl50%甲醇骤冷。离心后,通过hplc分析了200μl上清液。反应结束时,反应混合物变成了细悬液。悬浮液的过滤以及残余物和滤液的hplc分析表明滤液中的rebm含量为81%并且固体中的rebm含量为98%获得了图76a中所示的反应特征。95小时后反应混合物的hplc显示于图76b中。实施例59ugtsl2用于将莱鲍迪苷a转化成莱鲍迪苷d的定向进化(第4轮)将来自第三轮(参见实施例53)的最有活性酶ugtsl2_第3轮-var45用作起始点。将来自第3轮的对于活性的五个最佳突变用于形成一组10个变体,其各自含有这些突变中的两个。对于在大肠杆菌中的表达密码子优化后,合成基因,在pet30a+质粒中亚克隆并用于大肠杆菌bl21(de3)化学感受态细胞的转化。在卡那霉素的存在下,将获得的细胞在皮氏培养皿的固体lb培养基上生长。选择合适的克隆并使其在试管中的液体lb培养基中生长。将作为冷冻保护剂的甘油加入悬浮液中并将400μl等份试样储存在-20℃和-80℃下。将这些含有pet30a+_ugtsl2var质粒的大肠杆菌bl21(de3)的储存等份试样融化并且加入lbgkp培养基(20g/lluria肉汤lennox;50mmpipes缓冲液ph7.00;50mm磷酸盐缓冲液ph7.00;2.5g/l葡萄糖和50mg/l卡那霉素)中。使这个培养物在30℃下在96微量滴定平板中振荡8小时。用50μl上述培养物接种3.95ml含有60g/lovernightexpresstm已配制好的tb培养基10g/l甘油和50mg/l卡那霉素的生产培养基。在48深孔平板中,使所得到的培养物在20℃下搅拌。培养物获得了显著生长并且获得了良好的od(600nm)。44小时后,通过离心收集细胞并冷冻。通过将master混合物加入融化的细胞中来进行裂解,并通过离心收集裂解产物。在活性测试前,用水将裂解产物稀释五倍。为了测量变体将莱鲍迪苷a转化成莱鲍迪苷d的活性,将100μl新鲜裂解产物加入50mm磷酸盐缓冲液ph7.2中的莱鲍迪苷a(终浓度0.5mm)、mgcl2(终浓度3mm)和udp-葡萄糖(终浓度2.5mm)的溶液中。使反应在30℃下运行并且在2、4、6和22小时后取样,使用以上针对莱鲍迪苷a转化成莱鲍迪苷d所述的分析方法,在hplc分析(cad检测)后,测定活性。通过测量在100%udp-glc转化下形成的莱鲍迪苷m2的量来测定每个克隆的选择性(限定为(2*[rebm2]+[rebd])/([reba]+[rebd]+[rebm2])。平行地,用基线克隆ugtsl2-第3轮-var45进行了实验。将针对这个基线克隆的初始速率限定为100%。针对第4轮克隆的相对初始速率以及在100%udp-glc转化下形成的莱鲍迪苷m2的含量描述于下表中:*突变如下注释:参照基因-初始氨基酸-位置-新氨基酸:例如,对于ugtsl2,位置240的异亮氨酸突变成亮氨酸注释为ugtsl2(i240l)。实施例60ugt76g1用于将莱鲍迪苷d转化成莱鲍迪苷x的定向进化(第4轮)选择来自第三轮的ugt76g1的定向进化(参见实施例44第3轮_ugt76g1var21,含有突变:i46l_k303g_k393r))的最有活性克隆作为用于第4轮的基线克隆。将来自第3轮的最佳鉴定的突变(s119a、274g、i295m、f314s和k334r)用于形成一组10个变体,其各自含有这些突变中的2个。对于在大肠杆菌中的表达密码子优化后,合成基因,在pet30a+质粒中亚克隆并用于大肠杆菌bl21(de3)化学感受态细胞的转化。在卡那霉素的存在下,将获得的细胞在皮氏培养皿的固体lb培养基上生长。选择合适的克隆并使其在试管中的液体lb培养基中生长。将作为冷冻保护剂的甘油加入悬浮液中并将400μl等份试样储存在-20℃和-80℃下。将这些含有pet30a+_utg76g1var质粒的大肠杆菌bl21(de3)的储存等份试样融化并且加入lbgkp培养基(20g/lluria肉汤lennox;50mmpipes缓冲液ph7.00;50mm磷酸盐缓冲液ph7.00;2.5g/l葡萄糖和50mg/l卡那霉素)中。使这个培养物在30℃下在96微量滴定平板中振荡8小时。用50μl上述培养物接种3.95ml含有60g/lovernightexpresstm已配制好的tb培养基10g/l甘油和50mg/l卡那霉素的生产培养基。在48深孔平板中,使所得到的培养物在20℃下搅拌。培养物获得了显著生长并且获得了良好的od(600nm)。44小时后,通过离心收集细胞并冷冻。通过将master混合物加入融化的细胞中来进行裂解,并通过离心收集裂解产物。将100μl新鲜裂解产物加入50mm磷酸盐缓冲液ph7.2中的莱鲍迪苷d(终浓度0.5mm)、mgcl2(终浓度3mm)和udp-葡萄糖(终浓度2.5mm)的溶液中,来进行活性测试。使反应在30℃下运行并且在1、2、4、6和22小时后取样,使用以上针对莱鲍迪苷d转化成莱鲍迪苷x所述的分析方法,通过hplc分析(cad检测),来测定转化和初始速率。平行地,用基线克隆第3轮-var21进行了实验。将针对这个基线克隆的22小时后的转化和初始速率限定为100%,并且针对第4轮克隆的标准化转化和初始速率描述于下表中:*突变如下注释:参照基因-初始氨基酸-位置-新氨基酸:例如,对于来自ugt76g1的第四轮定向进化的变体1,位置119的丝氨酸突变成丙氨酸,注释为第3轮-var21(s119a)。应当理解之前的描述和特定的实施方案已经完全公开、说明和提供了本发明的最佳方式及其原理,并且本领域技术人员可以进行改变和添加,而不脱离本发明的精神和范围,其只受所附权利要求的范围的限制。序列表<110>purecirclesdnbhd<120>高纯度甜菊醇糖苷<130>39227-52wo<160>13<170>patentinversion3.5<210>1<211>1397<212>dna<213>甜菊<400>1ccatggcccatatggaaaacaaaaccgaaaccaccgttcgtcgtcgtcgccgtattattc60tgtttccggttccgtttcagggtcatattaatccgattctgcagctggcaaatgtgctgt120atagcaaaggttttagcattaccatttttcataccaattttaacaaaccgaaaaccagca180attatccgcattttacctttcgctttattctggataatgatccgcaggatgaacgcatta240gcaatctgccgacacatggtccgctggcaggtatgcgtattccgattattaacgaacatg300gtgcagatgaactgcgtcgtgaactggaactgctgatgctggcaagcgaagaagatgaag360aagttagctgtctgattaccgatgcactgtggtattttgcacagagcgttgcagatagcc420tgaatctgcgtcgtctggttctgatgaccagcagcctgtttaactttcatgcacatgtta480gcctgccgcagtttgatgaactgggttatctggatccggatgataaaacccgtctggaag540aacaggcaagcggttttccgatgctgaaagtgaaagatatcaaaagcgcctatagcaatt600ggcagattctgaaagaaattctgggcaaaatgattaaacagaccaaagcaagcagcggtg660ttatttggaatagctttaaagaactggaagaaagcgaactggaaaccgtgattcgtgaaa720ttccggcaccgagctttctgattccgctgccgaaacatctgaccgcaagcagcagcagcc780tgctggatcatgatcgtaccgtttttcagtggctggatcagcagcctccgagcagcgttc840tgtatgttagctttggtagcaccagcgaagttgatgaaaaagattttctggaaattgccc900gtggtctggttgatagcaaacagagctttctgtgggttgttcgtccgggttttgttaaag960gtagcacctgggttgaaccgctgccggatggttttctgggtgaacgtggtcgtattgtta1020aatgggttccgcagcaagaagttctggcacacggcgcaattggtgcattttggacccata1080gcggttggaatagcaccctggaaagcgtttgtgaaggtgttccgatgatttttagcgatt1140ttggtctggatcagccgctgaatgcacgttatatgagtgatgttctgaaagtgggtgtgt1200atctggaaaatggttgggaacgtggtgaaattgcaaatgcaattcgtcgtgttatggtgg1260atgaagaaggtgaatatattcgtcagaatgcccgtgttctgaaacagaaagcagatgtta1320gcctgatgaaaggtggtagcagctatgaaagcctggaaagtctggttagctatattagca1380gcctgtaataactcgag1397<210>2<211>1442<212>dna<213>甜菊<400>2ccatggcacatatggcaaccagcgatagcattgttgatgatcgtaaacagctgcatgttg60caacctttccgtggctggcatttggtcatattctgccgtatctgcagctgagcaaactga120ttgcagaaaaaggtcataaagtgagctttctgagcaccacccgtaatattcagcgtctga180gcagccatattagtccgctgattaatgttgttcagctgaccctgcctcgtgttcaagaac240tgccggaagatgccgaagcaaccaccgatgttcatccggaagatattccgtatctgaaaa300aagcaagtgatggtctgcagccggaagttacccgttttctggaacagcatagtccggatt360ggatcatctatgattatacccattattggctgccgagcattgcagcaagcctgggtatta420gccgtgcacattttagcgttaccaccccgtgggcaattgcatatatgggtccgagcgcag480atgcaatgattaatggtagtgatggtcgtaccaccgttgaagatctgaccacccctccga540aatggtttccgtttccgaccaaagtttgttggcgtaaacatgatctggcacgtctggttc600cgtataaagcaccgggtattagtgatggttatcgtatgggtctggttctgaaaggtagcg660attgtctgctgagcaaatgctatcatgaatttggcacccagtggctgccgctgctggaaa720ccctgcatcaggttccggttgttccggtgggtctgctgcctccggaagttccgggtgatg780aaaaagatgaaacctgggttagcatcaaaaaatggctggatggtaaacagaaaggtagcg840tggtttatgttgcactgggtagcgaagttctggttagccagaccgaagttgttgaactgg900cactgggtctggaactgagcggtctgccgtttgtttgggcatatcgtaaaccgaaaggtc960cggcaaaaagcgatagcgttgaactgccggatggttttgttgaacgtacccgtgatcgtg1020gtctggtttggaccagctgggcacctcagctgcgtattctgagccatgaaagcgtttgtg1080gttttctgacccattgtggtagcggtagcattgtggaaggtctgatgtttggtcatccgc1140tgattatgctgccgatttttggtgatcagccgctgaatgcacgtctgctggaagataaac1200aggttggtattgaaattccgcgtaatgaagaagatggttgcctgaccaaagaaagcgttg1260cacgtagcctgcgtagcgttgttgttgaaaaagaaggcgaaatctataaagccaatgcac1320gtgaactgagcaaaatctataatgataccaaagtggaaaaagaatatgtgagccagttcg1380tggattatctggaaaaaaacacccgtgcagttgccattgatcacgaaagctaatgactcg1440ag1442<210>3<211>472<212>prt<213>水稻<400>3metaspaspalahisserserglnserproleuhisvalvalilephe151015protrpleualapheglyhisleuleuprocysleuaspleualaglu202530argleualaalaargglyhisargvalserphevalserthrproarg354045asnleualaargleuproprovalargprogluleualagluleuval505560aspleuvalalaleuproleuproargvalaspglyleuproaspgly65707580alaglualathrseraspvalpropheasplysphegluleuhisarg859095lysalapheaspglyleualaalapropheseralapheleuaspthr100105110alacysalaglyglylysargproasptrpvalleualaaspleumet115120125hishistrpvalalaleualaserglngluargglyvalprocysala130135140metileleuprocysseralaalavalvalalaserseralapropro145150155160thrgluserseralaaspglnargglualailevalargsermetgly165170175thralaalaproserpheglualalysargalathrgluglupheala180185190thrgluglyalaserglyvalserilemetthrargtyrserleuthr195200205leuglnargserlysleuvalalametargsercysprogluleuglu210215220proglyalaphethrileleuthrargphetyrglylysprovalval225230235240propheglyleuleuproproargproaspglyalaargglyvalser245250255lysasnglylyshisaspalailemetglntrpleuaspalaglnpro260265270alalysservalvaltyrvalalaleuglyserglualaprometser275280285alaaspleuleuarggluleualahisglyleuaspleualaglythr290295300argpheleutrpalametarglysproalaglyvalaspalaaspser305310315320valleuproalaglypheleuglyargthrglygluargglyleuval325330335thrthrargtrpalaproglnvalserileleualahisalaalaval340345350cysalapheleuthrhiscysglytrpglyservalvalgluglyleu355360365glnpheglyhisproleuilemetleuproileleuglyaspglngly370375380proasnalaargileleugluglyarglysleuglyvalalavalpro385390395400argasnaspgluaspglyserpheaspargglyglyvalalaglyala405410415valargalavalvalvalgluglugluglylysthrphephealaasn420425430alaarglysleuglngluilevalalaasparggluargglugluarg435440445cysileaspgluphevalglnhisleuthrsertrpasngluleulys450455460asnasnseraspglyglntyrpro465470<210>4<211>502<212>prt<213>糙伏毛燕麦<400>4metalavallysaspgluglnglnserproleuhisileleuleuphe151015propheleualaproglyhisleuileproilealaaspmetalaala202530leuphealaserargglyvalargcysthrileleuthrthrproval354045asnalaalaileileargseralavalaspargalaasnaspalaphe505560argglyseraspcysproalaileaspileservalvalprophepro65707580aspvalglyleuproproglyvalgluasnglyasnalaleuthrser859095proalaaspargleulysphepheglnalavalalagluleuargglu100105110propheaspargpheleualaaspasnhisproaspalavalvalser115120125aspserphephehistrpserthraspalaalaalagluhisglyval130135140proargleuglypheleuglysersermetphealaglysercysasn145150155160gluserthrleuhisasnasnproleugluthralaalaaspasppro165170175aspalaleuvalserleuproglyleuprohisargvalgluleuarg180185190argserglnmetmetaspprolyslysargproasphistrpalaleu195200205leugluservalasnalaalaaspglnlysserpheglygluvalphe210215220asnserphehisgluleugluproasptyrvalgluhistyrglnthr225230235240thrleuglyargargthrtrpleuvalglyprovalalaleualaser245250255lysaspmetalaglyargglyserthrseralaargserproaspala260265270aspsercysleuargtrpleuaspthrlysglnproglyservalval275280285tyrvalserpheglythrleuileargpheserproalagluleuhis290295300gluleualaargglyleuaspleuserglylysasnphevaltrpval305310315320leuglyargalaglyproaspserserglutrpmetproglnglyphe325330335alaaspleuilethrproargglyaspargglypheileilearggly340345350trpalaproglnmetleuileleuasnhisargalaleuglyglyphe355360365valthrhiscysglytrpasnserthrleugluservalseralagly370375380valprometvalthrtrpproargphealaaspglnpheglnasnglu385390395400lysleuilevalgluvalleulysvalglyvalserileglyalalys405410415asptyrglyserglyilegluasnhisaspvalileargglygluval420425430ilealagluserileglylysleumetglyserserglugluserasp435440445alaileglnarglysalalysaspleuglyalaglualaargserala450455460valgluasnglyglysersertyrasnaspvalglyargleumetasp465470475480gluleumetalaargargserservallysvalglygluaspileile485490495prothrasnaspglyleu500<210>5<211>470<212>prt<213>番茄<400>5metserprolysleuhislysgluleuphephehisserleutyrlys151015lysthrargserasnhisthrmetalathrleulysvalleumetphe202530propheleualatyrglyhisileserprotyrleuasnvalalalys354045lysleualaaspargglypheleuiletyrphecysserthrproile505560asnleulysserthrileglulysileproglulystyralaaspser65707580ilehisleuilegluleuhisleuprogluleuproglnleupropro859095histyrhisthrthrasnglyleuproproasnleuasnglnvalleu100105110glnlysalaleulysmetserlysproasnpheserlysileleugln115120125asnleulysproaspleuvaliletyraspileleuglnargtrpala130135140lyshisvalalaasngluglnasnileproalavallysleuleuthr145150155160serglyalaalavalphesertyrphepheasnvalleulyslyspro165170175glyvalgluphepropheproglyiletyrleuarglysileglugln180185190valargleuserglumetmetserlysserasplysglulysgluleu195200205gluaspaspaspaspaspaspaspleuleuvalaspglyasnmetgln210215220ilemetleumetserthrserargthrileglualalystyrileasp225230235240phecysthralaleuthrasntrplysvalvalprovalglypropro245250255valglnaspleuilethrasnaspvalaspaspmetgluleuileasp260265270trpleuglythrlysaspgluasnserthrvalphevalserphegly275280285serglutyrpheleuserlysgluaspmetglugluvalalapheala290295300leugluleuserasnvalasnpheiletrpvalalaargpheprolys305310315320glyglugluargasnleugluaspalaleuprolysglypheleuglu325330335argileglygluargglyargvalleuasplysphealaproglnpro340345350argileleuasnhisproserthrglyglypheileserhiscysgly355360365trpasnseralametgluserileasppheglyvalproileileala370375380metpromethisleuaspglnprometasnalaargleuilevalglu385390395400leuglyvalalavalgluilevalargaspaspaspglylysilehis405410415argglygluilealagluthrleulysglyvalilethrglylysthr420425430glyglulysleuargalalysvalargaspileserlysasnleulys435440445thrileargaspgluglumetaspalaalaalaglugluleuilegln450455460leucysargasnglyasn465470<210>6<211>464<212>prt<213>水稻<400>6methisvalvalmetleuprotrpleualapheglyhisileleupro151015phealagluphealalysargvalalaargglnglyhisargvalthr202530leupheserthrproargasnthrargargleuileaspvalpropro354045serleualaglyargileargvalvalaspileproleuproargval505560gluhisleuprogluhisalaglualathrileaspleuproserasn65707580aspleuargprotyrleuargargalatyraspglualapheserarg859095gluleuserargleuleuglngluthrglyproserargproasptrp100105110valleualaasptyralaalatyrtrpalaproalaalaalaserarg115120125hisglyvalprocysalapheleuserleupheglyalaalaalaleu130135140cysphepheglyproalagluthrleuglnglyargglyprotyrala145150155160lysthrgluproalahisleuthralavalproglutyrvalprophe165170175prothrthrvalalapheargglyasnglualaarggluleuphelys180185190proserleuileproaspgluserglyvalserglusertyrargphe195200205serglnserilegluglycysglnleuvalalavalargserasngln210215220gluphegluproglutrpleugluleuleuglygluleutyrglnlys225230235240provalileproileglymetpheproproproproproglnaspval245250255alaglyhisglugluthrleuargtrpleuaspargglngluproasn260265270servalvaltyralaalapheglysergluvallysleuthralaglu275280285glnleuglnargilealaleuglyleuglualasergluleuprophe290295300iletrpalapheargalaproproaspalaglyaspglyaspglyleu305310315320proglyglyphelysgluargvalasnglyargglyvalvalcysarg325330335glytrpvalproglnvallyspheleualahisalaservalglygly340345350pheleuthrhisalaglytrpasnserilealagluglyleualaasn355360365glyvalargleuvalleuleuproleumetphegluglnglyleuasn370375380alaargglnleualaglulyslysvalalavalgluvalalaargasp385390395400gluaspaspglyserphealaalaasnaspilevalaspalaleuarg405410415argvalmetvalglyglugluglyaspglupheglyvallysvallys420425430gluleualalysvalpheglyaspaspgluvalasnaspargtyrval435440445argasppheleulyscysleuserglutyrlysmetglnargglngly450455460<210>7<211>515<212>prt<213>琴叶拟南芥<400>7metaspasplyslysglugluvalmethisilealametpheprotrp151015leualametglyhisleuleupropheleuargleuserlysleuleu202530alaglnlysglyhislysileserpheileserthrproargasnile354045leuargleuprolysleuproserasnleuserserserilethrphe505560valserpheproleuproserileserglyleuproproserserglu65707580sersermetaspvalprotyrasnlysglnglnserleulysalaala859095pheaspleuleuglnproproleuthrglupheleuargleuserser100105110proasptrpileiletyrasptyralaserhistrpleuproserile115120125alalysgluleuglyileserlysalaphepheserleupheasnala130135140alathrleucysphemetglyproserserserleuileglugluser145150155160argserthrprogluaspphethrvalvalproprotrpvalprophe165170175lysserthrilevalpheargtyrhisgluvalserargtyrvalglu180185190lysthraspgluaspvalthrglyvalseraspservalargphegly195200205tyrthrileaspglyseraspalavalphevalargsercysproglu210215220phegluproglutrppheserleuleuglnaspleutyrarglyspro225230235240valpheproileglypheleuproprovalilegluaspaspaspasp245250255aspthrthrtrpvalargilelysglutrpleuasplysglnargval260265270asnservalvaltyrvalserleuglythrglualaserleuargarg275280285glugluleuthrgluleualaleuglyleuglulyssergluthrpro290295300phephetrpvalleuargasngluproglnileproaspglypheglu305310315320gluargvallysglyargglymetvalhisvalglytrpvalprogln325330335vallysileleuserhisgluservalglyglypheleuthrhiscys340345350glytrpasnservalvalgluglyileglypheglylysvalproile355360365pheleuprovalleuasngluglnglyleuasnthrargleuleugln370375380glylysglyleuglyvalgluvalleuargaspgluargaspglyser385390395400pheglyseraspservalalaaspservalargleuvalmetileasp405410415aspalaglyglugluileargglulysvallysleumetlysglyleu420425430pheglyasnmetaspgluasnileargtyrvalaspgluleuvalgly435440445phemetargasnaspgluserserglnleulysglugluglugluglu450455460aspaspcysseraspaspglnsersergluvalsersergluthrasp465470475480glulysgluleuasnleuaspleulysgluglulysargargileser485490495valtyrlysserleuserserglupheaspasptyrvalalaasnglu500505510lysmetgly515<210>8<211>772<212>prt<213>水稻<400>8methisvalvalilecysproleuleualapheglyhisleuleupro151015cysleuaspleualaglnargleualacysglyhisargvalserphe202530valserthrproargasnileserargleuproprovalargproser354045leualaproleuvalserphevalalaleuproleuproargvalglu505560glyleuproasnglyalagluserthrhisasnvalprohisasparg65707580proaspmetvalgluleuhisleuargalapheaspglyleualaala859095propheserglupheleuglythralacysalaasptrpvalmetpro100105110thrserseralaproargglnthrleuserserasnilehisargasn115120125serserargproglythrproalaproserglyargleuleucyspro130135140ilethrprohisserasnthrleugluargalaalaglulysleuval145150155160argserserargglnasnalaargalaargserleuleualaphethr165170175serproproleuprotyrargaspvalpheargserleuleuglyleu180185190glnmetglyarglysglnleuasnilealahisgluthrasnglyarg195200205argthrglythrleuproleuasnleucysargtrpmettrplysgln210215220argargcysglylysleuargproseraspvalglupheasnthrser225230235240argserasnglualaileserproileglyalaserleuvalasnleu245250255glnserileglnserproasnproargalavalleuproilealaser260265270serglyvalargalavalpheileglyargalaargthrserthrpro275280285thrproprohisalalysproalaargseralaalaproargalahis290295300argproproserservalmetaspserglytyrsersersertyrala305310315320alaalaalaglymethisvalvalilecysprotrpleualaphegly325330335hisleuleuprocysleuaspleualaglnargleualaserarggly340345350hisargvalserphevalserthrproargasnileserargleupro355360365provalargproalaleualaproleuvalalaphevalalaleupro370375380leuproargvalgluglyleuproaspglyalagluserthrasnasp385390395400valprohisaspargproaspmetvalgluleuhisargargalaphe405410415aspglyleualaalapropheserglupheleuglythralacysala420425430asptrpvalilevalaspvalphehishistrpalaalaalaalaala435440445leugluhislysvalprocysalametmetleuleuglyseralahis450455460metilealaserilealaaspargargleugluargalagluthrglu465470475480serproalaalaalaglyglnglyargproalaalaalaprothrphe485490495gluvalalaargmetlysleuileargthrlysglyserserglymet500505510serleualagluargpheserleuthrleuserargserserleuval515520525valglyargsercysvalgluphegluprogluthrvalproleuleu530535540serthrleuargglylysproilethrpheleuglyleumetpropro545550555560leuhisgluglyargarggluaspglygluaspalathrvalargtrp565570575leuaspalaglnproalalysservalvaltyrvalalaleuglyser580585590gluvalproleuglyvalglulysvalhisgluleualaleuglyleu595600605gluleualaglythrargpheleutrpalaleuarglysprothrgly610615620valseraspalaaspleuleuproalaglypheglugluargthrarg625630635640glyargglyvalvalalathrargtrpvalproglnmetserileleu645650655alahisalaalavalglyalapheleuthrhiscysglytrpasnser660665670thrilegluglyleumetpheglyhisproleuilemetleuproile675680685pheglyaspglnglyproasnalaargleuileglualalysasnala690695700glyleuglnvalalaargasnaspglyaspglyserpheaspargglu705710715720glyvalalaalaalaileargalavalalavalgluglugluserser725730735lysvalpheglnalalysalalyslysleuglngluilevalalaasp740745750metalacyshisgluargtyrileaspglypheileglnglnleuarg755760765sertyrlysasp770<210>9<211>442<212>prt<213>番茄<400>9metalathrasnleuargvalleumetpheprotrpleualatyrgly151015hisileserpropheleuasnilealalysglnleualaasparggly202530pheleuiletyrleucysserthrargileasnleugluserileile354045lyslysileproglulystyralaaspserilehisleuilegluleu505560glnleuprogluleuprogluleuproprohistyrhisthrthrasn65707580glyleuproprohisleuasnprothrleuhislysalaleulysmet859095serlysproasnpheserargileleuglnasnleulysproaspleu100105110leuiletyraspvalleuglnprotrpalagluhisvalalaasnglu115120125glnasnileproalaglylysleuleuthrsercysalaalavalphe130135140sertyrphepheserphearglysasnproglyvalglupheprophe145150155160proalailehisleuprogluvalglulysvallysilearggluile165170175leualalysgluproglugluglyglyargleuaspgluglyasnlys180185190glnmetmetleumetcysthrserargthrileglualalystyrile195200205asptyrcysthrgluleucysasntrplysvalvalprovalglypro210215220propheglnaspleuilethrasnaspalaaspasnlysgluleuile225230235240asptrpleuglythrlyshisgluasnserthrvalphevalserphe245250255glyserglutyrpheleuserlysgluaspmetglugluvalalaphe260265270alaleugluleuserasnvalasnpheiletrpvalalaargphepro275280285lysglyglugluargasnleugluaspalaleuprolysglypheleu290295300gluargileglygluargglyargvalleuasplysphealaprogln305310315320proargileleuasnhisproserthrglyglypheileserhiscys325330335glytrpasnseralametgluserileasppheglyvalproileile340345350alametproilehisasnaspglnproileasnalalysleumetval355360365gluleuglyvalalavalgluilevalargaspaspaspglylysile370375380hisargglygluilealagluthrleulysservalvalthrglyglu385390395400thrglygluileleuargalalysvalarggluileserlysasnleu405410415lysserileargaspgluglumetaspalavalalaglugluleuile420425430glnleucysargasnserasnlysserlys435440<210>10<211>454<212>prt<213>大肠杆菌<400>10metglythrgluvalthrvalhislysasnthrleuargvalleumet151015pheprotrpleualatyrglyhisileserpropheleuasnvalala202530lyslysleuvalaspargglypheleuiletyrleucysserthrala354045ileasnleulysserthrilelyslysileproglulystyrserasp505560serileglnleuilegluleuhisleuprogluleuprogluleupro65707580prohistyrhisthrthrasnglyleuproprohisleuasnhisthr859095leuglnlysalaleulysmetserlysproasnpheserlysileleu100105110glnasnleulysproaspleuvaliletyraspleuleuglnglntrp115120125alagluglyvalalaasngluglnasnileproalavallysleuleu130135140thrserglyalaalavalleusertyrphepheasnleuvallyslys145150155160proglyvalgluphepropheproalailetyrleuarglysasnglu165170175leuglulysmetsergluleuleualaglnseralalysasplysglu180185190proaspglyvalaspprophealaaspglyasnmetglnvalmetleu195200205metserthrserargileileglualalystyrileasptyrpheser210215220glyleuserasntrplysvalvalprovalglyproprovalglnasp225230235240proilealaaspaspalaaspglumetgluleuileasptrpleugly245250255lyslysaspgluasnserthrvalphevalserpheglyserglutyr260265270pheleuserlysgluaspargglugluilealapheglyleugluleu275280285serasnvalasnpheiletrpvalalaargpheprolysglygluglu290295300glnasnleugluaspalaleuprolysglypheleugluargilegly305310315320aspargglyargvalleuasplysphealaproglnproargileleu325330335asnhisproserthrglyglypheileserhiscysglytrpasnser340345350valmetgluservalasppheglyvalproileilealametproile355360365hisleuaspglnprometasnalaargleuilevalgluleuglyval370375380alavalgluilevalargaspasptyrglylysilehisarggluglu385390395400ilealagluileleulysaspvalilealaglylysserglygluasn405410415leulysalalysmetargaspileserlysasnleulysserilearg420425430aspgluglumetaspthralaalaglugluleuileglnleucyslys435440445asnserprolysleulys450<210>11<211>458<212>prt<213>甜菊<400>11metgluasnlysthrgluthrthrvalargargargargargileile151015leupheprovalpropheglnglyhisileasnproileleuglnleu202530alaasnvalleutyrserlysglypheserilethrilephehisthr354045asnpheasnlysprolysthrserasntyrprohisphethrphearg505560pheileleuaspasnaspproglnaspgluargileserasnleupro65707580thrhisglyproleualaglymetargileproileileasngluhis859095glyalaaspgluleuargarggluleugluleuleumetleualaser100105110glugluaspglugluvalsercysleuilethraspalaleutrptyr115120125phealaglnservalalaaspserleuasnleuargargleuvalleu130135140metthrserserleupheasnphehisalahisvalserleuprogln145150155160pheaspgluleuglytyrleuaspproaspasplysthrargleuglu165170175gluglnalaserglypheprometleulysvallysaspilelysser180185190alatyrserasntrpglnileleulysgluileleuglylysmetile195200205lysglnthrlysalaserserglyvaliletrpasnserphelysglu210215220leugluglusergluleugluthrvalilearggluileproalapro225230235240serpheleuileproleuprolyshisleuthralaserserserser245250255leuleuasphisaspargthrvalpheglntrpleuaspglnglnpro260265270proserservalleutyrvalserpheglyserthrsergluvalasp275280285glulysasppheleugluilealaargglyleuvalaspserlysgln290295300serpheleutrpvalvalargproglyphevallysglyserthrtrp305310315320valgluproleuproaspglypheleuglygluargglyargileval325330335lystrpvalproglnglngluvalleualahisglyalaileglyala340345350phetrpthrhisserglytrpasnserthrleugluservalcysglu355360365glyvalprometilepheserasppheglyleuaspglnproleuasn370375380alaargtyrmetseraspvalleulysvalglyvaltyrleugluasn385390395400glytrpgluargglygluilealaasnalaileargargvalmetval405410415aspglugluglyglutyrileargglnasnalaargvalleulysgln420425430lysalaaspvalserleumetlysglyglysersertyrgluserleu435440445gluserleuvalsertyrileserserleu450455<210>12<211>470<212>prt<213>番茄<400>12metserprolysleuhislysgluleuphephehisserleutyrlys151015lysthrargserasnhisthrmetalathrleulysvalleumetphe202530propheleualatyrglyhisileserprotyrleuasnvalalalys354045lysleualaaspargglypheleuiletyrphecysserthrproile505560asnleulysserthrileglulysileproglulystyralaaspser65707580ilehisleuilegluleuhisleuprogluleuproglnleupropro859095histyrhisthrthrasnglyleuproproasnleuasnglnvalleu100105110glnlysalaleulysmetserlysproasnpheserlysileleugln115120125asnleulysproaspleuvaliletyraspileleuglnargtrpala130135140lyshisvalalaasngluglnasnileproalavallysleuleuthr145150155160serglyalaalavalphesertyrphepheasnvalleulyslyspro165170175glyvalgluphepropheproglyiletyrleuarglysileglugln180185190valargleuserglumetmetserlysserasplysglulysgluleu195200205gluaspaspaspaspaspaspaspleuleuvalaspglyasnmetgln210215220ilemetleumetserthrserargthrileglualalystyrileasp225230235240phecysthralaleuthrasntrplysvalvalprovalglypropro245250255valglnaspleuilethrasnaspvalaspaspmetgluleuileasp260265270trpleuglythrlysaspgluasnserthrvalphevalserphegly275280285serglutyrpheleuserlysgluaspmetglugluvalalapheala290295300leugluleuserasnvalasnpheiletrpvalalaargpheprolys305310315320glyglugluargasnleugluaspalaleuprolysglypheleuglu325330335argileglygluargglyargvalleuasplysphealaproglnpro340345350argileleuasnhisproserthrglyglypheileserhiscysgly355360365trpasnseralametgluserileasppheglyvalproileileala370375380metpromethisleuaspglnprometasnalaargleuilevalglu385390395400leuglyvalalavalgluilevalargaspaspaspglylysilehis405410415argglygluilealagluthrleulysglyvalilethrglylysthr420425430glyglulysleuargalalysvalargaspileserlysasnleulys435440445thrileargaspgluglumetaspalaalaalaglugluleuilegln450455460leucysargasnglyasn465470<210>13<211>808<212>prt<213>拟南芥<400>13metalaasnalagluargmetilethrargvalhisserglnargglu151015argleuasngluthrleuvalsergluargasngluvalleualaleu202530leuserargvalglualalysglylysglyileleuglnglnasngln354045ileilealaglupheglualaleuprogluglnthrarglyslysleu505560gluglyglyprophepheaspleuleulysserthrglnglualaile65707580valleuproprotrpvalalaleualavalargproargproglyval859095trpglutyrleuargvalasnleuhisalaleuvalvalglugluleu100105110glnproalaglupheleuhisphelysglugluleuvalaspglyval115120125lysasnglyasnphethrleugluleuasppheglupropheasnala130135140serileproargprothrleuhislystyrileglyasnglyvalasp145150155160pheleuasnarghisleuseralalysleuphehisasplysgluser165170175leuleuproleuleulyspheleuargleuhisserhisglnglylys180185190asnleumetleuserglulysileglnasnleuasnthrleuglnhis195200205thrleuarglysalagluglutyrleualagluleulyssergluthr210215220leutyrgluglupheglualalyspheglugluileglyleugluarg225230235240glytrpglyaspasnalagluargvalleuaspmetileargleuleu245250255leuaspleuleuglualaproaspprocysthrleugluthrpheleu260265270glyargvalprometvalpheasnvalvalileleuserprohisgly275280285tyrphealaglnaspasnvalleuglytyrproaspthrglyglygln290295300valvaltyrileleuaspglnvalargalaleugluileglumetleu305310315320glnargilelysglnglnglyleuasnilelysproargileleuile325330335leuthrargleuleuproaspalavalglythrthrcysglygluarg340345350leugluargvaltyraspserglutyrcysaspileleuargvalpro355360365pheargthrglulysglyilevalarglystrpileserargpheglu370375380valtrpprotyrleugluthrtyrthrgluaspalaalavalgluleu385390395400serlysgluleuasnglylysproaspleuileileglyasntyrser405410415aspglyasnleuvalalaserleuleualahislysleuglyvalthr420425430glncysthrilealahisalaleuglulysthrlystyrproaspser435440445aspiletyrtrplyslysleuaspasplystyrhisphesercysgln450455460phethralaaspilephealametasnhisthrasppheileilethr465470475480serthrpheglngluilealaglyserlysgluthrvalglyglntyr485490495gluserhisthralaphethrleuproglyleutyrargvalvalhis500505510glyileaspvalpheaspprolyspheasnilevalserproglyala515520525aspmetseriletyrpheprotyrthrgluglulysargargleuthr530535540lysphehissergluileglugluleuleutyrseraspvalgluasn545550555560lysgluhisleucysvalleulysasplyslyslysproileleuphe565570575thrmetalaargleuaspargvallysasnleuserglyleuvalglu580585590trptyrglylysasnthrargleuarggluleualaasnleuvalval595600605valglyglyaspargarglysgluserlysaspasngluglulysala610615620glumetlyslysmettyraspleuilegluglutyrlysleuasngly625630635640glnpheargtrpileserserglnmetaspargvalargasnglyglu645650655leutyrargtyrilecysaspthrlysglyalaphevalglnproala660665670leutyrglualapheglyleuthrvalvalglualametthrcysgly675680685leuprothrphealathrcyslysglyglyproalagluileileval690695700hisglylysserglyphehisileaspprotyrhisglyaspglnala705710715720alaaspthrleualaaspphephethrlyscyslysgluaspproser725730735histrpaspgluileserlysglyglyleuglnargilegluglulys740745750tyrthrtrpglniletyrserglnargleuleuthrleuthrglyval755760765tyrglyphetrplyshisvalserasnleuaspargleuglualaarg770775780argtyrleuglumetphetyralaleulystyrargproleualagln785790795800alavalproleualaglnaspasp805当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1