使用埃氏巨型球菌生产青贮的植物材料的方法与流程
发明背景
发明领域
本发明涉及使用厌氧细菌埃氏巨型球菌(megasphaeraelsdenii)生产青贮的植物材料的方法。本发明还涉及通过该方法生产的青贮的植物材料。
背景
青贮是用于储存由动物例如牲畜所消耗的植物材料(例如,饲料/或谷物)的发酵过程。通过青贮过程生产的储存植物材料被称为青贮的植物材料。青贮的植物材料的实例包括但不限于青贮的饲料(也称为青贮饲料),青贮的谷物(也称为发酵的谷物)以及青贮的饲料和谷物的组合。
通常,收集植物材料并将其密封在料仓中,所述料仓是可以维持厌氧环境的任何容器。最初,料仓中夹带的大气氧通过植物材料和需氧微生物的呼吸活动而减少。当料仓中的条件变为厌氧状态时,发酵开始。这可以通过包括压紧植物材料和防止空气进入料仓的方法来辅助。
通过与存在于植物材料上的乳酸菌相关的乳酸发酵,可以抑制在青贮过程中诸如梭菌、肠杆菌和酵母的不良微生物的生长。在有利的青贮条件下,乳酸菌会酸化植物材料并阻止不良微生物的竞争性生长。但是,如果在青贮过程中未成功控制ph,则不良微生物会增殖并降解氨基酸,产生营养价值较低的青贮的植物材料。另外,在打开料仓暴露在空气中后,会发生青贮的植物材料的进一步降解。
因此,需要改善的生产青贮的植物材料的方法。
发明概述
本公开内容涉及生产具有改善的有氧稳定性的青贮的植物材料的方法,包括:(a)将有效量的埃氏巨型球菌细胞施加到植物材料,和(b)使植物材料青贮以生产青贮的植物材料,其中与在不存在埃氏巨型球菌细胞的情况下生产的对照青贮的植物材料相比,该青贮的植物材料包含改善的有氧稳定性。
在某些实施方案中,改善的有氧稳定性包括降低的ph。
本公开内容涉及生产增加量的青贮的植物材料的方法,包括:(a)将有效量的埃氏巨型球菌细胞施加到植物材料,和(b)使植物材料青贮以生产青贮的植物材料,其中与在不存在埃氏巨型球菌细胞的情况下所产生的对照青贮的植物材料的量相比,所产生的青贮的植物材料的量增加。
本公开内容涉及生产青贮的植物材料的方法,包括:(a)将埃氏巨型球菌细胞施加到植物材料,其中所述细胞选自下组:atcc@25940、atcc@17752、atcc@17753、ncimb702261、ncimb702262、ncimb702264、ncimb702331、ncimb702409、ncimb702410、ncimb41125、ncimb41787、ncimb41788、nrrl18624、niah1102及其组合,和(b)使植物材料青贮以生产青贮的植物材料。
在某些实施方案中,所述方法的任一种还包括将添加剂施加到植物材料。
在某些实施方案中,该施加是在收获植物材料之前,在收获植物材料之后,在青贮时或其组合。
在某些实施方案中,添加剂选自下组:另一种微生物、酶、可发酵底物、酸、防腐剂、营养物及其组合。
在某些实施方案中,埃氏巨型球菌细胞选自下组:atcc@25940、atcc@17752、atcc@17753、ncimb702261、ncimb702262、ncimb702264、ncimb702331、ncimb702409、ncimb702410、ncimb41125、ncimb41787、ncimb41788、nrrl18624、niah1102及其组合。
在某些实施方案中,埃氏巨型球菌细胞是埃氏巨型球菌ncimb41125细胞。
在某些实施方案中,植物材料选自下组:饲料、农作物、草、豆类、谷物、水果、蔬菜或其组合。
在某些实施方案中,植物材料是玉米、苜蓿、小麦、黑麦、大麦、燕麦、小黑麦、小米、三叶草、高粱或其组合。
在某些实施方案中,所述方法的任一种还包括施加在液体中的埃氏巨型球菌细胞。
在某些实施方案中,所述方法的任一种还包括在施加细胞之前,将冷冻干燥的埃氏巨型球菌细胞与液体混合。
在某些实施方案中,所述方法的任一种还包括以冷冻干燥的细胞施加埃氏巨型球菌细胞。
在某些实施方案中,干燥载体包括冷冻干燥的细胞。
在某些实施方案中,所述方法的任一种还包括施加至少约106至约1014cfu的埃氏巨型球菌细胞每吨植物材料。
本公开内容涉及通过所述方法的任一种生产的青贮的植物材料。
附图说明
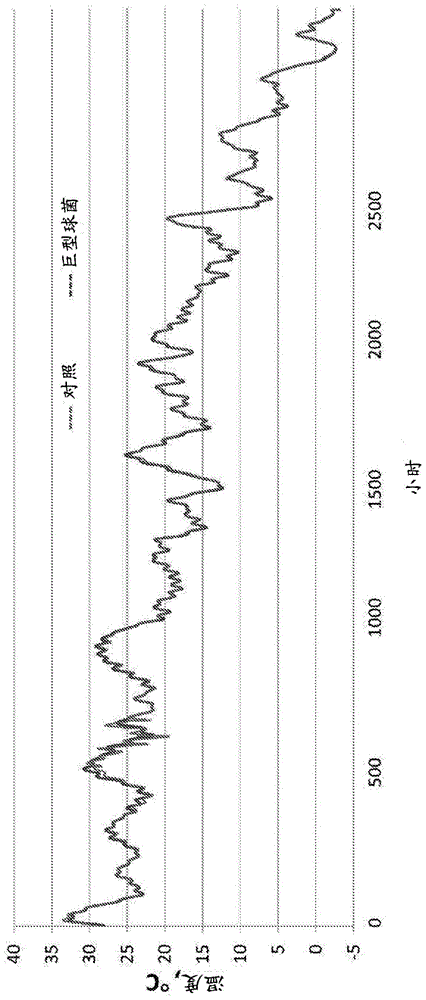
图1显示了在青贮的120天期间每小时测量的植物材料的温度(℃)。在图1-14中的“巨型球菌”和“对照”组中分别是来自用以50毫升每吨植物材料的比率的2x108cfu/ml埃氏巨型球菌细胞(埃氏巨型球菌菌株ncimb41125,
图2显示了在青贮的第7、14、21、28、39、90和120天的“巨型球菌”和“对照”组中的累积重量减轻(%),这是通过称量当日包含植物材料的料仓,并且与青贮第0天它们各自的开始重量进行比较而确定的。处理的效果,p<0.01;天数的效果,p>0.10;处理与天数相互作用,p>0.10;均值的标准误=3.16。
图3显示了取自“巨型球菌”和“对照”组的样品的平均ph。在三个开放日(即打开料仓的日子)从料仓中取样,包括青贮的第0天(“d0”)、第14天(“d14”)和第120天(“d120”)。处理无效果,p>0.6;均值的标准误=0.02。
图4显示了从如图3所述的“巨型球菌”和“对照”组中采集的样品中的平均挥发性脂肪酸(vfa)浓度(毫摩尔)。“sem”是均值的标准误。“d”=开放日效果,p<0.05。
图5显示了如图3所述在开放日第14天收集的“巨型球菌”和“对照”样品中暴露于环境空气14天测量的温度(℃)。在72-110小时,“巨型球菌”的温度高于“对照”,p<0.05。处理与时间相互作用,p<0.01;时间的效果,p<0.01;处理的效果,p<0.01;均值的标准误=0.023。
图6显示了如图3所述在开放日第14天收集后暴露于环境空气的第0天(“d0”)和第14天(“d14”)测量的“巨型球菌”和“对照”样品的平均ph。处理与天数相互作用,p<0.05;时间的效果,p<0.01;处理的效果,p<0.05;在第14天,用星号(*)表示的处理彼此不同,p<0.05;均值的标准误=0.07。
图7显示了如图3所示在开放日第14天收集后暴露于环境空气的第0天(“d0”)和第14天(“d14”)测量的“巨型球菌”和“对照”样品中的总挥发性脂肪酸的平均毫摩尔(“mm”)浓度。图7还显示了预青贮样品中挥发性脂肪酸的平均浓度。处理与开放日相互作用,p>0.5;接种物的效果,p>0.1;开放日的效果,p<0.6;均值的标准误=6.65。
图8显示了如图3所述在开放日第14天收集后暴露于环境空气的第0天(“d0”)和第14天(“d14”)测量的“巨型球菌”和“对照”样品中的挥发性脂肪酸(“vfa”)的平均毫摩尔浓度。“d”=开放日效果,p<0.05。
图9显示了如图3所述在开放日第14天收集的每个“巨型球菌”和“对照”样品暴露于环境空气的第0天、第7天和第14天以磅(“lb”)记的平均重量。处理与天数相互作用,p>0.9;天数的效果,p>0.1;处理的效果,p>0.6;均值的标准误=0.16。
图10显示了如图3所述在开放日第120天收集的“巨型球菌”和“对照”样品暴露于环境空气的14天测量的温度(℃)。在259-294小时,“巨型球菌”的温度高于“对照”,p<0.10。处理与时间相互作用,p>0.10;时间的效果,p<0.01;处理的效果,p<0.01;均值的标准误=1.23。
图11显示了如图3所述在开放日第120天收集后暴露于环境空气的第0天(“d0”)和第14天(“d14”)测量的“巨型球菌”和“对照”样品的平均ph。处理与天数相互作用,p>0.1;时间的效果,p>0.1;处理的效果,p>0.1;均值的标准误=0.23。
图12显示了如图3所述在开放日第120天收集后暴露于环境空气的第0天(“d0”)和第14天(“d14”)测量的“巨型球菌”和“对照”样品中的总挥发性脂肪酸的平均毫摩尔(“mm”)浓度。图12还显示了预青贮样品中挥发性脂肪酸的平均浓度。处理与氧气接触相互作用,p>0.5;接种物的效果,p>0.15;氧暴露天数的效果,p<0.01;均值的标准误=18.4。
图13显示了如图3所述在开放日第120天收集后暴露于环境空气的第0天(“d0”)和第14天(“d14”)测量的“巨型球菌”和“对照”样品中的挥发性脂肪酸(“vfa”)的平均毫摩尔浓度。“d”=氧气暴露天数效果;“i”=相互作用效果;“t”=处理效果;字母表示p<0.05。
图14显示了如图3所述在开放日第120天收集的每个“巨型球菌”和“对照”样品暴露于环境空气的第0天、第7天和第14天以磅(“lb”)计的平均重量。处理与天数相互作用,p>0.90;天数的效果,p>0.6;处理的效果,p<0.01;均值的标准误=0.10。
图15显示了根据以对数(“log10”)比例的菌落形成单位每毫升(“cfu/ml”)的埃氏巨型球菌细胞的产量,在28天的时间里储存温度对埃氏巨型球菌ncimb41125液体培养物的活力的影响。
图16显示了在室温储存0、7、14、21和28天后,埃氏巨型球菌ncimb41125的液体培养物的活力,其根据以log10比例的cfu/ml计的埃氏巨型球菌细胞的产量。
图17显示了切向流过滤(“tff”)系统的示意图。
图18显示了通过tff系统加工后,以log10比例的y轴上截留物以cfu/ml表示的埃氏巨型球菌细胞的产量。x轴表示通过该系统的70%、80%或90%体积减少。“靶标”是指tff加工后的埃氏巨型球菌的理论回收率。“conc.”是指截留物中埃氏巨型球菌细胞的实际回收率,其是在所指体积减少后剩余的浓缩细胞的体积。
图19显示了在-80℃或在液氮(liqn)中冷冻细胞并使用慢速(在135mtorr的38小时)或快速(在250mtorr的18.5小时)冷冻干燥细胞后的细胞损失。细胞来自具有8%麦芽糊精/15%脱脂乳(m/sm)或8%海藻糖/15%脱脂(t/sm)作为防冻剂的培养物使用tff的70%、80%或90%体积减少后的截留物。
图20显示了起始快速(液氮)或慢速(-20℃)冷冻,然后冷冻干燥(在15%麦芽糊精和0%或7.5%海藻糖的存在下)后的埃氏巨型球菌ncimb41125细胞的产量。
图21显示了在-80℃或在液氮(liqn)中在有或没有4%海藻糖或7.5%脱脂乳的情况下冷冻的埃氏巨型球菌ncimb41125细胞中观察到的细胞损失。
图22显示了从90%体积减少截留物与8%海藻糖/15%脱脂乳(t/sm)或8%麦芽糊精/15%脱脂乳(m/sm)混合,在-80℃或在液氮(liqn)中冷冻,并使用快速循环冷冻干燥并在室温或4℃在厌氧条件下储存长达24周,得到的冷冻干燥的样品上观察到的细胞损失。
图23显示了从90%体积减少截留物与8%海藻糖/15%脱脂乳(t/sm)或8%麦芽糊精/15%脱脂乳(m/sm)混合,在-80℃或在液氮(liqn)中冷冻,并使用快速循环冷冻干燥并在室温或4℃在厌氧条件下储存24周,得到的冷冻干燥样品上观察到的细胞损失。没有共同上标的条在统计上是不同的,p<0.02。
图24显示了非冷冻干燥的或再水合的冷冻干燥的产品上进行的生长曲线,所述冷冻干燥的产品从90%体积减少截留物与8%海藻糖/15%脱脂乳(t/sm)或8%麦芽糊精/15%脱脂乳(m/sm)混合,在液氮(liqn)中冷冻,并使用快速循环冷冻干燥在4或25℃在厌氧条件下储存12、16、20或24周后获得。显示了从0小时到20小时测量的在600纳米(nm)处的光密度(od)。黄线=非冷冻干燥的,红线=t/sm,蓝线=m/sm,虚线=储存在4℃,实线=储存在25℃。
图25显示了在青贮120天后,未经处理(对照/未经处理)和经过埃氏巨型球菌处理的玉米青贮饲料的液体提取物中的乙酸酯的平均毫摩尔浓度。
图26显示了在青贮过程中用或不用埃氏巨型球菌处理重构的高水分玉米对ph水平的影响。
图27显示了在含有用或不用埃氏巨型球菌处理的重构的高水分玉米的混合瘤胃微生物的体外培养物中干物质含量的影响。
图28显示了在背景阶段(育肥前)期间,与未经处理的青贮饲料相比,给牛饲喂经埃氏巨型球菌处理的青贮饲料时胴体价值的影响。每个胴体的价值是使用标准化网格计算得出的,该网格是通过对usda每周价格数据(从2008年1月至2018年1月的10年期间报告的溢价和折价)进行平均得出的。
发明详述
本发明涉及使用埃氏巨型球菌细胞产生青贮的植物材料的方法。本发明还涉及通过该方法生产的青贮的植物材料。
出于所有目的,本文中提及的所有出版物、专利和其他参考文献通过引用整体并入本文,如同每个单独的出版物或专利申请均被明确地和单独地指出通过引用并入本文。另外,在本申请中对任何参考文献的引用或标识均不应解释为承认该参考文献可用作本发明的现有技术。
术语
除非另有定义,否则本文中使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同含义。在发生冲突的情况下,以包括定义的本申请为准。除非上下文另有要求,否则单数形式应包括复数并且复数形式应包括单数。
就使用部分标题而言,不应将其解释为必须的限制。
如本文和所附权利要求书中所使用的,单数形式“一个”、“一种”和“该”包括复数引用,除非上下文另外明确指出。例如,术语“一种化合物”或“至少一种化合物”可包括多种化合物,包括其混合物。例如,术语“一个”、“一种”、“该”、“一个或多个”和“至少一个”在本文中可以互换使用。
如本文所用,术语“约”在用于修饰与本发明有关的量时,是指可能发生的数值上的变化,例如通过常规测试和处理;通过在此类测试和处理中的无意错误;通过本发明所用成分的制造、来源或纯度上的差异;等等。不论是否被术语“约”修饰,权利要求均包括所列举量的等同形式。在一些实施方案中,术语“约”是指所报告的数值的正负10%。
在整个本申请中,本发明的各种实施方案可以以范围格式呈现。应当理解,范围格式的描述仅是为了方便和简洁,并不应被解释为对本发明范围的不灵活限制。因此,应该将范围的描述视为已明确公开了所有可能的子范围以及该范围内的各个数值。例如,对范围例如1至6的描述应视为已明确公开了子范围,例如1至2、1至3、1至4、1至5、2至3、2至4、2至5、2至6、3至4、3至5、3至6等,以及该范围内的单个数字,例如1、2、3、4、5和6。这适用于各种范围的广度。
术语“包括”、“包括的”、“包含”、“包含的”,“具有”及其变化形式是可互换的,并且意指“包括但不限于”。应该理解的是,无论本文中在何处用语言“包括”来描述方面,都还提供了以“由...组成”和/或“基本上由...组成”描述的类似方面。
术语“由...组成”是指“包括且限于”。
术语“基本上由...组成”是指组合物的指定材料或方法的指定步骤,以及不实质性影响该材料或方法的基本特性的那些其他材料或步骤。
在本文中使用的术语“和/或”应被理解为两个指定的特征或组分中的每个具有或不具有另一个的具体公开。因此,在本文中在诸如“a和/或b”之类的短语中使用的术语“和/或”旨在包括“a和b”、“a或b”、“a”(单独)和“b”(单独)。同样地,在诸如“a、b和/或c”的短语中使用的术语“和/或”旨在涵盖以下方面中的每个:a、b和c;a、b或c;a或c;a或b;b或c;a和c;a和b;b和c;a(单独);b(单独);和c(单独)。
本文所用的术语“植物材料”是指可以用作动物食品并且可以被青贮的任何植物材料,包括但不限于饲料、农作物、草、豆类、谷物、水果、蔬菜或其组合。对本文公开的“植物材料”或特定类型的植物材料(例如,饲料、农作物、草、豆类、谷物、水果、蔬菜或其组合)的提及包括经加工的植物材料(包括但不包括限于切、砍、切碎或修剪的植物材料,或其组合),以及植物材料的一部分,包括但不限于茎、柄、叶、皮、壳、穗轴、穗、谷粒、农作物残渣或其组合。
如本文所用,术语“培养”,“用于培养”和“培养的”是指在允许细胞生长或分裂或者维持细胞处于存活状态的体外条件下孵育细胞。术语“培养物”在本文中也可以用于指在体外条件下孵育的细胞(例如,在液体生长培养基中孵育的细胞)。如本文所用,术语“生长培养基”和“培养基”是指包含支持细胞生长的组分的固体(例如琼脂)、半固体(例如琼脂)或液体(例如肉汤)组合物。
如本文所用,术语“添加剂”是指一种或多种成分、产物或物质(例如,细胞),其单独或一起使用(例如,用于改善青贮的植物材料的质量,改善动物的性能和/或健康,和/或增强青贮的植物材料的消化率)。
如本文所用,关于细胞的术语“收获”和“收获的”是指从培养物中收集细胞,例如,从培养物中收集生长培养基中的细胞,通过从培养物中除去一定量的生长培养基来收集细胞(例如,通过在液体培养物中浓缩细胞或将细胞与生长培养基分离),或停止细胞培养。该术语包括从液体培养物中收集或移取一定体积的包含细胞的液体,包括其中细胞已经被浓缩的一定体积。如本文相对于植物材料所使用的术语“收获”、“收获的”和“收集”是指通过任何手动或机械手段来收集植物材料。
如本文所用,术语“分离的”不一定反映分离物已被纯化的程度,而是表示与天然形式或天然环境的分离或分开。分离物可以包括但不限于分离的微生物、分离的生物质或分离的培养物。
如本文所用,术语“有效量”是指达到期望结果的量。
如本文所用,“赋形剂”是指组分或组分的混合物,其用于赋予本文公开的青贮的植物材料以所需的特性。本发明的赋形剂可被描述为“药学上可接受的”赋形剂,意指该赋形剂是化合物、材料、组合物、盐和/或剂型,其在合理的医学判断范围内适合于与动物(即人类和非人类动物)的组织接触而在期望的接触持续时间内没有过度毒性、刺激性、过敏反应或其他有问题的并发症,且具有合理的获益/风险比。
如本文所用,术语“产量”是指存活或活细胞的量,包括以特定体积(例如,菌落形成单位每毫升(“cfu/ml”))或以特定重量(例如,cfu每克(“cfu/g”))计的量。
如本文所用,术语“活的”是指一种或多种存活生物体(例如,一种活的微生物细胞或多种活的微生物细胞)。“活力”是指存活的能力,尤其是在某些条件下。
如本文所用,“纯化”、“纯化的”和“进行纯化”是指与不需要的组分、材料污染、掺混或瑕疵分开基本上纯净或澄清。
当例如在短语“本发明”或“本公开内容”中描述或使用时,术语“发明”和“公开内容”可以互换使用。
应当理解,为清楚起见在单独的实施方案的上下文中描述的本发明的某些特征也可以在单个实施方案中组合提供。相反,为简洁起见在单个实施方案的上下文中描述的本发明的各种特征也可以单独地或以任何合适的子组合或者在本发明的任何其他所述的实施方案中合适地提供。在各种实施方案的上下文中描述的某些特征不应被认为是那些实施方案的必要特征,除非该实施方案在没有那些要素的情况下是不可操作的。
尽管类似于或等同于本文描述的那些的方法和材料可以用于本发明的实践或测试中,但是下面描述了合适的方法和材料。材料、方法和实施例仅是示例说明性的,并不意图是限制性的。根据详细描述和权利要求,本发明的其他特征和优点将显而易见。
生产青贮的植物材料的方法
在一个方面,本发明涉及生产具有改善的有氧稳定性的青贮的植物材料的方法,包括:(a)将有效量的埃氏巨型球菌细胞施加到植物材料,和(b)使植物材料青贮以产生青贮的植物材料,其中与在不存在埃氏巨型球菌细胞的情况下生产的对照青贮的植物材料相比,该青贮的植物材料包含改善的有氧稳定性。在一些实施方案中,改善的有氧稳定性包括降低的ph、降低的重量损失或两者。
在另一个方面,本发明涉及生产增加量的青贮的植物材料的方法,包括:(a)将有效量的埃氏巨型球菌细胞施加到植物材料,和(b)使植物材料青贮以产生青贮的植物材料,其中与在不存在埃氏巨型球菌细胞的情况下生产的对照青贮的植物材料的量相比,该青贮的植物材料的量增加。可以例如通过称重青贮的植物材料或称重包含青贮的植物材料的容器并减去容器的重量来确定青贮的植物材料的量。
在另一个方面,本发明涉及生产青贮的植物材料的方法,包括:(a)将埃氏巨型球菌细胞施加到植物材料,其中所述细胞选自下组:atcc@25940、
在本发明的方法中的植物材料包括可被青贮用于生产青贮的植物材料的任何植物材料。
在一些实施方案中,本发明的方法中的植物材料是反刍动物消耗的任何植物材料。在一些实施方案中,反刍动物可以是但不限于牛、水牛、绵羊、山羊、鹿、驯鹿、驼鹿、长颈鹿、牦牛和麋鹿。在一些实施方案中,反刍动物选自下组:牛、水牛、绵羊、山羊、鹿和驯鹿。在一些实施方案中,本发明的方法中的植物材料是骆驼科动物消耗的任何植物材料。在一些实施方案中,骆驼科动物可以是但不限于羊驼(alapacas)、美洲驼、原驼(guanaco)、骆马
在一些实施方案中,植物材料选自下组:饲料、农作物、草、豆类、谷物、水果、蔬菜或其组合。在一些实施方案中,植物材料是玉米(即玉蜀黍)、苜蓿、小麦、黑麦、大麦、燕麦、小黑麦、小米、三叶草、高粱或其组合。在一些实施方案中,植物材料是农作物残余物,例如但不限于高粱、玉米秸秆或大豆秸秆。在一些实施方案中,植物材料是杂草。在一些实施方案中,植物材料是草和豆类的混合物,包括一种或多种草和一种或多种豆类。
草包括但不限于:剪股颖属物种(agrostisspp.)–剪股颖(bentgrass)(例如,细弱剪股颖(agrostiscapillaris)–常见的剪股颖和匍匐剪股颖(agrostisstolonifera)–匍匐剪股颖(creepbentgrass));沙地须芒草(andropogonhallii)–沙蓝茎;燕麦草(arrhenatherumelatius)-假燕麦草;臭根子草(bothriochlobladhii)–澳大利亚蓝茎;孔颖草(bothriochloapertusa)–飓风草;俯仰臂形草(brachiariadecumbens)–苏里南草;湿生臂形草(brachiariahumidicola)–科罗尼维亚草;雀麦属物种(bromusspp.)–雀麦;美洲蒺藜草(cenchrusciliaris)–水牛草;非洲虎尾草(chlorisgayana)–罗得草;狗牙根(cynodondactylon)–百慕大草;鸭茅(dactylisglomerata)–果园草;金字塔稗(echinochloapyramidalis)–羚羊草;entolasiaimbricata–本戈马草;羊茅属物种(festucaspp.)–羊茅(例如,苇状羊茅(festucaarundinacea)–高羊茅,草甸羊茅(festucapratensis)–草地羊茅,以及紫羊茅(festucarubra)–红色羊茅);扭黄茅(heteropogoncontortus)–黑矛草;膜稃草(hymenachneamplexicaulis)–西印度沼泽草;红苞茅(hyparrheniarufa)–红苞茅(jaragua);李氏禾(leeriahexandra)–南部切草;黑麦草属物种(loliumspp.)–黑麦草(例如多花黑麦草(loliummultiflorum)–意大利黑麦草和多年黑麦草(loliumperenne)–多年生黑麦草);大黍(megathyrsusmaximus)–几内亚草;糖蜜草(melinisminutiflora)–糖蜜草;毛花雀稗(paspalumdilatatum)–达利斯草(dallisgrass);虉草(phalarisarundinacea)-芦苇加那利虉草(reedcanarygrass);梯牧草(phleumpratense)–蒂莫西;早熟禾属物种(poaspp.)–早熟禾,草地早熟禾(例如,德克萨斯早熟禾(poaarachnifera)–德州早熟禾,草地早熟禾(poapratensis)–肯塔基早熟禾,以及普通早熟禾(poatrivialis)–粗禾早熟禾);狗尾草(setariasphacelata)–非洲狗尾草;阿拉伯黄背草(themedatriandra)–袋鼠草;和中间偃麦草(thinopyrumintermedium)–中级小麦草。
豆类包括但不限于草本豆类和树木豆类。草本豆类包括但不限于:多年生花生(arachispintoi)–品脱花生;圆叶决明(chamaecristarotundifolia)–圆叶敏感豌豆;蝶豆(clitoriaternatea)–蝴蝶豌豆;百脉根(lotuscorniculatus)–鸟脚三叶;紫花大翼豆(macroptiliumatropurpureum)–紫色灌木豆;macroptiliumbracteatum–勃艮第豆;苜蓿属物种(medicagospp.)–苜蓿(例如紫花苜蓿(medicagosativa)–苜蓿,紫花苜蓿(lucerne)和蒺藜苜蓿(medicagotruncatula)–桶苜蓿);草木犀属物种(melilotusspp.)–草木犀(sweetclovers);新诺顿豆(neonotoniawightii)–多年生大豆;红豆草(onobrychisviciifolia)–普通红豆草;笔花豆属物种(stylosanthesspp.)–柱花草(stylo)(例如矮柱花草(stylosantheshumilis)–汤斯维尔(townsville)柱花草);西卡柱花草(stylosanthesscabra)–灌木状柱花草;车轴草属物种(trifoliumspp.)–三叶草(例如,杂车轴草(trifoliumhybridum)–阿尔斯克(alsike)三叶草,绛车轴草(trifoliumincarnatum)–深红色三叶草,红车轴草(trifoliumpratense)–红三叶草,白车轴草(trifoliumrepens)–白三叶草);和野豌豆属物种(viciaspp.)–野豌豆(例如viciaarticulata–单花野豌豆,viciaervilia–苦野豌豆,纳本野豌豆(vicianarbonensis)–纳本野豌豆,救荒野豌豆(viciasativa)–普通野豌豆,巢菜(tare),柔毛野豌豆(viciavillosa)–毛野豌豆);和帕克豇豆(vignaparkeri)–匍匐豇豆)。树木豆科植物包括但不限于:无脉相思树(acaciaaneura)–金合欢;合欢属物种(albiziaspp.)–丝绸树;白合欢(albiziacanescens)–贝尔蒙特西里斯(belmontsiris);阔荚合欢(albizialebbeck)–莱贝克(lebbeck);环耳象耳豆(enterolobiumcyclocarpum)–象耳豆;和银合欢(leucaenaleucocephala)–铅树(leadtree)。
在一些实施方案中,本发明的方法中的植物材料是包含约30%至约90%、约35%至约85%、约40%至约80%、约40%至约75%、约40%至约70%、约40%至约65%、约40%至约60%、约45%至约80%、约45%至约75%、约45%至约70%、约45%至约65%、约50%至约80%、约50%至约75%、约50%至约70%、约50%至约65%或约50%到大约60%的水分含量的植物材料。
可以在任何合适的时间,例如,当水分处于合适水平时,收获或收集植物材料。如果水分水平太高,则可以允许植物材料例如枯萎,直到水分达到合适水平。
在一些实施方案中,根据本发明的任何方法,可以将先前脱水的植物材料(例如,干燥的谷物)再水合用于青贮中。
在本发明的任何方法中的青贮可以根据青贮植物材料的任何标准或已知方法进行。将本发明的方法中的植物材料在密封的容器中进行青贮以允许植物材料的厌氧发酵,所述密封的容器在本文中也称为“料仓”。
在一些实施方案中,本发明的方法还包括将添加剂施加到植物材料。
在一些实施方案中,在本发明的任何方法中的施加(即,施加埃氏巨型球菌细胞,施用添加剂或两者)是在收获植物材料之前,在收获植物之后,在青贮时或其组合。当施加埃氏巨型球菌和添加剂两者时,它们可以一起施加,或者在相同或不同的时间分开施加。
在本发明的方法中的添加剂可以是在青贮过程中使用或施加到青贮的植物材料的任何添加剂。
在一些实施方案中,本发明的方法中的添加剂选自下组:微生物、酶、可发酵底物、酸、防腐剂、营养物及其组合。
在一些实施方案中,本发明的方法中的添加剂是可发酵的碳水化合物,包括但不限于糖源,例如但不限于糖蜜、蔗糖、葡萄糖、右旋糖、乳清、麦片谷物、米糠、麦麸、柑橘果肉、菠萝果肉或甜菜果肉。
在一些实施方案中,本发明的方法中的添加剂是酶,例如但不限于纤维素酶、半纤维素酶、淀粉酶、果胶酶、蛋白酶或木聚糖酶。
在一些实施方案中,本发明的方法中的添加剂是刺激发酵的微生物,例如但不限于乳酸菌。在一些实施方案中,微生物是乳杆菌属(lactobacillus)、片球菌属(pediococcus)、肠球菌属(enterococcus)、丙酸杆菌属(propionibacterium)、乳球菌属(lactococcus)、链球菌属(streptococcus),明串珠菌属(leuconostoc)或月形单胞菌属(selenomonas)。在一些实施方案中,微生物是植物乳杆菌(lactobacillusplantarum)、嗜酸乳杆菌(lactobacillusacidophilus)、布氏乳杆菌(lactobacillusbuchneri)、干酪乳杆菌(lactobacilluscasei)、棒状乳杆菌(lactobacilluscornyiformis)、弯曲乳杆菌(lactobacilluscurvatus)、唾液乳杆菌(lactobacillussalivarus)、短乳杆菌(lactobacillusbrevis)、发酵乳杆菌(lactobacillusfermentum)、绿色乳杆菌(lactobacillusviridescens)、乳酸片球菌(pediococcusacidilactici)、戊糖片球菌(pediococcuspentocaceus)、啤酒片球菌(pediococcuscerevisiae)、屎肠球菌(enterococcusfaecium)、粪肠球菌(enterococcusfaecalis)、詹氏丙酸杆菌(propionibacteriumjensenii)、产丙酸丙酸杆菌(propionibacteriumacidipropionici)、费氏丙酸杆菌(propionibacteriumfreudenreichii)、球形丙酸杆菌(propionibacteriumglobosum)、谢尔曼丙酸杆菌(propionibacteriumshermanii)、乳酸乳球菌(lactococcuslactis)、牛链球菌(streptococcusbovis)、肠膜明串珠菌(leuconostocmesenteroides)或反刍月形单胞菌(selenomonasruminantium)。
在一些实施方案中,本发明的方法中的添加剂是发酵的抑制剂,包括但不限于酸和有机盐,例如但不限于无机酸(例如盐酸)、甲酸、乙酸、己酸、山梨酸、苯甲酸、硫酸、乳酸、丙烯酸、甲酸钙、丙酸或丙酸盐或其他化学抑制剂,例如但不限于甲醛、多聚甲醛、亚硝酸钠、焦亚硫酸钠二氧化硫、氢氧化钠、硫酸钠、氯化钠、尿素或氨。
在一些实施方案中,本发明的方法中的添加剂是需氧腐败抑制剂,例如但不限于丙酸、丙酸盐、乙酸、己酸或氨。
在一些实施方案中,本发明的方法中的添加剂是营养物或营养物源,例如但不限于尿素、氨、石灰石(limestone)或其他矿物质。
在一些实施方案中,本发明的方法中的添加剂是吸收剂,例如但不限于谷物、稻草、膨润土、甜菜浆或聚丙烯酰胺。
在一些实施方案中,在本发明的方法中的埃氏巨型球菌的有效量是至少约106、至少约107、至少约108、至少约109、至少约1010、约106至约1014、约106至约1013、约106至约1012、约106至约1011、约107至约1014、约107至约1013、约107至约1012、约107至约1011、约108至约1011、约109至约1011、约1010至约1011、约1010至约1012、约1010至约1013或约1010至约1014菌落形成单位(cfu)每吨植物材料。
在一些实施方案中,本发明方法的埃氏巨型球菌细胞选自下组:
在一些实施方案中,本发明的方法中的埃氏巨型球菌细胞是埃氏巨型球菌ncimb41125细胞。
在一些实施方案中,本发明的方法包括施加在液体中的埃氏巨型球菌细胞。
在一些实施方案中,本发明的方法包括以冷冻干燥的细胞施加埃氏巨型球菌细胞。在一些实施方案中,干燥载体包含冷冻干燥的细胞。在一些实施方案中,干燥载体包括但不限于碳酸钙、奶粉或蔗糖。
在一些实施方案中,本发明的方法还包括在施加细胞之前,将冷冻干燥的埃氏巨型球菌细胞与液体混合。
在一些实施方案中,本发明的方法包括施加在液体中的添加剂。当都在液体中施加埃氏巨型球菌细胞和添加剂时,它们可以在单独的液体中施加,可以在不同的时间或同时在单独的液体中施加,或者可以以混合物在同一液体中施加。
在一些实施方案中,本发明的方法包括以干燥形式施加添加剂,例如但不限于粉末、颗粒或冷冻干燥形式。当为干燥形式时,添加剂可与干燥载体混合。当都以干燥形式施加埃氏巨型球菌细胞和添加剂时,它们可以以单独的干燥形式,可以在不同的时间或同时以单独的干燥形式施加,或者可以以干燥形式的混合物施加,包括干燥载体中干燥形式的混合物。
在另一方面,本发明涉及通过本发明的任何方法生产的青贮的植物材料。
埃氏巨型球菌
来自任何菌株或菌株的任何组合的埃氏巨型球菌细胞可以用于本文所述的发明中。
一种或多种埃氏巨型球菌菌株可以选自原种培养物保藏中心(例如,美国典型培养物保藏中心
可以从培养物保藏中心中选择的埃氏巨型球菌菌株的实例包括但不限于表1中保藏号列出的菌株。还指出了保藏号的替代名称。
表1.埃氏巨型球菌菌株的实例和每种菌株的来源。
在一些实施方案中,埃氏巨型球菌细胞来自具有选自下组的保藏号的菌株:
在一些实施方案中,埃氏巨型球菌细胞来自从反刍动物(例如,母牛)分离的菌株。参见,例如,美国专利号7,550,139。
在一些实施方案中,埃氏巨型球菌细胞来自从非反刍动物(例如人)分离的菌株。
在一些实施方案中,埃氏巨型球菌细胞来自针对乳酸盐利用(例如,在糖存在下利用乳酸盐的菌株),对离子载体抗生素的抗性,相对高的生长速率,主要产生乙酸盐的能力,在ph值低于5.0并低至4.5时具有增殖能力,挥发性脂肪酸(vfa)的产生,肌醇六磷酸酶活性及其组合而选择的菌株。参见,例如,美国专利号7,550,139。
在一些实施方案中,针对乳酸盐利用而选择的菌株在可溶性碳水化合物(例如葡萄糖和/或麦芽糖)存在下利用乳酸盐作为优选的碳源。乳酸盐的利用可以例如基于在含有乳酸盐和缺乏可溶性碳水化合物的培养基中的生长与补充有可溶性碳水化合物的相同培养基相比来确定。
在一些实施方案中,埃氏巨型球菌细胞来自与其他菌株相比具有高生长速率的菌株。可以例如通过在液体培养基中培养细胞并监测光密度随时间的增加来确定不同菌株的生长速率。
在一些实施方案中,埃氏巨型球菌细胞来自能够产生vfa的菌株,vfa可以例如通过气相色谱法确定。在一些实施方案中,vfa是6-碳脂肪酸。
在一些实施方案中,埃氏巨型球菌细胞来自埃氏巨型球菌菌株ncimb41125。该埃氏巨型球菌菌株具有较高的比生长速率(0.94代/小时),能够在4.5至6.5或更高的ph范围内生长,使用d-和l-乳酸盐作为其优选的底物,但也具有利用葡萄糖和其他碳水化合物并耐受离子载体的能力。
在一些实施方案中,埃氏巨型球菌细胞来自埃氏巨型球菌菌株ncimb41787。在一些实施方案中,埃氏巨型球菌来自埃氏巨型球菌菌株ncimb41788。
在一些实施方案中,埃氏巨型球菌细胞来自埃氏巨型球菌菌株
在一些实施方案中,埃氏巨型球菌细胞衍生自选自原种培养物保藏中心或从天然来源分离的菌株。从菌株“衍生”的细胞可以是天然或人工衍生物,如例如亚分离株、突变体、变体或重组菌株。
在一些实施方案中,埃氏巨型球菌细胞是商业制备物,例如
制备包含埃氏巨型球菌细胞的培养物
可以在液体培养物中生长用于本文的埃氏巨型球菌细胞并且直接用作液体培养物。备选地,可以从液体或固体培养物中分离细胞并且在使用前重悬于合适的液体中或冷冻干燥。
埃氏巨型球菌是厌氧细菌,必须在严格的厌氧条件下培养以获得最大的产量和活力。
在一些实施方案中,培养物包含埃氏巨型球菌细胞和生长培养基。
在一些实施方案中,培养物包含一种或多种埃氏巨型球菌细胞菌株。在一些实施方案中,培养物包含单一的埃氏巨型球菌细胞菌株。在一些实施方案中,培养物由一种或多种埃氏巨型球菌细胞菌株组成(即,培养物中的细胞由埃氏巨型球菌细胞组成,例如一种或多种埃氏巨型球菌细胞菌株)。在一些实施方案中,培养物由单一的埃氏巨型球菌细胞菌株组成。
在一些实施方案中,本发明的方法还可以包括生长、收获和/或冷冻干燥用于所述方法中的埃氏巨型球菌细胞。
可以使用用于接种、生长和收获埃氏巨型球菌细胞的多种发酵参数,包括连续发酵(即,连续培养)或分批发酵(即,分批培养)。参见,例如,美国专利号7,550,139。
埃氏巨型球菌细胞的生长培养基可以是固体、半固体或液体。培养基可以包含提供实现生长的必需元素和特定因子的营养物。多种微生物培养基和变体是本领域众所周知的。可以在任何时间(包括培养的开始、培养期间或间断/连续地)向培养物中添加培养基。
生长培养基的实例包括但不限于:(1)半限定培养基,其包含蛋白胨,3g/l;酵母,3g/l;维生素溶液,2ml/l;矿物质溶液,25ml/l;靛蓝胭脂红(0.5%),1g/l;12.5%l-半胱氨酸,2g/l;12.5%的硫化钠,2g/l;并补充乳酸钠(半限定乳酸盐,sdl),葡萄糖(半限定葡萄糖,sdg)或麦芽糖(半限定麦芽糖,sdm);(2)改良的强化梭菌琼脂/肉汤培养基(预还原的),其含有蛋白胨,10g/l;牛肉提取物,10g/l;酵母提取物,3g/l;右旋糖5g/l;nacl,5克/升;可溶性淀粉,1g/l;l-半胱氨酸hcl,0.5g/l;乙酸钠3g/l;和刃天青(0.025%),4ml/l;(3)具有去纤维的羊血的胰酪胨(trypticase)大豆琼脂/肉汤;(4)半限定的无瘤胃液体培养基,其含有乳酸钠(70%),10g/l;蛋白胨,2g/l;kh2po41g/l;(nh4)2so43g/l;mgso47h2o0.2g/l;cacl2.2h2o0.06g/l;维生素(盐酸吡哆素,4mg/l;吡哆胺,4mg/l;核黄素,4mg/l;氯化硫胺,4mg/l;烟酰胺,4mg/l;ca-d-泛酸盐,4mg/l;4-氨基苯甲酸,0.2mg/l,生物素,0.2mg/l,叶酸0.1mg/l和氰钴胺,0.02mg/1);na2s.9h2o,0.25g/l;半胱氨酸,0.25g/l;消泡剂,0.07ml/l和莫能菌素,10mg/l;并且其是通过以下制备:将乳酸钠和矿物质溶液添加到储液瓶中并高压灭菌60分钟;将蛋白胨溶解在300ml蒸馏h2o中并分别高压灭菌;事先对维生素溶液和两种还原剂进行过滤灭菌;高压灭菌后,用厌氧气体向储液瓶充气过夜;冷却后分别添加其他成分;并用5nhcl调节ph至所需值;和(5)孵育的瘤胃液乳酸盐(“irfl”)培养基,其含有来自紫花苜蓿喂养的绵羊的400ml孵育的澄清的瘤胃液,371ml蒸馏水,2g蛋白胨,15g琼脂,100ml10%(w/v)d,l-乳酸钠溶液,100ml0.04%(w/v)溴甲酚紫溶液和25ml矿物质溶液,含40g/lkh2po4;120g/l(nh4)2so4;8g/lmgso4.7h2o和2.4g/lcacl2.2h2o,其中使用乳酸(90%w/v)将ph调节至5.5,再在121℃高压灭菌25分钟,然后在50℃水浴中冷却,同时用厌氧气体混合物充气,随后加入各两毫升的na2s.9h2o(12.5%w/v)和半胱氨酸.hcl.h2o(12.5%w/v)。
在一些实施方案中,培养物包含含有至少两种碳源的生长培养基。在一些实施方案中,至少两种碳源选自下组:酪蛋白、淀粉(例如糊化的淀粉和/或可溶性淀粉)、乳酸盐(即乳酸)、右旋糖、果糖、果聚糖、葡萄糖、蔗糖、乳糖、麦芽糖、乙酸盐、甘油、甘露醇、蔗糖、木糖、糖蜜、岩藻糖、葡萄糖胺、右旋糖酐、脂肪、油、甘油、乙酸钠、阿拉伯糖、大豆蛋白、可溶性蛋白、棉子糖及其组合。
在一些实施方案中,至少两种碳源由约1-99%的第一碳源(例如,本文所述的任何碳源)和约1-99%的第二碳源(例如,与第一碳源不同的本文所述的任何碳源)组成,其中至少两种碳源中的100%由第一碳源和第二碳源组成。在一些实施方案中,至少两种碳源由约50-60%的第一碳源和约40-50%的第二碳源,约50-70%的第一碳源和约30-50%的第二碳源,约50-80%的第二碳源和约20-50%的第二碳源,或约50-90%的第一碳源和约10-50%的第二碳源组成。在其他实施方案中,至少两种碳源由约65-75%的第一碳源和约25-35%的第二碳源组成。在一些实施方案中,第一碳源是乳酸盐。
在一些实施方案中,将埃氏巨型球菌细胞培养在约39℃至约40℃、约35℃、约36℃、约37℃、约38℃、约39℃或约40℃。
在一些实施方案中,将埃氏巨型球菌细胞冷却至约18℃至约25℃以储存。
在一些实施方案中,包含埃氏巨型球菌细胞的培养物的ph(例如,在培养期间和/或在收获时)为约4.5至约7.0、约4.5至约6.5、约4.5至约6.0、约4.5至约5.5、约4.5至约5.0、约4.6至约6.9、约4.7至约6.8、约4.8至约6.7、约4.9至约6.6、约5.0至约7.0、约5.0至约6.5、约5.0至约6.0、约5.0至约5.5、约5.1至约6.9、约5.2至约6.8、约5.3至约6.7、约5.4至约6.6、约5.5至约7.0、约5.5至约6.5、约5.1至约6.4、约5.2至约6.3、约5.3至约6.2、约5.4至约6.1、约5.5至约6.0、约5.0至约6.1、约5.0至约6.2、约5.0至约6.3、约5.0至约6.4、约5.1至约6.5、约5.2至约6.5、约5.3至约6.5或约5.4至约6.5。
为了培养埃氏巨型球菌细胞,可以使用维持厌氧条件的不同尺寸和设计的发酵罐。发酵罐能够例如发酵足以用于商业生产埃氏巨型球菌细胞的培养体积。
在一些实施方案中,包含埃氏巨型球菌细胞的培养物还包含另一种微生物(即不是埃氏巨型球菌细胞的微生物细胞)。在一些实施方案中,培养物包含埃氏巨型球菌细胞和另一种专性厌氧微生物。在一些实施方案中,培养物包含埃氏巨型球菌细胞和选自下组的另一种微生物:乳杆菌属、片球菌属、肠球菌属、丙酸杆菌属、乳球菌属、链球菌属、明串珠菌属或月形单胞菌属。
冷冻干燥的埃氏巨型球菌细胞
在一些实施方案中,用于本发明的方法和青贮的植物材料中的埃氏巨型球菌细胞是冷冻干燥的细胞。
冷冻干燥的埃氏巨型球菌细胞可以通过包括以下的方法产生:制备包含埃氏巨型球菌细胞和生长培养基的培养物;收获细胞;冷冻细胞;并冷冻干燥细胞,其中产生了冷冻干燥的埃氏巨型球菌细胞。在一些实施方案中,以制备培养物,然后收获细胞(即,收获培养的细胞),然后冷冻细胞(即,冷冻收获的细胞)并然后冷冻干燥细胞(即将冷冻的细胞冷冻干燥)的顺序执行所述方法。
在一些实施方案中,所述方法在厌氧条件下进行。在一些实施方案中,所述方法包括在厌氧条件下制备培养物,收获细胞,冷冻细胞,冷冻干燥细胞或其组合。
所述方法可以包括本文所述的制备培养物的任何方法。所述方法的培养物还可以包含本文所述培养物的任何性质。
在一些实施方案中,培养物中的细胞包含埃氏巨型球菌细胞。在一些实施方案中,培养物中的细胞由埃氏巨型球菌细胞组成。
在一些实施方案中、生长培养基包含选自下组的至少两种碳源:酪蛋白、乳酸盐(即乳酸)、右旋糖、果糖、果聚糖、葡萄糖、蔗糖、乳糖、麦芽糖、乙酸盐、甘油、甘露醇、蔗糖、木糖、糖蜜、岩藻糖、葡糖胺、右旋糖酐、脂肪、油、甘油、乙酸钠、阿拉伯糖、大豆蛋白、可溶性蛋白、棉子糖及其组合。
在一些实施方案中,所述方法包括在培养结束其指数生长期之后的12小时内收获细胞。可以将培养物冷却至室温以在收获时停止生长。
在一些实施方案中,培养物包含液体,并且所述方法包括收获具有一定百分比的液体的埃氏巨型球菌细胞(例如,浓缩的埃氏巨型球菌细胞)。在一些实施方案中,所述方法包括收获具有约1%至约40%、约1%至约35%、约1%至约30%、约1%至约25%、约1%至约20%、约1%至约15%、约1%至约10%、约1%至约5%、约10%、约9%、约8%、约7%、约6%、约5%、约4%、约3%、约2%或约1%的液体的细胞。在一些实施方案中,所述方法包括收获具有小于约40%,小于约35%,小于约30%,小于约25%,小于约20%,小于约15%,小于约10%,小于约9%,小于约8%,小于约7%,小于约6%,小于约5%,小于约4%,小于约3%,小于约2%或小于1%的液体的细胞。
在一些实施方案中,培养物包含液体并且所述方法包括通过除去一定百分比的液体来收获埃氏巨型球菌细胞(例如,浓缩的埃氏巨型球菌细胞)。在一些实施方案中,收获细胞包括除去约50%至约100%的液体、约55%至约100%、约60%至约100%、约65%至约100%、约70%至约100%、约75%至约100%、约80%至约100%、约85%至约100%、约90%至约100%或约95%至约100%的液体。在一些实施方案中,收获细胞包括除去至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或至少约100%的液体。
在一些实施方案中,所述方法包括通过浓缩细胞来收获埃氏巨型球菌细胞。在一些实施方案中,收获细胞包括通过选自离心、过滤、透析、反渗透及其组合中的至少一种技术来浓缩细胞。在一些实施方案中,过滤包括粘土过滤。在一些实施方案中,过滤包括切向流过滤,也称为错流(cross-flow)过滤。
在一些实施方案中,在收获时包含埃氏巨型球菌细胞的培养物的ph为约4.5至约7.0、约4.5至约6.5、约4.5至约6.0、约4.5至约5.5、约4.5至约5.0、约4.6至约6.9、约4.7至约6.8、约4.8至约6.7、约4.9至约6.6、约5.0至约7.0、约5.0至约6.5、约5.0至约6.0、约5.0至约5.5、约5.1至约6.9、约5.2至约6.8、约5.3至约6.7、约5.4至约6.6、约5.5至约7.0、约5.5至约6.5、约5.1至约6.4、约5.2至约6.3、约5.3至约6.2、约5.4至约6.1、约5.5至约6.0、约5.0至约6.1、约5.0至约6.2、约5.0至约6.3、约5.0至约约6.4、约5.1至约6.5、约5.2至约6.5、约5.3至约6.5或约5.4至约6.5。
在一些实施方案中,所述方法包括在发酵罐中的生长培养基中接种包含埃氏巨型球菌细胞的接种物以制备培养物,并在约39℃的温度孵育培养物直至培养物的ph为约6.0。在一些实施方案中,包含埃氏巨型球菌细胞的接种物是埃氏巨型球菌细胞的摇瓶培养物或其部分。在一些实施方案中,所述方法包括以1/50至1/4,000的接种物与培养基的比率接种发酵罐中的生长培养基。在一些实施方案中,接种物对培养基的比率为1/100。
在一些实施方案中,培养物还包含至少一种冷冻保护剂。在一些实施方案中,至少一种冷冻保护剂选自下组:果糖、葡萄糖、蔗糖、奶粉、婴儿配方奶、脱脂乳、海藻糖、麦芽糊精、甜菜碱及其组合。在一些实施方案中,至少一种冷冻保护剂以培养物的约1%至约50%(w/v)、培养物的约1%至约40%(w/v)、培养物的约1%至约30%(w/v)、培养物的约1%至约20%(w/v)、培养物的约1%至约10%(w/v)、培养物的约1%至约5%(w/v)、培养物的约10%至约20%(w/v)、培养物的约15%至约25%(w/v)、培养物的约20%至约30%(w/v)、培养物的约30%至约40%(w/v)、培养物的约40%至约50%(w/v)、培养物的约60%至约70%(w/v)、培养物的70%至80%(w/v)的量存在。在一些实施方案中,通过将粉末状的冷冻保护剂直接添加至浓缩的埃氏巨型球菌细胞来添加冷冻保护剂。在一些实施方案中,通过将冷冻保护剂的溶液以1/1的比率、以1/5的比率或以1/10的比率直接添加到浓缩的埃氏巨型球菌细胞中来添加冷冻保护剂。
在一些实施方案中,冷冻细胞包括将细胞置于冰箱中或使细胞与干冰、液氮或其组合接触。冷冻细胞包括在细胞处于容器中时冷冻细胞。接触细胞包括使包含细胞的容器与用于冷冻细胞的介质接触。用于冷冻细胞的介质包括但不限于冰箱、丙酮干冰浴、液氮或其组合。
在一些实施方案中,所述方法包括在约-20℃至约-210℃的温度冷冻细胞。在一些实施方案中,所述方法包括在约-20℃至约-80℃的温度冷冻细胞。在一些实施方案中,所述方法包括在约-80℃至约-210℃的温度冷冻细胞。在一些实施方案中,所述方法包括在约-20℃至约-196℃的温度冷冻细胞。在一些实施方案中,所述方法包括在约-80℃至约-196℃的温度冷冻细胞。在一些实施方案中,所述方法包括在约-20℃的温度冷冻细胞。在一些实施方案中,所述方法包括在约-80℃的温度冷冻细胞。在一些实施方案中,所述方法包括在约-196℃的温度冷冻细胞。在一些实施方案中,所述方法包括通过使细胞与液氮接触来冷冻细胞。
在一些实施方案中,所述方法包括在厌氧条件下冷冻细胞。
在一些实施方案中,冷冻产生包含细胞的冷冻丸粒。例如,可以使用速冻冰箱来实现冷冻。
在一些实施方案中,冷冻丸粒的直径为约0.001至约1.0英寸、约0.01至约1.0英寸、约0.1至约1.0英寸、约0.2至约1.0英寸、约0.3至约1.0英寸、约0.4至约1.0英寸、约0.5至约1.0英寸、约0.6至约1.0英寸、约0.7至约1.0英寸、约0.8至约1.0英寸、约0.9至约1.0英寸、约0.001至约0.9英寸、约0.01至约0.9英寸、约0.1至约0.9英寸、约0.2至约0.9英寸、约0.3至约0.9英寸、约0.4至约0.9英寸、约0.5至约0.9英寸、约0.6至约0.9英寸、约0.7至约0.9英寸、约0.8至约0.9英寸、约0.001至约0.8英寸、约0.01至约0.8英寸、约0.1至约0.8英寸、约0.2至约0.8英寸、约0.3至约0.8英寸、约0.4至约0.8英寸、约0.5至约0.8英寸、约0.6至约0.8英寸、约0.7至约0.8英寸、约0.001至约0.7英寸、约0.01至约0.7英寸、约0.1至约0.7英寸、约0.2至约0.7英寸、约0.3至约0.7英寸、约0.4至约0.7英寸、约0.5至约0.7英寸、约0.6至约0.7英寸、约0.001至约0.6英寸、约0.01至约0.6英寸、约0.1至约0.6英寸、约0.2至约0.6英寸、约0.3至约0.6英寸、约0.4至约0.6英寸、约0.5至约0.6英寸、约0.001至约0.5英寸、约0.01至约0.5英寸、约0.05至约0.5英寸、约0.1至约0.5英寸、约0.15至约0.5英寸、约0.2至约0.5英寸、约0.3至约0.5英寸或约0.4至约0.5英寸。
冷冻的埃氏巨型球菌细胞可以在冷冻干燥之前冷冻储存(例如,低于0℃)或可以立即冷冻干燥。在一些实施方案中,冷冻的埃氏巨型球菌细胞储存在低于约0℃、低于约-10℃、低于约-20℃、低于约-50℃、低于约-80℃或低于-196℃的温度。在一些实施方案中,冷冻的埃氏巨型球菌细胞储存在约-20℃、约-30℃、约-40℃、约-50℃、约-60℃、约-70℃、约-80℃、约-90℃、约-100℃、约-150℃、约-196℃或约-210℃的温度。
在一些实施方案中,将冷冻的埃氏巨型球菌细胞冻干。在一些实施方案中,将冷冻的埃氏巨型球菌细胞冷冻干燥。冷冻干燥包括例如从冷冻的细胞中除去液体。
在一些实施方案中,将埃氏巨型球菌细胞冷冻干燥包括将冷冻的细胞放入冷冻干燥器中。在一些实施方案中,冷冻干燥包括使冷冻的细胞经受减压,并逐渐将细胞加热至室温。
在一些实施方案中,所述方法包括在厌氧条件下冷冻干燥细胞。
在一些实施方案中,以商业规模生产冷冻干燥的埃氏巨型球菌。
在一些实施方案中,埃氏巨型球菌细胞的冻干在约50mtorr至约2,000mtorr、约100mtorr至约1,950mtorr、约150mtorr至约1,900mtorr、约200mtorr至约1,850mtorr、约250mtorr至约1,800mtorr、约300mtorr至约1,750mtorr、约350mtorr至约1,700mtorr、约400mtorr至约1,650mtorr、约450mtorr至约1,600mtorr、约500mtorr至约1,550mtorr、约550mtorr至约1,500mtorr、约600mtorr至约1,500mtorr、约650mtorr至约1,450mtorr、约700mtorr至约1,400mtorr、约750mtorr至约1,350mtorr、约800mtorr至约1,300mtorr、约850mtorr至约1,250mtorr、约900mtorr至约1,200mtorr、约950mtorr至约1,150mtorr或约1,000mtorr至约1,100mtorr的压强下发生。在一些实施方案中,冻干过程中的压强为135mtorr。在一些实施方案中,冻干过程中的压强为250mtorr。
在一些实施方案中,完成冻干过程的时间为约5小时至15天、约6小时至15天、约7小时至15天、约8小时至15天、约9小时至15天、约10小时至15天、约11小时至15天、约12小时至15天、约18小时至15天、约24小时至15天、约36小时至14天、约48小时至13天、约3天至12天、约4天至11天、约5天至10天、约6天至9天、约7天至8天。在一些实施方案中,完成冻干过程的时间为约18.5小时。在一些实施方案中,完成冻干过程的时间为约38.5小时。
在一些实施方案中,通过本文公开的方法产生约1×103至1×1012cfu/g的冷冻干燥的埃氏巨型球菌细胞。在一些实施方案中,冷冻干燥后约1×103至1×1012cfu/g的埃氏巨型球菌细胞是活的。
冷冻干燥的埃氏巨型球菌细胞也可以通过包括以下的方法产生:(a)在厌氧条件下制备包含埃氏巨型球菌细胞和生长培养基的培养物,所述生长培养基包含选自下组的至少两种碳源:酪蛋白、乳酸盐(即乳酸)、右旋糖、果糖、果聚糖、葡萄糖、蔗糖、乳糖、麦芽糖、乙酸盐、甘油、甘露糖醇、蔗糖、木糖、糖蜜、岩藻糖、葡萄糖胺、右旋糖酐、脂肪、油、甘油、乙酸钠、阿拉伯糖、大豆蛋白、可溶性蛋白、棉子糖及其组合,(b)在厌氧条件下收获细胞,(c)冷冻细胞,和(d)冷冻干燥细胞,其中产生约1x103至约1x1012cfu/g的冷冻干燥的埃氏巨型球菌细胞。
也可以通过包括以下的方法产生冷冻干燥的埃氏巨型球菌细胞:(a)制备包含埃氏巨型球菌细胞和生长培养基的培养物,(b)在培养结束其指数生长期后的12小时内,在厌氧条件下收获细胞;(c)冷冻细胞;(d)冷冻干燥细胞;和可选地(e)封装冷冻干燥的细胞,其中产生了冷冻干燥的埃氏巨型球菌细胞或封装的冷冻干燥的埃氏巨型球菌细胞。
也可以通过包括以下的方法产生冷冻干燥的埃氏巨型球菌细胞:(a)制备包含埃氏巨型球菌细胞和生长培养基的培养物,(b)收获细胞,(c)在收获后5小时内将细胞在约-80℃至约-210℃的温度冷冻,(d)冷冻干燥细胞,和可选地(e)封装冷冻干燥的细胞,其中产生了冷冻干燥的埃氏巨型球菌细胞或产生了封装的冷冻干燥的埃氏巨型球菌细胞。
在一些实施方案中,本发明涉及包含埃氏巨型球菌细胞的封装的冷冻干燥的组合物,其中冷冻干燥的粉末用以下封装:(a)油,包括但不限于植物油、棕榈油、棕榈酸、硬脂酸、油酸、亚油酸和亚麻酸(b)食品级聚合物,包括但不限于海藻酸盐、壳聚糖、羧甲基纤维素、黄原胶、淀粉、角叉菜胶、galatin和果胶(c)乳蛋白,包括但不限于酪蛋白和乳清蛋白,和(d)来自大豆、豆类(pulse)和谷类(cereal)的植物蛋白,包括但不限于玉米醇溶蛋白。在一些实施方案中,本文公开的方法产生的冷冻干燥的埃氏巨型球菌细胞或封装的冷冻干燥的埃氏巨型球菌细胞的量和/或冷冻干燥后存活的埃氏巨型球菌细胞或封装的冷冻干燥的埃氏巨型球菌细胞的量为约1x103cfu/g至约1x1012cfu/g、约1x103cfu/g至约1x1011cfu/g、约1x103cfu/g至约1x1010cfu/g、约1x103cfu/g至约1x109cfu/g、约1x103cfu/g至约1x108cfu/g、约1x103cfu/g至约1x107cfu/g、约1x103cfu/g至约1x106cfu/g、约1x103cfu/g至约1x105cfu/g、约1x104cfu/g至约1x1012cfu/g、约1x105cfu/g至约1x1012cfu/g、约1x106cfu/g至约1x1012cfu/g、约1x107cfu/g至约1x1012cfu/g、约1x108cfu/g至约1x1012cfu/g、约1x109cfu/g至约1x1012cfu/g、约1x1010cfu/g至约1x1012cfu/g、约1x103cfu/g至约1x105cfu/g、约1x104cfu/g至约1x106cfu/g、约1x105cfu/g至约1x107cfu/g、约1x106cfu/g至约1x108cfu/g、约1x107cfu/g至约1x109cfu/g、约1x108cfu/g至约1x1010cfu/g、约1x109cfu/g至约1x1011cfu/g或约1x1010cfu/g至约1x1012cfu/g。
在一些实施方案中,冷冻干燥的埃氏巨型球菌细胞或封装的冷冻干燥的埃氏巨型球菌细胞在约-80℃、约-20℃、约4℃、约25℃或其组合存活约14天至约24个月。在一些实施方案中,冷冻干燥的埃氏巨型球菌细胞或封装的冷冻干燥的埃氏巨型球菌细胞在约-80℃、约-20℃、约4℃、约25℃或其组合存活至少约14天、至少约1个月、至少约6个月、至少约8个月、至少约10个月、至少约12个月、至少约15个月、至少约18个月或至少约24个月。
在一些实施方案中,在约-80℃、约-20℃、约4℃或其组合的温度储存至少约14天、至少约1个月、至少约6个月、至少约8个月、至少约10个月、至少约12个月、至少约15个月、至少约18个月或至少约24个月后,约1x103cfu/g至约1x1012cfu/g、约1x103cfu/g至约1x1011cfu/g、约1x103cfu/ml至约1x1010cfu/g、约1x103cfu/g至约1x109cfu/g、约1x103cfu/g至约1x108cfu/g、约1x103cfu/g至约1x107cfu/g、约1x103cfu/g至约1x106cfu/g、约1x103cfu/g至约1x105cfu/g、约1x104cfu/g至约1x1012cfu/g、约1x105cfu/g至约1x1012cfu/g、约1x106cfu/g至约1x1012cfu/g、约1x107cfu/g至约1x1012cfu/g、约1x108cfu/g至约1x1012cfu/g、约1x109cfu/g至约1x1012cfu/g、约1x1010cfu/g至约1x1012cfu/g、约1x103cfu/g至约1x105cfu/g、约1x104cfu/g至约1x106cfu/g、约1x105cfu/g至约1x107cfu/g、约1x106cfu/g至约1x108cfu/g、约1x107cfu/g至约1x109cfu/g、约1x108cfu/g至约1x1010cfu/g、约1x109cfu/g至约1x1011cfu/g或约1x1010cfu/g至约1x1012cfu/g冷冻干燥的埃氏巨型球菌细胞或封装的冷冻干燥的埃氏巨型球菌细胞存活。
在一些实施方案中,在约25℃的温度储存至少约14天、至少约1个月、至少约6个月、至少约8个月、至少约10个月、至少约12个月、至少约15个月、至少约18个月或至少约24个月后,约1x103cfu/g至约1x1012cfu/g、约1x103cfu/g至约1x1011cfu/g、约1x103cfu/g至约1x1010cfu/g、约1x103cfu/g至约1x109cfu/g、约1x103cfu/g至约1x108cfu/g、约1x103cfu/g至约1x107cfu/g、约1x103cfu/g至约1x106cfu/g、约1x103cfu/g至约1x105cfu/g、约1x104cfu/g至约1x1012cfu/g、约1x105cfu/g至约1x1012cfu/g、约1x106cfu/g至约1x1012cfu/g、约1x107cfu/g至约1x1012cfu/g、约1x108cfu/g至约1x1012cfu/g、约1x109cfu/g至约1x1012cfu/g、约1x1010cfu/g至约1x1012cfu/g、约1x103cfu/g至约1x105cfu/g、约1x104cfu/g至约1x106cfu/g、约1x105cfu/g至约1x107cfu/g、约1x106cfu/g至约1x108cfu/g、约1x107cfu/g至约1x109cfu/g、约1x108cfu/g至约1x1010cfu/g、约1x109cfu/g至约1x1011cfu/g或约1x1010cfu/g至约1x1012cfu/g冷冻干燥的埃氏巨型球菌细胞或封装的冷冻干燥的埃氏巨型球菌细胞存活。
实施例
现在参考以下实施例,其与以上描述一起以非限制性方式示例显示了本发明的一些实施方案。
实施例1
在青贮的植物材料生产中对埃氏巨型球菌ncimb41125评价
a.植物材料的处理和青贮
将来自新鲜玉米的植物材料通过喷枪以50ml每吨植物材料的比率施加2x108cfu/ml埃氏巨型球菌细胞(即埃氏巨型球菌菌株ncimb41125,
将约100磅(lb)的用埃氏巨型球菌细胞处理的植物材料或未经处理的植物材料包装到分别的15加仑桶(即料仓)中并密封。每种处理准备四次重复。在标准条件下青贮进行120天。
每个料仓包含连接到数据记录器的温度探针。在青贮的120天内,每小时收集温度读数(℃),数据如图1所示用于用埃氏巨型球菌细胞(“巨型球菌”)的处理或对照(“对照”)。
在第7、14、21、28、39、90和120天对料仓称重以确定与在第0天时的开始重量相比,在青贮期间的累积重量损失(例如,呼吸损失)的百分比。参见图2;处理的效果,p<0.01;天数的效果,p>0.10;处理与天数相互作用,p>0.10;均值的标准误=3.16。
在三个开放日(即打开料仓之日)进行了另外的测试,三个开放日包括青贮的第0天,第14天和第120天。
b.ph和vfa测试
在开放日第0、14和120天从每个处理料仓收集样品。测量样品中的ph和挥发性脂肪酸(vfa)毫摩尔浓度。ph的平均值显示在图3中。处理无效果,p>0.6;均值的标准误=0.02。vfa浓度的平均值显示在图4中;“sem”是均值的标准误。“d”=开放日效果,p<0.05。
c.有氧稳定性测试
在每个开放日第14天和第120天,将约10lb的青贮的植物材料从每个处理料仓转移到相应的18l容器中。将每个18l容器中的样品暴露于环境空气14天。
图5和图10显示了对于在开放日第14天(图5;处理与时间相互作用,p<0.01;时间的效果,p<0.01;处理的效果,p<0.01;均值标准误差=0.023)和开放日第120天(图10;处理与时间相互作用,p>0.10;时间的效果,p<0.01;处理的效果,p<0.01;均值的标准误=1.23)的每种处理,暴露于环境空气14天内测得的平均温度(℃)。
图6和图11显示了对于在开放日第14天和开放日第120天的每种处理,在暴露于环境空气的第0天(“d0”)和第14天(“d14”)的平均ph测量值,开放日第14天(图6;处理与天数相互作用,p<0.05;时间的效果,p<0.01;处理的效果,p<0.05;以星号(*)标注的处理在第14天彼此不同,p<0.05;均值的标准误=0.07),开放日第120天(图11;处理与天数相互作用,p>0.1;时间的效果,p>0.1;处理的效果,p>0.1;均值的标准误=0.23)。
图7-8和图12-13显示了对于在开放日第14天(图7-8)和开放日第120天(图12-13)收集的每个样品,在暴露于环境空气的第0天和第14天测量的平均vfa浓度(毫摩尔(mm))。图7和图12显示了总vfa浓度,包括预青贮的样品。对于图7,处理与开放日相互作用,p>0.5;接种物的效果,p>0.1;开放日的效果,p<0.6;均值的标准误=6.65。对于图8,“d”=开放日效果,p<0.05。对于图12,处理与氧气暴露相互作用,p>0.5;接种物的效果,p>0.15;氧气暴露天数的效果,p<0.01;均值的标准误=18.4。对于图13,“d”=氧气暴露天数的效果;“i”=相互作用效果;“t”=处理效果;字母表示p<0.05。
图9和图14显示了对于在开放日第14天(图9,处理与天数相互作用,p>0.9;天数的效果,p>0.1;处理的效果,p>0.6;均值的标准误=0.16)和开放日第120天(图14,处理与天数相互作用,p>0.90;天数的效果,p>0.6;处理的效果,p<0.01;均值的标准误=0.10)的每种处理,暴露于环境空气的第0天、第7天和第14天的平均重量(lb)。
d.总结
与对照相比,在青贮之前用埃氏巨型球菌细胞处理植物材料导致例如在青贮期间中(即,在厌氧发酵期间)重量损失更少,以及在暴露于环境空气后ph降低和重量损失更少(即增加有氧稳定性)。参见,分别例如,图2、6和9。
实施例2
温度对埃氏巨型球菌的液体培养物产量的效果
测试了4℃、20℃和39℃的储存温度,以评估第0、7、14、21和28天后,埃氏巨型球菌ncimb41125的液体培养物中的细胞活力。结果表明无论取样日如何,与在20℃或39℃储存相比,将产品储存在4℃显著地改进了培养物的活力(p<0.001)。28天后,在4℃储存的产品具有3.98x106个菌落形成单位每毫升(cfu/ml),相比之下在20℃或39℃储存的产品分别为1.26x106和6.3x105cfu/ml(p<0.01;图15)。因此,结果表明降低的储存温度提高了埃氏巨型球菌ncimb41125的液体培养物的活力。
来自单独研究的另外的数据显示,在室温储存0、7、14、21和28天后,液体培养物中的埃氏巨型球菌ncimb41125的产量降低。
实施例3
使用切向流过滤来浓缩埃氏巨型球菌的培养物
研究切向流过滤(tff)作为以高通量浓缩大体积培养物的方法。
将中试(pilot)规模的tff系统(参见图17)整合到埃氏巨型球菌的生产线中并在500升(l)的生产运行中进行测试,以在70%、80%和90%的体积减少水平评估中试规模系统。使用具有一个rc100kda膜(0.875mm通道高度)的tff模块。每个减少水平执行了三个生产运行,总共进行了九个运行。每次运行均收集样品并分析其ph、光密度(od)、需氧污染物的存在与否、容量渗透摩尔浓度、挥发性脂肪酸谱、埃氏巨型球菌浓度和生长特性。从以下收集样品:从在开始过滤之前9种埃氏巨型球菌培养物(“非冷冻干燥的”),从渗透物(“渗透物”)(其是系统除去的体积)和从截留物(“截留物”)(其是体积减小后保留的包含细胞的浓缩埃氏巨型球菌培养物体积)。
在浓缩过程的开始、中间和结束时收集的渗透物样品在各体积减小水平上具有一致的od读数,所有od读数均低于0.045(数据未显示)。在浓缩过程中,在渗透物中回收的埃氏巨型球菌的量增加了(p=0.0006),但与在截留物中收集的细胞的量相比,仍可忽略不计(小于3x104cfu/ml)(<0.002%)。体积减小水平对渗透物中回收的埃氏巨型球菌浓度没有影响(p>0.9;表2)。
表2.在执行九次生产运行以评估中试规模tff系统在70%、80%和90%的体积减少期间收集的样品中的平均埃氏巨型球菌产量
在每个装袋过程的开始、中间或结束时收集的袋子中,截留物中的埃氏巨型球菌产量没有差异(p=0.6088;数据未显示)。截留物产量受体积减少水平的影响(p>0.0001;表2和图18)。90%体积减少的截留物具有比70%和80%体积减少的截留物更高的产量(p<0.0001)。但是,70%和80%的截留物彼此没有差异(p>0.09)。
当接种回到sdl-20培养基中时,过滤过程不影响埃氏巨型球菌细胞生长的能力(表3)。指数期的斜率不受体积减少水平的影响(p>0.3),但受样品类型的影响:“截留物”对比“非冷冻干燥的”(p<0.001)。滞后时间受体积减少水平和样品类型两者的影响(p<0.001)。随着体积减少的增加,截留物的滞后时间减少,这代表更高的细胞浓度。
表3.在不同的体积减少tff运行期间收集的初始埃氏巨型球菌(过滤前=非冷冻干燥)和截留物(过滤后)之间的斜率和滞后时间的比较
实施例4
埃氏巨型球菌的冷冻和冷冻干燥参数
a.截留物的冷冻和冷冻干燥
将通过tff获得的截留物用于测试冷冻方案,冷冻保护剂纳入以及多种冷冻干燥参数。
将截留物转移至无菌的脱气血清瓶中并与不同的冷冻保护剂配方(w/v)进行无菌混合:无冷冻保护剂(ctrl)、脱脂乳(sm)、海藻糖(t)和甜菜碱。将与合适的冷冻保护剂混合的截留物取样,以测定冷冻干燥前的埃氏巨型球菌浓度(即活力计数)。将混合物转移到10ml小瓶中(4ml/小瓶)并在液氮中速冻或在-80℃缓慢冷冻过夜。将小瓶转移到冷冻干燥机中,以慢速或快速循环进行冻干。一旦冷冻干燥完成,通过将冻干的产物重悬于具有厌氧稀释剂的厌氧室中,允许其在室温再水合40分钟,然后铺在sdl20琼脂上来确定细菌的存活。
通过从在与冷冻保护剂混合或未与冷冻保护剂混合的相应截留物中测量的埃氏巨型球菌的初始浓度中减去冷冻干燥后回收的埃氏巨型球菌的浓度来计算细胞损失。使用
与其他标准无关,在对照处理(无冷冻保护剂)中观察到的细胞损失是5log(cfu/ml)或更高。同样,与其他标准无关,在甜菜碱处理中观察到的细胞损失是3.96logcfu/ml或更高。可接受的细胞损失限度设置为1.6logcfu/ml。与t/sm或m/sm混合的截留物均低于该阈值,而与所采用的冷冻干燥循环或冷冻方法无关,一个例外是用t/sm冷冻在-80℃并使用慢速或快速循环进行冷冻干燥(图19)。
b.冷冻干燥条件对储存的影响
使用过滤装置将埃氏巨型球菌ncimb41125浓缩10倍,并执行冷冻干燥测定法以测试不同的特征:快速或慢速的初始冷冻(液氮对比-20℃),有或没有海藻糖(0%、4%、7.5%和10%),以及温和或快速的冷冻干燥循环(在2x10-6torr的38小时对比在135x10-6torr的16.5小时)。测试的所有冷冻干燥过程均导致产品能够保留足够的活力以在水合后启动培养物的生长,即使在室温长时间储存4至12个月后也是如此。然而,根据所使用的冷冻干燥特征观察到细菌活力的差异(图20)。慢速冷冻,掺入7.5%海藻糖和缓慢的冷冻干燥步骤从而将最终水分活度保持在0.04之上,这与埃氏巨型球菌的存活率更高有关。
c.冷冻保护剂对冷冻干燥的埃氏巨型球菌活力的效果
在冻干之前,将离心的埃氏巨型球菌ncimb41125细胞浓缩物重悬于婴儿配方奶中,导致当随后将细胞再水合时,仅使细胞活力降低1-log。在-80℃缓慢冷冻或在液氮中速冻之前,测试了向埃氏巨型球菌浓缩物中添加4%海藻糖和7.5%脱脂乳,以确定在初始冷冻过程中遇到的细胞损失。如图21所示,用4%海藻糖或7.5%脱脂乳进行速冻获得最大的活细胞回收率(活细胞计数减少0.79log)。与使用何种冷冻技术无关,不添加冷冻保护剂的产品损失2.34至1.95logcfu/ml的埃氏巨型球菌。
实施例5
贮藏条件对冷冻干燥的埃氏巨型球菌产量和稳定性的影响
为了确定冷冻干燥方案和储存条件对埃氏巨型球菌ncimb41125生长特性和储存期限的影响,将从90%体积减少获得的截留物与8%海藻糖/15%脱脂乳(t/sm)或8%麦芽糊精/15%脱脂牛奶(m/sm)混合,在-80℃或在液氮(liqn)中冷冻,并使用快速循环冷冻干燥。然后使用生长曲线分析和扩散铺板技术测试截留物样品在需氧或厌氧条件下在4℃或25℃储存0、2、4、8、12、16、20和24周期间的细菌生长特性和细胞存活。简要地说,对储存的产品进行取样,连续稀释,然后铺在sdl琼脂平板上。另外,用再水合的冷冻干燥的产物接种(1:100)生长培养基(sdl)并记录光密度(od,600nm),直到培养物达到稳定期。在3个不同日重复进行该实验,并且所有处理进行一式三份。将再水合的冷冻干燥的样品稀释以形成生长曲线,因为在没有稀释的情况下,由于存在脱脂乳,吸光度高于极限。为了协助生长曲线比较,对用作对照的非冷冻干燥样品进行了相同的稀释。
结果:将样品冷冻干燥并在有氧或厌氧条件下在室温或4℃储存6个月。仅储存2周后,有氧状态下储存的样品无论何种处理都快速腐烂并伴有相比于其厌氧对应物的额外的细胞损失,范围为0.4至3.2log。基于这些结果并为了改善图的清晰度,在图22中仅示出了在厌氧储存的冷冻干燥的产品中观察到的细胞损失。在厌氧条件下的储存期间,室温储存的样品的腐烂速度要快于在4℃储存的其对应物,但在液氮中冷冻的t/sm样品除外。在16周的储存期内,在液氮中冷冻且冷冻干燥后在室温储存的t/sm样品与在4℃储存的其对应物相比在统计学上没有损失更多的细胞(p>0.1)。但是,在储存20周后,室温和4℃储存之间样品之间的差异变得明显(p=0.0002),储存20周后的差异为0.84log和储存24周后的差异为0.89log。所有m/sm样品的腐败都快于其t/sm对应物。储存24周后(图23),在液氮中冷冻并在厌氧条件下在4℃储存的t/sm样品中细胞损失明显低于其他任何处理(p<0.02)。与在冷冻干燥之前观察到的埃氏巨型球菌浓度相比,在液氮中冷冻并在厌氧条件下在4℃储存的t/sm样品具有2.16log损失,有0.82log损失来自24周的储存期。在每个取样日,进行生长曲线实验以比较冷冻干燥产品与非冷冻干燥产品的生长特性。图24示出了对在液氮中冷冻,以快速循环冷冻干燥(在250mtorr的18.5小时)并且在4℃或室温厌氧储存的样品执行的生长曲线。用于每条生长曲线的非冷冻干燥的样品均为“新鲜”(不超过2天龄)。在4℃储存的冷冻干燥的产品比在室温下储存的冷冻干燥产品具有更短的滞后时间,这与在这些样品中观察到的埃氏巨型球菌浓度的差异是一致的(表4)。储存16周后,无论储存温度如何,t/sm样品比m/sm样品具有更短的滞后时间。
表4.在厌氧条件下在4或25℃储存12、16、20或24周后在非冷冻干燥的或再水合的冷冻干燥的样品上观察到的滞后时间,该冷冻干燥的样品获得自90%体积减少的截留物,与8%海藻糖/15%脱脂乳(t/sm)或8%麦芽糊精/15%脱脂乳(m/sm)混合,在液氮(liqn)中冷冻,并使用快速循环进行冷冻干燥
非冷冻干燥的并且msm处理在25℃储存12周和msm处理在20℃存储16周的斜率异常低(表5)。储存20周和24周后,冷冻干燥的样品的指数期斜率与非冷冻干燥的对照在数值上没有差异。
表5.在4或25℃在厌氧条件下储存12、16、20或24周后在非冷冻干燥的或再水合的冷冻干燥的样品上观察到的指数期斜率,该冷冻干燥的样品获得自90%体积减少的截留物,与8%海藻糖/15%脱脂乳(t/sm)或8%麦芽糊精/15%脱脂乳(m/sm)混合,在液氮(liqn)中冷冻,并使用快速循环进行冷冻干燥
实施例6
用埃氏巨型球菌处理鲜切饲料改变玉米青贮饲料的有机酸谱
a.青贮鲜切饲料并测量样品中的干物质、ph、vfa、乳酸和乙酸的方法
收获包含约39%干物质的全株玉米(植物材料)并用埃氏巨型球菌处理或不进行处理(对照)。将植物材料放入四个青贮袋(100-125吨/袋)中。植物材料用通过饲料收获机板载喷雾器以每吨植物材料50ml的比率施用的2x109cfu/ml的埃氏巨型球菌细胞(即埃氏巨型球菌菌株ncimb41125,
在120天的青贮之后,使用饲料探针(30”长)从每个中提取12份青贮饲料样品。从在每个袋子的长度上均匀分布的12个点采集样品,放入箔袋中,然后将其真空密封并存储在-20℃的冰箱中。从每个箔袋中取出两个子样品。第一个用于测定干物质,通过称出约200g到箔锅中并将其放入105℃的强制通风烤箱中24小时。使用手扳压机压缩其余部分以提取液体,并测量液体提取物的ph。将4ml液体提取物与1ml的25%(w/v)偏磷酸溶液合并在10ml锥形管中,然后冷冻以促进样品的脱蛋白。
然后将提取物解冻、匀浆并以14,000xg离心15分钟。将澄清的上清液转移至色谱瓶中,并使用配备有火焰离子化检测器和毛细管柱(nukol长度15mx直径0.5mmx膜厚0.5μm)的agilent7890气相色谱仪并使用氢气作为载气测定挥发性脂肪酸(vfa)的浓度。
使用比色法分析液体提取物中的乳酸浓度。简而言之,制备乳酸标准品的浓度为0、2.5、5、10和15mg/dl。将去离子水与酸化的液体提取物合并以达到40:1的稀释度。将所得溶液(0.5ml)与0.5ml的20%cuso4.5h2o、4ml去离子水和0.5g的ca(oh)2合并。将溶液剧烈涡旋并静置约30分钟,然后以1000xg离心10分钟,其后将0.5ml上清液转移至含有0.25μl的4%cuso4.5h2o的玻璃管中。向溶液中加入3ml浓硫酸,并使用涡旋混合器将溶液均质化,在沸水浴中加热5分钟,然后通过浸入冰浴中冷却至低于20℃。一旦溶液冷却,加入50μl对羟基二酚,对管进行涡旋震荡,在30℃水浴中加热30分钟,然后回到沸水浴中1.5分钟以烧掉多余的碱。将管在冰浴中冷却,并通过移液管将30μl溶液转移至96孔板中的一个孔中。使用读板器在560nm波长处测定吸光度。使用计算机软件基于从5个标准生成的回归线评估值。
使用sas的mixed程序(版本9.2)分析所有数据。将处理用作固定效应并将重复用作随机效应。使用sas中的pdiff函数比较最小二乘均值。
b.样品中干物质、ph、vfa、乳酸和乙酸含量的结果
与对照青贮饲料相比,用埃氏巨型球菌制备的玉米青贮饲料包含的干物质略少(38.8%对比40.3%;p<0.02)(表6)。表6列出了其他发酵特性。与对照(未经处理)青贮饲料相比,用埃氏巨型球菌处理的青贮饲料的青贮饲料ph稍低(3.77对比3.81;p=0.01)。与对照青贮饲料相比,用埃氏巨型球菌处理的产品含有更高浓度的丙酸酯(6.1mm对比10.0mm;p=0.04)、异丁酸酯(3.6mm对比5.1mm;p<0.01)和总挥发性脂肪酸(297.6mm对比359.1mm;p<0.001),但含有更少的乳酸(4.36m对比4.75m;p=0.01)。两种青贮饲料中存在的主要挥发性脂肪酸均由乙酸组成,其在用埃氏巨型球菌处理的玉米青贮饲料中更高(342.6mm对比286.6mm;p<0.001;图25)。
表6.来自用埃氏巨型球菌处理的青贮饲料的液体提取物的发酵特性。青贮120天后,有机酸的浓度和ph值反映了液体提取物的特性。
与未经处理的对照组相比,用埃氏巨型球菌处理的玉米青贮饲料具有更低的ph和更少的乳酸,但是含有更高浓度的挥发性脂肪酸。最显著的是,用埃氏巨型球菌处理的青贮饲料中乙酸的浓度更高,当青贮的材料暴露于环境空气中并且需氧生物的活性增加有可能破坏青贮材料(出料阶段(feedoutphase))时,这可以提高玉米青贮饲料的有氧稳定性。一般认为,具有升高浓度的乙酸的青贮饲料可改善青贮饲料的有氧稳定性。与未经处理的对照相比,用埃氏巨型球菌处理植物材料使乙酸浓度增加约20%(图25),表明该处理将提高经处理的青贮饲料的有氧稳定性。
实施例7
与未经处理的对照相比,用埃氏巨型球菌处理重构的高水分玉米粒改变发酵特性
a.青贮重构的高水分玉米粒(corngrain)并测量样品中干物质、ph、vfa、乳酸、乙酸和消化率的方法
将玉米粒干轧至约3,000μm(3mm)的平均几何粒度然后与水合并以达到32%的最终水分含量。实验处理包括未经处理的对照(对照)和用埃氏巨型球菌ncimb41125(msbiotec,wamego,ks)处理的玉米。在厌氧性稀释剂中预先稀释了埃氏巨型球菌并将其以气雾剂施加到谷粒,提供约4500万个cfu每磅谷粒。然后通过与行星式混合器(univexm20,salem,nh)掺合3分钟来使混合物均质化。然后将掺合的混合物分成两磅的等分试样,将其放入箔袋中并真空密封。每种处理重复此过程四次。指定每个处理和重复中的袋子的发酵时间为0、7、14、21或28天。将第0天的袋立即放入冰箱中进行储存。将剩余的袋子放在隔热的箱子中并分别保持7、14、21或28天的青贮期。青贮后,将袋子从箱子取出并放入冰箱。
发酵后,通过将25克样品(基于干物质)与70ml蒸馏水混合来确定所得产物的ph。将混合物放在定轨振荡器上以100rpm30分钟,然后通过长丝纸过滤。收集渗透物,并使用校准的ph计确定ph。然后将4ml渗透物与1ml的25%偏磷酸溶液合并,用涡旋混合器均质化,然后冷冻。然后将样品解冻,用涡旋混合器均质化,然后将2ml液体级分转移到离心管中,并以14,000xg离心15分钟。移取上清液并放入色谱瓶中。挥发性脂肪酸,包括乙酸酯、丙酸酯、异丁酸酯、丁酸酯、异戊酸酯、戊酸酯、异己酸酯、己酸酯和庚酸酯的浓度是通过气相色谱法使用配备有火焰离子化检测器和nukol毛细管柱(15m长度×直径0.53mm,膜厚0.50μm)的agilent7890气相色谱仪测定的。一式两份测量样品。
利用比色实验室分析来确定玉米提取物中乳酸的浓度。制备乳酸标准液的浓度为0、2.5、5、10和15mg/dl。通过将20份蒸馏水和1份渗透物合并,并用涡旋混合器均质化,将过滤的、酸化的和离心的渗透液稀释。将稀释的样品(0.5ml)与4ml去离子水、0.5g氢氧化钙和0.5ml20%硫酸铜溶液混合。将混合物以1000×g离心10分钟。将所得的上清液(0.5ml)与25μl的4%硫酸铜溶液和3ml硫酸混合,混合,并立即置于沸水浴中5分钟。然后将样品放入冰浴中并冷却至室温。向溶液中加入五十(50)μl对羟基联苯,用涡旋混合器将混合物均质化,然后将其置于86°f(30℃)的浴中30分钟。然后将样品放入沸水浴中,并在90秒后将其从浴中移出并冷却至室温。将两百(200)μl溶液放入96孔板的孔中,并使用读板器在560nm处读取吸光度。一式四份分析样品。
使用体外培养系统评估了用埃氏巨型球菌处理的玉米的消化率。从位于堪萨斯州立大学牛肉牛研究中心(beefcattlereseachcenter)的插管泽西杂交肉用公牛收集瘤胃液。瘤胃液通过粗棉布过滤,倒入分液漏斗中,充入氮气,然后在102°f(39℃)的培养箱中放置约45分钟,以便分层。丢弃底层,收集中间层并用作微生物接种物用于体外分析。将十(10)ml的滤过的瘤胃液添加到含有140mlmcdougall缓冲液和3克谷粒(干基)的培养瓶中。将内容物充入氮气,将瓶子用ankom压力感应模块(ankomrfgasproductionsystem,macedon,ny)加盖,放入102°f(39℃)的轨道床培养箱中,并连续搅拌16小时。在孵育循环结束时,将瓶从摇床中移出,并使用校准的ph计测量ph。将四(4)ml的液体层转移到小瓶中,与1ml的25%偏磷酸溶液混合,用涡旋混合器均质化,然后放入冰箱中。将每个瓶子的剩余内容物倒入浅铝锅中,并在221°f(105℃)干燥48小时。记录干燥物的重量,并确定每种培养物的干物质消失。使用先前针对谷物提取物所述的程序,通过气相色谱法确定每种培养物的有机酸谱。
b.样品中干物质、ph、vfa、乳酸和乙酸含量的结果
在图26中示出了在28天青贮期间谷粒的ph值变化。与对照(未经处理的)谷粒相比,用埃氏巨型球菌处理谷粒导致从第0天到第7天的更快ph下降(p<0.01),在青贮的第14、21和28天ph差异持续(处理的效果;时间的效果;处理和青贮天数之间的相互作用;p<0.01)。谷粒的有机酸谱总结在表7中。与对照谷粒相比,在青贮的第7天和14天时,用埃氏巨型球菌处理的重构的谷粒中挥发性脂肪酸的总浓度更高(p<0.05),但其后没有差异(p>0.50)。用或不用埃氏巨型球菌处理的青贮谷粒的乙酸和丙酸的浓度相似(p>0.10)。与对照相比,用埃氏巨型球菌处理的谷粒中的异戊酸、戊酸、异己酸、己酸和庚酸的浓度通常更高(p<0.05),但用或不用埃氏巨型球菌处理的谷粒中乳酸浓度相似(p>0.10)。
表7.来自用埃氏巨型球菌处理的重构的高水分玉米粒或未经处理的对照组的液体提取物的有机酸浓度。
在图27中总结了埃氏巨型球菌处理的玉米和未经处理的玉米的体外干物质含量变化。与未经处理的对照谷物相比,用埃氏巨型球菌处理玉米不改变玉米粒对微生物消化的易感性。来自培养物的干物质减少通常随着青贮天数增加,但是青贮天数与玉米的埃氏巨型球菌处理之间没有明显的相互作用。
该实施例表明,与对照(未经处理的)谷物相比,用埃氏巨型球菌处理高水分谷物改变青贮的谷物的发酵特性。该方法构建了在重构的高水分谷物中加速发酵活性的一种方式。
实施例8
与未经处理的对照相比,用埃氏巨型球菌处理的玉米青贮饲料饲喂牛提高胴体价值(carcassvalue)
a.饲喂牛、饲料组成和收获胴体的方法
在背景研究中使用杂种肉用公牛(336头;633±14.1lb)来评估埃氏巨型球菌作为青贮处理对生长表现的影响。到达牛肉牛研究中心约24小时后,肉用公牛接种bovishieldgold5和ultrabac7/somnubac(zoetisanimalhealth,florhampark,nj),用泼淋杀外寄生虫药处理(standguard,elancoanimalhealth,greenfield,in),用编号的耳标标识,植入带有tylan的componentte-200(elancoanimalhealth),并称重。
将肉用公牛按初始体重进行分组,并在组内分配给28个育肥场围栏(feedlotpen),每个围栏14头牛并且每个处理14个围栏。处理包括背景饮食(表8),其由未经处理的玉米青贮饲料(对照)或用10亿菌落形成单位的埃氏巨型球菌(菌株ncimb41125;msbiotec,wamego,ks)每吨新鲜饲料材料处理过的玉米青贮饲料制成。肉用公牛每天随意喂饲一次,共112天。
表8.背景和育肥饮食的组成。1湿玉米面筋饲料,cargillstarches&sweetenersnorthamerica;minneapolis,mn。2以50ml新鲜培养物每吨鲜切草料材料的比率使用板载喷雾器在收获机上将埃氏巨型球菌菌株ncimb41125施加到饲料。接种提供1000亿菌落形成单位每吨饲料。在制备对照玉米青贮饲料时不使用微生物接种物。3包含大豆粉、石灰石、盐、微量矿物质、维生素和饲料添加剂预混物,并提供(按总饮食dm计)0.25%盐、0.15ppm钴、10ppm铜、0.50ppm碘、20ppm锰、0.10ppm硒、30ppm锌、1000iu/lb维生素a、10iu/lb维生素e和30克/吨瘤胃素(elancoanimalhealth)。4包含石灰石、盐、尿素、微量矿物质、维生素和饲料添加剂预混物,并提供(按总饮食dm计)0.25%盐、0.15ppm钴、10ppm铜、0.50ppm碘、20ppm锰、0.10ppm硒、30ppm锌、1000iu/lb维生素a、10iu/lb维生素e和30克/吨瘤胃素(elancoanimalhealth)。在育肥阶段期间以0或8克/吨的比率饲喂磷酸tylosin(tylan,elancoanimalhealth)(在背景阶段的处理中平均分配)。在收获前的最后34天以24克/吨的比率喂食盐酸莱克多巴胺(optaflexx,elancoanimalhealth)。
在背景阶段结束时,称重牛,重新植入componentte-200tylan植入物,并过渡到普通的育肥饮食(表8)。在育肥阶段,每天随意喂牛一次,共115天。在育肥阶段结束时,对围栏称重,并将肉用公牛运输到商业屠宰场,在该处在收获日收集热胴体重量和肝脓肿发病率。
在冷藏36小时后,收集了肋眼(ribeye)面积、第12肋骨背脂肪厚度、大理石花纹得分以及usda质量和产量等级。最终活重计算为热胴体重量除以63%的普通修整(commondressing)百分比,并使用胴体调整后的活重计算平均日增重和饲养效率。使用标准网格(grid)确定胴体价值,该标准网格使用10年平均基准价格以及胴体溢价(premium)和折扣构建,如usda报告的(2008年1月至2018年1月)。
使用用于连续数据的mixed程序和用于分类数据的glimmix程序,在sas版本9.2(sasinst.inc.,cary,nc)中分析数据。背景处理是固定效应,块是随机效应,围栏是实验单位。
b.牛生长和饲料摄入量的结果及胴体特征
表9总结了背景和育肥阶段牛的表现。对于饲喂含有具有和不具有微生物接种物的玉米青贮饲料的背景饮食的牛,生长和育肥阶段的平均日增重、干物质摄入和饲料:增重是相似的(p>0.10)。
表9.在背景阶段(育肥场育肥之前),饲喂含有或不含有埃氏巨型球菌作为青贮饲料处理的玉米青贮饲料的肉用公牛的背景和育肥表现。以50ml新鲜培养物每吨新鲜饲料材料的比率,使用板载喷雾器在收获机上施加埃氏巨型球菌菌株ncimb41125。接种物提供1000亿个菌落形成单位每吨饲料。对照青贮饲料处理未接受接种物。¥均值的标准误。
胴体特性示于表10中。两种处理的胴体特性的单个量度相似(p>0.10);然而,与饲喂未经处理的青贮饲料的牛相比,胴体特性中非显著变化的累积影响倾向于(p<0.07)增加饲喂接种了埃氏巨型球菌的青贮饲料的牛的总体胴体价值($1628.68vs.$1597.98)(图28)。这种差异主要是由以下驱动的:埃氏巨型球菌青贮饲料组的胴体重量非显著但实质的增加,以及胴体质量和产量等级的较小差异。我们认为这些差异实际上是在背景阶段出现的,但很可能被胃肠道填充的差异掩盖了。因此,该实验表明给牛饲喂用埃氏巨型球菌处理过的青贮饲料提高了总体胴体价值。
表10.在背景阶段(育肥场育肥之前),饲喂含有或不含有埃氏巨型球菌作为青贮饲料接种物的玉米青贮饲料的肉用公牛的胴体特征。
- 还没有人留言评论。精彩留言会获得点赞!