蝉花活性物质、其制备方法、包含其的医药组合物及其用途与流程
本发明有关于蝉花活性物质的开发,特别是指蝉花活性物质于预防物理性伤害或化学性伤害所诱导的干眼症相关病变的
技术领域:
。
背景技术:
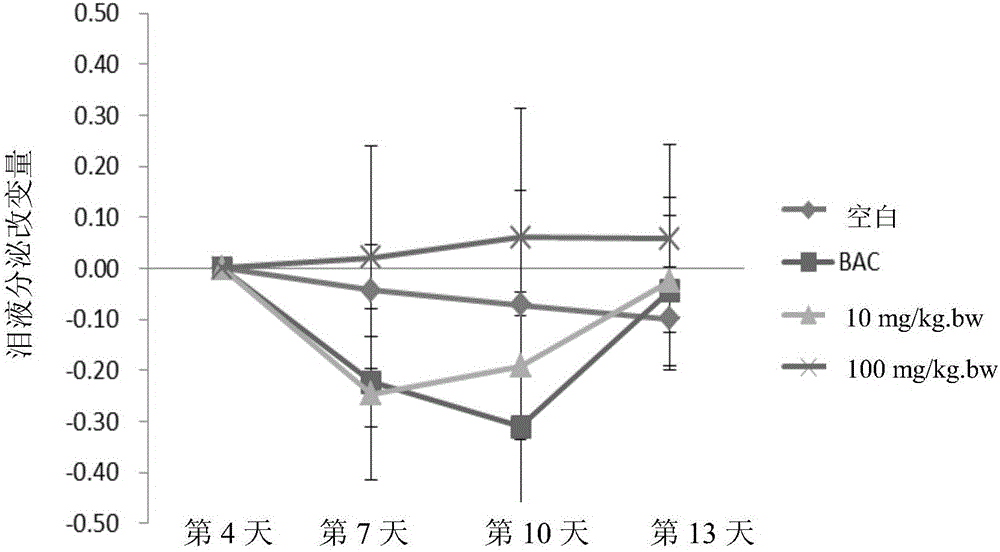
:干眼症(Xerophthalmia)“干眼症”是眼科门诊相当常见的疾病之一(占成人人口比例的10-15%),主要是由于眼球表面缺乏泪液或泪液质量不佳所引起,常见的症状包括眼睛干涩、容易疲倦、想睡、会痒、有异物感、痛灼热感、眼皮紧绷沉重、分泌物黏稠、怕风、畏光、对外界刺激敏感以及暂时性视力模糊等;有时眼睛太干、基本泪液不足反而刺激反射性泪液分泌而造成常常流眼泪的症状;较严重的患者,眼睛会红、肿、充血、角质化,角膜上皮破皮而有丝状物黏附,长期的伤害则会造成角结膜病变,并会影响视力。而造成泪液分泌不正常的原因有许多可能,包含过度用眼、长时间配戴隐形眼镜、眼表炎症、老化、荷尔蒙失衡、自体免疫疾病、糖尿病以及一些外来因素造成眼表的受损等。由于许多因素都会导致干眼症状,因此干眼症又可称为干眼症候群(Dryeyesyndrome)。泪液的组成及功用正常的眼睛表面有一层泪液层,经由眨眼的动作而均匀分布,覆盖在眼角膜及结膜上,形成一个润滑保护膜,最后经由鼻泪管排除掉,具有滋润及保护的功能;泪液层由外而内又可分为3层:(1)油脂层:由眼睑的皮脂腺所分泌,在最外层,主要功用是增加泪液膜的表面张力,延缓水层液的蒸发,润滑眼睑及眼球表面。(2)水液层:由泪腺所分泌,在中间层,占泪液膜的绝大部分,含营养素维生素及抗菌物质;主要功用是提供眼睛润滑清晰的表面、提供角膜氧气、有杀菌作用、以及清除代谢产物的作用。(3)黏液素层:由结膜的杯状细胞所分泌,在最内层,主要作用是和角结膜上 皮细胞接触,使之变成亲水性,而使得泪液水层能均匀分布在角结膜表面。这3层泪液的组成如果有一层分泌不足或是分布不均匀,都会造成干眼的症状。干眼症属于慢性疾病,根治并不容易。目前治疗法可分为内科性疗法及外科性疗法:干眼症病患的内科性疗法1.人工泪液:人工泪液除了提供润湿功能、添加水分等功能外,尚有稀释发炎物质、降低泪液渗透压等作用,因此为干眼症病患最常使用的疗法。如果对防腐剂过敏或使用频率较高(1天超过4到6次眼剂,含非人工泪液的其他药物),建议改用不含防腐剂的润滑用眼药水。2.自体血清:血清中具有类似泪液的成分,此外也富含生长因子,因此可用以治疗严重的干眼症病患。每次制备后的血清可以冷冻保存3-6个月,因此病患不必太过频繁抽血。3.化痰剂(黏液溶解剂):用以治疗呼吸道疾病的黏液溶解剂局部使用时,可以减少眼表面丝状缀生物、黏液、或黏液斑块的形成。4.植入型人工泪液:此为放置在下眼结膜深处的固体人工泪液,它可以慢慢地释放出润滑剂,在24小时内保持眼睛的湿润。但缺点是放置不易(需眼科医师示范),且病患感觉眼表浓稠,视力稍微受到影响。5.抗发炎疗法:干眼症不单单只是泪液分泌量不足,挥发太快,或是泪液成分失常而已;目前已知眼表的发炎反应也扮演重要的角色。因此,局部使用类固醇,或Restasis(环孢灵表cyclosporine眼用药水)也是治疗的另一个方针。Restasis已在2002年经过美国药品食品检验局(FDA)认证用以治疗慢性干眼症,它是目前市面上所有干眼症药物中唯一证实对泪液分泌量有增加效果的药物。6.抗生素:口服四环霉素或其相关药物(doxyclcine)对于眼睑板发炎,尤其有酒糟鼻体质的病患特别有效。然而这类的病患最好能够同时注意眼睑清洁和热疗法辅助。局部施用维他命A药膏:可用于睡前使用,但其效果目前仍有争议。7.若伴有全身免疫系统疾病的病患,则需配合风湿免疫专科医师共同治疗。干眼症病患的外科性疗法以外科疗法治疗干眼症一般用于重度、内科疗法治疗成效不彰的病患。常用的方法可以分为以下几类:1.泪小管填塞:以栓塞法将泪小管开口加以阻塞,其作用原理类似水槽的塞子,只让少量的泪液流出,让更多的泪液可以留在眼表面,帮助维持眼球上的泪膜稳定。一般而言,眼科医师会先使用暂时性、可溶解的栓塞以测试治疗效果;如果暂时性的栓塞法能改善干眼症的症状,医师才会放置永久性的栓塞。接受泪小管填塞的病患须注意术前是否有严重发炎现象,以避免手术后因发炎物质长期留置眼表而造成眼表伤害。2.眼睑缝合术:极严重的干眼患者、合并其他角膜病变或眼睑愈合不全的患者,可施行“眼睑缝合术”,以避免进一步恶化。干眼症的诊断眼科医师可由临床症状和一些检查来诊断干眼症;包括泪液分泌试验、角膜结膜染色试验、泪液层瓦解时间、以及其他泪腺的检查、结膜功能的检查等等;此外一些免疫疾病相关的检查也可以帮助找出病因。蝉花(Cordycepscicadae)蝉花型态与分布蝉花又名土蝉花、虫花、蝉草、胡蝉、蝉菌、蝉蛹草、金蝉花、蝉茸或蚕茸等,为子囊菌亚门(Ascomycotina),麦角菌目(Claricipiyales),麦角菌科(clavicipitaceae),虫草属(Cordyceps)真菌,由感染蝉蛹或蝉科山蝉(Cicadaflammate)、蝼蛄(Platypleurakaempferi)、黑蚱(Crytotympanapustulata)及竹蝉(Platylomiapieli)等幼虫身上使其死亡,后于蝉蛹前端或虫体头部形成花蕾状子座而成,故名蝉花。为一种菌虫复合体。蝉花可依不同的寄主及感染菌种分类为大蝉花或金蝉草(C.cicadae)、小蝉花(C.sobolifera)及蝉草或蝉生虫草(C.cicadicola)三种。蝉花多产于长江以南热带和亚热带地区,在中国为福建、浙江、四川、云南及江苏等地。在中国台湾部分山区亦有野生蝉花子实体踪迹。蝉拟青霉的有性阶段,被认为是大蝉草(Cordycepscicadae),大蝉草俗名独角龙,子座棒状或角状,从寄主头部发出,单生或丛生,褐色。在自然界广为分布的是蝉拟青霉(蝉花),大蝉草稀少。蝉花功效蝉花为名贵传统中药材,性寒、味甘、无毒,晒干后可入药,有散风热、镇惊、明目、退翳障、透疹的功效。主治小儿天吊、惊痫、心悸、夜啼《本草纲目》。蝉花入药已有一千多年历史,且野生蝉花的历史记载比冬虫夏草早了800年。蝉花之名最早见于南北朝刘宋时代的《雷公炮制论》,其中记载:凡使蝉花要白花全者。收得后于屋下悬干,去甲土后用浆水煮一日,至夜焙干,研细用之。根据宋朝苏颂的传统医书《图经草本》记载“山蜀中,其蝉上有一角,如花冠状,谓之蝉花。”;北宋唐慎微所著《证类草本》记载“蝉花味甘、性寒、无毒,具疏散风热、定惊解痉之效,主治小儿夜啼、心悸等症状。”;《本草纲目》亦记载“蝉花功同蝉蜕,又止疟疾。”;亦有中医药书记载主治翳膜遮睛,如:《景岳全书》“蝉花散:治肝经风热,毒瓦斯上攻,眼目赤痛,及一切内外翳障。”但目前仍无相关科学论证或发表。其他传统常用方剂如“万应蝉花散”、“蝉花明目方”及“蝉花清热方”等皆可见于《中华药物大全》及《中华药海》记载。而现今亦有文献报导“蝉花五味散”及“万应蝉花散”应用于眼部相关疾病的研究。河南医科大学第一附属医院眼科的彭广华等曾以中药生液散和“蝉花五味散”配合西药治疗外伤性低眼压。外伤性低眼压是眼外伤的一种常见并发症,严重影响视功能。结果显示中西药治疗组14人达正常眼压(>1.33kPa),有效率占46.67%,平均提高眼压0.76kPa,西药治疗组30人中8人达正常眼压,有效率占26.67%,平均提高眼压0.41kPa;中国新乡市中医院徐大梅等观察“万应蝉花散”加减内服外洗治疗春季结膜炎100例临床观察,并与西药治疗做对比观察。结果治疗组治愈率为78%,对照组为26%。一年后,治疗组复发率为22%,对照组为88%。以上二例皆为添加蝉花子实体的复方应用,分别于眼压及春季结膜炎的临床观察,并无明确表示单方蝉花或蝉花液态发酵菌丝体活性物质制备方法及其对角膜损伤或干眼症状的预防用途和效果。蝉花与冬虫夏草同属虫生真菌复合体,蝉花的功能性与应用性不亚于冬虫夏草和蛹虫草,具相近医疗保健功效,且含有相近的化学成分,所以常作为冬虫夏草的代用品。而天然冬虫夏草产量日趋减少,且天然蝉花子实体亦不多,限制了大量的使用,可以人工培养作为天然蝉花的替代品,人工培养物的主要生物活性成分、药理学作用均和天然蝉花相似或超出天然蝉花。天然蝉花的产生需依赖于寄主,而寄主又受自然环境的制约,特别是受气候因子或人为因素的影响。以人工培养品来替代日益枯竭的自然资源,为一条理想的途径,因此蝉花液态发酵菌丝体具高度经济应用价值。技术实现要素:本发明的目的为提供一种蝉花活性物质及该活性物质的制备方法,以及其用于预防或治疗物理性伤害或化学性伤害所诱导的角膜伤害或干眼症及其所导致的病变的用途。相较一般西药治疗或眼药水,本发明的制备方法更为安全、简便,其活性物质更天然、安全,并达到预防和/或治疗眼睛病变的效果。本发明提供一种用于预防和/或治疗干眼症的蝉花活性物质的制备方法,所述制备方法包括下列步骤:(a)取蝉花菌丝体于平板培养基上,于15-35℃培养5-14天;(b)将步骤(a)培养后的蝉花菌丝体接种至烧瓶内,于15-35℃、pH2-8的条件培养数天;(c)将步骤(b)培养后的蝉花菌丝体接种至发酵槽内,于15-35℃、pH2-8、槽压0.5-1.0kg/cm2且通气速率0.01-1.5VVM的条件培养3-5天,形成蝉花菌丝体发酵液;(d)将所述蝉化菌丝体发酵液冷冻干燥后磨粉,形成蝉花菌丝体冻干粉;(e)将所述蝉花菌丝体冻干粉以至少一种溶剂萃取,形成蝉花菌丝体萃取液;及(f)将蝉花菌丝体萃取液干燥后,获得所述蝉花活性物质。一实施例中,上述步骤(b)的烧瓶培养采用振荡培养,且振荡速率为10-250rpm。一实施例中,上述步骤(c)内通入发酵槽的气体包括空气、氧气、二氧化碳、氦气或其组合。一实施例中,上述步骤(a)、(b)及(c)的培养温度为25℃,且步骤(b)及(c)的pH值为4-7。一实施例中,上述步骤(b)及(c)的培养pH值为4.5。一实施例中,上述步骤(b)及步骤(c)使用相同的培养基,且此培养基包括谷类、豆类、无机盐类、糖类、酵母提取物(Yeastextract)、麦芽提取物或其组合。一实施例中,上述步骤(e)内所述溶剂的数量为两种,包括水及醇类。一实施例中,上述步骤(e)的醇类为甲醇和/或乙醇。一实施例中,上述步骤(f)内以水作为溶剂的蝉花菌丝体萃取液干燥后形成水萃物,以醇类作为溶剂的蝉花菌丝体萃取液干燥后形成醇萃物,所述蝉花活性物质为将水萃物及醇萃物混合而成。一实施例中,蝉花活性物质是由等重的蝉花菌丝体水萃物及蝉花菌丝体醇萃物混合而成。另一方面,本发明提供一种用于治疗和/或预防干眼症的蝉花活性物质,其是由以前述的制备方法制成。另一方面,本发明所述蝉花活性物质可用于制备治疗和/或预防干眼症的药物。即,本发明提供所述的蝉花活性物质在制备治疗和/或预防干眼症的药物中的应用。另一方面,本发明提供一种用于治疗和/或预防干眼症医药组合物。此医药组合物包括所述蝉花活性物质,以及药学上可接受的载剂、赋形剂、稀释剂或辅剂。另一方面,本发明所述医药组合物的可用于制备治疗和/或预防干眼症药物。即,本发明提供所述的医药组合物在制备治疗和/或预防干眼症的药物中的应用。为使本发明的特征及优点能更加清楚,以下配合附图说明本发明的具体实施方式。附图说明图1A至图1D为根据小鼠泪液测试的结果绘制的示意图(分别对应表3-1至表3-4)。图1A为根据UVB小鼠组泪液分泌改变量绘制的示意图;图1B为根据BAC小鼠组泪液分泌改变量绘制的示意图;图1C为根据UVB小鼠组泪液分泌量绘制的示意图;图1D为根据BAC小鼠组泪液分泌量绘制的示意图。图2A及图2B为根据小鼠角膜平滑度分析的结果绘制的示意图(分别对应表4-1及表4-2)。图2A为根据UVB小鼠角膜平滑度的平均分级绘制的示意图;图2B为根据BAC小鼠角膜平滑度的平均分级绘制的示意图。图3A及图3B为根据小鼠角膜清澈度分析的结果绘制的示意图(分别对应表5-1及表5-2)。图3A为根据UVB小鼠角膜清澈度的平均分级绘制的示意图;图3B为根据BAC小鼠角膜清澈度的平均分级绘制的示意图。图4A及图4B为根据小鼠角膜地图分析的结果绘制的示意图(分别对应表6-1及表6-2)。图4A为根据UVB小鼠角膜地图的平均分级绘制的示意图;图4B为根据BAC小鼠角膜地图的平均分级绘制的示意图。图5A及图5B为根据小鼠角膜损伤染色分析的结果绘制的示意图(分别对应表7-1及表7-2)。图5A为根据UVB小鼠角膜损伤染色的平均分级绘制的示意图;图5B为根 据BAC小鼠角膜损伤染色的平均分级绘制的示意图。图6A及图6B为根据小鼠HE染色分析的结果绘制的示意图。图6A为根据UVB小鼠HE染色绘制的示意图;图6B为根据BAC小鼠角膜HE染色绘制的示意图。图7A至图7D为根据小鼠泪膜破裂时间试验的结果绘制的示意图(分别对应表8-1至表8-4)。图7A为根据UVB小鼠的角膜破裂时间绘制的示意图;图7B为根据BAC小鼠的角膜破裂时间绘制的示意图;图7C为根据UVB小鼠的角膜破裂相对时间绘制的示意图;图7D为根据BAC小鼠的角膜破裂相对时间绘制的示意图。图8A及图8B为根据小鼠角膜敏感性分析的结果绘制的示意图(分别对应表9-1及表9-2)。图8A为根据UVB小鼠角膜敏感性分析的结果绘制的示意图;图8B为根据BAC小鼠角膜敏感性分析的结果绘制的示意图。用于专利程序的微生物保存:保藏日期:2015年05月04日;保藏单位:中国微生物菌种保藏管理委员会普通微生物中心(CGMCC);保藏单位地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,100101保藏编号:CGMCCNo.10486;分类命名:蝉花Cordycepscicadae。具体实施方式实验原理角膜是人体内神经最密集,感觉最灵敏的组织之一,是眼睛最前端部分,直接和空气接触,无血管组织,并透过泪液及房水获取养分及氧气,易损伤并造成疾病。因此本发明中的部分实施例即通过物理性或化学性诱导角膜损伤并评估蝉花活性物质用于预防或治疗其所导致的干眼症及其他眼部疾病的效果及用途。紫外线(UV:Ultraviolet)在地球上无所不在,依其波长区段不同可分为UVA(315-380nm)、UVB(280-315nm)及UVC(100-280nm)。紫外线的过度照射会造成光化学伤害,尤以UVB对眼球的伤害最明显。会引发自由基的形成,使眼角膜上的抗氧化酶失去活性。UVB会被角膜所吸收,主要会导致眼表(Ocularsurface)与眼角膜的光损伤,造成结膜的结缔组织增生,眼睑皮肤也会因为曝晒造成角质增生, 使眼角膜结膜及眼睑组织伤害及加速老化。长期照射会使眼睛有异物感及刺痛感,亦会产生角膜发炎、上皮脱落以及眼角膜的退化性伤害等症状。一般民众除了配戴太阳眼镜之外较少做到眼睛防护,因此在不知不觉中忽略UVB对眼表的伤害而导致慢性发炎甚至干眼症的发生。氯化苯二甲羟铵(benzalkoniumchloride;BAC、BAK)是一种阳离子界面活性剂,属非氧化性的广效杀菌剂,可用于杀菌、消毒、防腐、乳化、去垢、增溶等功能。早期常被添加于眼药水中作为防腐用途,但近来研究显示该化合物会导致泪膜不稳定性、杯状细胞的流失、结膜鳞状上皮化生(Metaplasia)和凋亡(Apoptosis)、角膜上皮屏障的破坏及更深层眼睛组织的损伤,轻度症状会导致眼睛发炎与干眼症,严重者甚至会造成眼表的永久伤害而影响视力。BAC造成上述影响的机制尚未厘清,但目前的研究已证实其会造成前趋炎症细胞激素(Proinflammatorycytokine)的释放、细胞凋亡以及氧化应激(Oxidativestress)而导致免疫炎症反应发生,此外也会与泪膜及细胞膜上的脂质成分有直接的交互作用(Interaction)。因此本发明根据上述原理,设计两种小鼠动物模式(UVB及BAC模式)来观察蝉花活性物质对于物理性或化学性诱导眼表损伤而导致的干眼症的预防效果及其应用于眼睛保健的相关用途。实验步骤蝉花活性物质的制备蝉花菌丝体来源本发明的实施例所用的蝉花(Cordycepscicadae)菌丝体由采集而得的中国台湾野生蝉花子实体,经分离而得其菌丝,并继代保存于平板培养基上,经中国台湾食品工业发展研究所做鉴定证实其基因序列为蝉花(Cordycepscicadae),此菌株现已公开寄存于财团法人食品工业发展研究所的生物资源研究中心(BCRC),寄存编号为MU30106。此菌株亦于2015年05月04日保藏至中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),该保藏单位地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,100101,保藏编号:CGMCCNo.10486;该菌株分类命名:蝉花Cordycepscicadae。但本发明所述的蝉花活性物质不限于由此菌种所得。液体培养蝉花液态发酵菌丝体活性物质的制备及蝉花菌丝体液体培养,其是将菌丝体接种于平板培养基上,于适当温度15-35℃(较佳为25℃)下培养5天至2周后,刮取菌丝接种于烧瓶内;在15-35℃(较佳为25℃),pH2-8,较佳为pH4-7,更佳者约pH4.5,振荡速率10-250rpm之下培养约3天,培养时间可依培养条件及菌丝生长情形进行调整;然后将烧瓶培养物接种于发酵槽培养基(参下表1),(同烧瓶培养基)内,在15-35℃(较佳为25℃),槽压0.5-1.0kg/cm2,pH2-8下,10-150rpm搅拌速度或不搅拌(airlift)情况,以0.01-1.5VVM通气速率通入空气,或空气与氧气、二氧化碳与氮气的混合物,较佳者为空气,培养时间为3-5天内,即得蝉花菌丝体液体培养发酵液,包括菌丝体与澄清液。此发酵液内即含本发明的蝉花活性物质。蝉花菌丝体液体培养发酵液可进一步通过干燥步骤制备为发酵液冻干粉。培养基配方如下表1:表1、培养基配方成分含量(重量%)综合性碳氮源0.01~5动植物来源蛋白及其水解物0.01~2酵母或麦芽提取物(粉、膏)0.001~2无机盐类0.0001~0.05糖类0.01~10上述培养基配方中,综合性碳氮源可为谷类(如:麦粉类)或豆类(如:黄豆粉、绿豆粉、大豆粉等);无机盐类可为硫酸镁、磷酸氢二钾、磷酸二氢钾、硫酸铁等;糖类可为葡萄糖、果糖、麦芽糖、蔗糖等。特别说明的是,上述培养基配方仅为一范例,使用时成分可依需求调整,或搭配市售培养基使用,并无特别限制。干燥干燥包含但不限于:喷雾干燥、热风干燥、滚筒干燥、冷冻干燥、减压浓缩或其他适合的干燥方法,将发酵液制备成发酵液冻干粉。萃取1.水萃取发酵液经干燥法制备而得的发酵液冻干粉加入蒸馏水回溶,以90℃-121℃温度加热数分钟,待冷却后经减压浓缩法或上述的任一干燥法进行干燥,即得蝉花菌丝体水萃物。2.醇萃取蝉花菌丝体液体培养发酵液经干燥法制备而得的发酵液冻干粉加入醇类溶剂(1%-100%重量或体积百分浓度的甲醇和/或乙醇)回溶,萃取数分钟(包含但不限于浸泡、搅拌、振荡或超音波萃取法),之后经减压浓缩法或上述的任一干燥法进行干燥,即得蝉花菌丝体醇萃物。3.萃取物混合物(任何比例)由上述的水萃物与醇萃物混合的混合物,可包含任何混合的比例,不受特别的限制。实施例1蝉花液态发酵培养及活性物质的制备菌丝体菌株:平板培养:将蝉花菌丝体接种于平板培养基上,培养基为马铃薯糊精培养基(PotatoDextroseAgar,PDA),于25℃下培养约5天。烧瓶培养:刮取平板上的菌丝接种于烧瓶内,用下表2的培养基,在约25℃,pH4.5下,于振荡机上以转速120rpm振荡培养3天;表2、培养基配方发酵槽培养:培养基同表2,将烧瓶培养物接种于发酵槽培养基内,在25℃,槽压0.5-1.0kg/cm2,pH4.5下,10-150rpm搅拌速度或不搅拌(airlift)情况,以0.5-1.0VVM通气速率通入空气,培养3天,得菌丝体与澄清液,称为蝉花菌丝体发酵液。发酵液内含本发明的蝉花活性物质。将蝉花菌丝体发酵液经冷冻干燥可得发酵液冻干粉。萃取物制备:水萃取取蝉花菌丝体发酵液冻干粉加入20倍体积蒸馏水溶解,以温度100℃加热三十分钟,待冷却后经冷冻干燥法进行干燥,得蝉花菌丝体水萃物。醇萃取取蝉花菌丝体发酵液冻干粉加入20倍体积乙醇回溶,利用超音波振荡萃取1小时,萃取悬浮液离心后取上清液经减压浓缩,得蝉花菌丝体醇萃物。萃取物混合物取上述等重的水萃物与醇萃物均匀混合并以冷冻干燥法使其完全干燥,得水/醇萃取混合物。结果:20吨发酵槽培养完毕的蝉花菌丝体液体培养发酵液经冷冻干燥后,可得约110公斤发酵液冻干粉。经由萃取步骤可取得较高浓度的用以预防和/或治疗物理性伤害或化学性伤害所诱导的干眼症及其所导致的病变的蝉花活性物质。蝉花活性物质包含蝉花菌丝体发酵液(菌丝体与澄清液)、发酵液冻干粉、水/醇萃取液混合物或其他剂型。以下实施例2中,其为以水/醇萃取液混合物作为蝉花活性物质。实施例2干眼症动物模式及相关指针的分析1.干眼症小鼠动物模式的建立实验动物:品系ICR雌性小鼠购自乐斯科公司(中国台湾),年龄7~10周,体重25~33克,饲养于中山医学大学实验动物中心,提供正常洁净饲料及饮水,饲养环境为12小时照光及12小时黑暗的循环光照,温度控制在20±2℃,湿度控制在50±5%。(1)紫外灯UVB诱导干眼症紫外灯购自Vilberlourmat公司,灯管型号为VL-6MC,波长设定为280nm~320nm范围,主要波峰在312nm。试验进行前将小鼠随机分为4组,每组6只,分别为对照组(喂食生理食盐水,未喂食蝉花活性物质、无UVB处理)、UVB处理组(经UVB处理)、低剂量试验组(喂食10mg/kg·bw蝉花活性物质,经UVB处理)及高剂量试验组(喂食100mg/kg·bw蝉花活性物质,经UVB处理)。其中,单位mg/kg·bw指每千克体重给多少毫克药物,bw代表的是体重(bodyweight)。本试验共进行10天,试验组每日皆管喂试验设计剂量的蝉花活性物质(水/醇萃取液混合物),UVB处理组及试验组由第4天开始,每日将小鼠以2.5%Avertin麻醉后置于暗箱中,眼球朝上照射0.72J/cm2强度的UVB90秒,使小鼠眼表受到损伤。所有组别进行小鼠泪液测试(第4、7及10天),泪膜破裂时间及角膜敏感性测试(第4、7及10天),角膜外观评估及牺牲后的眼球组织染色分析(第10天)以评估蝉花活性物质是否能改善由UVB造成的眼表损伤及干眼症状。数据表明(详述如后),蝉花活性物 质对紫外灯UVB物理性伤害诱导眼表损伤造成的干眼症具保护效果。(2)BAC诱导干眼症试验进行前将小鼠随机分为4组,每组6只,分别为对照组(喂食生理食盐水,未喂食蝉花活性物质、无BAC处理)、BAC处理组(经BAC处理)、低剂量试验组(喂食10mg/kg·bw蝉花活性物质,经BAC处理)及高剂量试验组(喂食100mg/kg·bw蝉花活性物质,经BAC处理)。本试验共进行14天,试验组由第1天至第13天每日皆管喂试验设计剂量的蝉花活性物质,第4天起至第13天为止,BAC处理组及试验组的小鼠,每日取体积5μL0.2%BAC点于眼球,使小鼠眼表受到损伤。所有组别进行小鼠泪液测试(第4、7、10及13天),泪膜破裂时间及角膜敏感性测试(第4、7、10及13天),角膜外观评估及牺牲后的眼球组织染色分析(第14天)以评估蝉花活性物质是否能改善由BAC造成的眼表损伤及干眼症状。数据结果显示(详述如后),蝉花活性物质对化学物质BAC化学性伤害诱导眼表损伤造成的干眼症具保护效果。2.眼表损伤程度检测项目及干眼症评估相关指针分析本试验采用两种小鼠动物模式(UVB与BAC伤害模式)来观察蝉花活性物质对于眼表的保护效果。根据试验设计,分别在试验中途及试验结束后取样进行眼表损伤程度及干眼症评估。相关指标分析采用与临床干眼症评估诊断相似的项目,包含泪液测试、角膜外观分析、HE染色组织学分析、泪膜破裂时间及角膜敏感性;其中角膜外观分析共进行角膜平滑度、角膜清澈度、角膜地图及角膜损伤染色4项评估。(1)泪液测试(Tearproduction)泪液测试可反应泪液的基础分泌量。使用石蕊试纸测试小鼠泪液的分泌量。将其置入已麻醉小鼠靠耳侧的眼窝中吸取泪液,数秒后取出试纸并测量试纸湿润长度,以评估小鼠是否有泪液分泌量改变的情形。(2)角膜外观分析分为角膜平滑度(Cornealsmoothness)、角膜清澈度(Cornealopacity)、角膜地图(Cornealtopography)及角膜损伤染色(Cornealstaining)4项进行测试,评级分数越高表示角膜受损程度越高。(2.1)角膜平滑度分析:以环形光源照射眼球表面,根据角膜反射光源环形影 像的完整度做分级,分为0级到5级;0级影像为完整无扭曲环形,1-3级依序为1/4、1/2、3/4部分的环形出现扭曲,4级为整个环形皆出现扭曲,最严重的5级则为极度扭曲到无法辨识环形线条。(2.2)角膜清澈度分析:以光源照射眼球,观察角膜的清澈度,依不透明程度分为0级到4级;0级为正常的角膜透明度,1-3级分别为轻度、中度、中度(虹膜不清楚)的不透明变性,而4级则为重度不透明变性,可观察到明显白色混浊并伴随着角膜溃疡。(2.3)角膜地图分析:角膜地图分析是以5重环形图形投射眼表,可观察较大范围的角膜平滑程度。评估方法为将眼表以十字等分成4区,每区皆有5重环形的5条圆弧线,每当1条圆弧线扭曲或无法判读时计数1分,全眼共20分;分数越高表示角膜不平滑程度越高,依程度分为0-5级,得分0分定为0级,1-4分为1级、5-9分为2级、10-14分为3级、15-19分为4级,最严重的20分定为5级。(2.4)角膜损伤染色分析:因受损的角膜会被染剂上色,故可通过染色面积来评估角膜受损的程度。依面积大小将分析结果定为0-5级,未被染色者为0级、25%以下为1级、25-50%为2级、50-75%为3级、75%-99%为4级,全角膜皆被染色则定为5级。(3)HE染色(Hematoxylinandeosinstain、H&Estain)此为组织学最常用的染色方法之一,染料苏木紫(Hematoxylin)可将嗜碱性结构染成蓝紫色,如核内染色质与胞内核糖体等,而伊红(Eosin)为酸性染料,可使细胞质及胞外基质呈现红色,以利组织学判读。在本试验的最后一天结束后,将小鼠牺牲,取出其眼球组织经3%福尔马林浸泡及正丁醇脱水后进行石蜡包埋、切片及HE染色,观察中央角膜的细胞层数、型态与厚薄度,评估给予蝉花活性物质的效果。(4)泪膜破裂时间(Tearbreak-uptime,TBUT)泪膜质量亦是影响干眼症是否发生的原因之一。泪膜破裂时间可评估泪液质量,可反应泪膜的稳定性。将1μL之0.1%液体荧光剂钠滴入结膜囊,经三次眨眼后以秒为单位记录泪膜破裂时间。90秒后,角膜上皮损伤程度分级由裂隙灯显微镜经钴蓝色滤光片评估。将角膜分成四象限,分别计分,四组分数相加取得总分(满分为16分)。未染色得0分;轻微点状染色并小于30点得1分;点状染色超过30点并无扩散现象得2分;严重点状染色并扩散,但无明显斑块得3分;有明显荧光斑块得4分。(5)角膜敏感性(Cornealsensitivity,CS)利用柯-博二氏感觉测量器(CochetandBonnetaesthesiometer)评估角膜敏感性,测量角膜中央知觉及敏感度。经物理性或化学性伤害后未麻醉的小鼠在不同时间点由颈背抓住固定并利用可调整长度的单丝纤维垂直触碰角膜表面,直至使线变弯曲到可观察到的弯度(大约偏斜5°)。如小鼠无出现眨眼反应,再依序缩短单丝纤维的长度,直到小鼠有眨眼反应。单丝纤维单位间隔0.5公分,依序使用长度6.0-0.5公分的单丝纤维触碰角膜表面测试,单丝纤维愈长,愈容易弯曲,角膜表面所承受的顶端压力愈小。眨眼反应以单丝纤维不相差大于5mm为正常。每支不同长度的单丝纤维以垂直角膜表面方向触碰,至少4次才可记为无眨眼反应。在0.5公分单丝纤维触碰的眨眼数计分为0。每次操作测量必须为同一操作者。上述实验结果皆以第18版SPSS软件进行无母数检定Mann-WhitneyU统计分析。在以下的测试结果中,星号(*)表示p<0.05,即两者间具有显著差异。实施例3蝉花活性物质对于预防干眼症及相关指标的效果评估1.泪液测试本试验使用裁切成1mm宽的石蕊试纸(ToyoRoshiKaisha,Ltd),将其置入已麻醉小鼠靠耳侧的眼窝中吸取泪液,待20秒后取出试纸并测量试纸湿润长度(mm),测试小鼠泪液的分泌量,以评估小鼠是否有泪液分泌量改变的情形。试验结果列于下表3-1至表3-4(分别对应图1A至图1D)。此结果显示,不论是物理性或化学性诱导伤害,蝉花活性物质可减少泪液分泌量改变情形并增加泪液分泌量,有助于预防干眼症症状产生和/或治疗干眼症。表3-1、UVB小鼠组泪液分泌改变量(mm)(对应图1A)表3-2、BAC小鼠组泪液分泌改变量(mm)(对应图1B)表3-3、UVB小鼠组泪液分泌量(mm)(对应图1C)表3-4、BVC小鼠组泪液分泌量(mm)(对应图1D)2.角膜外观分析(1)角膜平滑度分析:以环形光源照射眼球表面,根据角膜反射光源环形影像的完整度无扭曲至严重扭曲依序分为0级到5级。试验结果列于下表4-1及表4-2(分别对应图2A及图2B)。此结果显示,不论是物理性或化学性诱导伤害,经喂食蝉花活性物质的组别其反射光源环形影像的扭曲程度平均等级皆低于对照组,有效减少角膜平滑度伤害,有助于预防干眼症的症状产生和/或治疗干眼症。表4-1、UVB小鼠角膜平滑度平均分级表(对应图2A)表4-2、BAC小鼠角膜平滑度平均分级表(对应图2B)(2)角膜清澈度分析:以光源照射眼球,观察角膜的清澈度,依不透明程度分为0级到4级。试验结果列于下表5-1及表5-2(分别对应图3A及图3B)。此结果显示,不论是物理性或化学性诱导伤害,经喂食蝉花活性物质的组别其混浊变性程度平均等级皆低于对照组,有效减少角膜混浊变性伤害,有助于预防干眼症的症状产生和/或治疗干眼症。表5-1、UVB小鼠角膜清澈度平均分级表(对应图3A)表5-2、BAC小鼠角膜清澈度平均分级表(对应图3B)(3)角膜地图分析:以五重环形图形投射眼表,观察较大范围的角膜平滑程度。评估方法为将眼表以十字等分成4区,每区皆有五重环形的5条圆弧线,每当1条圆弧线扭曲或无法判读时计数1分,全眼共20分,依角膜不平滑程度分为0-5级。试验结果列于下表6-1及表6-2(分别对应图4A及图4B)。此结果显示,不论是物理性或化学性诱导伤害,经喂食蝉花活性物质的组别其环形圆弧线扭曲程度平均等级皆低于对照 组,有效减少角膜不平滑程度,有助于预防干眼症的症状产生和/或治疗干眼症。表6-1、UVB小鼠角膜地图平均分级表(对应图4A)表6-2、BAC小鼠角膜地图平均分级表(对应图4B)(4)角膜损伤染色分析:因受损的角膜会被染剂上色,故可通过染色面积来评估角膜受损的程度。依被染色的面积大小程度轻微至严重结果定为0-5级。试验结果列于下表7-1及表7-2(分别对应图5A及图5B)。此结果显示,试验结果表明,不论是物理性或化学性诱导伤害,经喂食蝉花活性物质的组别其被染色面积大小平均等级皆低于对照组,有效减少角膜受损程度,有助于预防干眼症的症状产生和/或治疗干眼症。表7-1、UVB小鼠角膜染色平均分级表(对应图5A)表7-2、BAC小鼠角膜染色平均分级表(对应图5B)3.HE染色(HistologyandH-Estain)利用HE染色法,观察角膜的细胞层数、形态与厚薄度。试验结果如图6A及图6B,其显示不论是物理性UVB或化学性BAC诱导伤害,喂食蝉花活性物质的组别经HE染色后可看出角膜的细胞层数、形态与厚薄度皆大于受诱导损伤的组别,有效减少角膜受损程度,有助于预防干眼症的症状产生和/或治疗干眼症。4.泪膜破裂时间TBUT(Tearfilmbreakuptime)利用荧光剂滴入结膜囊,并用裂隙灯观察泪膜破裂时间评估泪膜质量。试验结果列于下表8-1至表8-4(分别对应图7A至图7D)。此结果显示,不论是物理性或化学性诱导伤害,经喂食蝉花活性物质的组别其泪膜破裂时间及泪膜破裂相对时间皆高于诱导伤害组,有效延长泪膜破裂时间及降低角膜受损程度,有助于预防干眼症的症状产生和/或治疗干眼症。表8-1、UVB小鼠泪膜破裂时间(秒)(对应图7A)表8-2、BAC小鼠泪膜破裂时间(秒)(对应图7B)表8-3、UVB小鼠泪膜破裂相对时间(秒)(对应图7C)表8-4、BAC小鼠泪膜破裂相对时间(秒)(对应图7D)5.角膜敏感性CS(Cornealsensitivity)利用柯-博二氏测量器评估角膜敏感性。试验结果列于下表9-1及表9-2(分别对应图8A及图8B)。此结果显示,不论是物理性或化学性诱导伤害,经喂食蝉花活性物质的组别其角膜敏感度皆低于诱导伤害组,有效减少角膜损伤程度即减少角膜敏感性,有助于预防干眼症的症状产生和/或治疗干眼症。表9-1、UVB小鼠角膜敏感性(mm)(对应图8A)表9-2、BAC小鼠角膜敏感性(mm)(对应图8B)上述实施例3的试验证明,以实施例1制备方法制成的蝉花活性物质,对于物理性UVB及化学性BAC诱导的角膜损伤具有治疗效果,可改善其受损情形。故蝉花活性物质可应用于眼睛保健、干眼症治疗和/或预防的领域。上述实施方式是针对本发明的数个可行实施例的具体说明,但这些实施例并非用以限制本发明。本领域的技术人员在不脱离本发明技艺精神的范畴内,当可对这些实施例进行等效实施或变更。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1