提升及抑制免疫调节细胞表达之方法与流程
交叉引用相关申请
本发明系主张美国临时专利申请案之优先权,该美国临时专利申请案之申请号为62/052,083,申请日为公元2014年9月18日,全文以参考文献之方式并入本案。
本发明系关于提升及抑制免疫调节细胞表达之方法。尤其是,本发明系关于经由il-25提升及抑制免疫调节细胞表达之方法。
先前技术
多能人类间叶干细胞(multipotenthmscs)为体细胞祖细胞,可分离自骨髓(bm)(friedenstein,1976friedenstein,a.j.,int.rev.cytol.1976,47,327-359.;pittenger,m.f.etal.,science1999,284,143-147)及许多其它位置,如脂肪组织、脐带血、及胎盘(ericesetal.,2000erices,a.etal.,br.j.haematol2000,109,235-242;yen,b.l.etal.,stemcells2005,23,3-9;zuk,p.a.etal.,tissueeng.2000,7,211-228)。先前研究已暗示,藉由给予正确的环境引导,hmscs可分化成成骨细胞、软骨细胞及脂肪细胞之轴旁中胚层系及非中胚层系(dominici,m.etal.,cytotherapy2006,8,315-317;engler,a.j.etal.,cell2006,126,677-689)。因此,人类间叶干细胞已被广泛应用于许多再生医学之临床试验中(giordano,a.etal.,j.cell.physiol.2007,211,27-35;hare,j.m.etal.,jama2012,308,2369-2379)。又,已发现人类间叶干细胞具有很强的免疫调节性质,具有惊人的治疗潜能,如同利用该等多功能之祖细胞对免疫相关疾病之众多临床试验所证明(gebler,a.etal.,trendsmol.med.2012,18,128-134;leblanc,k.etal.,lancet2008,371,1579-1586;tan,j.etal.,jama2012,307,1169-1177)。人类间叶干细胞调控白血球之不同族群,研究最多者为针对t淋巴球,可抑制t淋巴球之效应功能(bartholomew,a.etal.,exp.hematol.2002,30,42-48;dinicola,m.etal.,blood2002,99,3838-3843;uccelli,a.etal.,nat.rev.immunol.2008,8,726-736)。该分子作用机制显示同时涉及旁分泌因子(paracrinefactors)—特别是在人类系统中—包含肿瘤生长因子-β(tgf-β)、吲哚胺2,3-二加氧酶(ido)及前列腺素e2(pge2),以及,与白血球表面受体接合之细胞表面分子(uccelli,a.etal.,nat.rev.immunol.2008,8,726-736;chen,p.m.etal.,j.biomed.sci.2011,18,49-59)。人类间叶干细胞亦影响辅助型cd4t细胞(th)次群表型之多样性,强力地使th1细胞反应转向th2细胞反应(aggarwal,s.etal.,blood2005,105,1815-1822;aksu,a.e.etal.,clin.immunol.2008,127,348-358);及,可能诱导调节性t细胞(tregs),即一种具有免疫调节功能之t细胞族群之产生(chang,c.j.etal.,stemcells2006,24,2466-2477;maccario,r.etal.,haematologica2005,90,516-525;selmani,z.etal.,stemcells2008,26,212-222)。
于t淋巴球中,一群可分泌白介素(il)-17a之t细胞逐渐受关注(dong,2008),其亦称为th17细胞,此种辅助型t细胞次族群系调控宿主反应以应对微生物感染,以及,参与许多长久以来被认为是由th1细胞所引起之自体免疫疾病及慢性发炎性疾病之致病性(miossec,p.etal.,nat.rev.drugdiscov.2012,11,763-776)。一些研究显示,人类间叶干细胞会弱化th17所调控之免疫力(ghannam,s.etal.,j.immunol.2010,185,302-312;gonzalez,m.a.etal.,arthritisrheum.2009,60,1006-1019;xu,j.etal.,blood2012,120,3142-3151);另外一些研究则发现,人类间叶干细胞实际上增强th17反应(darlington,p.j.etal.,ann.neurol.2010,68,540-545;tso,g.h.etal.,stemcells2010,28,939-954)。这些互相矛盾的报告似肇因于不完全了解人类间叶干细胞(hmsc)与th17淋巴球交互作用之相关机制,由于th17细胞在人类疾病中具有角色,此交互作用对于人类间叶干细胞的临床应用具有重要关联(korn,t.etal.,annu.rev.immunol.2009,27,485-517)。因此,本发明系检测hmsc-th17交互作用之本质,并阐明相关机制。本发明并发现,人类间叶干细胞对th17的抑制反应系同时经由旁分泌作用及细胞-细胞接触机制,并涉及il-25(亦称为il17e)及pd-l1(pd-1家族之配体)。此数据证实,人类间叶干细胞持续地分泌il-25,经由jnk及stat3,以提升pd-l1之细胞表面表达,其中stat3系与pd-l1之转录控制有关。人类间叶干细胞亦已被描述可增加具免疫调控性功能之骨髓衍生性抑制细胞(mdscs)白血球族群(yen,b.l.etal,stemcellrep.2013,1,139-51)。
技术实现要素:
本发明系提供一种于体外(invitro)提升免疫调节细胞之表达之方法,系包括以il-25处理该免疫调节细胞以增加pd-l1之表达。于一实施例中,该免疫调节细胞为人类单核细胞或人类间叶干细胞(hmsc)。该方法进一步包括以jnk及/或stat3活化剂(activator)处理该免疫调节细胞。
本发明亦提供一种藉由前述方法治疗免疫异常之方法,该免疫异常系包括,但不限于,自体免疫疾病、移植、及炎症。
本发明系提供一种抑制免疫调节细胞表达之方法,系包括抑制pd-l1之表达。该免疫调节细胞为人类单核细胞或人类间叶干细胞。该方法可进一步包括抑制il-25之表达,及/或以stat3抑制剂及/或jnk抑制剂处理。
本发明进一步提供一种治疗免疫逃避疾病(immune-evasivediseases)之方法,系包括藉由前述方法抑制免疫调节细胞之表达。该免疫逃避疾病包括,但不限于,癌症。
附图简单说明
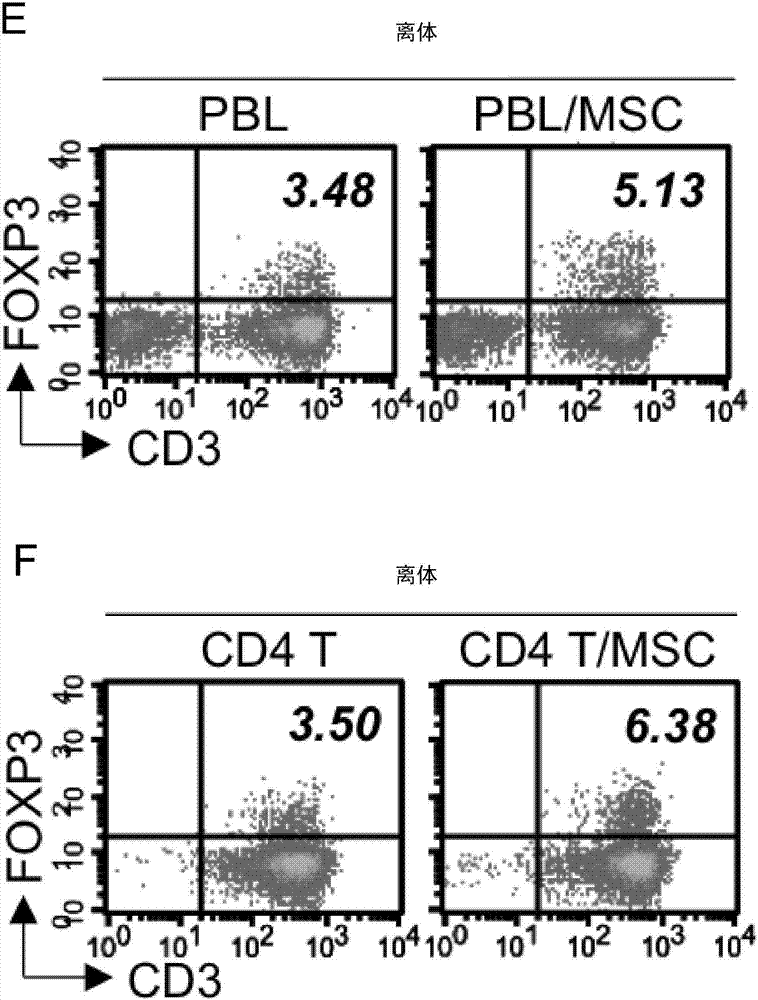
图1系表示于体外扩增之外周血白血球(pbl)及cd4细胞中,人类间叶干细胞抑制il-17a之表达,并于人类t细胞中增强foxp3表达。来自3位提供者之人类外周血白血球(a:代表数据;b:合并数据)或cd4t细胞(c:代表数据;d:合并数据)系单独(左列)或与人类间叶干细胞(提供者a&b)(右列)于抗-cd3/cd28珠粒刺激下体外共培养3天。于佛波醇12-肉豆蔻酸盐13-乙酸盐(pma)/离子霉素刺激6小时后,以胞内染色评估经活化之cd3+t细胞之il-17a之产生。右上象限之数字表示il-17a+细胞百分比。*,p<0.05。以胞内染色评估新鲜分离之外周血白血球(e)或cd4t细胞(f)系单独(左列)或与人类间叶干细胞(右列)于cd3+t细胞中之foxp3之表达。代表性点状图系显示使用3位提供者之外周血白血球/t细胞及2位提供者之人类间叶干细胞之实验;foxp3+cd3+t细胞之百分比系显示于右上象限。
图2系表示多能人类间叶干细胞抑制th17反应。人类外周血cd3+白血球(a:代表数据;b:合并数据)或cd3+cd4t细胞(c:代表数据;d:合并数据)系单独(左列)或与人类间叶干细胞(右列)于离体(exvivo)共培养3天,接着以pma/离子霉素刺激6小时。以胞内染色评估离体培养之cd3+t细胞之il-17a之产生。来自外周血白血球(n=17)或cd4t细胞(n=11)与全部3个hmsc提供者共培养之合并数据系分别显示于(b)及(d)。以流式细胞仪分析与或不与人类间叶干细胞共培养之cd3+外周血白血球(e:代表数据;f,合并数据)或cd3+cd4t细胞(g:代表数据;h,合并数据)中之il-17a及ifn-γ产生。代表性胞内染色之显示为:il-17a+ifn-γ--cd3+t细胞(r3区域)及il-17a+ifn-γ+(r5区域)cd3+t细胞,及来自外周血白血球(n=4)或cd4t细胞(n=4)与2位提供者之hmsc(提供者a&b)共培养之合并数据系分别显示于(f)及(h)。柱状图之灰色表示il-17a+ifn-γ--cd3+t细胞之百分比,而白色表示il-17a+ifn-γ+t细胞之百分比。以胞内染色分析与或不与2位提供者之人类间叶干细胞(提供者a&b)共培养之4位提供者之cd3+cd4t细胞(i:代表数据;j,合并数据)之il-22产生。细胞百分比系标注于点状图关注处之象限。数据以平均值±sd显示;*,p<0.05;**,p<0.01。
图3系表示人类间叶干细胞持续性表达il-25。以rt-pcr检测il-25基因表达:胎盘衍生性人类间叶干细胞及纤维母细胞株(mrc-5及ws-1)(a),及胎盘(左列)及骨髓(bm;右列)人类间叶干细胞各3位提供者(b)。il-25蛋白质表达之检测:(c)蛋白质印记(k562细胞株及如标示剂量之重组人类il-25(rhil-25)为阳性对照组;微管蛋白为内部对照组)及(d)针对流式细胞分析之胞内染色(左列:胎盘人类间叶干细胞提供者a;右列,bm人类间叶干细胞提供者a)。充填之柱状图表示同型对照组;未充填之柱状图表示il-25抗体染色,及合并数据(各3位提供者之胎盘及bm人类间叶干细胞)系显示于(e)。ctrl:同型对照;mfi:平均荧光强度;a.u.:任意单位。(f)胎盘人类间叶干细胞(提供者c,黑色柱状图)、bm人类间叶干细胞(提供者b,灰色柱状图)、mrc-5(条纹柱状图)、或ws-1(白色柱状图)所分泌之il-25系收集各类型细胞之条件培养基并以elisa分析。数据均以三重复之平均值±sd。
图4系表示siil-25于人类间叶干细胞中成功地沉默il-25之表达。以小段干扰rna:非专一性片段(sictrl)或针对il-25(siil-25)对间叶干细胞中il-25之表达系以(a)rt-pcr:代表性凝胶并以光密度分析定量(全部3个提供者);及(b)胞内染色分析。充填之柱状图表示同型对照;未充填之柱状图表示il-25抗体染色。a.u.:任意单位;mfi:平均荧光强度;*,p<0.05。
图5系表示于体外或体内沉默人类间叶干细胞中的l-25会逆转th17反应。新鲜分离之人类外周血白血球(a)或cd4t细胞(c)系单独(左列)或与sictrl-hmsc(中列)或siil-25-hmsc(右列)其一共培养3天,接着以pma/离子霉素刺激6小时。以胞内染色分析cd3+细胞之il-17a产生。右上象限之数字表示il-17a产生之cd3+t细胞之百分比。来自外周血白血球(n=3)或cd4t细胞(n=3)及2位人类间叶干细胞提供者(提供者a&b)之合并数据系分别显示于(b)及(d)。数据以平均值±sd表示。*,p<0.05;**,p<0.01。(e)建立野生型c57bl/6j小鼠之体内发炎条件与th17细胞扩增及人类间叶干细胞之过继转移之实验策略。(f)lps(100μg/小鼠)处理后第三天,将对照组小鼠、pbs处理之小鼠、sictrl-hmsc处理之小鼠、或siil-25-hmsc处理之小鼠,以胞内染色分析il-17a产生状况。于对照组小鼠、pbs处理之小鼠、sictrl-hmsc处理之小鼠、或siil-25-hmsc处理之小鼠(n=6)中,经计算之(g)及相对之(h)il-17a表达之cd4t细胞平均百分比。数据以平均值±sd表示。*,p<0.05.**,p<0.01;***,p<0.005。
图6系表示单独使用外生性il-25不足以对th17反应产生显著抑制作用,且,人类间叶干细胞所调控对th17反应之抑制作用需要细胞接触。(a)人类cd4t细胞以指示剂量之重组人类il-25(rhil-25)处理18小时,接着以pma/离子霉素刺激6小时。以胞内染色分析cd3+细胞之il-17a产生。右上象限之数字表示il-17a产生之cd3+t细胞之百分比;(b)5位外周血白血球提供者之合并数据。(c)人类cd4t细胞(n=4)单独或与人类间叶干细胞(2提供者:b&c)于transwell屏障存在或不存在下共培养。来自健康提供者之合并数据系显示于(d)。数据以平均值±sd表示。**,p<0.01;n.s.,不显著。
图7系表示il-25于人类间叶干细胞及人类单核细胞上诱导pd-l1表面表达。(a)以表面染色分析sictrlmscs(左列)及sipd-l1mscs(右列)之pd-l1。(b)新鲜分离之人类外周血白血球系单独(左列)或与sictrlmscs(中列)或与sipd-l1mscs(右列)共培养3天,接着以pma/离子霉素刺激6小时。以胞内染色分析cd3+细胞之il-17a产生。右上象限之数字所示之代表性数据系表示il-17a产生之cd3+t细胞之百分比。(c)显示来自外周血白血球(n=4)及2位人类间叶干细胞提供者(提供者a&b)之合并数据。(d)系显示siil-25及sipd-l1之经逆转之表型之倍数。(e)以细胞表面染色分析sictrl-hmscs(左列)及siil-25-hmscs(右列)之pd-l1表达。充填之长条图表示同型对照;未充填之长条图表示pd-l1抗体染色。(f)系显示siil-25-hmscs及sipd-l1-hmscs(共3位提供者)之pd-l1表达之合并数据,系以平均荧光强度mfi之倍数变化表示。比较以针对标的基因(il-25或pd-l1)或以sictrl沉默之人类间叶干细胞之间之pd-l1表达量。(g)以指示剂量之rhil-25处理人类间叶干细胞达18小时,并以细胞表面染色分析细胞表面pd-l1表达。图表中所示之合并数据(共3位提供者),右侧柱状图系以mfi表示(任意单位;a.u.)。(h)以指示剂量之rhil-25处理人类外周血白血球达18小时,并以流式细胞仪,采用fsc及ssc过闸,分析单核细胞表面pd-l1之表达。(i)显示合并数据(10位pbl提供者),以柱状图表达mfi。*,p<0.05;**,p<0.01;n.s.,不显著。
图8系表示人类间叶干细胞沉默il-25r系弱化t细胞il17a产生之抑制效果。(a)以免疫印记法检测人类间叶干细胞上il-25r之表达。(b)以表面染色分析sictrlmscs(左列)与siil-25rmscs(右列)上之il-25r。充填之长条图表示同型对照;未充填之长条图表示il-25r抗体染色。(c)新鲜分离之人类外周血白血球系单独(左列)或与sictrlmscs(中列)或siil-25rmscs(右列;提供者a&b)共培养3天,接着以pma/离子霉素刺激6小时。以胞内染色检测cd3+t细胞(3位提供者)中il-17a之产生。右上象限之数字表示il-17a产生之cd3+t细胞之百分比。(d)系显示来自外周血白血球(n=3)之合并数据。
图9系表示于人类单核细胞及人类间叶干细胞中,il-25系经由jnk及stat3而调控pd-l1之表达,且stat3涉及pd-l1之转录控制。(a)人类外周血白血球于100ng/mlrhil-25处理前,以抑制剂stat3(wp1066;2.5μm)、jnk(sp600125;25μm)或mek1(pd98059;20μm)预处理18小时,接着以流式细胞仪以fsc及ssc过闸,分析单核细胞上之pd-l1表面表达。充填之长条图表示同型对照;未充填之长条图表示pd-l1抗体染色。(b)显示合并数据(3提供者)及表示mfi之柱状图。人类间叶干细胞以下列抑制剂:(c)stat3(wp1066;2.5μm)及(d)jnk(sp600125;25μm)处理6小时,接着以流式细胞仪分析pd-l1表面表达。系提供个别抑制剂(左表)之合并数据(共3位提供者)及表示mfi之柱状图。(e)以tfsearch网页基础之软件测定之于人类pd-l1基因之近侧启动子区域之假设gas单元(stat键结位置),系转录起始位置之上游700bp。(f)以染色质免疫沉淀(chip)及对区域1及区域2之启动子专一性引物分析人类间叶干细胞中stat3或igg(阴性对照组)之键结。输入样本(阳性对照组)代表1%起始染色质。(g)hmsc所调控之th17反应之抑制作用之模块示意图,系涉及il-25/stat3/pd-l1序列轴。
图10系表示il-25诱导之pd-l1表达于人类外周血单核细胞中参与之讯号途径。(a)mek抑制后之pd-l1表达之合并数据(3提供者)(以mfi显示)。(b)以抑制剂pi3k(ly294002;10μm)或akt(aktinhibitoriii;10μm)预处理人类外周血单核细胞,接着以100ng/mlil-25刺激。于il-25处理18小时后,藉由细胞表面染色检测pd-l1表达。(c)显示pd-l1表达之合并数据(3提供者),以mfi显示。a.u.:自行设定单位。
图11系显示il-25可扩增外周血白血球中的cd33-/cd11b+/cd33+骨髓衍生性抑制细胞(mdsc)。藉由重组人类il-25自人类外周血白血球扩增cd14-cd11b+cd33+细胞。同种异体之外周血白血球(2提供者)系单独培养或如指示添加不同剂量之il-25。首先,以前向散射(fsc)/侧向散射(ssc)(r1)过闸,接着针对cd14-及cd11b+(r2)分析,并进一步针对cd33+分析(r3,表示细胞百分比)。
实施方式
于本发明中,一种于体外提升免疫调节细胞之表达之方法系包括以il-25处理该免疫调节细胞以增加pd-l1之表达。于一实施方案中,该免疫调节细胞为人类单核细胞或人类间叶干细胞(hmsc)。
于一些实施方案中,该人类间叶干细胞系分离自骨髓、脂肪组织、脐带血、或胎盘。于另一实施方案中,该人类单核细胞可分离自外周血白血球。于一实施方案中,于体外提升免疫调节细胞之表达之方法可进一步包括以jnk及/或stat3活化剂处理该免疫调节细胞。
于本发明中,一种治疗免疫异常之方法,系藉由使用前述于体外提升免疫调节细胞之表达之方法。于一些实施方案中,该免疫异常可为自体免疫疾病、移植、及炎症。
于本发明中,一种抑制免疫调节细胞表达之方法,系包括抑制pd-l1之表达。于一实施方案中,该免疫调节细胞为人类单核细胞或人类间叶干细胞。又,该人类间叶干细胞可为骨髓、脂肪组织、脐带血、或胎盘之间叶干细胞。
于一实施方案中,该抑制免疫调节细胞表达之方法可进一步包括抑制il-25之表达。于一些实施方案中,该il-25之表达系藉由抑制il-25与il-25r之间的交互作用、或以抗-il25或抗-il-25r抗体处理而抑制。于一些实施方案中,抑制该il-25之表达,系藉由指向(targeting)il-25及il-25r之sirna处理而抑制il-25与il-25r之表达。
于另一实施方案中,该抑制免疫调节细胞表达之方法可进一步包括以stat3抑制剂及/或jnk抑制剂处理。于一些实施方案中,该stat3抑制剂为wp1066,而该jnk抑制剂为sp600125。
本发明进一步提供一种治疗免疫逃避疾病之方法,系藉由前述方法抑制免疫调节细胞之表达。该免疫免疫逃避疾病包括,但不限于,癌症。
实施例
实验流程
细胞培养
依据先前已发表之流程(pittenger,m.f.etal.,science1999,284,143-147;yen,b.l.etal.,stemcells2005,23,3-9),由bm及胎盘将人类间叶干细胞分离及扩增。简言之,胎盘间叶干细胞系分离自人类足月胎盘(38至40周妊娠;3位提供者分别标示为a、b及c),向机构审查委员会呈报及经同意后进行。将胎盘组织经机械性及酶促消化(0.25%胰蛋白酶-edta;购自gibco-invitrogen),并培养于杜氏改良之伊格氏培养基(dmem)-低葡萄糖(gibco-invitrogen)、10%胎牛血清(fbs;hyclone)、2mml-谷氨酰胺(gibco-invitrogen)、及100u/ml青霉素-链霉素(gibco-invitrogen)中。骨髓间叶干细胞(bmmsc)可自商业上购得(cambrex,2位提供者标示为a及b;及promocell,1位提供者标示为c)。除非另有指示,所使用的人类间叶干细胞均为胎盘衍生性。人类外周血白血球(pbl)系分离自健康供给者血液样本(台湾血液基金会台北捐血中心,位于台湾台北)之白色血球层(buffycoat),向机构审查委员会呈报及经同意后进行;以及如先前报导之方式(chang,c.j.etal.,stemcells2006,24,2466-2477;yen,b.l.etal.,stemcellreports2013,1,139-151)培养。依据制造商之流程,利用人类cd4微粒(microbeads)(购自miltenyibiotec)自pbl纯化cd4t细胞。以流式细胞仪分析纯度(>98%为cd4阳性)。人类纤维母细胞株mrc-5及ws-1系得自美国菌种保存中心(atcc),并依所建议之流程培养。
人类间叶干细胞-白血球共培养试验
在与人类外周血白血球或cd4细胞共培养之前,于6孔平盘中以每孔3.5x104细胞涂布人类间叶干细胞,并于37℃培养24小时。针对共培养,将1x105人类外周血白血球或cd4细胞添加至包含人类间叶干细胞之孔洞中,并以磁性抗cd3/cd28涂覆之dynabeads(gibco-invitrogen)依据制造商之说明书进行刺激或否。3天后,将细胞以佛波醇12-肉豆蔻酸盐13-乙酸盐(pma)(50ng/ml;sigma-aldrich)加上离子霉素(1μg/ml;sigma-aldrich)于莫能菌素(ebioscience)存在下刺激6小时,接着以胞内染色评估t细胞之il-17a之表达。针对transwell培养,将人类外周血白血球或cd4细胞涂布于穿孔细胞培养平盘之上方分隔(0.4μm孔洞尺寸;bdfalcontm),而人类间叶干细胞涂布于下方分隔。于建立对单核细胞及人类间叶干细胞之毒性概况后,将人类重组il-25(rhil-25;peprotech)及不同抑制剂(wp1066/insolutiontmstat3抑制剂iii及akt抑制剂iii,购自millipore;sp600125jnk抑制剂及ly294002pi3激酶抑制剂,购自cellsignalingtechnology;以及pd98059/mek1/2抑制剂,购自cellsignalingtechnology)依据所指示之剂量添加于不同实验组别中。
流式细胞仪
以下列抗体(括号内为购买来源)对细胞染色:抗人类il-25-pe(r&dsystems)、小鼠igg1同型对照-pe(r&dsystems)、抗人类cd3-pe/cy5(biolegend)、抗人类cd4-pe(biolegend)、抗人类il-17a-pe(ebioscience)、抗人类ifn-γ-fitc(biolegend)、抗人类il-22-pe(ebioscience)、抗人类foxp3-alexafluor488(bdpharmingen)、抗人类cd274(b1-h1)-pe(ebioscience)、小鼠igg1同型对照-pe(ebioscience)、抗人类il-25r-pe(r&dsystems)、及小鼠igg2b同型对照-pe(r&dsystems)、抗小鼠cd4-apc(ebioscience)、抗小鼠cd3e-pe/cy5(ebioscience)、及抗小鼠/大鼠il-17a-pe(ebioscience)。以bdfacscaliburtm(bdbiosciences)仪器收集数据,并以软件cellquestprosoftwear(bdbiosciences)分析。
质谱法
依据先前报导(chang,w.c.etal.,int.jproteomics2010,726968)进行串联式质谱(ms/ms)实验。简言之,系以ltq-fticrms(购自thermoelectron)配备奈电洒离子源(购自newobjective)、agilent1100系列二元hplc泵(购自agilenttechnologies)及famos自动注射器(购自lcpackings)进行ms/ms。以计数1,000之最小阈值作为ms/ms连续分离之临界值,系藉由ltq以个别带电离子排斥达到ms/ms定序。
rt-pcr
依据制造商之说明书,利用trizol试剂(购自gibco-invitrogen)由细胞制备全rna。以improm-ii反转录酶(购自promega)由该rna合成第一股cdna。针对pcr,以下列引物组对cdna进行pcr。il-25,正向
5’-ttcctacaggtggttgcattc-3’、反向
5’-cgcctgtagaagacagtctgg-3’(furuta,s.etal.,sci.transl.med.2011,3,78ra31);β-肌动蛋白,正向5’-tggcaccacaccttctacaatgagc-3’、反向5’-gcacagcttctccttaatgtcacgc-3’。
elisa
人类il-25elisa试剂盒系购自peprotech,并依据制造商之说明书进行。其检测范围为0~2000pg/ml。
rna干扰
以隐形(stealth)rna干扰(rnai)双链体寡核苷酸(gibco-invitrogen)依据制造商之说明书,沉默(silencing)人类il-25、il-25r或pd-l1于人类间叶干细胞中的表达,并以无目标sirna(中度gc双链体)作为对照组。依据制造商之说明书,以lipofectaminernaimax(gibco-invitrogen)进行rnai之转染。以流式细胞仪确认敲减(knockdown)效果。
人类间叶干细胞过继转移(adoptivetransfer)
所有动物试验均依据已经机构内动物照护及使用委员会核准之实验流程进行。野生型c57bl/6j小鼠系购自动物实验中心(位于台湾台北)。以类似于先前报导之方式(shi,g.etal.,j.immunol.2013,191,415-423),进行th17细胞之体内诱导。简言之,取8至12周之小鼠,以腹腔注射入lps(100μg;escherichiacoli00041:b4;sigma-aldrich),接着于2小时后,以无目标rnai或il-25rnai转染(分别为sictrl或siil-25)后,注入人类间叶干细胞(1x105细胞/小鼠)。于第3天牺牲小鼠,并取得脾细胞以测定cd4t细胞中之il-17a+表达。
染色质免疫沉淀(chip)
chip分析系以ez-zymetm染色质制备试剂盒(millipore)及ez-chiptm染色质免疫沉淀试剂盒(millipore)依据制造商之说明书进行。经消化之染色质系用以进行多重免疫沉淀,系使用抗-stat3(124h6)小鼠单克隆抗体(cellsignalingtechnology)及一般小鼠igg。百分之一之反应系移除以作为输入染色质。pcr检测系利用对人类cd274启动子区域中stat3之推定之键结位置为专一性之引物组进行。该引物组之序列为:
正向5′-aggtgcgttcagatgttggc-3′及
反向5′-tgcccaaggcagcaaatccag-3′,可扩增-337bp至-118bp之片段;以及,
正向5′-tgacaccatcgtctgtcatc-3′及5′-gtcagcagcagacccatatg-3′,可扩增-803bp至-477bp之片段。
免疫印记分析
全细胞溶胞液之制备,系将细胞置于溶解缓冲液(300mmnacl、50mmhepes[ph7.6]、1.5mmmgcl2、10%甘油、1%tritonx-100、10mmnapyrpo4、1mmegta、0.1mmedta、1mmdtt、1mmpmsf、及1mmna4vo3)中于4℃下达15分钟而溶解细胞。溶胞液首先以12,000×g离心20分钟。将等量的样本溶解于7%sds-page,接着转移至硝化纤维素(gehealthcare)并以抗-il-25r抗体(genetex)点渍。
统计分析
以学生t测试(双侧)进行两组之间的统计分析,并以anova进行多组的统计分析。统计显著性系设定为p<0.05。所有数据均以平均值±sd表示。
结果
人类间叶干细胞抑制th17反应
由于msc-th17的交互作用有许多相互矛盾的报告,本发明首先设定以回答人类间叶干细胞系促进或抑制th17细胞扩增。为了检测,系使用胎盘衍生性人类间叶干细胞,其已于先前证实可为三种系多能祖细胞且为免疫调节性,类似于bmmscs(yen,b.l.etal.,stemcells2005,23,3-9;chang,c.j.etal.,stemcells2006,24,2466-2477;yen,b.l.etal.,stemcellreports2013,1,139-151)。该等人类间叶干细胞接着与人类外周血白血球(外周血白血球)或经纯化之cd4t细胞于稳态下共培养3天。于佛波醇12-肉豆蔻酸盐13-乙酸盐(pma)/离子霉素处理6小时后,约1至3%之未激活(non-primed)t细胞变成il-17a生产者,并发现,当人类间叶干细胞存在时,外周血白血球(图2a,代表数据;图2b,合并数据)或cd4t细胞(图2c,代表数据;图2d,合并数据)中之il-17a-表达之t细胞之频率强烈减少60%-65%。为了进一步确认此表征,以抗-cd3/cd28珠粒并添加离子霉素体外刺激外周血白血球或t细胞以活化th17作用者表型(santarlasci,v.etal.,immunity2012,36,201-214)。发现到,体外扩增之il-17a表达之外周血白血球(图1a,代表数据;图1b,合并数据)及t细胞(图1c,代表数据;图1d,合并数据)之频率系显著减少,与人类间叶干细胞存在的情况一致。已知tregs及th17种系互为连锁,其中一种会被选择超过另一种以维持体内免疫平衡(weaver,c.t.etal.,nat.rev.immunol.2009,9,883-889)。附随地,发现在与人类间叶干细胞共培养后,外周血白血球及cd4细胞中的foxp3表达之天然tregs之频率系增加(图1e及1f)。人类间叶干细胞不只抑制il-17a细胞,亦显著地抑制il-17a/ifn-γ双重生产者细胞,其为th17细胞在发炎位置的主要次型(annunziato,f.etal.,j.exp.med.2007,204,1849-1861;zielinski,c.e.etal.,nature2012,484,514-518)。先前报导显示,于外周血白血球及t细胞中,人类间叶干细胞系强力抑制ifn-γ—一种典型的th1细胞介素—产生(aksu,a.e.etal.,clin.immunol.2008,127,348-358;aggarwal,s.etal.,blood2005,105,1815-1822),本发明发现此情况为真(分别为图2e及2g)。另外发现人类间叶干细胞系实质上抑制ifn-γ/il-17a表达之t细胞(针对外周血白血球:图2e,代表数据;图2f,合并数据;针对cd4细胞:图2g,代表数据;图2h,合并数据)。亦已知th17细胞可产生il-22(dong,c.,nat.rev.immunol.2008,8,337-348),且将cd4t细胞与人类间叶干细胞共培养亦显著降低il-22产生(图2i,代表数据;图2j,合并数据)。此等结果证实,人类间叶干细胞系有效地抑制th17反应。
人类间叶干细胞持续表达il-25
于人类系统中,间叶干细胞-t细胞交互作用系主要牵涉于旁分泌因子(kim,n.etal.,ann.hematol.2013,92,1295-1308);因此,为了鉴定能够抑制th17反应之可能候选分泌因子,系对人类间叶干细胞之条件培养基进行质谱(ms)分析。令人惊讶地是,ms/ms研究显示人类间叶干细胞可高量分泌il-25(亦已知为il17e,及为th17反应之潜在抑制剂(kleinschek,m.a.etal.,j.exp.med.2007,204,161-170;zaph,c.etal.,j.exp.med.2008,205,2191-2198))。为了重新验证ms/ms结果,发明人检验了不同来源之人类间叶干细胞之il-25之转录子,并与其它体细胞类型如纤维母细胞比对。il-25信使rna(mrna)可于人类间叶干细胞中被检测到,但于纤维母细胞株mrc-5或ws-1则否(图3a)。于来自三个不同提供者之人类胎盘衍生性间叶干细胞及人类骨髓间叶干细胞中,亦检测到il-25mrna之表达(图3b),表示在横跨不同来源之人类间叶干细胞之il-25表达之信赖度。为确认il-25蛋白质产生,以全部蛋白质产物进行蛋白质印记(图3c)及以胞内流式细胞仪侦测il-25(图3d),于两种分析中均可检测得蛋白质表达。另外亦发现,以elisa检测,可测得人类间叶干细胞于条件培养基中所表达之il-25蛋白质为分泌型(图3e)。该等发现系暗示人类间叶干细胞持续性产生il-25。
沉默人类间叶干细胞所衍生之il-25,系于体外及体内逆转th17反应之抑制作用,但仅外生性il-25则不足以抑制th17反应。为测定人类间叶干细胞所分泌之il-25是否涉及抑制th17反应,将il-25于人类间叶干细胞中的表达藉由rna干扰作用(siil-25)而沉默。于确认减弱效果后(图4a及4b)发现,与对照组经沉默之人类间叶干细胞(silencedhmsc,sictrl)(图5a)相较,以对人类间叶干细胞基因专一性之小段干扰rna(sirna)沉默il-25分泌作用几乎完全逆转了对th17细胞的抑制效果。于il-17a-表达之t细胞中,与sictrl-人类间叶干细胞共培养者,可见平均降低35%;当使用siil-25-人类间叶干细胞时,则完全消失(图5b)。当sictrl或siil-25-人类间叶干细胞与经纯化之cd4淋巴球共培养时,亦可见类似倾向(图5c)。当以sictrl-人类间叶干细胞共培养时,th17淋巴球平均降低至基准线之52%;而采用siil-25-人类间叶干细胞时为87%(图5d)。藉由将sictrl-人类间叶干细胞或siil-25-人类间叶干细胞之一过继转移至脂多糖(lps)处理之c57bl/6j小鼠中,进一步证实在体内发炎条件下,人类间叶干细胞所衍生之il-25对于th17抑制之能力(图5e)。发现sictrl-人类间叶干细胞之体内转移系抑制脾脏之il-17a表达之cd4t细胞之族群,而siil-25-人类间叶干细胞则并未达成此种反应(图5f及5g)。于sictrl-人类间叶干细胞之转移,il-17a表达之t细胞系平均降低至基准线之41%,但转移siil-25-人类间叶干细胞几乎完全消除该等效果,使il-17a表达之t细胞系平均回到基准线之98%(图5h)。该等数据证实,人类间叶干细胞所分泌之il-25系涉及体外及体内之抑制th17反应。
为进一步确认il-25于抑制th17反应中的角色,以重组人类il-25(rhil-25)处理cd4t细胞达18小时,再以pma/离子霉素刺激并检测cd4细胞中之il-17a之量。令人惊讶的是,发现单独添加il-25至cd4细胞无法抑制th17反应至明显程度(图6a,代表数据;图6b,合并数据)。另外,当藉由transwell膜将cd4t细胞与人类间叶干细胞分离,于cd4细胞中之倾向th17细胞之抑制性反应丧失(图6c,代表数据;图6d,合并数据)。此暗示膜结合因子似乎亦参与il-25调控之效果。
藉由上游调控pd-l1之表面表达,人类间叶干细胞所分泌之il-25系抑制th17反应。
已有报导(chang,c.j.etal.,stemcells2006,24,2466-2477;stagg,j.etal.,blood2006,107,2570-2577),持续表达于人类间叶干细胞表面之pd-l1配体,于人类t细胞中为一种对il-17a产生之强力抑制剂(brown,j.a.etal.,j.immunol.2003,170,1257-1266;hirahara,k.etal.,immunity2012,36,1017-1030)。因此,考虑到人类间叶干细胞所分泌之il-25对th17反应之效果,可能经由与此种间叶干细胞表面分子之交互作用而调控。为了确认先前报导中pd-l1于th17细胞上之抑制效果,以sipd-l1减弱pd-l1于人类间叶干细胞之表达(图7a)。发现与先前报导一致的结果,于人类间叶干细胞中减弱pd-l1,系逆转对th17细胞之抑制作用(图7b及7c),但与siil-25处理者相较为明显较低程度(图7d)。为检测pd-l1于th17反应之il-25依赖性抑制作用中之角色,需探讨il-25是否涉及pd-l1于人类间叶干细胞之表达。发现当il-25于人类间叶干细胞中被沉默时,pd-l1之表面表达被强力减少,且减少至类似于以对其专一性之sirna减弱之程度(图7e,代表数据;图7f,siil-25vs.sipd-l1之合并数据),表示il-25可能诱导pd-l1表达。il-25之受体为il25r(lee,j.etal.,j.biol.chem.2001,276,1660-1664),检查il25r于人类间叶干细胞之表达,蛋白质印记显示人类间叶干细胞持续表达此受体(图8a)。当以siil-25r沉默il-25r于人类间叶干细胞上之表达(图8b),发现人类间叶干细胞对th17反应之抑制作用明显被消除(图8c&8d)。故,人类间叶干细胞所分泌之il-25需要于人类间叶干细胞上与其受体il-25r交互作用,以引导th17反应之抑制作用。
为了进一步确认il-25于pd-l1表达之交互作用,将rhil-25直接添加至人类间叶干细胞,以分析pd-l1之进一步之正调控。发现外生性rhil-25可进一步提升pd-l1于人类间叶干细胞之表面表达,但未达显著程度(图7g),可能系因pd-l1原本即为持续性高度表达于人类间叶干细胞上,因而掩盖了rhil-25之进一步效果。故,为进一步厘清il-25对pd-l1表达之显著性,采用来自外周血白血球之人类初级单核细胞,已知该等细胞会对il-25反应且其pd-l1表达量以基准线而言为低浓度(caruso,r.etal.,blood2009,113,3512-3519)。发现当人类外周血白血球以rhil-25处理时,单核细胞中pd-l1表达系戏剧性及显著性的增加,且具有剂量依赖性(图7h,代表数据;图7i,合并数据)。因此,此等发现证实il-25系涉及人类间叶干细胞及人类单核细胞中之pd-l1表面表达之正向调控。
il-25诱导之pd-l1正向调控系经由jnk及stat3所调控,且stat3涉及pd-l1之转录控制
接着欲探讨il-25调控之pd-l1之讯号途径。首先采用来自人类外周血白血球之单核细胞以回答此一问题,于该种细胞中pd-l1为诱发性而非持续性表达。于人类初级单核细胞中,wp1066:一种stat3抑制剂,或sp600125:一种jnk抑制剂,实质上消除了il-25调控之pd-l1诱导(图9a,代表数据;图9b,合并数据)。反之,pd98059:一种mek1/2抑制剂显示最小效果,而ly294002:一种pi3k抑制剂及akt抑制剂ii仅部分影响il-25诱导之pd-l1之表达(图10a及10b)。于持续性高量表达pd-l1之人类间叶干细胞中,亦发现wp1066之stat3抑制作用(图9c)或sp600125之jnk抑制作用(图9d)会大幅减少pd-l1之表达。
由于stat3亦已知为转录因子,合理推测此分子可能不只涉及il-25调控之pd-l1表达,还可能在pd-l1之转录控制上扮演某种角色。为了回答此一问题,首先分析介于-700核苷酸及+1核苷酸之间之人类pd-l1基因之启动子,其为假设之stat3键结单元。以软件预测为基准,发现介于转录起始位置上游595至116bp之间之三种假设gas单元(stat3键结位置)(图9e),提高了stat3可直接键结至pd-l1启动子之可能性。为测试此种可能性,以染色质免疫沉淀(chip)测定stat3于人类间叶干细胞中是否键结至pd-l1启动子,发现stat3系持续加至该pd-l1启动子之gas单元(图9f)。此数据证实,于人类间叶干细胞中,il-25系经由jnk及stat3而调控pd-l1之细胞表面表达,而stat3系涉及pd-l1之转录控制(图9g)。
为了进一步确认il-25可诱导来自外周血之骨髓衍生性抑制细胞(mdscs)扩增,同种异体之pbl(2提供者)系单独培养或如指示添加不同剂量之il-25(图11)。经处理之细胞首先以前向散射(fsc)/侧向散射(ssc)(r1)过闸,接着针对cd14-及cd11b+(r2)分析,并进一步针对cd33+分析(r3,表示细胞百分比)。此数据证实il-25可于外周血白血球中扩增cd33-/cd11b+/cd33+mdscs。
讨论
人类间叶干细胞已知为广泛性免疫调节性,且此等效果具治疗关连性(caplan,a.i.etal.,cellstemcell2011,9,11-15;leblanc,k.etal.,nat.rev.immunol.2012,12,383-396;uccelli,a.etal.,nat.rev.immunol.2008,8,726-736)。现已知th17细胞涉及多种自体免疫及慢性炎症之病理学(miossec,p.etal.,nat.rev.drugdiscov.2012,11,763-776);然而,人类间叶干细胞与此种重要的白血球族群间的交互作用却显示了矛盾的结论(darlington,p.j.etal.,ann.neurol.2010,68,540-545;ghannam,s.etal.,j.immunol.2010,185,302-312;gonzalez,m.a.etal.,arthritisrheum.2009,60,1006-1019;tso,g.h.etal.,stemcells2010,28,939-954;xu,j.etal.,blood2012,120,3142-3151)。本发明数据显示,人类间叶干细胞对th17细胞为抑制性效果,且需要旁分泌因子il-25及细胞表面分子pd-l1两者。又,pd-l1于人类间叶干细胞之表达系经由il-25r连结至il-25,进一步到下游之jnk及stat3,后者系涉及pd-l1之转录控制。th17细胞已被认为与移植排斥相关,但机转不明(antonysamy,m.a.etal.,j.immunol.1999,162,577-584;faust,s.m.etal.,j.immunol.2009,183,7297-7306)。对于人类间叶干细胞可在相关疾病治疗中产生强力疗效,该数据可对背后机转提供一些线索(bassi,e.j.etal.,diabetes2012,61,2534-2545;sun,l.etal.,stemcells2009,27,1421-1432;zhou,b.etal.,clin.immunol.2011,141,328-337),并暗示il-25促效剂在改善自体免疫/炎症及移植排斥上所扮演的角色。
il-25(il-17e)为il-17家族之一员(iwakura,y.etal.,immunity2011,34,149-162)。然而,不像il-17a或f(此白介素家族中较为人所知者)于自体免疫及慢性炎症之直接的角色,il-25实际上显示为对抗il-17a/th17及th1状态之保护作用(caruso,r.etal.,gastroenterology2009a,136,2270-2279)。于th17所调控之实验性自体免疫脑脊髓炎(eae)(一种人类多发性硬化症之模式)中,额外促进th1反应之il-25缺乏之小鼠,系具有较高量之il-17a-表达之t细胞及ifn-γ-表达之t细胞(kleinschek,m.a.etal.,j.exp.med.2007,204,161-170)。有趣的是,累积的数据证实,il-25在免疫系统中具有其它角色,藉由促进th2反应,而预防寄生虫感染(fallon,p.g.etal.,j.exp.med.2006,203,1105-1116)及嗜酸粒细胞性气道炎症(kim,m.r.etal.,blood2002,100,2330-2340)。直至今日,il-25经报导之来源包括免疫细胞,如t细胞、巨噬细胞、单核细胞衍生之树突细胞、巨细胞、嗜酸性球及嗜碱性球,以及非免疫细胞如上皮及内皮细胞(monteleone,g.etal.,interleukin&growthfactorrev.2010,21,471-475)。发现不同来源之人类间叶干细胞可高量且持续表达il-25,但纤维母细胞则否。又,此数据显示il-25系直接负责人类间叶干细胞对同种异体th17反应之抑制作用,包含减少高度病原性之il-17a/ifn-γ+细胞;进一步证实il-25系广泛保护性地拮抗th17及th1反应。由于其持续且高量的表达,合理推测il25于人类间叶干细胞中其它可能的生物学角色。可持续进行更深入的研究,以评估此细胞介素是否在人类间叶干细胞之增殖及/或分化中扮演某种角色。
本研究重要发现之一为,il-25可于白血球(单核细胞)及非白血球(人类间叶干细胞)两种族群中直接提升表面分子pd-l1。pd-l1具有强烈的免疫抑制性,于多种自体免疫疾病中为自体t细胞活化之抑制剂(keir,m.e.etal.,annu.rev.immunol.2008,26,677-704),而,最近证实,在t细胞上封锁其受体pd-1可非常有效地拮抗癌症免疫抑制作用(topalian,s.l.etal.,n.engl.j.med.2012,366,2443-2454)。近来,一报导显示小鼠间叶干细胞经由此途径抑制th17反应(luz-crawford,p.etal.,plosone2012,7,e45272)。然而,该报导之数据显示,封锁该pd-l1/pd-1途径仅部分地逆转小鼠间叶干细胞对th17反应之抑制作用,暗示了其它因子参与此过程。此数据亦证实,沉默pd-l1会部分逆转人类间叶干细胞对th17反应之抑制作用,而沉默il-25则造成人类间叶干细胞所调控之th17抑制作用为明显较高的逆转或几乎完全逆转(图7d)。另外,pd-l1表达的减弱程度系类似于使用il-25或pd-l1专一性之sirna(图7f)。又,发现il-25可于人类间叶干细胞及人类白血球两者中,经由stat3直接影响pd-l1之转录之证据,有助于回答pd-l1转录控制的问题(sumpter,t.l.etal.,eur.j.immunol.2011,41,286-290;wolfle,s.j.etal.,eur.j.immunol.2011,41,413-424)。重要的是,稳定状态之小鼠间叶干细胞并不表达pd-l1,而人类间叶干细胞则持续表达高量pd-l1(stagg,j.etal.,blood2006,107,2570-2577)。重要的是,应注意来自小鼠系统的数据虽然很重要,但在间叶干细胞的免疫生物学上,来自小鼠系统与人类系统的数据有时会互相矛盾(eliopoulos,n.etal.,blood2005,106,4057-4065;leblanc,k.etal.,lancet2008,371,1579-1586),例如pd-l1表达的案例。以对人类间叶干细胞治疗不同免疫相关疾病之临床反应为基础,显示人类间叶干细胞可发挥强力免疫调节效果(leblanc,k.etal.,nat.rev.immunol.2012,12,383-396),但于小鼠研究中并不总是如此(eliopoulos,n.etal.,blood2005,106,4057-4065)。因此,为探究人类间叶干细胞治疗应用之机转,仍然必须以人类间叶干细胞进行体外试验。
综上所述,该等发现证实人类间叶干细胞系抑制th17反应,且需要分泌因子il-25及由il-25正向调控之表面pd-l1两者。jnk及stat3之下游讯号途径系涉及pd-l1之il-25调控作用,其中stat3系牵涉到pd-l1之转录控制。于th17细胞在自体免疫及慢性炎症中已知角色之外,近来研究亦显示th17细胞于增进检查点免疫疗法(checkpointimmunotherapy)效果的重要性(lutz,e.r.etal.,cancerimmunol.res.2014,2,616-631)。因此,il-25之调整可能具有强烈的临床关连性,因为此细胞介素可调控pd-l1/pd-1交互作用以及th17细胞。该等发现提供了人类间叶干细胞及th17细胞之间交互关系之较佳理解,以及强调了该il-25/stat3/pd-l1序列轴可作为相关疾病之治疗标的候选者。
- 还没有人留言评论。精彩留言会获得点赞!