表皮生长因子和脂质体的混合型多层纳米结构及其制造方法与流程
本发明涉及一种表皮生长因子(epidermalgrowthfactor,egf)和脂质体的混合型多层纳米结构及其制造方法。更具体地,本发明涉及一种新型蛋白质-脂质混合型多层纳米结构(protein-lipidhybridmulti-lamellarnanostructures)及其制造方法,所述蛋白质-脂质混合型多层纳米结构通过阳离子脂质形成的空囊泡与阴离子表皮生长因子蛋白质之间的除疏水相互作用以外的多价静电相互作用(multivalentelectrostaticinteractions)制成。
背景技术:
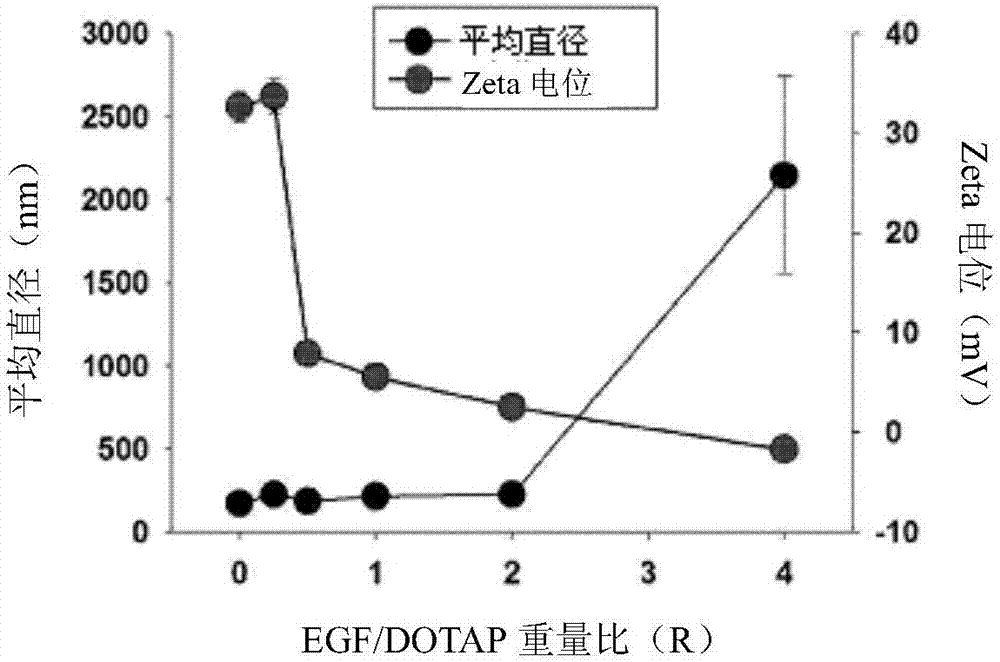
:由于对美容的兴趣增长,具有特定作用机理和良好功效的生理学活性蛋白质作为功能性化妆产品的材料而引人注意。然而,由于生理学活性蛋白质的高的分子量、短的半衰期和结构不稳定性,其不容易渗透皮肤。因此,对这些生理学活性蛋白质的皮肤递送的兴趣迅速增长。在生理学活性蛋白质当中,已知表皮生长因子在皮肤再生中发挥关键作用,因此其被用作功能性化妆品组分。目前,表皮生长因子被列入美国化妆品、化妆用具和香料协会(ctfa)的国际化妆品成分词典(icid)中,并且其也被韩国食品和药品安全部(mdfs)批准用作化妆品原材料,因此在韩国和其他国家中其已被正式用作化妆品原材料(韩国食品药品管理部门通知号2006-12,2006.4.12)。然而,在生理学活性蛋白质组分(如表皮生长因子)的皮肤递送中的最大问题在于,这些蛋白质组分具有低的皮肤吸收率(渗透率)。克服这个问题的典型方法是通过使用脂质体作为载体,将生理学活性蛋白质如表皮生长因子递送到皮肤中。脂质体是主要由作为细胞膜的组分的两亲性磷脂(phospholipid)形成的脂质双层(lipid-bilayer)囊泡(vesicle)。亲水性物质可以被包封在脂质体的内部水性隔室(aqueouscompartment)中,或者疏水性物质可以被装载在脂质双层中。脂质体的层结构与细胞膜的结构相似,因此脂质体具有低的毒性,并且其可以通过与细胞融合或通过内吞作用递送物质。特别地,由于脂质体具有极好的生物相容性,已经积极地进行了有关脂质体用作载体的研究(bangham,a.d.;torchilin,v.p.,2005,nat.rev.drugdiscov.,4:145)。尽管有这样的优势,但由于一些问题,脂质体难以被广泛使用。脂质体的一个问题在于,在脂质体中包封的效率低。特别地,亲水性物质仅可以被包封在脂质体的内部水性隔室中,并且因为内部水性隔室的体积小,包封的效率也必然是低的。其通常显示约10-20%的包封效率,并且显示严重的技术限制,因为相对于脂质体的总重量,包封的蛋白质的量非常低(martins,susana等人,2007,int.j.nanomed.,2.4,595)。另一方面,亲脂性物质以相对高的效率被包封,因为其在脂质双层中被增溶。然而,在一些情况下,亲脂性物质可以使脂质双层不稳定以降低脂质体的稳定性。因此,脂质体技术被商业化应用于一些亲脂性物质,但是其用于亲水性物质的用途是非常微不足道的。使用脂质体作为蛋白质递送载体的另一个问题在于,生理学活性蛋白质在一般的脂质体制备过程中严重变性以失去其特征性的生理学活性。作为一般的脂质体制备方法,bangham法(bangham等人,1965j.mol.biol.13:238-252)或高压均质(high-pressurehomogenization)法被广泛使用。bangham法包括:在玻璃装置中将表面活性剂加入并溶解于溶剂中;蒸发溶液以在玻璃壁上形成表面活性剂(即磷脂)层;引入待包封的材料溶液;并将溶液剧烈搅拌或超声波均质化,从而制备脂质体。在高压均质法中,将脂质体组分彼此混合,并通过具有亚微米(sub-micro)尺寸的微孔(micro-pore)的卡套式流通池或阀门(也被称作“相互作用室(interactionchamber)”)。在本文中,微孔的尺寸为约50-300μm。通过在通过期间出现的大剪切应力(shearstress),形成由表面活性剂构成的脂质双层,并且药物被包封在磷脂双层中。如果使用这些方法捕获生理学活性蛋白质,由于其暴露在由微孔中的剪切应力引起的严酷条件(如高压、高温、摩擦热)中,并且由于有机溶剂的使用,蛋白质可以聚集、变性、氧化或降解,因此很可能失去其特征性的生理学活性。例如,韩国专利号0752990涉及一种由脂质体层构成的纳米脂质体,其包含作为中性脂质的酯化卵磷脂(esterifiedlecithin),并且其公开了一种用于预防或治疗皮肤疾病的组合物,其包含:包封有表皮生长因子的纳米脂质体;和具有抗炎活性的天然提取物。韩国专利号0962566公开了一种含有人生长激素作为活性成分的纳米脂质体,其中使用作为中性脂质的大豆卵磷脂通过高压均质法制备所述纳米脂质体。然而,在以上描述的专利文献中公开的含有生理学活性蛋白质的脂质体具有以下问题:活性成分的包封效率非常低,并且由于脂质体是在高温和高压下制备的,蛋白质的生理活性严重下降。因此,需要开发方法,其能够确保高的包封率,同时在制备载体结构的过程中稳定地保持表皮生长因子的生理学活性。根据前面研究结果的分析,有许多使用不同添加剂或开发新的工艺方法的尝试,以便提高将生理学活性蛋白质(如表皮生长因子)包封在脂质体的内部水性隔室中的效率(pisal,dipaks.等人,2010,j.pharm.sci.,99.6,2557-2575)。然而,所有尝试的特征都在于,它们关注于提高将蛋白质包封在脂质体的内部水性隔室中的效率。技术实现要素:技术问题因此,本发明人已努力开发一种新方法,其能够将表皮生长因子有效地合并入或捕获入脂质体中,同时保持表皮生长因子的高生理学活性。特别地,打破将蛋白质包封在脂质体的内部水性隔室中的方法的陈规,本发明人已经对通过在脂质体和蛋白质之间诱导更多的正相互作用制备新的纳米结构的方法进行了研究。特别地,本发明人已注意到研究表明,作为阴离子生物聚合物的核酸与阳离子脂质体缀合形成新的纳米结构(safinya,c.r.等人,1997,science,275.5301,810-814),因此本发明人已对方法进行了研究,所述方法不在脂质体制备过程中将蛋白质包封,而是在脂质体的制备后通过脂质体-蛋白质相互作用产生新的结构。因此,本发明人已经发现,当在合适的条件下,在由阳离子脂质形成的空囊泡与作为阴离子蛋白质的表皮生长因子之间使用多价静电相互作用(multivalentelectrostaticinteractions)与疏水相互作用的组合时,可以制备新型蛋白质-脂质混合型多层纳米结构,其中,表皮生长因子以非常高的效率被捕获同时保持其生理学活性,从而完成了本发明。技术方案因此,本发明的目的之一是提供一种混合型多层纳米结构,其由表皮生长因子与由阳离子脂质形成的空囊泡之间的相互作用制成。本发明的另一个目的是提供一种通过混合表皮生长因子和由阳离子脂质形成的空囊泡,通过在常温和常压下发生的自发自组装(spontaneousself-assembly)过程制造蛋白质-脂质混合型多层纳米结构的方法。本发明的另一个目的是提供一种化妆品组合物,其含有混合型多层纳米结构。有益效果根据本发明所述的新的混合型多层纳米结构不仅表现出高的包封效率,还表现出简单的制造过程,从而允许将表皮生长因子以高的生理学活性递送到身体或细胞中。附图说明图1为显示根据本发明的一个实施方案形成egf-dotap混合型多层纳米结构的过程的示意图。图2显示根据本发明的一个实施方案制备的egf-dotap混合型多层纳米结构的颗粒尺寸和表面电荷的测量结果。图3显示根据本发明的一个实施方案制备的egf-dotap混合型多层纳米结构的透射率的测量结果。图4显示根据本发明的一个实施方案制备的egf-dotap混合型多层纳米结构的包封率的测量结果。图5显示通过cryo-tem观察到的根据本发明的一个实施方案制备的egf-dotap混合型多层纳米结构的实际结构。图6显示根据本发明的一个实施方案制备的egf-dotap混合型多层纳米结构的稳定性的分析结果。图7显示根据本发明的一个实施方案制备的egf-dotap混合型多层纳米结构的皮肤渗透性质的测量结果(图7a:皮肤表面;和图7b:皮肤切片)。具体实施方式本发明提供一种由表皮生长因子与由阳离子脂质形成的空囊泡之间的相互作用形成的混合型多层纳米结构;一种通过表皮生长因子与由阳离子脂质形成的空囊泡之间的自组装制造蛋白质-脂质混合型多层纳米结构的方法;和一种含有混合型多层纳米结构的化妆品组合物。在下文中,详细描述本发明。本发明涉及一种表皮生长因子-脂质体混合型多层纳米结构,其包含:(a)由阳离子脂质双层构成的空单层脂质体;(b)围绕空单层脂质体且由阳离子脂质双层构成的一个或多个单层脂质体;和(c)表皮生长因子,其中,所述表皮生长因子通过静电相互作用与单层脂质体结合,并且位于单层脂质体之间。所述阳离子脂质可以为选自1,2-二油酰基-sn-甘油基-3-乙基磷酰胆碱(1,2-dioleoyl-sn-glycero-3-ethylphosphocholine,edopc)、1-棕榈酰基-2-油酰基-sn-甘油基-3-乙基磷酰胆碱(1-palmitoyl-2-oleoyl-sn-glycero-3-ethylphosphocholine,epopc)、1,2-二肉豆蔻酰基-sn-甘油基-3-乙基磷酰胆碱(1,2-dimyristoyl-sn-glycero-3-ethylphosphocholine,edmpc)、1,2-二硬脂酰基-sn-甘油基-3-乙基磷酰胆碱(1,2-distearoyl-sn-glycero-3-ethylphosphocholine,spc)、1,2-二棕榈酰基-sn-甘油基-3-乙基磷酰胆碱(1,2-dipalmitoyl-sn-glycero-3-ethylphosphocholine,edppc)、1,2-二油酰基-3-三甲基铵-丙烷(1,2-dioleoyl-3-trimethylammonium-propane,dotap)、n-[1-(2,3-二油基氧基)丙基]-n,n,n-三甲基氯化铵(n-[1-(2,3-dioleyloxy)propyl]-n,n,n-trimethylammoniumchloride,dotma)、3β-[n-(n',n'-二甲基氨基乙烷)-氨基甲酰基]胆固醇(3β-[n-(n',n'-dimethylaminoethane)-carbamoyl]cholesterol,dc-胆固醇)、二油酰基谷氨酰胺(dioleoylglutamide)、二硬脂酰基谷氨酰胺(distearoylglutamide)、二棕榈酰基谷氨酰胺(dipalmitoylglutamide)、二油酰基天冬酰胺(dioleoylaspartamide)和二甲基二-十八烷基溴化铵(dimethyldioctadecylammoniumbromide,ddab)中的一种或多种,但不限于此。所述空单层脂质体可以具有+1至100mv,优选+30mv或更高的zeta电位(zetapotential)(或表面电荷)。所述混合型多层纳米结构可以具有50-900nm,优选50-500nm,更优选100-200nm的颗粒尺寸。如果纳米结构的颗粒尺寸大于900nm,则由于其大的尺寸,纳米结构将难以渗透皮肤,因此其将不适合于将表皮生长因子递送到皮肤中。如果纳米结构的颗粒尺寸小于50nm,则可以出现安全性方面的问题,因为纳米结构对人体的安全性尚未得到证实。混合型多层纳米结构的表皮生长因子:阳离子脂质重量比(w/w)可以为0.001至2.5:1,优选0.001至2.3:1,更优选0.001至2.0:1。如果表皮生长因子:阳离子脂质重量比(w/w)小于0.001:1,则不能形成多层纳米结构。如果表皮生长因子:阳离子脂质重量比(w/w)大于2.5:1,则由于其大的尺寸,纳米结构将难以渗透皮肤,因此其将不适合于将表皮生长因子递送到皮肤中。混合型多层纳米结构中表皮生长因子的包封率可以为至少60%,优选至少80%,更优选至少90%。本发明中使用的表皮生长因子可以是韩国赛特瑞恩股份有限公司制备的重组蛋白质,或者可以是市售可得的产品。根据本发明所述的“混合型多层纳米结构(hybridmulti-lamellarnanostructures)”是通过由阳离子脂质形成的空囊泡与阴离子表皮生长因子之间的多价静电和疏水相互作用形成的新的纳米结构。更具体地,如图1所示,可以通过空囊泡与表皮生长因子之间的自发自组装(spontaneousself-assembly)形成新型混合型多层纳米结构。如本文所使用,术语“空囊泡”是指具有空的内部空间的囊泡。更具体地,该术语是指由脂质双层构成的一般脂质体。甚至更具体地,术语“空囊泡”是指本发明中的空单层脂质体。根据本发明所述的“一个或多个单层脂质体”可以是在脂质体颗粒中具有多个非同心的(non-concentric)内部水性隔室的多囊泡脂质体(multivesicularliposome;mvl),或者是具有由散布有水性层的脂质双层(lipidbilayer)形成的一系列大体上为球形的壳(shell)的多囊泡脂质体(mvl),但不限于此。本发明还涉及一种用于制备混合型多层纳米结构的方法,其包括以下步骤:(1)制备含有由阳离子脂质构成的具有均匀颗粒尺寸的空单层脂质体的溶液;(2)制备含有表皮生长因子的水性溶液;和(3)将在步骤(1)中获得的含有空单层脂质体的溶液与在步骤(2)中获得的含有表皮生长因子的水性溶液混合。步骤(1)中的阳离子脂质可以为选自1,2-二油酰基-sn-甘油基-3-乙基磷酰胆碱(1,2-dioleoyl-sn-glycero-3-ethylphosphocholine,edopc)、1-棕榈酰基-2-油酰基-sn-甘油基-3-乙基磷酰胆碱(1-palmitoyl-2-oleoyl-sn-glycero-3-ethylphosphocholine,epopc)、1,2-二肉豆蔻酰基-sn-甘油基-3-乙基磷酰胆碱(1,2-dimyristoyl-sn-glycero-3-ethylphosphocholine,edmpc)、1,2-二硬脂酰基-sn-甘油基-3-乙基磷酰胆碱(1,2-distearoyl-sn-glycero-3-ethylphosphocholine,spc)、1,2-二棕榈酰基-sn-甘油基-3-乙基磷酰胆碱(1,2-dipalmitoyl-sn-glycero-3-ethylphosphocholine,edppc)、1,2-二油酰基-3-三甲基铵-丙烷(1,2-dioleoyl-3-trimethylammonium-propane,dotap)、n-[1-(2,3-二油基氧基)丙基]-n,n,n-三甲基氯化铵(n-[1-(2,3-dioleyloxy)propyl]-n,n,n-trimethylammoniumchloride,dotma)、3β-[n-(n',n'-二甲基氨基乙烷)-氨基甲酰基]胆固醇(3β-[n-(n',n'-dimethylaminoethane)-carbamoyl]cholesterol,dc-胆固醇)、二油酰基谷氨酰胺(dioleoylglutamide)、二硬脂酰基谷氨酰胺(distearoylglutamide)、二棕榈酰基谷氨酰胺(dipalmitoylglutamide)、二油酰基天冬酰胺(dioleoylaspartamide)和二甲基二-十八烷基溴化铵(dimethyldioctadecylammoniumbromide,ddab)中的一种或多种,但不限于此。可以通过一般的脂质体制备方法制备步骤(1)中的空单层脂质体。脂质体制备方法可以选自bangham法、干燥脂质水合(drylipidhydration)法、冷冻解冻(freezeandthawing)法(其中,重复用液氮冷冻然后在室温解冻的过程)、挤出法(extrusionmethod)、声波降解(sonication)法和微流化器(microfluidizer)法,但不限于此。在步骤(1)中获得的空单层脂质体可以具有100-300nm,优选100-250nm,更优选100-200nm的颗粒尺寸。在步骤(3)中,表皮生长因子和空单层脂质体通过它们之间的多价静电和疏水相互作用彼此结合,以形成新的蛋白质-脂质混合型多层纳米结构。更具体地,如图1所示,空单层脂质体和表皮生长因子通过它们之间的多价静电和疏水相互作用自发自组装(spontaneouslyself-assembly),从而形成如图5所示的混合型多层纳米结构。混合型多层纳米结构包含:(a)由阳离子脂质双层构成的空单层脂质体;(b)围绕空单层脂质体且由阳离子脂质双层构成的一个或多个单层脂质体;和(c)表皮生长因子,其中所述表皮生长因子位于单层脂质体之间。所述混合型多层纳米结构可以具有50-900nm,优选50-500nm,更优选100-200nm的颗粒尺寸。所述混合型多层纳米结构的表皮生长因子:阳离子脂质重量比(w/w)可以为0.001至2.5:1,优选0.001至2.3:1,更优选0.001至2.0:1。所述混合型多层纳米结构中表皮生长因子的包封率可以为至少60%,优选至少80%,更优选至少90%。不同于用于制备脂质体的一般方法,根据本发明所述的制备方法包括制备具有期望尺寸的空的脂质囊泡(空单层脂质体),并将制备的脂质体与生理学活性成分混合。因此,根据本发明所述的制备方法的优势在于,省略了将表皮生长因子(即生理学活性成分)在脂质体制备期间暴露于高压、高温或强酸性溶液中的过程,因此可以保持表皮生长因子的生理学活性。本发明还涉及一种含有混合型多层纳米结构的化妆品组合物。所述混合型多层纳米结构可以渗透到皮肤的真皮,但不限于此。根据本发明所述的化妆品组合物的类型没有特别限制,并且根据所制备的制剂,本发明的化妆品组合物可以含有在本发明的领域中通常使用的化妆品组合物组分。本发明的化妆品组合物可以被制备成制剂,包括皮肤柔肤水、乳剂、滋养霜、护肤霜、美容液、精油等,并且根据所制备的制剂,本发明的化妆品组合物可以进一步含有选自油、水、表面活性剂、润湿剂、低级醇、增稠剂、螯合剂、颜料、防腐剂、芳香剂等的一种或多种。发明的模式在下文中,将参考实施例、实验实施例和制剂实施例更详细地描述本发明。然而,应当理解,这些实施例、实验实施例和制剂实施例仅用于说明目的,并不旨在限制本发明的范围。实施例1:egf-dotap混合型多层纳米结构的制备1.1:含有dotap的阳离子空单层脂质体的制备将阳离子脂质dotap(20.96mg,avantipolarlipid,inc.)溶解于1ml氯仿中,然后在圆形玻璃烧瓶中混合。在旋转蒸发器(rotaryevaporator)中,用氮气以低速冲洗脂质溶液以去除氯仿,并将脂质干燥,从而形成薄的脂质层。将形成的脂质层进一步在真空中干燥12小时,以完全去除剩余的氯仿。将1ml纯化水加入到制备的脂质层中,然后在37℃搅拌2小时,从而制备空的脂质囊泡。将获得的空脂质囊泡挤出通过孔径为100nm的聚碳酸酯膜(polycarbonatemembrane)(avantipolarlipid,inc.)数次,从而制备包含dotap且具有均匀的颗粒尺寸的阳离子空单层脂质体。1.2:egf-dotap混合型多层纳米结构的制备将含有在实施例1.1中制备的包含dotap的阳离子空单层脂质体的溶液(500μl)和egf溶液(500μl,celltrion,inc.)在常温在纯化水中彼此混合,从而制备egf-dotap混合型多层纳米结构。将制备的纳米结构储存在4℃直至使用。实验实施例1:egf-dotap混合型多层纳米结构的形成的评价1.1:阳离子空单层脂质体的形成的确认使用动态光散射(dynamiclightscattering)(dls,elsz-1000,otsukaelectronics)测量在实施例1.1中制备的阳离子空单层脂质体的颗粒尺寸和zeta电位,测量结果示于下表1中。测量结果表明,制备的阳离子空单层脂质体具有200nm的颗粒尺寸和正的表面电荷。[表1]空单层脂质体空单层脂质体颗粒尺寸(nm)zeta电位(mv)dotap197.7±4.956.5±2.51.2:egf-dotap混合型多层纳米结构的形成的确认使用dls测量在实施例1.2中制备的egf-dotap混合型多层纳米结构的颗粒尺寸和zeta电位,并使用分光光度计(spectrophotometer,jasco-815,jasco.inc.)在500nm处测量其透射率。测量结果示于图2和图3。如图2所示,当egf/dotap重量比为2或更小时,egf-dotap混合型多层纳米结构的颗粒尺寸为约200nm,这与dotap空单层脂质体的颗粒尺寸相似,而egf-dotap混合型多层纳米结构的表面电荷与空单层脂质体相比有所降低。这被认为是因为阴离子的egf通过静电相互作用与阳离子空单层脂质体相结合,从而形成新型结构。如图3所示,当egf/dotap重量比为2或更小时,透射率保持在恒定水平,但是当重量比大于2时,透射率降低。这可能是因为没有与阳离子空单层脂质体相结合而聚集的egf的量随着egf浓度的增加而增加。实验实施例2:在egf-dotap混合型多层纳米结构中egf的包封效率的评价为了测量包封在egf-dotap混合型多层纳米结构中的egf的量,使用超速离心机(200,000xg,2小时,4℃,beckman)将在实施例1.2中制备的egf-dotap混合型多层纳米结构(1ml)离心,以分离未包封的游离egf。使用微量bca测试(microbcaassay)和elisa测试(elisaassay)测量分离的游离egf的量。测量结果示于图4。从图4中可以看出,在大部分egf/dotap重量比下出现60%或更高的高包封率,其根据用于定量egf的方法而略有变化。因此,可以看出,根据本发明的结构中的包封效率显著高于常规脂质体中的包封效率(仅10-20%)。实验实施例3:egf-dotap混合型多层纳米结构的多层结构的形成的确认为了确认egf-dotap混合型多层纳米结构的多层结构的形成,使用投入-浸渍法(plunge-dippingmethod)用cryo-tem进行观察,所述投入-浸渍法使得能够精确观察水溶液中的颗粒材料。将4μl在实施例1.2中制备的egf-dotap混合型多层纳米结构放置在花边网格(laceygrid)上,从而形成薄层。将薄水性层保持在合适的温度和97-99%的湿度以使溶剂不蒸发,然后将其迅速投入液态乙烷(约-170℃)中以获得单层冷冻样品。使用透射电子显微镜(jem-3011,jeolltd.)在加速电压(300kv)下观察如上所描述制成的冷冻样品,并使用gatandigitalmicrograph程序分析数据。如图5所示,显示egf-dotap混合型多层纳米结构的多层结构是通过egf与dotap之间的静电吸引形成的。实验实施例4:egf-dotap混合型多层纳米结构的稳定性的考察为了通过egf-dotap混合型多层纳米结构中egf的结构变化考察egf蛋白质的稳定性,通过使用jasco-815cd分光偏振计(spectropolarimeter,jasco-815,jascoinc.)在180-260nm的范围内测量圆二色性(circulardichroism,cd)。将在实施例1.2中制备的egf-dotap混合型多层纳米结构放置在0.5mm光程流通池(pathlengthcell)中并分析。使用未被捕获在纳米结构中的游离egf作为对照。在不同温度考查egf的结构变化持续100天。cd数据示于图6。由图6可以看出,相比于对照(egf),在4℃储存的egf-dotap混合型多层纳米结构(egf-dotap,4℃)和在常温储存的egf-dotap混合型多层纳米结构(egf-dotap,常温)没有经历很大的物理变化。实验实施例5:egf-dotap混合型多层纳米结构的皮肤渗透性的考查为了考查egf-dotap混合型多层纳米结构的皮肤渗透性,使用裸鼠(skh-1hairless,5周龄,orientbio,korea)。将pdms模具(直径:0.8cm;高度:0.5cm)固定到每只小鼠的背部,并将50ml样品装载在pdms模具中,并允许其与小鼠皮肤反应1小时,所述样品通过使荧光剂(fitc)与egf、dotap或在实施例1.2中制备的egf-dotap混合型多层纳米结构反应获得。用恒冷箱切片机(leicacm1850,leicamicrosystems)将从小鼠上分离的皮肤切片,然后用荧光显微镜(leicadmi3000b,leicamicrosystems)观察。如图7a所示,观察到单独的egf或dotap沉积在皮肤表面上而没有渗透过表皮,但是egf-dotap混合型多层纳米结构没有保留在皮肤表面上。此外,如图7b所示,使用切片机(microtome)获得的皮肤切片的观察表明,egf-dotap混合型多层纳米结构从皮肤的表皮渗透至真皮。基于上面的实验实施例的结果,现在将描述含有本发明的egf-dotap混合型多层纳米结构的化妆品组合物的制剂实施例。然而,本发明的组分不限于这些制剂实施例。制剂实施例1:皮肤洗剂根据常规方法制备具有下表2所示组分的皮肤洗剂。[表2]皮肤洗剂的组合物组分含量(重量份)egf-dotap混合型多层纳米结构0.51,3-丁二醇6.0甘油4.0油醇0.1聚山梨酯200.5乙醇15.0二苯甲酮-90.05芳香剂和防腐剂适量纯化水至100制剂实施例2:乳液洗剂根据常规方法制备具有下表3所示组分的乳液洗剂。[表3]乳液洗剂的组合物组分含量(重量份)egf-dotap混合型多层纳米结构1.0丙二醇6.0甘油4.0三乙醇胺1.2醋酸生育酚3.0液体石蜡5.0角鲨烷3.0澳洲坚果油2.0聚山梨酯601.5脱水山梨糖醇倍半油酸酯1.0羧基乙烯基聚合物1.0丁基羟基甲苯0.01edta-2na0.01芳香剂和防腐剂适量纯化水至100制剂实施例3:精油(essence)根据常规方法制备具有下表4所示组分的精油。[表4]精油的组合物制剂实施例4:滋养霜根据常规方法制备具有下表5所示组分的滋养霜。[表5]滋养霜的组合物组分含量(重量份)egf-dotap混合型多层纳米结构2.0十八十六醇2.0硬脂酸甘油酯1.5三辛酸甘油酯5.0聚山梨酯601.2脱水山梨糖醇硬脂酸酯0.5角鲨烷5.0液体石蜡3.0环甲硅油3.0丁基羟基甲苯0.05δ-生育酚0.2浓缩甘油4.01,3-丁二醇2.0黄原胶0.1edta-2na0.05芳香剂和防腐剂适量纯化水至100制剂实施例5:护肤霜根据常规方法制备具有下表6所示组分的护肤霜。[表6]护肤霜的组合物组分含量(重量份)egf-dotap混合型多层纳米结构1.0丙二醇2.0甘油4.0羧基乙烯基聚合物0.3乙醇7.0peg-40氢化蓖麻油0.8三乙醇胺0.3丁基羟基甲苯0.01edta-2na0.01芳香剂和防腐剂适量纯化水至100当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1