一类基于RGD多肽-化疗药物的小分子偶联物及其纳米前药系统的制作方法
本发明涉及一类基于rgd多肽-化疗药物的小分子偶联物及其纳米前药系统,属于生物医药和纳米医药技术领域。本发明提供一类rgd多肽-化疗药物的小分子偶联物及其纳米前药系统的组成及制备方法。
背景技术:
恶性肿瘤是严重威胁人类生命健康的重大疾病之一。据世界卫生组织(worldhealthorganization,who)统计,癌症患者数量呈逐年递增趋势,每年全世界有近100万人被诊断出癌症,但目前癌症治疗还是一个世界性难题。在癌症的治疗中,化疗是肿瘤特别是中晚期肿瘤的主要的治疗手段,然而,临床上最有效的抗肿瘤药物-细胞毒药物严重缺乏靶向性,在癌症治疗的同时也会损伤健康的器官和组织,易造成局部或全身的毒副作用,另外,许多化疗药物仍存在水溶性差、递送重现性差、体内外不相关、治疗效果欠佳等关键问题。这些原因严重限制了抗肿瘤药物的临床使用。
抗体-药物偶联物(antibody-drugconjugates,adcs)源于德国病理学家paulehrlich构想的“生物导弹”靶向治疗肿瘤的理念,且随连接技术的突破而迅速发展,到目前为止,全球已有30多种adcs处于临床研究阶段。有专利(美国专利公开号us2013/0108620a1)报道利用抗erbb受体的抗体偶联美登素dm1,增加肿瘤靶向性、提高疗效同时,也降低了dm1毒副作用。另有报道(中国专利公开号cn1993146a),抗体-药物偶联物特别是曲妥珠单抗-美登素药物dm1偶联物对her2阳性乳腺癌有很好的治疗效果。然而,抗体的免疫原性、高分子量、高成本等也是急需解决的问题。
近年来抗肿瘤多肽药物的研发备受关注,有专利(中国专利公开号cn104940949a)报道了一种酸响应的抗肿瘤多肽纳米药物,生物相容性好,毒副作用低。肽是蛋白质-蛋白质相互作用的基础,组成肽链的氨基酸可随意结合,易于设计针对不同靶点的肽,还可以进行拼接和组装作为药物靶向载体,具有免疫原性低、分子量小、细胞通透性好、易于改造等优点。某些肽类对整合素受体具有较好的亲和性或特异性,如含“精氨酸-甘氨酸-天冬氨酸”(rgd)的寡肽序列能被整合素αvβ3受体特异性识别和结合。整合素αvβ3受体是一类非常重要的细胞膜受体,在多种肿瘤细胞表面和新生血管内皮细胞上有高表达,对肿瘤细胞信号传导、基因表达、肿瘤形成、生长、分化和转移以及血管生长都起着重要作用。近年来,多肽-药物偶联物(peptide-drugconjugates,pdcs)的研究开始不断出现,但尚处于临床前研究阶段。
美登素(maytansine)衍生物dm1、dm3和dm4,是kupchan等美国植物化学家于1972年首次从热带非洲的宽齿叶美登木中发现的、具有抗肿瘤活性的大环内酯类天然化合物,是一种微管蛋白抑制剂(破坏微管蛋白),可与微管蛋白结合破坏细胞内微管网络,通过抑制微管蛋白聚合同时促进其解聚,进而抑制微管的形成,从而阻止细胞周期、抑制细胞分裂而引起细胞凋亡性死亡。研究表明,与传统的化疗药物相比,dm1对癌细胞的杀伤效力是临床常规抗癌药物的100~1000倍,通常平均四到六个分子就可实现对靶细胞的杀伤,由于它的毒副作用大以及对肿瘤细胞特异性不强,已被临床上禁止使用。所以人们一直在探索美登素衍生物更好的临床用药形式。显然,提高靶向递送,降低其毒副作用是非常必要的。有专利报道(美国专利公开号us2013/0029900a1)细胞黏合性肽键偶联美登素dm1后,能显著抑制肿瘤生长,降低毒副作用,提高存活率。
阿霉素(adriamycin)是上世纪60年代初由米兰farmitaliaresearchlaboratories从一种链霉菌中分离出来的蒽环霉素类抗生素,周期非特异性药物,对各种生长周期的肿瘤细胞都有杀灭作用。阿霉素具有广泛的抗肿瘤作用,作为治疗癌症的一线药物常用于肝癌、胃癌、乳腺癌、肺癌、卵巢癌和多种血癌等的临床治疗中,疗效好,但静脉注射阿霉素,毒副作用大、骨髓抑制和心脏毒性等不良反应而严重限制了其临床应用。另外长期使用容易产生剂量依赖性,易发生多药耐药。阿霉素本身溶解度很低,形成盐酸盐以后,阿霉素药效学功能大幅度下降,从而给临床应用带来很大困难。通过制备在肿瘤部位转化成原型药的前药系统可较好解决阿霉素药物治疗过程中毒副作用问题。在此领域已有一些研究和报导,有专利(中国专利公开号cn104147613a)报道将peg衍生物通过肿瘤内蛋白酶敏感多肽连接dox,延长药物半衰期和降低药物毒性的同时,保证药物在病灶部位快速释药。
纳米递送系统被认为是最有前景的药物传递系统之一。优良的纳米递送系统能够解决难溶性药物的注射给药问题、提高药物的利用度、避免被巨噬细胞识别和吞噬、靶向递送到肿瘤组织甚至细胞,从而更好地发挥疗效,降低毒副作用。关于细胞毒药物dox的纳米前药系统的制备已有一些研究和报导,而关于美登素dm1、dm3和dm4的纳米前药报道较少。有专利(中国专利公开号cn104984361a)报道了一种含羧酸基聚合物的dox大分子纳米前药,具有长循环功能,在提高抗肿瘤活性,降低毒副作用的同时,也降低肿瘤细胞耐药性。另有报道(中国专利授权公开号cn101879313b)合成rgd环肽作为靶头、聚乙二醇为亲水链段、经酸敏感化学键和树枝状聚合物连接dox的高分子纳米前药系统,与dox相比,该高分子纳米前药系统具有明显的靶向效果,在提高疗效的同时,也降低了药物毒性。但这些前药系统都采用了高分子聚合物为载体,需考虑细胞毒药物的载药量、载体大小、载体生物相容性等问题。
因此,为了进一步提高抗肿瘤药物的疗效、安全性、靶向递送的稳定性、重现性以及体内外相关性,本发明提供了一种具有主动靶向性、载药量高、渗透性好、肿瘤部位环境敏感(如氧化还原、酶敏感等)释药的“小型化”的抗肿瘤纳米前药系统。具体地,本发明提供一种rgd多肽-化疗药物的小分子偶联物及其纳米前药系统的组成及制备方法。
技术实现要素:
本发明的目的是提供一类基于rgd多肽-化疗药物的小分子偶联物及其纳米前药系统(peptide-drugconjugatenanoparticles,pdcnps),尤其是该抗肿瘤纳米前药系统的结构组成及其制备方法,以克服现有技术中诸如大分子靶头和载体的生物相容性差、载药量低、渗透性低等问题。
为了实现上述目的,本发明采用以下技术方案:
本发明提供一类基于rgd多肽-化疗药物的小分子偶联物的纳米前药系统,由下述三个功能部分组成:(1)具有靶向作用的rgd多肽位于最外层;(2)抗肿瘤药物选择美登素(dm1、dm3和dm4)和阿霉素(dox)为疏水内核;(3)选择还原敏感、酶敏感化学键作为小分子连接桥臂偶联靶头和抗肿瘤模型药物。rgd多肽-化疗药物小分子偶联物的结构可简单表示为:
rgd-linker-drug
其中,rgd多肽为环(精氨酰-甘氨酰-天冬氨酸-d-苯丙氨酸-赖氨酸)[c(rgdfk)]、环(精氨酰-甘氨酰-天冬氨酸-d-酪氨酸-赖氨酸)[c(rgdyk)]、环(精氨酰-甘氨酰-天冬氨酸-d-苯丙氨酸-半胱氨酸)[c(rgdfc)]、环(精氨酰-甘氨酰-天冬氨酸-d-酪氨酸-半胱氨酸)[c(rgdyc)]、环(精氨酰-甘氨酰-天冬氨酸-d-苯丙氨酸-赖氨酸-coch2sh)[c(rgdfk-coch2sh)]、环(精氨酰-甘氨酰-天冬氨酸-d-苯丙氨酸-赖氨酸-coch2ch2sh)[c(rgdfk-coch2ch2sh)]等含有rgd序列的亲水性多肽,选自结构中含有游离氨基或游离巯基的多肽中的一种或几种;linker为小分子连接桥臂,其分子量为200~800道尔顿,选自两末端分别以马来酰亚胺基和琥珀酰亚胺活化酯封端的连接臂、二硫吡啶基和羧酸封端的连接臂、二硫吡啶基和琥珀酰亚胺活化酯封端的连接臂、马来酰亚胺基和对硝基氯甲酸苯酯封端的缬氨酸-瓜氨酸类的连接臂中的一种或几种,如4-(n-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯(smcc)、6-(马来酰亚胺基)己酸琥珀酰亚胺酯(mcosu)、3-二硫吡啶基丙酸(py-ss-cooh)、马来酰亚胺基-缬氨酸-瓜氨酸对氨基苄醇基对硝基苯基碳酸酯(mc-val-cit-pabc-pnp)等;drug为大环内酯类、蒽环类药物抗肿瘤药物,选自美登素衍生物(dm1、dm3和dm4)和阿霉素(dox)。
本发明提供的基于rgd多肽-化疗药物的小分子偶联物的纳米前药系统中,rgd多肽-化疗药物的小分子偶联物具有式ⅰ、式ⅱ、式ⅲ、式ⅳ、式ⅴ、式ⅵ、式ⅶ、式ⅷ或式ⅸ所示结构:
rgd多肽-美登素类药物的小分子偶联物的结构式如式ⅰ、式ⅱ、式ⅲ、式ⅳ、式ⅴ和式ⅵ所示,其中,cm:c代表碳原子;m代表两末端分别为马来酰亚胺基和琥珀酰亚胺活化酯封端的小分子连接桥臂。c(rnk):c代表括弧中为环肽;r代表精氨酰肽段;n代表甘氨酰-天冬氨酸-d-苯丙氨酸(-gd-d-f-)、甘氨酰-天冬氨酸-d-酪氨酸(-gd-d-y-)等连接肽,连接肽的个数为1。而k代表赖氨酸肽段。
rgd多肽-阿霉素类药物的小分子偶联物的结构式如式ⅶ、式ⅷ和式ⅸ所示,其中,cx:c代表碳原子;x代表两末端分别为马来酰亚胺基和琥珀酰亚胺活化酯封端、二硫吡啶基和琥珀酰亚胺活化酯封端、二硫吡啶基和羧酸封端、马来酰亚胺基和对硝基氯甲酸苯酯封端的缬氨酸-瓜氨酸类的小分子连接桥臂。c(ryc):c代表括弧中为环肽;r代表精氨酰肽段;y代表甘氨酰-天冬氨酸-d-苯丙氨酸(-gd-d-f-)、甘氨酰-天冬氨酸-d-酪氨酸(-gd-d-y-)、甘氨酰-天冬氨酸-d-苯丙氨酸-coch2sh(-gd-d-f-coch2sh)、甘氨酰-天冬氨酸-d-苯丙氨酸-coch2ch2sh(-gd-d-f-coch2ch2sh)等连接肽,连接肽的个数为1;c代表半胱氨酸肽段。
本发明提供的基于rgd多肽-化疗药物的小分子偶联物的纳米前药系统的制备方法,其包括下述内容:
1)rgd多肽-美登素系列的小分子偶联物的制备
(1)美登素衍生物(dm1、dm3或dm4)与含游离氨基的rgd多肽通过稳定硫醚键连接
将含有游离氨基的rgd多肽充分溶于干燥的n,n-二甲基甲酰胺(dmf)中,加入三口反应瓶,调节ph至8~10;将美登素衍生物与马来酰亚胺基琥珀酰亚胺活化酯类化合物经迈克尔(michael)加成反应制得的化合物充分溶于干燥dmf中,然后加入到上述反应瓶中,室温搅拌过夜,tlc跟踪检测,反应结束,粗产物经柱分离纯化得到目标小分子偶联物。
(2)美登素衍生物(dm1、dm3或dm4)与含游离氨基的rgd多肽通过还原敏感二硫键连接
将二硫吡啶基羧酸类化合物充分溶于干燥的dmf中,加入三口反应瓶,将活化剂o-苯并三氮唑-四甲基脲六氟磷酸酯(hbtu)加入反应体系,活化羧基20~60min,tlc跟踪检测反应;充分活化后,将含有游离氨基的rgd多肽的dmf溶液加入上述反应瓶,调节ph至8~11,室温搅拌过夜,tlc跟踪检测,反应结束,粗产物经乙醚结晶纯化,得到二硫吡啶基-rgd多肽化合物。
将上述制备的二硫吡啶基-rgd多肽化合物充分溶于干燥dmf,加入三口反应瓶;然后将美登素衍生物的dmf溶液加入上述反应瓶,室温下搅拌过夜,tlc跟踪检测反应,反应结束,粗产物经乙醚结晶纯化得到目标小分子偶联物。
2)rgd多肽-阿霉素系列小分子偶联物的制备
(1)阿霉素与含游离巯基的rgd多肽通过稳定硫醚键连接
将dox·hcl溶于干燥dmf且充分脱盐酸后,加入三口反应瓶,加入调节ph至8.5~11;然后将马来酰亚胺基琥珀酰亚胺酯类化合物的dmf溶液加入上述反应瓶,室温避光搅拌过夜,tlc跟踪检测,反应结束,粗产物经柱分离纯化,得到马来酰亚胺基-dox化合物。
将上述制备的马来酰亚胺基-dox化合物充分溶于干燥dmf,加入三口反应瓶;将含游离巯基的rgd多肽充分溶于醋酸钠缓冲液,然后加入上述反应瓶中,室温避光搅拌过夜,tlc跟踪检测反应,反应结束,粗产物经柱分离纯化得到目标小分子偶联物。
(2)阿霉素与含游离巯基的rgd多肽通过还原敏感二硫键连接
将二硫吡啶基羧酸类化合物充分溶于干燥dmf,加入三口反应瓶,将活化剂hbtu加入反应瓶,活化羧基20~60min,tlc跟踪检测反应;将dox·hcl溶于干燥dmf且充分脱盐酸后,加入上述反应瓶,调节体系ph至8~11,室温避光搅拌过夜,tlc跟踪检测,反应结束,经柱分离纯化得到二硫吡啶基-dox化合物。
将上述制备的二硫吡啶基-dox化合物充分溶于干燥dmf,加入三口反应瓶;然后将含游离巯基的rgd多肽的dmf溶液加入上述反应瓶,室温避光搅拌过夜,tlc跟踪检测,反应结束,粗产物经乙醚结晶纯化,得到目标小分子偶联物。
(3)阿霉素与含游离巯基的rgd多肽通过组织蛋白酶b敏感键连接
将dox·hcl溶于干燥dmf且充分脱盐酸后,加入三口反应瓶,调节ph至8~11;然后将缬氨酸-瓜氨酸类化合物的dmf溶液加入上述反应瓶,室温避光搅拌过夜,tlc跟踪检测,反应结束,粗产物经乙醚结晶纯化,得到缬氨酸-瓜氨酸基-dox化合物。
将上述制备的缬氨酸-瓜氨酸基-dox化合物充分溶于干燥dmf,加入三口反应瓶;将含游离巯基的rgd多肽充分溶于醋酸钠缓冲液,然后加入上述反应瓶中,室温避光搅拌过夜,tlc跟踪检测反应,反应结束,粗产物经柱分离纯化,得到目标小分子偶联物。
3)基于rgd多肽-美登素、rgd多肽-阿霉素的小分子偶联物的纳米前药系统(pdcnps)的制备
采用反溶剂沉淀法制备纳米前药系统,首先将rgd多肽-美登素、rgd多肽-阿霉素的小分子偶联物充分溶解于良溶剂,如溶于dmso中制备母液;然后在超声过程中将母液缓慢滴加到双蒸水中,超声5~30min即可自组装成以难溶性药物为疏水内核,rgd多肽为亲水外壳的核-壳型纳米系统,粒径大小为80nm~380nm。
本发明提供的一类基于rgd多肽-化疗药物的小分子偶联物的纳米前药系统的制备过程中,所用dmso溶剂在整个体系中的含量小于0.5%,并且可通过冷冻干燥得到纳米前药系统的固体冻干粉制剂。
本发明提供的基于rgd多肽-化疗药物的小分子偶联物的纳米前药系统,不需要高分子材料作为载体,载药量高;其固体冻干粉制剂中,含30wt%~60wt%偶联物质量比的药物。
与现有技术相比,本发明提供的基于rgd多肽-化疗药物的小分子偶联物的纳米前药系统的显著优点在于:
1)基于rgd多肽与化疗药物经连接臂直接共价连接而成的小分子偶联物,提高了体系的载药量;
2)利用亲水性rgd多肽修饰疏水性化疗药物,进一步提高了药物的溶解度,且偶联物能自组装成以药物为疏水内核、rgd多肽为亲水外壳的纳米前药系统;
3)利rgd多肽靶头的靶向作用,可将纳米前药系统特异性地运送到肿瘤组织,减少正常组织的蓄积,降低其生物毒性,通过配体-受体的相互作用增加肿瘤细胞和肿瘤新生血管对纳米前药系统的摄取;
4)rgd多肽与化疗药物之间的硫醚化学键、还原敏感二硫化学键或组织蛋白酶b敏感化学键在血液循环条件下稳定不释放药物,一旦纳米前药系统经内吞作用进入细胞内,在溶酶体、还原型谷胱甘肽或组织蛋白酶b作用下,化疗药物与rgd多肽之间的化学键被切断而释放出游离药物,进而发挥其细胞毒性作用,有效提高抗肿瘤药物的生物利用度;
5)基于rgd多肽与化疗药物的小分子偶联物,不需要高分子材料作为载体,也不需要大分子抗体为靶头,生物相容性更好,而且有利于纳米前药系统更均匀、更有效地渗透肿瘤组织和细胞,发挥更好的抗肿瘤作用;
6)本发明所制备的纳米前药系统,可明显提高美登素衍生物或阿霉素药物的体内抗肿瘤疗效,具有良好的临床应用价值。
附图说明
图1为实施例1、2、3和4中rgd多肽-化疗药物的小分子偶联物的化学结构图。a:crgd-smcc-dm1;b:crpq-smcc-dm1;c:crgd-ss-dm1;d:crpq-ss-dm1
图2为实施例5、6和7中rgd多肽-化疗药物的小分子偶联物的化学结构图。a:crgd-dox;b:crgd-ss-dox;c:crgd-vc-dox
图3为实施例8中rgd多肽-化疗药物的小分子偶联物的粒径分布图和透射电镜图。a:crgd-smcc-dm1粒径分布;b:crgd-smcc-dm1透射电镜图;c:crpq-smcc-dm1粒径分布图;d:crpq-smcc-dm1透射电镜图;e:crgd-ss-dm1粒径分布图;f:crgd-ss-dm1透射电镜图;g:crpq-ss-dm1粒径分布图;h:crpq-ss-dm1透射电镜图
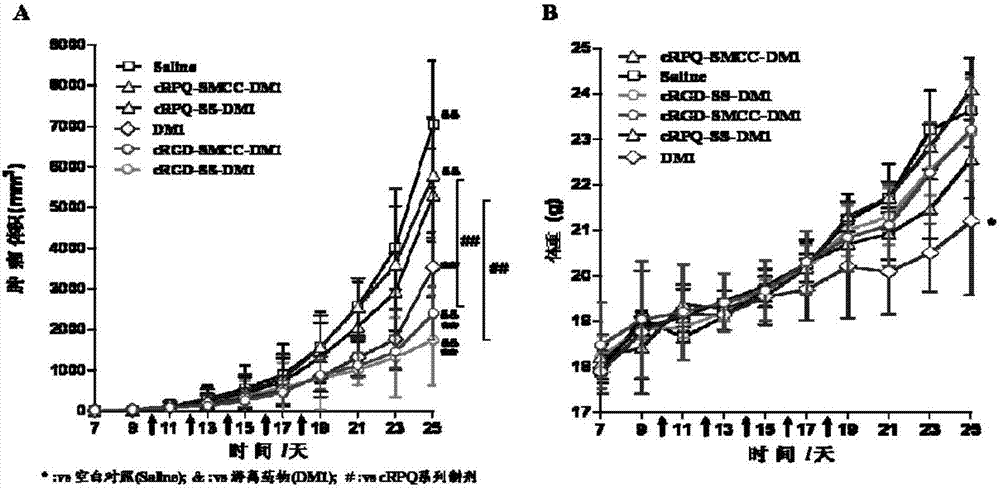
图4为实施例9中dm1系列纳米前药系统与游离dm1的抗肿瘤药效学比较研究。a:肿瘤生长曲线;b:体重变化曲线
图5为实施例8中rgd多肽-化疗药物的小分子偶联物的粒径分布图和透射电镜图。a:crgd-dox粒径分布;b:crgd-dox透射电镜图;c:crgd-ss-dox粒径分布图;d:crgd-ss-dox透射电镜图;e:crgd-vc-dox粒径分布图;f:crgd-vc-dox透射电镜图
图6为实施例10中dox系列纳米前药系统与dox·hcl的抗肿瘤药效学比较研究。a:肿瘤生长曲线;b:体重变化曲线
具体实施方式
以下结合附图和具体实施例进一步说明本发明,但不作为对本发明进行的具体限制。
实施例1、crgd-smcc-dm1小分子偶联物的制备
将含有游离氨基的c(rgdfk)(0.0105mmol,1.05eq)溶于干燥dmf(0.2ml),加入反应瓶充分搅拌,接着加入n-甲基吗啉(0.20mmol,20eq)调节ph至8~10。将dm1-smcc(0.01mmol,1eq)充分溶于干燥dmf(0.2ml),然后低温加入到反应瓶中,室温n2氛围反应过夜,tlc跟踪检测,反应结束,经硅胶柱(ch2cl2:ch3oh=20:1~5:1)分离纯化得目标产物crgd-smcc-dm1为白色固体,产率为61%。esi-ms质谱检测结果为1559.80g/mol,表明dm1经smcc化学键已连接到crgd多肽上。
实施例2、crpq-smcc-dm1小分子偶联物的制备
将含有游离氨基的c(rpqfk)(0.0105mmol,1.05eq)溶于干燥dmf(0.2ml),加入反应瓶充分搅拌,接着加入n-甲基吗啉(0.20mmol,20eq)调节ph至8~10。将dm1-smcc(0.01mmol,1eq)充分溶于干燥dmf(0.2ml),然后低温加入到反应瓶中,室温n2氛围反应过夜,tlc跟踪检测,反应结束,经硅胶柱(ch2cl2:ch3oh=15:1~4:1)分离纯化得目标产物crpq-smcc-dm1为白色固体,产率为61%。esi-ms质谱检测结果为1613.71g/mol,表明dm1经smcc化学键已连接到crpq多肽上。
实施例3、crgd-ss-dm1小分子偶联物的制备
将制备的3-二硫吡啶基丙酸(py-ss-cooh)(0.10mmol,1eq)溶于干燥dmf(0.4ml),加入反应瓶,充分搅拌溶解,将羧基活化剂hbtu(0.20mmol,2eq)溶于0.4ml干燥dmf,加入反应瓶,活化羧基20~60min,tlc跟踪检测反应。充分活化后,将c(rgdfk)(0.12mmol,1.2eq)的0.7ml干燥dmf溶液加入反应瓶,加入n,n-二异丙基乙胺(diea)(0.60mmol,6eq)调节反应体系的ph至8~11,室温n2氛围反应过夜,tlc跟踪检测,反应结束,冷乙醚重结晶,甲醇洗涤,充分干燥得py-ss-crgd为浅黄色固体,产率为53%。
将上述制备的py-ss-crgd(0.01mmol,1eq)溶于0.7ml干燥dmf中,加入反应瓶,充分搅拌。然后将dm1(0.02mmol,2eq)充分溶于0.2ml干燥dmf,加入反应瓶,室温n2氛围反应过夜,tlc跟踪检测,反应结束,冷乙醚重结晶,二氯甲烷洗涤,充分干燥得目标产物crgd-ss-dm1为白色固体,产率为59%。esi-ms质谱检测结果为1426.58g/mol,表明dm1经ss化学键已连接到crgd多肽上。
实施例4、crpq-ss-dm1小分子偶联物的制备
将制备的3-二硫吡啶基丙酸(py-ss-cooh)(0.10mmol,1eq)溶于干燥dmf(0.3ml),加入反应瓶,充分搅拌溶解,将羧基活化剂hbtu(0.20mmol,2eq)溶于0.4ml干燥dmf,加入反应瓶,活化羧基20~60min,tlc跟踪检测反应。充分活化后,将c(rpqfk)(0.12mmol,1.2eq)的0.9ml干燥dmf溶液加入反应瓶,加入n,n-二异丙基乙胺(diea)(0.60mmol,6eq)调节反应体系的ph至8~11,室温n2氛围反应过夜,tlc跟踪检测,反应结束,冷乙醚重结晶,甲醇洗涤,充分干燥得py-ss-crpq为浅黄色固体,产率为74%。
将上述制备的py-ss-crpq(0.01mmol,1eq)溶于0.4ml干燥dmf中,加入反应瓶,充分搅拌。然后将dm1(0.02mmol,2eq)充分溶于0.3ml干燥dmf,加入反应瓶,室温n2氛围反应过夜,tlc跟踪检测,反应结束,冷乙醚重结晶,二氯甲烷洗涤,充分干燥得目标产物crpq-ss-dm1为白色固体,产率为51%。esi-ms质谱检测结果为1481.13g/mol,表明dm1经ss化学键已连接到crpq多肽上。
实施例5、crgd-dox小分子偶联物的制备
将dox·hcl(0.01mmol,1eq)加入干燥dmf(0.2ml),加入diea(0.01mmol,1eq)充分脱盐酸,加入反应瓶,调节ph至8.5~11。将mcosu(0.02mmol,2eq)充分溶于0.2ml干燥dmf,然后将其低温条件下加入到反应瓶中,室温n2氛围避光过夜反应,tlc跟踪检测,反应结束,经硅胶柱(ch2cl2:ch3oh=20:1~5:1)分离纯化得mc-dox为红色固体,产率为61%。
将上述制备的mc-dox(0.01mmol,1eq)溶于0.5ml干燥dmf中,加入反应瓶,充分搅拌。将c(rgdfc)(0.02mmol,2eq)充分溶于ph=6.0的醋酸钠缓冲液中,然后将其加入反应瓶,n2氛围避光过夜反应,tlc跟踪检测,反应结束,经硅胶柱(ch2cl2:ch3oh=15:1~4:1)分离纯化得目标产物crgd-dox为深红色固体粉末,产率为63%。esi-ms质谱检测结果为1314.48g/mol,表明dox已连接到crgd多肽上。
实施例6、crgd-ss-dox小分子偶联物的制备
将制备的3-二硫吡啶基丙酸(py-ss-cooh)(0.10mmol,1eq)溶于0.4ml干燥dmf中,加入反应瓶,充分搅拌溶解,将hbtu(0.20mmol,2eq)溶于0.4ml干燥dmf,加入反应瓶,活化羧基20~60min,tlc跟踪检测反应。充分活化后,将dox·hcl(0.12mmol,1.2eq)加入0.5ml干燥dmf中,加入diea(0.30mmol,1eq)充分脱盐酸,加入反应瓶,并调节体系ph至8.5~11,室温n2氛围反应过夜,tlc跟踪检测,反应结束,经硅胶柱(ch2cl2:ch3oh=20:1~5:1)分离纯化得py-ss-dox为深红色固体,产率为98%。
将上述制备的py-ss-dox(0.20mmol,2eq)溶于1.0ml干燥dmf中,加入反应瓶,充分搅拌。将c(rgdfc)(0.10mmol,1eq)充分溶于ph=6.0的醋酸钠缓冲液中,然后将其加入反应瓶,n2氛围避光过夜反应,tlc跟踪检测,反应结束,经硅胶柱(ch2cl2:ch3oh=15:1~4:1)分离纯化得目标产物crgd-ss-dox为深红色固体粉末,产率为90%。esi-ms质谱检测结果为1719.67g/mol,表明dox经ss化学键已连接到crgd多肽上。
实施例7、crgd-vc-dox小分子偶联物的制备
将dox·hcl(0.011mmol,1.1eq)加入0.3ml干燥dmf,加入diea(0.01mmol,1eq)充分脱盐酸,加入反应瓶,调节ph至8.5~11。将mc-val-cit-pabc-pnp(0.01mmol,1eq)充分溶于0.3ml干燥dmf,然后将其加入反应瓶中,室温n2氛围避光过夜反应,tlc跟踪检测,反应结束,经硅胶柱(ch2cl2:ch3oh=20:1~5:1)分离纯化得目标产物mc-val-cit-pabc-dox为红色固体粉末,产率为81%。
将上述制备的mc-val-cit-pabc-dox(0.01mmol,1eq)充分溶于0.4ml干燥dmf中,加入反应瓶,匀速搅拌。将c(rgdfc)(0.02mmol,2eq)充分溶于ph=6.0的醋酸钠缓冲液中,然后将其加入反应瓶,n2氛围避光过夜反应,tlc跟踪检测,反应结束,经硅胶柱(ch2cl2:ch3oh=15:1~4:1)分离纯化得目标产物crgd-val-cit-pabc-dox(crgd-vc-dox)为红色固体粉末,产率为82%。esi-ms质谱检测结果为1207.39g/mol,表明dox经vc-pabc化学键已连接到crgd多肽上。
实施例8、基于美登素类、阿霉素类的rgd多肽-化疗药物的小分子偶联物的纳米前药系统(pdcnps)制备及表征
采用反溶剂沉淀法制备pdcnps。称取实施例1、2、3、4、5、6、7中合成的crgd-smcc-dm1、crpq-smcc-dm1、crgd-ss-dm1、crpq-ss-dm1、crgd-dox、crgd-ss-dox、crgd-vc-dox小分子偶联物,加入dmso良溶剂充分溶解配制成40mg/ml的母液,然后于室温超声过程中,将12.5μl母液缓慢滴加到3987.5μl的双蒸水中,滴加完记时探超10min,溶剂在水相迅速扩散得到均一澄清的纳米药物体系(体系中药物浓度:0.125mg/ml;dmso体积含量:0.3%)。利用动态光散射(dynamiclightscattering,dls)测定其粒度及分布,利用透射式电子显微镜观察pdcnps的形态。其pdcnps粒径及分布、形态见表1,图3和图5。
表1基于rgd多肽-化疗药物的小分子偶联物的纳米前药系统的粒径及分布
实施例9美登素dm1系列的纳米前药系统的体内抗肿瘤活性试验
近交系雌性c57bl/6小鼠(18-20g,北京维通利华实验动物中心提供),于小鼠右侧腋皮下接种8×105个/只b16-f10细胞,分别与接种后第10天、12天、14天、16天和18天经尾静脉注射给生理盐水、游离dm1、crgd-smcc-dm1纳米前药系统、crpq-smcc-dm1纳米前药系统、crgd-ss-dm1纳米前药系统、crpq-ss-dm1纳米前药系统,给药剂量均为400μg/kg。自接种肿瘤细胞第7天起隔天使用游标卡尺测量小鼠肿瘤的长短径,计算肿瘤体积v(v=[length×(width)2]/2),绘制肿瘤体积-时间变化图,并记录小鼠体重,绘制体重增长曲线以评价制剂的全身毒性。
实施例10阿霉素dox类的纳米前药系统的体内抗肿瘤活性试验
近交系雌性c57bl/6小鼠(18-20g,北京维通利华实验动物中心提供),于小鼠右侧腋皮下接种8×105个/只b16-f10细胞,分别与接种后第10天、12天、14天、16天和18天经尾静脉注射给生理盐水、游离dox·hcl、crgd-dox纳米前药系统、crgd-ss-dox纳米前药系统、crgd-vc-dox纳米前药系统,给药剂量均为2000μg/kg。自接种肿瘤细胞第7天起隔天使用游标卡尺测量小鼠肿瘤的长短径,计算肿瘤体积v(v=[length×(width)2]/2),绘制肿瘤体积-时间变化图,并记录小鼠体重,绘制体重增长曲线以评价制剂的全身毒性。
- 还没有人留言评论。精彩留言会获得点赞!