一种新的抗炎小分子多肽及其应用的制作方法
本发明涉及生物医药领域,更具体地,涉及一种新型的来源于乳清蛋白的小分子多肽、含有其的组合物以及其在药物、食品和化妆品中的应用。
背景技术:
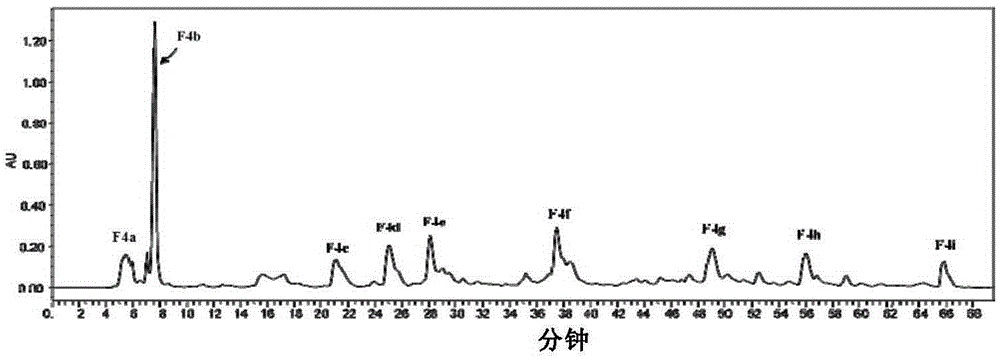
:我国作为一个乳业大国,有着丰富的乳品资源,对有关乳品开发的研究也有着迫切的需求。而乳清作为工业生产干酪的主要副产物,如何将其加以利用已成为我国食品工业重点关注的问题之一。乳清中最具营养价值的便是乳清蛋白,因此针对乳清蛋白营养价值的研究就显得尤为重要。乳清蛋白是存在于牛奶乳清中的一类优质蛋白质,其中包含有多种生物活性序列,这些活性序列可通过适当的蛋白酶水解而从乳清蛋白中释放出来,成为具有生理活性的肽段。生物学家研究发现:蛋白质在多肽的形式下显示出较强的生物活性。蛋白质经消化道酶促水解后,主要以小肽的形式被吸收,比完全游离氨基酸更易更快被机体吸收利用,并且仅需要微量的肽就可以发挥强大的生物活性。因此,乳清蛋白中可能存在的活性小肽成为本发明的研究重点。随着蛋白质组学的发展和分离、提取技术的成熟,近年来越来越多新的乳清蛋白生物活性肽被人们发现,乳源性蛋白质已经成为了研究生物活性肽性质和功能最为广泛的一类蛋白质,乳清蛋白的开发和利用价值也随之越来越高。国外已经陆续有以乳源性生物活性肽为功能因子的食品被开发出来并在市场上销售,但由于生物活性肽发挥其生物活性的作用机理一直是相关研究的难点,乳清蛋白生物活性肽能否作为功能因子大量应用于食品工业生产中仍有待进一步研究。我国虽然有很多科学家在实验室里对生物活性肽进行相关研究与开发,并取得了一系列成果。但由于我国从乳中分离乳清蛋白这一生产技术的不足,使得我国每年必须大量进口浓缩乳清蛋白粉等乳清相关产品,这大大限制了我国乳清蛋白产品的开发,更难以实现乳清蛋白生物活性肽的规模化生产。但随着膜分离、吸附分离等从乳清中分离乳清蛋白技术的不断发展和成熟,我国对于 乳清资源的开发利用必定会成为乳品市场新的经济增长点,对乳清蛋白生物活性肽的研究与开发也必定会受到越来越多的关注,未来乳清蛋白生物活性肽也必将在食品和药品领域得到更加广泛的应用和发展。目前,对于乳清蛋白活性肽的研究关注较多的主要集中于抗高血压肽、抗氧化肽、抗菌肽和免疫调节肽四类,对于乳清肽抗炎活性的研究相对较少,发现的抗炎活性肽种类不多,研究多集中于前期酶解工艺的优化和酶解粗产物的活性评价,有待深入探索,且由于抗炎药物多具有一定的副作用,因此本领域有必要积极研究来源于食物中安全、天然、高效的抗炎活性肽。技术实现要素:本发明的目的是提供一种能够有效获得抗炎活性肽及其制备的方法,为今后食源性抗炎活性肽的相关研究和开发利用提供理论依据,使经过筛选得到的抗炎肽段在食品、药品甚至其他领域得到更为广泛的应用。在本发明的第一方面,提供了一种分离的多肽,所述的多肽具有式I所示的结构:A-B-C式I;其中,A和C分别为无,或1-2个氨基酸残基;B为DQWL(SEQIDNO.:1)所示的核心序列;“-”为肽键;所述的多肽具有预防或治疗炎症性疾病的活性。在另一优选例中,所述多肽中,A和C均为无。在另一优选例中,其中,A为无或选自L、I、KL、KI、RL或RI,和/或C为无或选自C、S、CE、CD、SE或SD。在另一优选例中,所述多肽中,A为无,或KL,和/或C为无或CE。本发明第二方面,提供了一种多肽集合,所述多肽集合含有本发明第一方面所述的分离的多肽,和选自下组的一种或多种短肽:DYKKY(SEQIDNO.:2)、LF、AVF、WLA、WYSL(SEQIDNO.:3)、GTWY(SEQIDNO.:4)和EYGLF(SEQIDNO.:5)。在另一优选例中,所述的多肽集合含有本发明第一方面所述的分离的多肽,和SEQIDNO.:2所示的短肽。在另一优选例中,所述的分离的多肽或所示的多肽集合还包括其药学上可接受的盐。在本发明第三方面,提供了一种分离的多核苷酸,所述的多核苷酸编码本发明第一方面所述的分离的多肽,或所述的多肽编码权利要求2所述的多肽集合。本发明第四方面,提供了本发明第一方面所述的分离的多肽或本发明第二方面所述的多肽集合的用途,用于制备预防和/或治疗炎症性疾病、和/或抑制炎症因子的组合物。在另一优选例中,所述的炎症性疾病包括感染和/或非感染性炎症性疾病。在另一优选例中,所述的感染性炎症性疾病包括细菌和/或真菌引起的炎症性疾病。在另一优选例中,所述的非感染性炎症性疾病包括手术或外伤引起的红肿、疼痛、过敏性鼻炎、接触性皮炎、药物性皮炎,关节炎、湿疹、纤维组织炎、腱鞘炎、强直性脊柱炎等,以及一些慢性疾病可能会诱发的心脑血管疾病如癌症、哮喘、糖尿病、老年痴呆症、自身免疫病、骨质疏松症、或早衰。在另一优选例中,所述的炎症性疾病包括眼部炎性疾病、胰腺炎、炎症性肠病、肺部炎症、皮肤炎症、类风湿性关节炎、强直性脊柱炎、感染性心内膜炎、慢性支气管炎、阑尾炎、或风湿病。在另一优选例中,所述的炎症因子包括COX-2、TNF-α、IL-1β、IL-6、IL-8、MCP-1、或TGF-β。本发明第六方面,提供了一种组合物,含有本发明第一方面所述的分离的多肽,和/或本发明第二方面所述的多肽组合作为活性成分,以及药学上和/或食品学和/或化妆品学上可接受的载体。在另一优选例中,所述的组合物包括药物组合物、食品组合物和/或化妆品组合物。在另一优选例中,所述的活性成分的浓度为1-1000μg/ml,优选地,为5-500μg/ml,更优选地,为10-200μg/ml。在另一优选例中,所述组合物的剂型包括口服剂型、或胃肠外剂型,如外用或局部使用剂型。在另一优选例中,所述的组合物的剂型包括片剂、丸剂、微丸剂、缓释剂、乳剂、混悬剂、颗粒剂、粉剂、冻干剂、糖浆、膏剂、霜剂、滴剂、含服剂、 静脉注射剂、栓剂、喷雾剂、气雾剂、洗剂、含漱剂、贴剂、或滴眼剂。本发明第七方面,提供了一种体外非治疗性的抑制炎症因子的方法,包括步骤:向细胞培养物中添加本发明第一方面所述分离的多肽、本发明第二方面所述的多肽集合,和/或本发明第六方面所述的组合物,从而抑制所述细胞中的炎症因子。本发明第八方面,提供了一种预防和/或治疗炎症性疾病和/或抑制炎症因子的方法,包括步骤:向所需的对象施用安全有效量的本发明第一方面所述的分离的多肽、本发明第二方面所述的多肽组合和/或本发明第六方面所述的组合物。在另一优选例中,所述的对象为哺乳动物,包括小鼠、大鼠或人。在另一优选例中,所述的对象为患有炎症性疾病的对象,和/或体内炎症因子增高的对象。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1为SephadexG-25凝胶柱层析色谱图,其中,在收集到的5个具有抗炎活性的组分中,F4组分表现出较好的抗炎活性。图2为半制备型HPLC色谱图,所收集到的9个组分均表现出一定程度的抗炎活性,其中,F4e抗炎效果最为显著。图3为筛选获得的F4二级质谱图,从图中可以看出,经过初步纯化后的乳清蛋白肽仍含有多个组分,需要进一步的分离以及活性筛选实验来确定抗炎活性最好的肽段。图4显示了F4e中抗炎活性最好的肽段DQWL质谱。图5显示了合成肽RT-PCR抗炎结果。图6显示了合成肽ELISA抗炎结果。图7显示了肽段DQWL通过NF-κB、p38MAPK信号通路抑制了炎症因子的作用,从图中可以看出,该肽段可显著抑制NF-κB通路中NF-κBp65的核转位,IKKα/β的磷酸化及IκBα的降解并有效降低MAPK途径中磷酸化p38的表 达。具体实施方式本发明人经过广泛而深入的研究,通过将乳清蛋白酶解为肽段混合物,经过超滤分离得到不同分子量的肽段部位、再经过柱层析和制备色谱得到纯度较高的多肽样品,采用质谱分析鉴定出多肽的氨基酸序列,并对多肽进行抗炎活性测试,从乳清蛋白中发现具有抗炎活性的新多肽。通过分析乳清蛋白经适度酶解后肽段的组成和序列,本发明评价了不同肽段的抗炎活性,为乳清蛋白的高值化开发和利用提供了良好借鉴。本发明实验证明,通过碱性蛋白酶水解乳清蛋白,利用经筛选得到的活性组分可有效减少啮齿类动物细胞模型中因LPS诱导而产生的细胞因子释放,起到抗炎的效果。本发明提供的活性多肽为揭示乳清蛋白抗炎活性肽序列结构和活性之间的关系提供了理论基础,并为食源性抗炎活性肽的研究和开发利用提供了科学参考,以便最大限度发挥抗炎活性肽的优势作用,具有重要的理论意义和应用潜力。在此基础上,完成了本发明。活性多肽在本发明中,术语“本发明多肽”、“式I多肽”、“F4e小肽”或“肽F4e”可互换使用,都指具有炎症抑制活性的DQWL多肽(SEQIDNO.:1)作为核心序列的式I所示的分离的多肽。A-B-C式I;其中,A和C分别为无,或1-2个氨基酸残基;B为DQWL(SEQIDNO.:1)所示的核心序列;“-”为肽键;所述的多肽具有预防或治疗炎症性疾病的活性。其中,A为无或选自K、L、R、I、KL、KI、RL或RI,和/或C为无或选自C、E、S、D、CE、CD、SE或SD。此外,所述术语还包括含有式I所示多肽的具有炎症抑制功能的多肽集合,或者式I所示多肽序列的变异形式。这些变异形式包括除核心序列以外(但并不限于):1-3个(通常为1-2个,最佳地1个)氨基酸的缺失、插入和/或取代,以及在C末端和/或N末端添加一个或数个(通常为5个以内,较佳地为3个以内,更佳地为2个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在C末端和/或N末 端添加一个或数个氨基酸通常也不会改变蛋白质的结构和功能。本发明还包括F4e蛋白的活性片段、衍生物和类似物。如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持抑制炎症功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,或(ii)在一个或多个氨基酸残基中具有取代基团的多肽,或(iii)F4e多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽,或(iv)附加的氨基酸序列融合于此多肽序列而形成的多肽(与前导序列、分泌序列或6His等标签序列融合而形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。发明还提供了F4e蛋白或多肽的类似物。这些类似物与天然F4e多肽的差别可以是氨基酸序列上的差异,也可以是不影响序列的修饰形式上的差异,或者兼而有之。类似物还包括具有不同于天然L-氨基酸的残基(如D-氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的多肽并不限于上述例举的代表性多肽。修饰(通常不改变一级结构)形式包括:体内或体外的多肽的化学衍生形式如乙酰化或羧基化。修饰还包括糖基化,如那些在多肽的合成和加工中或进一步加工步骤中进行糖基化修饰而产生的多肽。这种修饰可以通过将多肽暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的多肽。本发明多肽还可以由药学上或生理学可接受的酸或碱衍生的盐形式使用。这些盐包括(但不限于)与如下酸形成的盐:氢氯酸、氢溴酸、硫酸、柠檬酸、酒石酸、磷酸、乳酸、丙酮酸、乙酸、琥珀酸、草酸、富马酸、马来酸、草酰乙酸、甲磺酸、乙磺酸、苯磺酸、或羟乙磺酸。其他盐包括:与碱金属或碱土金属(如钠、钾、钙或镁)形成的盐,以及以酯、氨基甲酸酯或其他常规的“前体药物”的形式。多肽集合本发明还提供了一种多肽集合。所述多肽集合除了本发明F4e(式I)多肽以外,还含有选自下组的一种或多种短肽:DYKKY(SEQIDNO.:2)、LF、AVF、WLA、WYSL(SEQIDNO.:3)、GTWY(SEQIDNO.:4)和EYGLF(SEQIDNO.:5)。本发明多肽集合所含有的多肽均为抗炎活性多肽,同时也包含了其药学上可接受的盐的形式。本发明多肽集合也可以是各种多肽的混合物形式,用于制备药物、食品和/或化妆品组合物。本发明多肽集合可以在独立制备各多肽后进行组合或混合,也可以采用重组的方式制备出各多肽的混合物。应理解,本发明多肽或多肽集合的制备均为本领域技术人员熟知。编码序列本发明还涉及编码本发明多肽或多肽集合的多核苷酸。在获得了氨基酸序列后,可采用常规方法获知这些多肽或多肽集合的野生编码序列。本发明的多核苷酸可以是DNA形式或RNA形式。DNA可以是编码链或非编码链。编码成熟多肽的编码区序列可以与式I所示的编码区序列相同或者是简并的变异体。如本文所用,“简并的变异体”在本发明中是指编码具有本发明多肽,但与其野生型蛋白中相应编码区序列有差别的核酸序列。本发明的F4e核苷酸全长序列或其片段通常可以用PCR扩增法、重组法或人工合成的方法获得。目前,已经可以完全通过化学合成来得到编码本发明多肽(或其片段,或其衍生物)的DNA序列。然后可将该DNA序列引入本领域中已知的各种现有的DNA分子(或如载体)和细胞中。本发明也涉及包含本发明的多核苷酸的载体,以及用本发明的载体或H-RN蛋白编码序列经基因工程产生的宿主细胞。酶解反应酶解获得生物活性肽常用的工具酶主要有胰蛋白酶、胰凝乳蛋白酶、碱性蛋白酶、胃蛋白酶、木瓜蛋白酶和复合蛋白酶等。目前已经应用在抗炎肽研究方面的蛋白酶主要有胰蛋白酶、胰凝乳蛋白酶、胃蛋白酶和植物蛋白酶等。其中,碱性蛋白酶在此方面的研究相对较少,且碱酶具有终端疏水性氨基酸的专一性,主要裂解疏水性氨基酸如:Leu、Ile、Val等的终端。本发明人采用了碱性蛋白酶对乳清蛋白进行了优化水解,从而获得了小片段本发明多肽。当然,在获得本发明多肽序列后,可采用更多经济、简便的方法制备本发明多肽。制备方法本发明多肽可以是重组多肽或合成多肽。本发明的多肽可以是化学合成的,或重组的。相应地,本发明多肽可用常规方法人工合成,也可用重组方法生产。一种优选的方法是使用液相合成技术或固相合成技术,如Boc固相法、Fmoc固相法或是两种方法联合使用。固相合成可快速获得样品,可根据目的肽的序列特征选用适当的树脂载体及合成系统。例如,Fmoc系统中优选的固相载体如连接有肽中C端氨基酸的Wang树脂,Wang树脂结构为聚苯乙烯,与氨基酸间的手臂是4-烷氧基苄醇;用25%六氢吡啶/二甲基甲酰胺室温处理20分钟,以除去Fmoc保护基团,并按照给定的氨基酸序列由C端逐个向N端延伸。合成完成后,用含4%对甲基苯酚的三氟乙酸将合成的胰岛素原相关肽从树脂上切割下来并除去保护基,可过滤除树脂后乙醚沉淀分离得到粗肽。将所得产物的溶液冻干后,用凝胶过滤和反相高压液相层析法纯化所需的肽。当使用Boc系统进行固相合成时,优选树脂为连接有肽中C端氨基酸的PAM树脂,PAM树脂结构为聚苯乙烯,与氨基酸间的手臂是4-羟甲基苯乙酰胺;在Boc合成系统中,在去保护、中和、偶联的循环中,用TFA/二氯甲烷(DCM)除去保护基团Boc并用二异丙基乙胺(DIEA)/二氯甲烷中和。肽链缩合完成后,用含对甲苯酚(5-10%)的氟化氢(HF),在0℃下处理1小时,将肽链从树脂上切下,同时除去保护基团。以50-80%乙酸(含少量巯基乙醇)抽提肽,溶液冻干后进一步用分子筛SephadexG10或Tsk-40f分离纯化,然后再经高效液相纯化得到所需的肽。可以使用肽化学领域内已知的各种偶联剂和偶联方法偶联各氨基酸残基,例如可使用二环己基碳二亚胺(DCC),羟基苯骈三氮唑(HOBt)或1,1,3,3-四脲六氟磷酸酯(HBTU)进行直接偶联。对于合成得到的短肽,其纯度与结构可用反相高效液相和质谱分析进行确证。在一优选例中,本发明F4e多肽,按其序列,采用固相合成的方法制备,经高效液相色谱纯化,获得高纯度的肽冻干粉,-20℃贮存。另一种方法是用重组技术产生本发明多肽。通过常规的重组DNA技术,可利用本发明的多核苷酸可用来表达或生产重组的本发明多肽。一般来说有以下步骤:(1).用本发明的编码本发明多肽的多核苷酸(或变异体),或用含有该多核苷酸的重组表达载体转化或转导合适的宿主细胞;(2).在合适的培养基中培养的宿主细胞;(3).从培养基或细胞中分离、纯化蛋白质。重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相色谱(HPLC)和其它各种液相色谱技术及这些方法的结合。由于本发明多肽较短,因此可以考虑将多个多肽串联在一起,重组表达后获得表达产物,然后通过酶切等方法形成所需的小肽。本发明多肽集合尤其适用于该种制备方法组合物和施用方法另一方面,本发明还提供了一种组合物,包括药物组合物、食品组合物或化妆品组合物,它含有(a)安全有效量的本发明多肽或其药学上/食品学上/化妆品学上可接受的盐;以及(b)药学上/食品学上/化妆品学上可接受的载体或赋形剂。本发明多肽的数量通常为10微克-100毫克/剂,较佳地为100-1000微克/剂。为了本发明的目的,有效的剂量为给予个体约0.01毫克/千克至50毫克/千克,较佳地0.05毫克/千克至10毫克/千克体重的本发明多肽。此外,本发明的多肽可以单用,也可与其他治疗剂一起使用(如配制在糖皮质激素、免疫抑制剂或非甾体类消炎药等药物组合物中)。本发明组合物还可含有药学上/食品学上/化妆品学上可接受的载体。术语“药学上/食品学上/化妆品学上可接受的载体”指用于口服和/或胃肠外施用的载体。该术语指这样一些药剂载体:它们本身不诱导产生对接受该组合物的个体有害的抗体,且给药后没有过分的毒性。这些载体是本领域普通技术人员所熟知的。在Remington'sPharmaceuticalSciences(MackPub.Co.,N.J.1991)中可找到关于药学上可接受的赋形剂的充分讨论。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、佐剂、及其组合。本发明组合物能够通过常规途径(如口服、直肠、静脉注射、肌肉内、皮下、通过宫内、硬脑膜注射、或通过侧脑室(intracerebroventricular)注射) 施用于哺乳动物,包括大鼠、小鼠、家畜和人。所以,药物组合物可以制成本领域已知的典型药物制剂。药物组合物可以制成口服制剂、可注射制剂、栓剂、经皮制剂和经鼻制剂,但不限于此。可以制成任何制剂,优选液体、悬浮液、粉末、颗粒、片剂、胶囊、药丸、乳液、糖浆、气雾剂或口服制剂,例如萃取物。这些组合物可根据常规方法通过混合、稀释或溶解而进行配制,并且偶尔添加合适的药物添加剂,如赋形剂、崩解剂、粘合剂、润滑剂、稀释剂、缓冲剂、等渗剂(isotonicities)、防腐剂、润湿剂、乳化剂、分散剂、稳定剂和助溶剂,而且该配制过程可根据剂型用惯常方式进行。治疗性组合物中药学上可接受的载体可含有液体,如水、盐水、甘油和乙醇。另外,这些载体中还可能存在辅助性的物质,如润湿剂或乳化剂、pH缓冲物质等。载体和添加剂可以是任何药学上可接受的例子。具体地说,优选的稀释剂的例子可以包括:乳糖、葡萄糖、蔗糖、玉米淀粉、豆油、微晶纤维素、山梨醇、木糖醇和甘露醇,优选的润滑剂的例子可以包括:硬脂酸镁和滑石,优选粘结剂的例子可以包括:聚乙烯吡咯烷酮或羟丙基纤维素。另外,优选的崩解剂的例子可以包括:羧甲基纤维素钙、羧甲淀粉钠、聚丙烯酸钾或交聚维酮,优选的甜味剂的例子可以包括:白糖、果糖、山梨醇或阿斯巴甜,优选的稳定剂的例子可以包括:羧甲基纤维素钠、β-环糊精、百蜜蜡、和黄原胶(Xhantangum),优选的防腐剂的例子可以包括:对羟基苯甲酸甲酯、对羟基苯甲酸丙酯和山梨酸钾。除这些成分之外,还可包含用于改善口味的已知添加剂,例如:天然调味剂,如李子、柠檬、菠萝或药草口味,天然果汁、天然染料,如叶绿酸或黄酮类,甜味剂成分,如果糖、蜂蜜、糖醇、或食糖、或者酸化剂如柠檬酸或柠檬酸钠。用于胃肠外施药制剂的例子包括:无菌水溶液、无水溶剂、悬浮液、乳液、冻干剂和栓剂。为了制备无水溶剂和悬浮液,可以使用丙二醇、聚乙二醇、植物油如橄榄油、或可注射酯如油酸乙酯。作为栓剂基料,可以使用witepsol(一种饱和脂肪酸混合物的甘油酯)、聚乙二醇、吐温61、可可脂、月桂酸油或甘油明胶。通常,可将治疗性组合物制成可注射剂,例如液体溶液或悬液;还可制成 在注射前适合配入溶液或悬液中、液体载体的固体形式。本发明的药物组合物还可以缓释剂形式给药。例如本发明多肽或其盐可被掺入以缓释聚合物为载体的药丸或微囊中,然后将该药丸或微囊通过手术植入待治疗的组织。此外,本发明多肽或其盐还可通过插入预先涂有药物的眼内透镜而得以应用。作为缓释聚合物的例子,可例举的有乙烯-乙烯基乙酸酯共聚物、聚羟基甲基丙烯酸酯(polyhydrometaacrylate)、聚丙烯酰胺、聚乙烯吡咯烷酮、甲基纤维素、乳酸聚合物、乳酸-乙醇酸共聚物等,较佳地可例举的是可生物降解的聚合物如乳酸聚合物和乳酸-乙醇酸共聚物。当本发明的药物组合物被用于实际治疗时,作为活性成分的本发明多肽或其药学上可接受的盐的剂量,可根据待治疗的每个病人的体重、年龄、性别、症状程度而合理地加以确定。例如,当局部施用时,通常其浓度约为0.1-10wt%,较佳地1-5wt%,每日可2-6次给药,每次1-5ml。本发明的食品组合物可以配制为本领域已知的典型食物制品。所述食品组合物可以制备为以下形式:粉末、颗粒、片剂、药丸、胶囊、悬浮液、乳液、糖浆、液体、提取物、口香糖、茶、果冻、或饮料。饮食学上可接受的载体或添加剂可以是本领域已知的任何载体或添加剂。健康功能食品组合物可以包含本发明多肽或多肽集合作为活性成分,基于食品的总重,本发明活性成分占本发明组合物的0.01到100%(wt),优选0.2到80%(wt)。除了上述的活性成分,本发明食品组合物还可包含其他组分,所述其他组分可以是常规饮料中使用的各种调味剂或天然碳水化合物。上述天然碳水化合物的例子是常规糖,如单糖(如葡萄糖、果糖等),二糖(如麦芽糖、蔗糖等)和多糖(如葡聚糖、环糊精等),以及糖醇,如木糖醇、山梨醇和赤藓糖醇。也可以添加其他调味剂、天然调味剂(如奇异果甜蛋白(taumatin)、甜叶菊提取物等)以及合成调味剂(如糖精、阿斯巴甜等)。此外,本发明组合物还可以是化妆品组合物,可按照本领域常规技术将本发明多肽制备成乳剂、霜剂、膏剂、滴剂、混悬剂等用于外用或局部制剂。适应症本发明多肽及其衍生多肽可用于制备抑制炎症或治疗与炎症相关疾病的组合物。如本文所用,所述的炎症包括感染性和非感染性炎症。在炎症反应过程中,促炎症细胞因子参与了炎症的发生和发展。其中,TNF-α是炎症反应过程中出现最早、最重要的炎性介质,能激活中性粒细胞和淋巴细胞,使血管内皮细胞通透性增加,调节其他组织代谢活性并促使其他细胞因子的合成和释放。炎症相关疾病可用于本发明的炎症相关疾病包括眼部炎性疾病、胰腺炎、炎症性肠病、肺部炎症、皮肤炎症、类风湿性关节炎、强直性脊柱炎。在本发明中,炎症相关疾病,多以TNF-α、COX-2、IL-1β或IL-6增高为共性,因此,只要本发明多肽能够有效抑制促炎性细胞因子TNF-α、COX-2、IL-1β或IL-6,所述多肽即具有抑制炎症或治疗所述炎症相关疾病的作用。工业应用性含有本发明多肽(或多肽集合)或其药学上可接受盐作为活性成分的药物组合物,对炎症有显著的抑制活性。多肽的应用主要集中在多肽药物、组织工程材料、诊断用多肽,多肽疫苗,多肽药物载体,组织工程材料、化妆品多肽和多肽营养食品等方面。本发明的主要优点包括:(a)本发明多肽的分子量小,可透过各种人体组织屏障;(b)水溶性好,能在体液中保持较高的浓度;(c)安全性高,对生物组织毒副作用小;(d)可通过固相合成的方法制备,纯度高,产量大,成本低。因此本发明多肽有望开发成药物、食品或化妆品,用于治疗全身或局部的炎症相关性疾病,如炎症性肠病、皮肤炎症等。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如Sambrook等人,分子克隆:实验室手册(NewYork:ColdSpringHarborLaboratoryPress,1989)中所述的条件,或按照制造厂商所建议的条件。通用方法氨基酸序列分析液相色谱条件:流动相:A-超纯水(体积分数0.1%甲酸),B-乙腈(体积分数0.1%甲酸);0min:95%A;55min:60%A+40%B;80min:5%B。质谱仪条件:离子方式:ESI+;毛细管电压:2.5kV;锥孔电压:30V;离子源温度:100℃;脱溶剂气体温度:250℃;脱溶剂气体流量:600L/h;锥孔气体流量:50L/h;碰撞能量:40V;质荷比扫描范围:500~2000m/z;检测电压:1600V。取一定量RP-HPLC制备所得样品,加乙腈-水溶液溶解;用UPLC-TOF/MS对样品进行质谱分析,得到实验质谱图;用所得质谱图进行专业软件分析和数据库搜索,分析并推导出氨基酸序列。ELISA测定在12孔板中培养细胞,当RAW246.7细胞生长达到80%的融合时,将抗炎活性肽溶于PBS,加入RAW246.7的培养体系中,达到100μg/mL和10μg/mL终浓度,生化培养箱37℃,5%CO2继续培养24h。随后采用脂多糖(LPS)刺激,LPS终浓度为10ng/mL,细胞继续培养24h。最后,收集培养液用于后期实验。实施例1碱酶酶解制备乳清蛋白抗炎活性肽及多肽的纯化1.1碱酶酶解制备乳清蛋白抗炎活性肽将乳清蛋白粉配制成一定底物浓度的溶液(6%),搅拌混匀。80℃预处理10min,待乳清蛋白溶液冷却后,用0.1mol/LCH3COONH4缓冲液调pH至酶的最适值(pH=8),加入碱性蛋白酶([E/S]=6%),55℃下酶解6h,90℃灭酶10min,迅速冷却,获得乳清蛋白活性肽粗提液。8000r/min冷冻离心20min。收集上清液,抽滤。收集滤液,调节ph至中性,真空冷冻干燥。1.2超滤分离纯化将酶解所得冻干粉加水溶解,玻璃棒搅拌混匀,配制成待滤液,所述待滤液通过1kD的超滤膜进行超滤(30psi),收集分子量<1kD的滤液,将所述滤液真空冷冻干燥后,获得具有抗炎活性的乳清蛋白肽粗品。1.3葡聚糖凝胶柱色谱分离纯化取50mg超滤所得样品,加1mL超纯水溶解;将乳清肽粗提液上样于葡聚 糖凝胶柱(SephadexG-25)分离,以去离子水作为溶剂和流动相(流速0.6mL/min),对超滤所得样品进行洗脱;将收集到的样品溶液在280nm波长下测定吸光值,收集抗炎活性较好组分F4冷冻干燥。1.4半制备型RP-HPLC分离纯化将冻干粉溶于超纯水,用反相HPLC制备,洗脱液A:水-0.01%三氟乙酸,洗脱液B:乙腈-0.01%三氟乙酸;流速:5mL/min;检测波长:280nm。RP-HPLC梯度洗脱方法收集抗炎活性较好的部分F4c、F4e、F4i真空冷冻干燥,所获结果的层析色谱图见图1和图2,其中抗炎活性最好的肽段DQWL质谱图见图4。经质谱检测,结果如下:F4c,主要成分为Gly-Thr-Trp-Tyr(GTWY),Asp-Tyr-Lys-Lys-Tyr(DYKKY);F4e,主要成分为Leu-Phe(LF),Ala-Val-Phe(AVF),Trp-Leu-Ala(WLA),Asp-Gln-Trp-Leu(DQWL);F4i主要成分为Trp-Tyr-Ser-Leu(WYSL),Glu-Tyr-Gly-Leu-Phe(EYGLF)。对上述抗炎活性肽进行单体合成,并进行基因和蛋白质水平上抗炎活性的验证。实施例2溶解度测试称取实施例1中抗炎活性最好的肽段DQWL的粉末状供试品,置于25±2℃一定容量的纯水中,每隔5分钟强力振摇30秒钟,观察30分钟内的溶解情况,如无目视可见的溶质颗粒或液滴,即视为完全溶解。结果表明,25mgDQWL粉末可溶解于1mL水中,表明其具有较好的溶解性。实施例3抗炎活性测试(1)实验采用小鼠的腹腔巨噬细胞RAW264.7,通过PCR检测LPS诱导而 产生的炎症因子的释放,而检测其抗炎的效果;(2)抗炎实验:在6孔板中培养细胞,当RAW246.7细胞生长达到80%的融合时,将不同分离纯化阶段收集的组分溶于PBS,加入六孔板中RAW246.7的培养体系中,达到100μg/mL终浓度(肽单体为100μg/mL和10μg/mL两个浓度),生化培养箱37℃,5%CO2继续培养72h。随后采用脂多糖(LPS)刺激,LPS终浓度为10ng/mL,细胞继续培养4h。最后,弃去培养液,收集细胞用于后期实验。(3)提取总RNA:将培养基吸出,加入Trizol试剂提取总RNA,转移至离心管中,每管加入200μL氯仿,12000rpm,4℃下离心20min,吸取上清液,并加入等体积的异丙醇,-20℃下过夜。取出过夜后的总RNA提取物,12000rpm,4℃下离心20min;吸除上清液,75%乙醇-DEPC水溶液溶解,10000rpm,4℃下离心15min;吸除上清液,75%乙醇-DEPC水溶液溶解,10000rpm,4℃下离心5min;吸除取上清液,通风橱内挥干。挥干后的RNA提取物用20μLDEPC水溶解,NanoDrop280nm波长下测定每个样品的总RNA含量;(4)反转录PCR:构建20μL反应体系,合成cDNA;(5)实时荧光定量PCR:对cDNA进行扩增。(6)采用SPSS单因素方差分析对实时荧光定量PCR的结果进行分析,比较组间差异显著性,可得到不同实验组TNF-α,IL-1β,COX-2mRNA的表达水平结果。结果表明(图5-6),上述8个肽段,在基因和蛋白质水平上都表现出一定的抗炎效果,其中,DQWL在两个水平两个浓度上抗炎效果最为显著,活性最好。实施例4Western测定在6孔板中培养细胞,当RAW246.7细胞生长达到80%的融合时,将抗炎活性肽溶于PBS,加入RAW246.7的培养体系中,达到10μg/mL终浓度,生化培养箱37℃,5%CO2继续培养72h。随后采用脂多糖(LPS)刺激,LPS终浓度为10ng/mL,细胞继续培养1h。最后,弃去培养液,收集细胞,提取蛋白并测定总蛋白含量用于后期实验,结果如图7(DQWL10μg/mL,LPS10ng/mL)。结果表明,DQWL能够引发IKKα/β的磷酸化和IκBα的降解以及细胞质p65向细胞核的转移。同时,能够显著降低MAPK途径中磷酸化p38的表达。因此DQWL对炎症因子的抑制主要是通过NF-κB和p38MAPK信号通路调节。实施例5DQWL衍生肽的制备及活性测试按下表序列变化合成了符合式I的DQWL衍生多肽:表1ABCSEQIDNO.:多肽2LDQWLC6多肽3IDQWLS7多肽4KLDQWLCE8多肽5KIDQWLCD9多肽6RLDQWLSE10多肽7RIDQWLSD11按实施例3的方法,对表1中合成的序列进行了抗炎测试,结果发现,在10μg/ml的浓度下,这些多肽对TNF-α,IL-1β,COX-2等炎症因子均具有显著的抑制效应。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1