人脐带MSC无血清培养液脂质体冻干粉及其制备和应用的制作方法
本发明属于干细胞培养液化妆品技术领域,具体涉及一种人脐带MSC(间充质干细胞)无血清培养液脂质体冻干粉,还涉及了该干细胞无血清培养液脂质体冻干粉的制备方法和应用。
背景技术:
干细胞美容最早被应用于整形外科,整形外科中应用较多的干细胞种类是间充质干细胞、表皮干细胞、血管内皮祖细胞及前脂肪细胞等。
人间充质干细胞(mesenchymal stem cell,MSC)在培养中分泌碱性成纤维细胞生长因子(bFGF)、人表皮生长因子(EGF)、血管内皮生长因子(VEGF)、胰岛素样生长因子-1(IGF-1)和肝细胞生长因子(HGF)在内的多种促进皮肤细胞再生的生长因子。这些具有生物活性的生长因子能够有效的促进皮肤细胞的新陈代谢;促进细胞外透明质酸、糖蛋白等大分子的合成和分泌,增强皮肤的亲水性;促进表皮细胞的生长、分化和修复,使衰老死亡的细胞得以及时补充;同时能够加速角质层修复,加速基底新老细胞更替,使肌肤回到年轻姿态。因此,将人间充质干细胞用于美容护肤得到了广泛地关注和研究。
目前人间充质干细胞在美容领域的应用主要采用传统的干细胞美容术,即直接注射干细胞针剂的方法,这种注射用干细胞的来源主要是从流产的胚胎中提取的,所以难免会引起免疫排斥反应,而且存在一定的伦理问题。即使是采用自体干细胞,但是在干细胞的培养扩增过程中会引入外源性的蛋白(胎牛血清),也容易引起免疫排斥反应;而且液态培养上清在常温保存时间很短,即使是通过冷冻干燥技术除去水分做成冻干粉,其稳定性也不理想,必须现配现用。同时很难直接添加到各种剂型的化妆品中。这样就在很大程度上限制了其在化妆品领域的应用。
技术实现要素:
本发明的一个目的是提供一种人脐带间充质干细胞无血清培养液脂质体冻干粉,解决了现有美容用人脐带间充质干细胞培养上清液易引起免疫排斥反应、保存期限短以及在化妆品中配伍性差的问题。
本发明的第二个目的是提供上述人脐带间充质干细胞无血清培养液脂质体冻干粉的制备方法。
本发明的第三个目的是提供上述人脐带间充质干细胞无血清培养液脂质体冻干粉的应用,解决现有美容用人脐带间充质干细胞难以直接加入化妆品的问题。
本发明所采用的一个技术方案是,一种人脐带间充质干细胞无血清培养液脂质体冻干粉,按质量百分比包括以下组分:人脐带间充质干细胞无血清培养液活性蛋白成分1~3%,磷脂15~60%,胆固醇1~12%,吐温-80 1~25%,脂溶性抗氧化剂0.5~10%,冻干保护剂10~60%,水1~5%,以上各组分的质量总和是100%。
优选地,磷脂选自蛋黄卵磷脂、大豆卵磷脂、氢化蛋黄磷脂、氢化大豆磷脂、脑磷脂、二棕榈酸磷脂酰胆碱、二硬脂酸磷脂酰胆碱、二肉豆寇酸磷脂酰胆碱、二月桂酸磷脂酰胆碱或二棕榈酸磷脂酰乙醇胺中的一种或几种的任意比例混合物;脂溶性抗氧化剂选自维生素E、丁基羟基茴香醚、二丁基羟基甲苯、泛醌或叔丁基对苯二酚中的一种或几种的任意比例混合物;冻干保护剂选自海藻糖、蔗糖、乳糖、葡萄糖、棉籽糖、右旋糖苷、甘露醇、山梨醇或木糖醇中的一种或几种的任意比例混合物。
本发明的另一个技术方案是,上述人脐带间充质干细胞无血清培养液脂质体冻干粉的制备方法,包括以下步骤:
步骤1,制备空白脂质体悬液;
首先将磷脂、胆固醇、吐温-80和脂溶性抗氧化剂溶于无水乙醇,得到原料溶液;再将该原料溶液缓慢加入到含有冻干保护剂的磷酸盐缓冲液中,进行水化,得到浅黄色乳浊液;然后去除乳浊液中的所有乙醇,最后对乳浊液进行超声整粒,得到空白脂质体悬液。
步骤2,制备人脐带间充质干细胞无血清培养液脂质体冻干粉;
将人脐带间充质干细胞无血清培养液加入空白脂质体悬液,在水浴和超声的条件下进行包封反应,包封反应结束后对产物进行过膜整粒,收集过膜后的产物,将产物依次经冻融、冷冻干燥后,得到人脐带间充质干细胞无血清培养液脂质体冻干粉。
其中,上述人脐带间充质干细胞无血清培养液的制备方法为:取新生儿脐带,将静脉内血迹洗涤干净;去除表皮、两条动脉血管及一条静脉血管,将组织剪碎,加入含FBS的DMEM/F12培养基培养,得到原代人脐带间充质干细胞;当细胞融合度为80%-90%时,胰蛋白酶消化细胞传代培养,取5~15代的传代细胞继续培养,当细胞融合度80%-90%时,弃含FBS的培养上清,PBS洗涤细胞,加入无血清的DMEM/F12培养基继续培养48-72小时,收集无血清培养液。
优选地,步骤1中磷脂、胆固醇、吐温-80、脂溶性抗氧化剂和乙醇的质量百分比为:磷脂5~30%,胆固醇1~10%,吐温-80 0.1~15%,脂溶性抗氧化剂0.1~5%,无水乙醇50~85%,以上各组分的质量总和是100%。
优选地,步骤1中原料溶液与冻干保护剂的质量关系为1:1-30:1,冻干保护剂的磷酸盐缓冲液中冻干保护剂的含量2-10%。
优选地,步骤2中空白脂质体悬液中总固含量和人脐带间充质干细胞无血清培养液中总固含量的质量比为30:1。
优选地,步骤2空白脂质体悬液的质量浓度为2~10%,所述包封反应具体为在30~35℃水浴中超声5-10min,超声功率200-300W。
优选地,步骤2中的冻融为-80℃冷冻1h,20℃水浴解冻,一共冻融2~10次;冷冻干燥中预冻温度为-60℃±2℃,预冻时间6h以上,冷阱温度为-50~-56℃,真空度≤80mT,冻干时间24-36h。
本发明还提供了上述人脐带间充质干细胞培养液脂质体冻干粉在化妆品中的应用。
制备化妆品时,将上述人脐带间充质干细胞无血清培养液脂质体冻干粉水化后,直接加入化妆品中。
本发明的有益效果是,(1)本发明所用的干细胞培养上清液为无血清培养上清,减小了干细胞用于美容中存在的免疫排斥反应;(2)采用脂质体工艺将具有多种活性细胞因子的干细胞无血清培养上清液包覆,进而冻干,保质期可长达三年,远高于现有人间充质干细胞的保质期,解决了上清液保存期短的问题;(3)经脂质体包覆后的干细胞无血清培养上清液可直接添加于乳液、霜膏、精华液、凝胶等多种剂型的化妆品,拓宽了其在化妆品领域的应用。
附图说明
图1是HUC和HUC-LP对L929细胞增殖影响干预培养1-7天倒置显微镜照片;
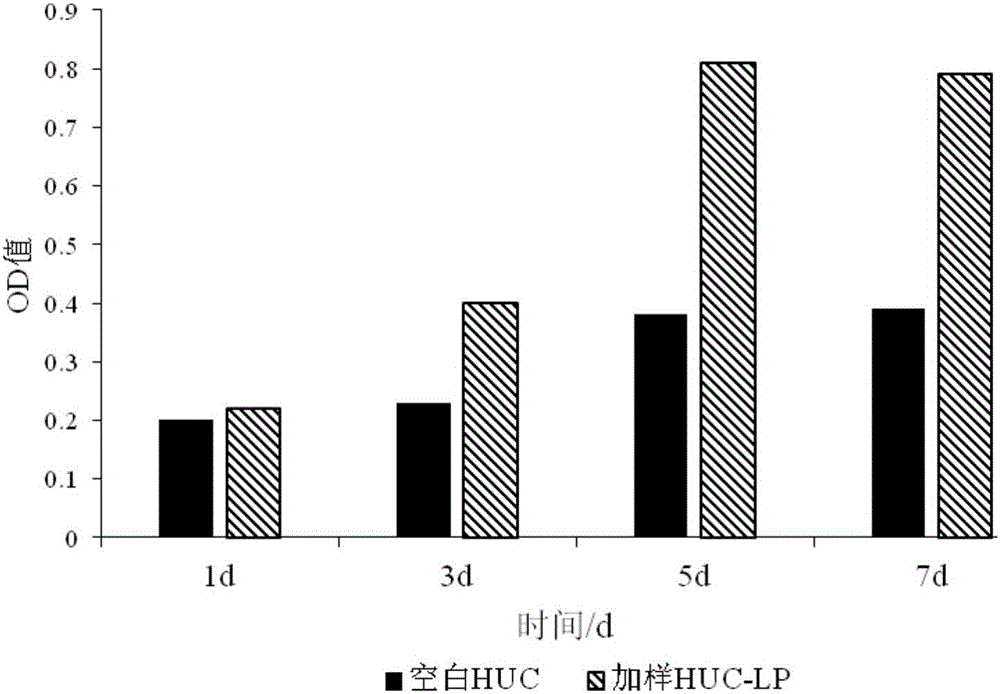
图2是HUC和HUC-LP对L929细胞增殖影响干预培养1-7天OD值;
图3是Rz和Ra结果(产品区、对照区与初始值的比较)比较图。
具体实施方式
下面结合附图和具体实施方式对本发明作进一步的详细说明,但本发明并不限于这些实施方式。
本发明的人脐带间充质干细胞无血清培养液脂质体冻干粉,按质量百分比包括以下组分:人脐带间充质干细胞无血清培养液活性蛋白成分1~3%,磷脂15~60%,胆固醇1~12%,吐温-80 1~25%,脂溶性抗氧化剂0.5~10%,冻干保护剂10~60%,水1~5%,以上各组分的质量总和是100%。
优选地,磷脂选自蛋黄卵磷脂、大豆卵磷脂、氢化蛋黄磷脂、氢化大豆磷脂、脑磷脂、二棕榈酸磷脂酰胆碱、二硬脂酸磷脂酰胆碱、二肉豆寇酸磷脂酰胆碱、二月桂酸磷脂酰胆碱或二棕榈酸磷脂酰乙醇胺中的一种或几种的任意比例混合物;脂溶性抗氧化剂选自维生素E、丁基羟基茴香醚、二丁基羟基甲苯、泛醌或叔丁基对苯二酚中的一种或几种的任意比例混合物;冻干保护剂选自海藻糖、蔗糖、乳糖、葡萄糖、棉籽糖、右旋糖苷、甘露醇、山梨醇或木糖醇中的一种或几种的任意比例混合物。
该人脐带间充质干细胞无血清培养液脂质体冻干粉的制备方法如下:
步骤(1),制备人脐带间充质干细胞无血清培养液
取新生儿脐带,将静脉内血迹洗涤干净;去除表皮、两条动脉血管及一条静脉血管,将组织剪碎,加入含FBS的DMEM/F12培养基培养,得到原代人脐带间充质干细胞;当细胞融合度为80%-90%时,胰蛋白酶消化细胞传代培养,取5-15代传代细胞继续培养,当细胞融合度80%-90%时,弃含FBS的培养上清,PBS洗涤细胞,加入无血清的DMEM/F12培养基继续培养48-72小时,收集无血清培养液。
步骤(2),乙醇注入法制备空白脂质体悬液
先将磷脂、胆固醇、吐温-80和脂溶性抗氧化剂溶于无水乙醇,得到原料溶液,其中,磷脂、胆固醇、吐温-80、脂溶性抗氧化剂和乙醇的质量百分比为:磷脂5~30%,胆固醇1~10%,吐温-80 0.1~15%,脂溶性抗氧化剂0.1~5%,无水乙醇50~85%,以上各组分的质量总和是100%。磷脂、胆固醇、吐温-80和脂溶性抗氧化剂的总质量与无水乙醇的最佳质量比为1:1~1:6。再将该原料溶液缓慢加入到含有冻干保护剂的磷酸盐缓冲液中进行水化,原料溶液与冻干保护剂的质量关系为1:1-30:1,冻干保护剂的磷酸盐缓冲液中冻干保护剂的含量2-10%。水化结束得到浅黄色乳浊液;然后去除乳浊液中的所有乙醇,最后对乳浊液进行超声整粒,超声功率为200-300W,超声时间为10~30min,得到空白脂质体悬液。
步骤(3),制备人脐带间充质干细胞无血清培养液脂质体冻干粉;
取人脐带间充质干细胞无血清培养液加入空白脂质体悬液,其中,空白脂质体悬液中总固含量和人脐带间充质干细胞无血清培养液中总固含量的质量比为30:1。在30~35℃水浴和200-300W超声功率的条件下超声5-10min,完成包封反应,然后对产物进行过膜整粒,为获得粒径均匀的脂质体,使产物依次经过孔径逐渐减小的多个滤膜,孔径最小的滤膜为0.22μm滤膜,收集最后一次过膜的产物,再将产物依次经冻融、冷冻干燥;冻融为-80℃冷冻1h,20℃水浴解冻,一共冻融2~10次;冷冻干燥中预冻温度为-60℃±2℃,预冻时间6h以上,冷阱温度为-50~-56℃,真空度≤80mT,冻干时间24-36h。冻干后得到本发明人脐带间充质干细胞无血清培养液脂质体冻干粉。
该脂质体冻干粉可添加于乳液、霜膏、面膜或水剂化妆品等一切常见形态的化妆品中。使用时,将本发明脂质体冻干粉用去离子水水化后,直接加入化妆品中,即可使用。
实施例1
制备一种人脐带间充质干细胞无血清培养液脂质体冻干粉,其方法如下:
步骤(1),制备人脐带间充质干细胞无血清培养液
人脐带间充质干细胞提取:无菌条件下,取新生儿脐带5~10cm,置脐带保存液,4℃储存(时间不超过8小时)。用D-Hanks液冲洗直至静脉内无血迹。去除表皮、两条动脉血管及一条静脉血管,将组织剪碎至大约1mm3/块,加入含10%FBS的DMEM培养基(含双抗)培养大约一个星期,培养条件为37℃、饱和湿度、5%CO2,即可得到原代人脐带间充质干细胞。
收集无血清培养液:细胞融合度80%时,胰蛋白酶消化细胞传代培养,取6代的细胞继续培养。当细胞融合度80%时,弃含10%FBS的培养上清,PBS(pH=7.0)洗涤细胞三次,加入无血清的DMEM培养基继续培养72小时,收集无血清培养液。
步骤(2),乙醇注入法制备空白脂质体悬液
称取以下原料组分,大豆卵磷脂3.6g,胆固醇1.2g,吐温-80 1.0g,维生素E 0.12g,将其溶于7.5mL无水乙醇,得到原料溶液。磷脂、胆固醇、吐温-80和脂溶性抗氧化剂的总质量与无水乙醇的质量比为1:1。再将6.5g冻干保护剂海藻糖加入pH值为6.5的150mL磷酸盐缓冲液中充分混合。然后将原料溶液转移到洁净的注射器中,通过注射器滴加到含有冻干保护剂的磷酸盐缓冲液中,原料溶液与冻干保护剂的质量关系比为1.8:1,冻干保护剂的磷酸盐缓冲液中冻干保护剂的含量4.3%,进行水化,水化时间30min,水化温度35℃,得到浅黄色乳浊液。水化结束后将浅黄色乳浊液旋转蒸发除去乙醇,水浴温度40℃,旋转转速50r/min,真空度维持在0.01MPa,直到蒸发出的乙醇体积达到原料液中添加的乙醇含量时停止减压蒸发。最后对乳浊液进行超声整粒,超声功率为300W,超声时间为10min,得到空白脂质体悬液,其质量浓度为3.8%。
步骤(3),制备人脐带间充质干细胞无血清培养液脂质体冻干粉
取步骤(2)的空白脂质体悬液置于摇床中,在振荡条件下将步骤(1)的人脐带间充质干细胞无血清培养液加入悬液中,其中,空白脂质体悬液中总固含量和人脐带间充质干细胞培养液中总固含量的质量比为30:1。在30℃水浴和300W超声功率的条件下超声5min,完成包封反应。包封反应结束后使反应物依次经过0.8μm滤膜、0.65μm滤膜、0.45μm滤膜和0.22μm滤膜,进行整粒,收集通过0.22μm滤膜的产物,得到粒径均匀的包封人脐带间充质干细胞无血清培养液的脂质体悬液。该脂质体悬液在-80℃冷冻1h,并在20℃水浴中解冻,如此反复冻融5次。最后将冻融产物放入冷冻干燥机中冷冻,预冻温度为-60℃±2℃,预冻时间6h,冷阱温度为-50~-56℃,真空度≤80mT,冻干时间24h。得到最终的包封人脐带间充质干细胞无血清培养液脂质体冻干粉。
本实施例得到的包封人脐带间充质干细胞无血清培养液脂质体冻干粉,其中,人脐带间充质干细胞无血清培养液活性蛋白成分1.5%,磷脂27.9%,胆固醇9.3%,吐温-80 7.7%,脂溶性抗氧化剂0.9%,冻干保护剂50.3%,水2.4%。
本实施例制备的人脐带间充质干细胞无血清培养液脂质体冻干粉可以在室温下保存3年。
实施例2
制备一种人脐带间充质干细胞无血清培养液脂质体冻干粉,其方法如下:
步骤(1),制备人脐带间充质干细胞无血清培养液
人脐带间充质干细胞提取:无菌条件下,取新生儿脐带5~10cm,置脐带保存液,4℃储存(时间不超过8小时)。用D-Hanks液冲洗直至静脉内无血迹。去除表皮、两条动脉血管及一条静脉血管,将组织剪碎至大约1mm3/块,加入含10%FBS的DMEM培养基(含双抗)培养大约一个星期,培养条件为37℃、饱和湿度、5%CO2,即可得到原代人脐带间充质干细胞。
收集无血清培养液:细胞融合度90%时,胰蛋白酶消化细胞传代培养,取10代的细胞继续培养。当细胞融合度90%时,弃含10%FBS的培养上清,PBS(pH=7.0)洗涤细胞三次,加入无血清的F12培养基继续培养48小时,收集无血清培养液。
步骤(2),乙醇注入法制备空白脂质体悬液
称取以下原料组分,蛋黄卵磷脂10.5g,胆固醇1.5g,吐温-80 0.35g,泛醌2g,将其溶于109mL无水乙醇,得到原料溶液。磷脂、胆固醇、吐温-80和脂溶性抗氧化剂的总质量与无水乙醇的质量比为1:6。再将2.0g冻干保护剂葡萄糖和2.0g甘露醇加入pH值为6.8的150mL磷酸盐缓冲液中充分混合。然后将原料溶液转移到洁净的注射器中,通过注射器滴加到含有冻干保护剂的磷酸盐缓冲液中,原料溶液与冻干保护剂的质量关系比为25:1,冻干保护剂的磷酸盐缓冲液中冻干保护剂的含量2.7%,进行水化,水化时间40min,水化温度35℃,得到浅黄色乳浊液。水化结束后将浅黄色乳浊液旋转蒸发除去乙醇,水浴温度45℃,旋转转速100r/min,真空度维持在0.01MPa,直到蒸发出的乙醇体积达到原料液中添加的乙醇含量时停止减压蒸发。最后对乳浊液进行超声整粒,超声功率为200W,超声时间为20min,得到空白脂质体悬液,其质量浓度为8.7%。
步骤(3),制备人脐带间充质干细胞无血清培养液脂质体冻干粉
取步骤(2)的空白脂质体悬液置于摇床中,在振荡条件下将步骤(1)的人脐带间充质干细胞无血清培养液加入悬液中,其中,空白脂质体悬液中总固含量和人脐带间充质干细胞培养液中总固含量的质量比为30:1。在35℃水浴和200W超声功率的条件下超声10min,完成包封反应。包封反应结束后使反应物依次经过0.8μm滤膜、0.65μm滤膜、0.45μm滤膜和0.22μm滤膜,进行整粒,收集通过0.22μm滤膜的产物,得到粒径均匀的包封人脐带间充质干细胞无血清培养液的脂质体悬液。该脂质体悬液在-80℃冷冻1h,并在20℃水浴中解冻,如此反复冻融2次。最后将冻融产物放入冷冻干燥机中冷冻,预冻温度为-60℃±2℃,预冻时间8h,冷阱温度为-50~-56℃,真空度≤80mT,冻干时间36h。得到最终的包封人脐带间充质干细胞无血清培养液脂质体冻干粉。
本实施例得到的包封人脐带间充质干细胞无血清培养液脂质体冻干粉,其中,人脐带间充质干细胞无血清培养液活性蛋白成分2.5%,磷脂55.2%,胆固醇7.9%,吐温-80 1.8%,脂溶性抗氧化剂10.5%,冻干保护剂21.0%,水1.1%。
本实施例制备的人脐带间充质干细胞无血清培养液脂质体冻干粉可以在室温下保存3年。
实施例3
制备一种人脐带间充质干细胞无血清培养液脂质体冻干粉,其方法如下:
步骤(1),制备人脐带间充质干细胞无血清培养液
人脐带间充质干细胞提取:无菌条件下,取新生儿脐带5~10cm,置脐带保存液,4℃储存(时间不超过8小时)。用D-Hanks液冲洗直至静脉内无血迹。去除表皮、两条动脉血管及一条静脉血管,将组织剪碎至大约1mm3/块,加入含10%FBS的F12培养基(含双抗)培养大约一个星期,培养条件为37℃、饱和湿度、5%CO2,即可得到原代人脐带间充质干细胞。
收集无血清培养液:细胞融合度85%时,胰蛋白酶消化细胞传代培养,取15代的细胞继续培养。当细胞融合度85%时,弃含10%FBS的培养上清,PBS(pH=7.0)洗涤细胞三次,加入无血清的F12培养基继续培养56小时,收集无血清培养液。
步骤(2),乙醇注入法制备空白脂质体悬液
称取以下原料组分,氢化大豆磷脂2.5g,胆固醇0.5g,吐温-80 3.0g,丁基羟基茴香醚0.5g,将其溶于16.5mL无水乙醇,得到原料溶液。磷脂、胆固醇、吐温-80和脂溶性抗氧化剂的总质量与无水乙醇的质量比为1:2。再将2.5g冻干保护剂右旋糖苷和2.5g山梨醇加入pH值为6.8的100mL磷酸盐缓冲液中充分混合。然后将原料溶液转移到洁净的注射器中,通过注射器滴加到含有冻干保护剂的磷酸盐缓冲液中,原料溶液与冻干保护剂的质量关系比为3.9:1,冻干保护剂的磷酸盐缓冲液中冻干保护剂的含量5%,进行水化,水化时间40min,水化温度35℃,得到浅黄色乳浊液。水化结束后将浅黄色乳浊液旋转蒸发除去乙醇,水浴温度45℃,旋转转速100r/min,真空度维持在0.01MPa,直到蒸发出的乙醇体积达到原料液中添加的乙醇含量时停止减压蒸发。最后对乳浊液进行超声整粒,超声功率为250W,超声时间为30min,得到空白脂质体悬液,其质量浓度为6.1%。
步骤(3),制备人脐带间充质干细胞无血清培养液脂质体冻干粉
取步骤(2)的空白脂质体悬液置于摇床中,在振荡条件下将步骤(1)的人脐带间充质干细胞无血清培养液加入悬液中,其中,空白脂质体悬液中总固含量和人脐带间充质干细胞培养液中总固含量的质量比为30:1。在35℃水浴和250W超声功率的条件下超声7min,完成包封反应。包封反应结束后使反应物依次经过0.8μm滤膜、0.65μm滤膜、0.45μm滤膜和0.22μm滤膜,进行整粒,收集通过0.22μm滤膜的产物,得到粒径均匀的包封人脐带间充质干细胞无血清培养液的脂质体悬液。该脂质体悬液在-80℃冷冻1h,并在20℃水浴中解冻,如此反复冻融10次。最后将冻融产物放入冷冻干燥机中冷冻,预冻温度为-60℃±2℃,预冻时间10h,冷阱温度为-50~-56℃,真空度≤80mT,冻干时间32h。得到最终的包封人脐带间充质干细胞无血清培养液脂质体。
本实施例得到的包封人脐带间充质干细胞无血清培养液脂质体冻干粉,其中,人脐带间充质干细胞无血清培养液活性蛋白成分1.8%,磷脂20.7%,胆固醇4.1%,吐温-80 24.8%,脂溶性抗氧化剂4.1%,冻干保护剂41.4%,水3.3%。
本实施例制备的人脐带间充质干细胞无血清培养液脂质体冻干粉可以在室温下保存3年。
对本发明的脂质体冻干粉的各项性能进行检测。
(一)MTT法考察人脐带间充质干细胞无血清培养液脂质体对细胞的增值能力。
采用小鼠成纤维细胞L929为靶细胞,对比对照组——人脐带间充质干细胞无血清培养液(HUC),样品组——人脐带间充质干细胞无血清培养液脂质体(HUC-LP)在培养7天中,对L929细胞增殖活力的影响,细胞活力是指总细胞群中活细胞所占的百分比,活细胞越多,光密度值(OD)就越高。通过酶标仪测定活细胞的数量,OD值越高表示活细胞数量越多。
将L929小鼠成纤维细胞接种于96孔板中,1×104个/孔,于37℃、5%CO2孵箱中培养24h,加入无菌过滤后的10mg/L HUC和HUC-LP 20μL,将孔板置于37℃、5%CO2孵箱中培养24h后取出,每孔中加入5mg/mL MTT溶液20μL孵育4h后,将孔板中液体倒出,每孔加入二甲基亚砜200μL,于37℃避光振摇15min,用酶标仪在490nm测定各孔的光密度值(OD),每组设3个复孔。参照图1和图2,试验结果显示,HUC-LP相对于HUC可以有效的促进细胞的增殖。说明人脐带间充质干细胞无血清培养液脂质体有延缓细胞凋亡的作用。
(二)人脐带间充质干细胞无血清培养液脂质体用于化妆品中的抗衰修复功效评价。
将本发明的人脐带间充质干细胞无血清培养液脂质体(HUC-LP)添加到护肤霜中,对照组采用不添加HUC-LP的护肤霜,采用两款护肤霜对42位女性进行效果测试。HUC-LP护肤霜的成分见表1。
表1 HUC-LP护肤霜成分表
护肤霜的制备方法为:A相、B相加热至80℃后,B相缓慢加入A相,搅拌15min,加入C相后搅拌10min后均质5min(4000r/min),降温(缓慢,降温速率1℃/min左右,降温时搅拌速率不得超过500r/min)至35℃加入D相搅拌5min,降温至30℃加入E相后降温慢速搅拌5min后出料。
受试对象:42位无皮肤敏感史的年龄在37~55岁的女性志愿者,测试期间志愿者随机一侧半脸使用对照产品——不含HUC-LP的基底护肤霜,另外一侧使用HUC-LP护肤霜,每天早晚各使用一次,连续使用8周,测试期间志愿者不可使用除测试产品及对照产品以外的任何护肤品。在产品使用前,使用4周和8周后,对两侧眼角进行皮肤快速光学成像(FOITS),并对图片进行分析,Rz表示皮肤平均粗糙度,Ra表示皮肤算术平均粗糙度。统计方法采用ANOVA,显著性:“+”表示显著性差异(p≤0.05);“-”表示非显著性差异(p>0.05),结果见图3和表2。
表2 Rz和Ra统计结果
由图3和表2看出,与初数始数值值)比较,产品使用4周后,产品区的Rz和Ra分别降低了6.0%和6.7%,对照区的Rz和Ra分别降低了2.7%和4.2%,产品使用8周后,产品区的Rz和Ra分别降低了10.9%和16.9%,对照区的Rz和Ra分别降低了4.9%和9.0%,与初始值比较,在产品使用4周及8周后,与初始值相比,产品区域Rz(皮肤平均粗糙度)和Ra(皮肤算术平均粗糙度)均有显著性差异,对照区域Rz(皮肤平均粗糙度)和Ra(皮肤算术平均粗糙度)均无显著性差异,说明含有HUC-LP的护肤霜具有显著改善皮肤粗糙度和纹理的效果,即具有延缓衰老的功效。
在本次功效测试中,42位受试者无一有免疫排斥反应或不适感。
本发明以上描述只是部分实施例,但是本发明并不局限于上述的具体实施方式。上述的具体实施方式是示意性的,并不是限制性的。凡是采用本发明的材料和方法,在不脱离本发明宗旨和权利要求所保护的范围情况下,所有具体拓展均属本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!