一种Sema4D‑VEGF涂层的构建方法及应用与流程
本发明涉及生物医用材料表面改性领域,具体涉及一种sema4d-vegf涂层的构建方法及应用。
背景技术:
心血管系统疾病是危害人类健康的重要疾病之一,人工植入血管支架或心脏瓣膜是治疗心血管疾病的有效方法;目前全世界每年大约超过200万冠心病病人需要进行经皮穿刺冠状动脉成形术,其中70%需要植入血管支架;我国2006年接受血管支架植入治疗的患者也逾10万次;我国心脏瓣膜病约占心脏病患者30%,每年也有十万以上危重病人必须施行人工心脏瓣膜置换术。
肝素(heparin)在临床上常被用作抗凝剂,主要用于治疗血栓症、血栓静脉炎及血栓栓塞症;肝素结构中含有大量的硫酸根基团,是目前发现的负电性最强的生物分子;sema4d是细胞膜表面锚定蛋白,广泛存在如血小板、t细胞等表面,其胞外蛋白水解产物sema4d具有促进内皮细胞迁移以及免疫调节的作用;sema4d的受体有plexinb1和cd72,前者主要存在于内皮细胞表面,而后者主要存在于免疫细胞中,sema4d功能主要通过作用相应受体而实现;大量研究表明,肝素与各种生长因子的结合能够对生长因子起到保护作用,延缓生长因子的半衰期,并促进生长因子和其受体间的识别和结合;目前还没有发现利用细胞膜表面锚定蛋白sema4d和血管内皮因子vegf协同作用构建微环境的技术。
技术实现要素:
本发明提供一种装载vegf功能因子并能够与sema4d协同作用的涂层,可促进内皮细胞迁移和增值,加速内皮化进程。
本发明采用的技术方案是:一种sema4d-vegf涂层的构建方法,包括以下步骤:
a、基底材料表面抛光清洗后用1-4mg/ml的盐酸多巴胺溶液,室温条件下浸泡反应12-24小时后,清洗;浸泡清洗过程重复2-5遍形成醌基活性层;
b、步骤a中的醌基活性层用2.5mg/ml的多赖氨酸(pll)4℃条件下浸泡处理12h,清洗;
c、将50-400ng/ml的sema4d与浓度为5-10mg/ml的heparin等体积混合,37℃条件下反应2-4h形成sema4d纳米复合物,将步骤b中处理后的样品浸没于sema4d纳米复合物中4℃条件下反应12-24h,清洗;
d、将步骤c中得到的样品浸于200-400ng/ml的vegf溶液中,在4℃条件下反应24-48h,清洗后既得目标产物。
进一步的,所述步骤a中的基底材料为钛或钛合金。
进一步的,所述步骤a中基底材料清洗采用纯净水超声清洗3min。
进一步的,所述步骤a、b、c、d中样品的清洗采用磷酸盐缓冲液进行。
进一步的,所述步骤b中多赖氨酸分子量为150-300kda。
一种sema4d-vegf涂层的应用,诱导受损组织修复和内皮化。
本发明的有益效果是:
(1)本发明将功能因子sema4d和vegf通过肝素间接固定于材料表面,肝素和sema4d的结合形成纳米复合物能够延缓sema4d的半衰期,并对sema4d起到保护作用,避免被蛋白酶降解,同时肝素能够促进sema4d、vegf与其相应受体间的识别与结合,保证sema4d和vegf功能的发挥;
(2)本发明sema4d和vegf双因子协同作用加速机体血管创伤修复;
(3)本发明工艺简单易于操作、无需昂贵复杂的设备,适用于各种复杂的心血管植入器械如血管支架等具有抗凝、快速内皮化要求的表面。
附图说明
图1为本发明流程示意图。
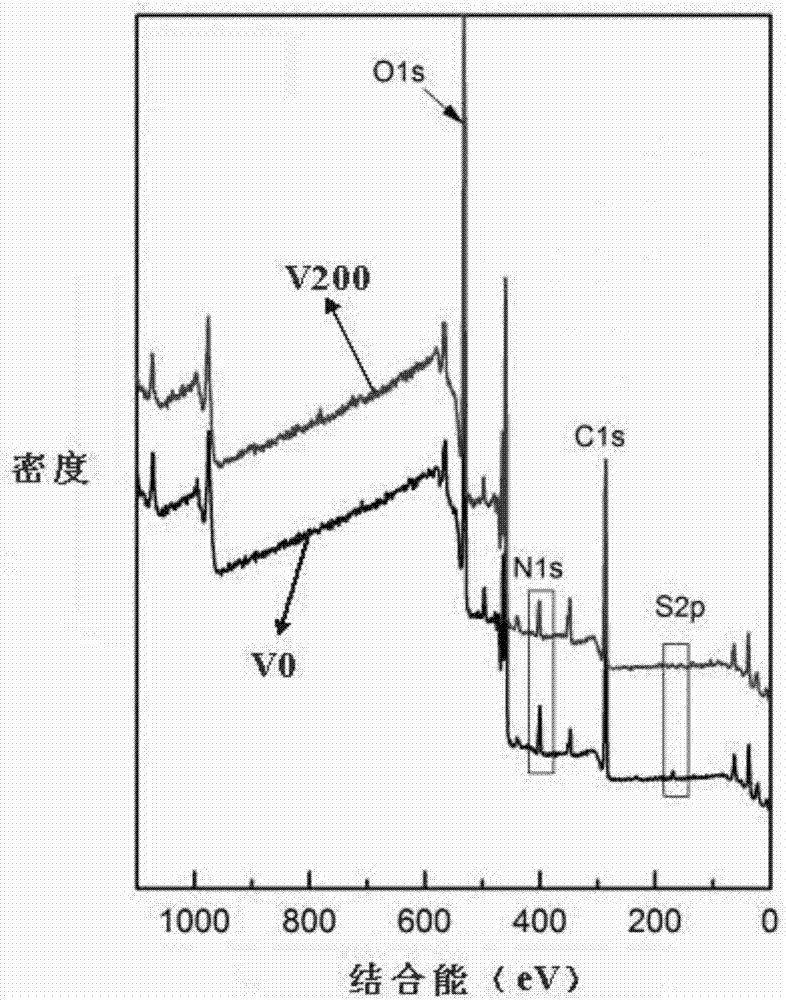
图2为本发明中实施例1和实施例2中制备样品的xps图谱。
图3为本发明中涂层修饰后12小时内皮细胞在材料表面迁移效果图。
图4为本发明中涂层修饰后内皮细胞培养1、3天的细胞数量图。
图5为本发明中涂层修饰后sd大鼠腹主动脉体内植入后的血管切片结果。
图6为本发明中涂层修饰后sd大鼠腹主动脉体内植入后的血管内皮细胞cd31和平滑肌α-sma的表达。
具体实施方式
下面结合附图和具体实施例对本发明做进一步说明。
实施例一
a、基底材料表面抛光清洗后用1-4mg/ml的盐酸多巴胺溶液,ph为8.5,室温条件下浸泡反应12-24小时后,清洗;浸泡清洗过程重复2-5遍形成醌基活性层;其中基底材料选用纯钛,用纯净水超声清洗3min;浸泡清洗后形成一层醌基活性层,浸泡清洗过程重复2-5遍,制备多层醌基活性层,保证材料表面足够多的活性醌基,利于后续氨基层的固定;
b、步骤a中的醌基活性层用2.5mg/ml的多赖氨酸4℃条件下浸泡处理12h,清洗;其中多赖氨酸的分子量为150-300kda,清洗过程采用磷酸盐缓冲液清洗;
c、将50-400ng/ml的sema4d与浓度为5-10mg/ml的heparin等体积混合,37℃条件下反应2-4h形成sema4d纳米复合物,将步骤b中处理后的样品浸没于sema4d纳米复合物中4℃条件下反应12-24h,清洗;其中清洗过程采用磷酸盐缓冲液进行;
d、将步骤c中得到的样品浸于200ng/ml的vegf溶液中,采用磷酸缓冲液pbs作为溶剂,ph为7.4;在4℃条件下反应24-48h,清洗后既得表面装载sema4d功能因子的材料;附图中用该方法制得的样品用v200表示。
对比例
a、基底材料表面抛光清洗后用1-4mg/ml的盐酸多巴胺溶液,ph为8.5,室温条件下浸泡反应12-24小时后,清洗;浸泡清洗过程重复2-5遍形成醌基活性层;其中基底材料选用纯钛,用纯净水超声清洗3min;浸泡清洗后形成一层醌基活性层,浸泡清洗过程重复2-5遍,制备多层醌基活性层,保证材料表面足够多的活性醌基,利于后续氨基层的固定;
b、步骤a中的醌基活性层用2.5mg/ml的多赖氨酸4℃条件下浸泡处理12h,清洗;其中多赖氨酸的分子量为150-300kda,清洗过程采用磷酸盐缓冲液清洗;
c、将50-400ng/ml的sema4d与浓度为5-10mg/ml的heparin等体积混合,37℃条件下反应2-4h形成sema4d纳米复合物,将步骤b中处理后的样品浸没于sema4d纳米复合物中4℃条件下反应12-24h,清洗;其中清洗过程采用磷酸盐缓冲液进行;
d、将步骤c中得到的样品浸于0ng/ml的vegf溶液中,采用磷酸缓冲液pbs作为溶剂,ph为7.4;在4℃条件下反应24-48h,清洗后既得表面装载sema4d功能因子的材料;附图中用该方法制得的样品用v0表示。
表1.sema4d-vegf涂层修饰后表面元素含量
实施例二
a、基底材料表面抛光清洗后用1-4mg/ml的盐酸多巴胺溶液,ph为7.4;室温条件下浸泡反应12-24小时后,清洗;浸泡清洗过程重复2-5遍形成醌基活性层;其中基底材料选用纯钛,用纯净水超声清洗3min;浸泡清洗后形成一层醌基活性层,浸泡清洗过程重复2-5遍,制备多层醌基活性层,保证材料表面足够多的活性醌基,利于后续氨基层的固定;
b、步骤a中的醌基活性层用2.5mg/ml的多赖氨酸4℃条件下浸泡处理12h,清洗;其中多赖氨酸的分子量为150-300kda,清洗过程采用磷酸盐缓冲液清洗;
c、将50-400ng/ml的sema4d与浓度为5-10mg/ml的heparin等体积混合,37℃条件下反应2-4h形成sema4d纳米复合物,将步骤b中处理后的样品浸没于sema4d纳米复合物中4℃条件下反应12-24h,清洗;其中清洗过程采用磷酸盐缓冲液进行;
d、将步骤c中得到的样品浸于300ng/ml的vegf溶液中,采用磷酸缓冲液pbs作为溶剂,ph为7.4;在4℃条件下反应24-48h,清洗后既得表面装载sema4d和vegf功能因子的材料;附图中用该方法制得的样品用v200表示。
表1.sema4d-vegf涂层修饰后表面元素含量
实施例三
a、基底材料表面抛光清洗后用1-4mg/ml的盐酸多巴胺溶液,ph为8.5,室温条件下浸泡反应12-24小时后,清洗;浸泡清洗过程重复2-5遍形成醌基活性层;其中基底材料选用纯钛,用纯净水超声清洗3min;浸泡清洗后形成一层醌基活性层,浸泡清洗过程重复2-5遍,制备多层醌基活性层,保证材料表面足够多的活性醌基,利于后续氨基层的固定;
b、步骤a中的醌基活性层用2.5mg/ml的多赖氨酸4℃条件下浸泡处理12h,清洗;其中多赖氨酸的分子量为150-300kda,清洗过程采用磷酸盐缓冲液清洗;
c、将50-400ng/ml的sema4d与浓度为5-10mg/ml的heparin等体积混合,37℃条件下反应2-4h形成sema4d纳米复合物,将步骤b中处理后的样品浸没于sema4d纳米复合物中4℃条件下反应12-24h,清洗;其中清洗过程采用磷酸盐缓冲液进行;
d、将步骤c中得到的样品浸于400ng/ml的vegf溶液中,采用磷酸缓冲液pbs作为溶剂,ph为7.4;在4℃条件下反应24-48h,清洗后既得表面装载sema4d和vegf功能因子的材料;附图中用该方法制得的样品用v400表示。
图2-6中,v0表示,实施例1中制备的样品,v200表示实施例2中制备的样品,v400为实施例3中制备的样品,ti表示基底材料未处理,作为对比样品;从图2可以看出构建了vegf活性层的样品表面硫元素的特征吸收峰消失,说明采用本制备方法vegf成功构建了活性层表面;从图3中可以看出构建了vegf活性层的样品较纯ti表面和未构建vegf活性层的样品具有更强的促迁移能力;从图4中可以看出构建了vegf活性层的样品较纯ti表面和未构建vegf活性层的样品具有更好的促进内皮细胞增殖的能力;从图5中可以看出中可以看出构建了vegf活性层的样品较纯ti表面和未构建vegf活性层的样品具有更完整的内皮层,内皮化功能更优异;从图6中可以看出中可以看出构建了vegf活性层的样品较纯ti表面和未构建vegf活性层的样品具有更高的内皮;从图中cd31和适度平滑肌(sma)表达说明sema4d-vegf活性层具有较好的快速内皮化的功能;从表1中可以看出构建了vegf的活性层较未构建vegf的活性层硫元素减少,硫元素是肝素特有的元素,其他生物分子中几乎不存在硫元素,证明表面的肝素参与了对vegf的固定,本发明sema4d-vegf活性层构建成功。
本发明的反应过程与机理主要分为三部分。第一部分多巴胺氧化和自聚合反应后在材料表面形成醌基层,醌基可与pll氨基间发生西夫碱反应,将pll共价固定于材料表面,使材料表面形成富氨基层;第二部分为sema4d纳米复合物的制备,heparin和sema4d为两种pi不同的分子,在中性ph7.4条件下,两者携带不同电荷,利用静电结合的方式形成特定的蛋白-糖纳米复合物;第三部分为sema4d纳米复合物表面肝素的强负电性与pll的强正电性间能够发生离子反应,可将sema4d纳米复合物固定于材料表面,同时肝素还能再与功能因子vegf结合,将vegf装载在材料表面。
本发明创造性地将双功能因子sema4d与vegf通过肝素间接固定于材料表面,肝素和sema4d的结合形成纳米复合物能够延缓sema4d的半衰期,并对sema4d起到保护作用,避免被蛋白酶降解,同时肝素能够促进sema4d、vegf与其相应受体间的识别与结合,保证sema4d和vegf功能的发挥;sema4d-vegf双因子协同作用可加速机体血管创伤修复;首先,肝素作为抗凝剂能够抑制体内血栓形成,抑制血小板和纤维蛋白在材料表面的粘附;其次,sema4d和vegf均为机体损伤后血小板激活过程中加速释放的促进机体修复的因子,sema4d能够促进t细胞和抗原递呈细胞的相互作用,激活t细胞启动(tcellpriming),促进b细胞增殖和抗体产生,产生正向免疫调控作用,同时通过受体plexin-b1促进内皮细胞迁移的功能,vegf可促进内皮细胞增值,同时协同促进sema4d功能的发挥,促进内皮化,加速血管组织修复;本发明简单易于操作,无需昂贵复杂的设备,浸没固定生物分子的方法保证样品表面生物分子均匀覆盖,适用于各种复杂的心血管植入器械如血管支架等具有抗凝、快速内皮化要求的表面。
- 还没有人留言评论。精彩留言会获得点赞!