一种兔的视网膜色素变性模型的制备方法与流程
本发明涉及生物技术和医药领域,特别是涉及一种兔的视网膜色素变性模型的制备方法。
背景技术:
视网膜色素变性是当前主要致盲性疾病之一。视网膜色素变性是一种进行性退行视网膜变性类疾病,它主要累及光感受器和色素上皮功能,是一种遗传性眼病。目前视网膜色素变性仍无明确有效的治疗药物和治疗方法,开发稳定可重复的理想的动物模型是解决相关研究和药物临床前药物评价的关键。
兔眼球大,背景数据清晰、丰富,是适合眼科研究及临床前药物评价。碘酸钠进入眼循环后可破坏视网膜色素上皮。目前已有利用兔通过静脉注射碘酸钠诱导建立视网膜色素变性疾病模型,静脉注射碘酸钠方法虽然操作更简单,但由于碘酸钠随静脉血液回流,再通过心脏进入机体各组织,进入眼组织的碘酸钠只是很少一部分,为到达视网膜色素变性的要求,必须给予较高剂量的碘酸钠,在该条件下可见明显的全身毒性,特别是肝脏、肾脏以及消化道,极易引起动物某种或多种脏器障碍或衰竭,最终导致动物死亡。静脉注射碘酸钠的方法,其引起视网膜色素变性的剂量与动物致死剂量相近,加上动物个体间体质差异,导致成模率低,重复性差,动物易死亡。1996年陈勤等,在“表皮生长因子治疗碘酸钠诱导视网膜色素上皮层扫描电镜观察”(眼科研究,第4期)文章中报道了通过耳缘静脉给新西兰兔注入10 mg/ml碘酸钠(剂量30 mg/kg)诱导视网膜色素变性,但该方法剂量偏低,故需要重复注射,而且重复注射间隔时间对结果影响较大。
技术实现要素:
本发明主要解决的技术问题是提供一种兔的视网膜色素变性模型的制备方法,能用于视网膜色素变性的研究和治疗药物开发及临床前评价。
为解决上述技术问题,本发明采用的一个技术方案是:提供一种兔的视网膜色素变性模型的制备方法,包括步骤为:将碘酸钠溶液以颈内动脉注入的方式实施于兔,所述碘酸钠溶液到达兔的眼内。
在本发明一个较佳实施例中,所述碘酸钠溶液是浓度为10 mg/ml的剂量为15 mg/kg的碘酸钠溶液;所述碘酸钠溶液由生理盐水配制。
在本发明一个较佳实施例中,所述兔的视网膜色素变性模型的制备方法的具体步骤为:将兔的颈动脉暴露,阻断兔的颈总动脉和颈外动脉,将所述碘酸钠溶液注入颈内动脉,注射结束后解除兔的颈外动脉阻断,再解除兔的颈总动脉阻断。
在本发明一个较佳实施例中,所述碘酸钠溶液经颈总动脉注入兔的颈内动脉,推注时间为25-35秒。
在本发明一个较佳实施例中,解除兔的颈外动脉阻断后,45~90秒后再解除兔的颈总动脉阻断。
在本发明一个较佳实施例中,注射结束后用止血海绵压迫注射点5~10分钟止血。
本发明的有益效果是:本发明使用的碘酸钠剂量小,对动物全身毒性小,不影响动物生命安全,操作简单可行,可重复性好,个体间模型差异小,成功率高。能为视网膜色素变性的研究提供一种可靠的模型,同时为治疗视网膜色素变性药物研发和临床前评价提供了动物模型。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图,其中:
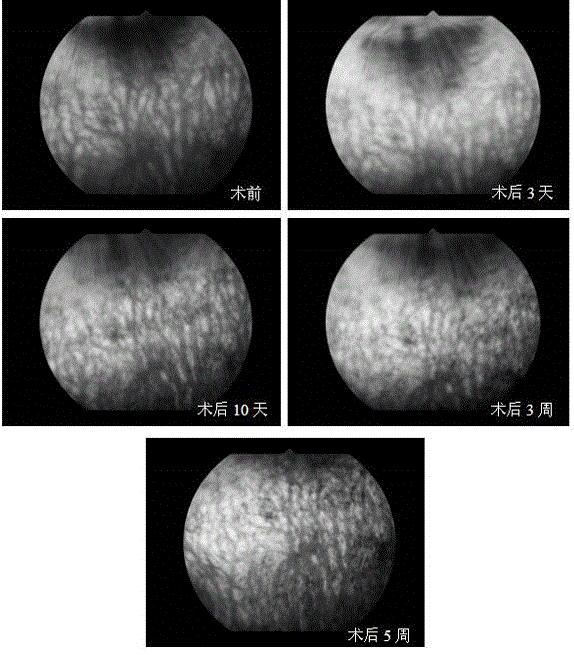
图1 是本发明兔的术前、术后3天、10天、3周、5周光相干断层扫描(OCT)图;
图2 是本发明兔的术前、术后3天、10天、3周、5周视网膜电流图(ERG)暗适应0.01结果图;
图3 是本发明兔的术前、术后3天、10天、3周、5周视网膜电流图(ERG)暗适应3.0结果图;
图4 是本发明兔的术前、术后3天、10天、3周、5周视网膜电流图(ERG)暗适应10.0结果图;
图5 是本发明兔的术前、术后3天、10天、3周、5周眼底照相图;
图6 是本发明兔的术前、术后3天、10天、3周、5周眼底荧光造影图;
图7 是本发明兔的视网膜组织病理学HE染色图(200×);
图8是本发明兔的肾脏组织病理学HE染色图(100×)。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
提供一种兔的视网膜色素变性模型的制备方法,具体见下:
一、实验主要试剂:
荧光素钠注射液(广州白云山明兴制药有限公司)、碘酸钠(Sigma公司,美国)。
二、主要仪器
光相干断层扫描仪(海德堡公司,德国)、眼底数码照相机(重庆康华瑞明)、眼电生理仪(Diagnosys,美国)。
三、实验动物
兔购于青岛康大生物科技有限公司;8只,14周龄,体重2.5~3 kg。
(1)动物饲养与管理
动物饲养与管理按照昭衍(苏州)新药研究中心有限公司的SOP执行,同时遵循实验动物饲养和使用指南第8版(Institute of Laboratory Animal Resources, Commission on Life Sciences, National Research Council; National Academy Press, Washington, D.C., 2010)和动物福利管理条例(Public Law 99-198)。昭衍(苏州)新药研究中心有限公司动物伦理委员会(IACUC)批准已经通过国际AAALAC组织的认证。实验动物的使用获得了江苏省科技厅的批准,实验动物使用许可证号:SYXK (苏) 2011-0029。
动物饲养于具有环境控制的普通级动物房,聚丙烯塑料笼具(规格为长×宽×高=530 mm×630mm×320 mm),单笼饲养,通风良好,除了需要禁食的情况外,动物自由摄食和饮水。动物房室温控制在18-26℃,相对湿度控制在40-70%,光照12 小时明暗交替。
(2)动物福利
本动物实验过程遵循公众认可的实验方法,实验过程中给予麻醉剂避免或减少动物疼痛、紧张和不舒服。实验涉及的所有动物处理相关内容已由昭衍(苏州)新药研究中心有限公司动物伦理委员会(IACUC)批准。
四、试验方法
对颈内动脉给予碘酸钠诱导青紫蓝兔视网膜色素变性,具体步骤为:
8只青紫蓝兔分为2组,4只右侧颈动脉注射15 mg/kg碘酸钠(10 mg/ml),4只做正常对照。
将兔仰面固定于手术台上,尽量暴露颈部,进行常规的皮肤消毒。用动脉夹夹住兔的颈总动脉和颈外动脉进行阻断。将浓度为10 mg/ml的剂量为15 mg/kg的碘酸钠溶液经颈总动脉注入兔的颈内动脉,所述碘酸钠溶液由生理盐水配制。注射时经颈总动脉穿刺推注,推注时间持续约30秒。推注结束后解除兔的颈外动脉阻断,继续保持颈总动脉阻断,45~90秒后解除阻断。注射结束使用止血海绵压迫注射点5~10分钟止血。颈动脉注射后3天、10天、3周、5周进行视网膜电图检测、光相干断层扫描(OCT)、眼底照相、眼底荧光造影检查,5周进行眼球、心脏、肝脏、肾脏病理。
五、试验结果
(1)动物死亡情况:试验期间未见动物死亡。
(2)光相干断层扫描(OCT):结果见图1。
光相干断层扫描(OCT)结果显示,注射碘酸钠3天后视网膜色素上皮层和视网膜感受器开始受到破坏,并逐渐加重。
(3)视网膜电流图(ERG):结果见图2、图3和图4。
视网膜电流图(ERG)结果显示,注射碘酸钠3天后视网膜电流图暗适应0.01、暗适应3.0和暗适应10.0 a波及b波振幅均明显下降,注射碘酸钠10天时视网膜电流图呈熄灭性,3周~5周暗适应3.0和暗适应10.0 b波有轻度恢复。
(4)眼底照相及眼底荧光造影:结果见图5和图6。
眼底照相和眼底荧光造影结果显示,注射碘酸钠10天后可见明显的视网膜色素上皮层色素紊乱,色素沉积。
(5)组织病理学结果:结果见图7和图8。
眼球HE染色结果显示,视网膜色素上皮紊乱、丢失,感受器细胞出现空泡样,同时内核层和外核层细胞也受到破坏。
肝脏和心脏未见明显毒性反应,个别动物肾脏可见肾脏毒性,显微镜下的症状主要表现为间质炎细胞浸润、肾小管/集合管扩张、嗜碱性肾小管、间质纤维化、髓质灶状坏死,但发生率低。
六、结论
以上结果表明,将碘酸钠按15 mg/kg的剂量注入兔颈内动脉,到达眼内,破坏视网膜色素上皮,造成兔视网膜色素上皮损伤,可建立稳定的兔视网膜色素变性模型。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书内容所作的等效结构或等效流程变换,或直接或间接运用在其它相关的技术领域,均同理包括在本发明的专利保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!