一种纳米载药系统(DOX‑RGD‑BSA@AuNCs)药物传递和生物成像的制作方法
本发明涉及生物制药技术领域,更具体的说是涉及一种纳米载药系统(dox-rgd-bsa@auncs)药物传递和生物成像。
背景技术:
肿瘤,尤其是恶性肿瘤—癌症是人类死亡的主要原因。为了提高肿瘤的诊断和治疗效果,靶向肿瘤生物成像和药物传递成为了重要的医疗手段。
近年来随着纳米技术的发展和广泛应用,纳米载药系统成为当前国际药学界的研究前沿和研究热点。金纳米簇(auncs)的粒径大部分都小于2nm,因为纳米簇的尺寸大小接近电子费米波长,使得状态的连续能量强度分解成了离散的能级,导致了它独特的光学和电化学特性。这种超小粒径还赋予了它更多不同于传统纳米粒子和有机荧光染料的特性。金属纳米簇作为一种具有超小粒径、低毒性、独特光学和理化性质的纳米材料,是理想的靶向肿瘤成像荧光纳米材料。可通过透射电镜(tem)以及微粒粒度及表面电位分析仪分别对纳米载药系统进行了形貌、粒径与表面电位的表征。
谷胱甘肽是谷氨酸、半胱氨酸和甘氨酸组成的三肽,在人体中具有解毒和抗氧化的功能。在肿瘤部位,过多的氧化型谷胱甘肽(gssg)被谷胱甘肽还原酶转换成具有还原型的谷胱甘肽(gsh),因此肿瘤细胞中的还原性的谷胱甘肽的浓度远远高于正常组织细胞还原型谷胱甘肽的浓度,研究表明:肿瘤细胞内的gsh含量约为2~10mm,是正常细胞内gsh含量的7倍,是细胞外gsh含量的100-1000倍。其中半胱氨酸上的巯基能够与某些药物、毒素等结合,因此谷胱甘肽能够在生物转化中把有机体内的有害物质排出体外。
为了能够更有效地实现金纳米簇的在体肿瘤诊断或治疗,选择一种合适的生物配体使得金纳米簇能选择性的传递至肿瘤细胞是很有必要的。肿瘤细胞或肿瘤细胞新生血管会特异性的高度表达出某些整合素受体,如整合素αvβ3,在正常细胞或组织的血管中含量就很少。rgd是由精氨酸、甘氨酸和天冬氨酸组成的三肽(arg-gly-asp),能够特异性识别整合素αvβ3,有助于药物与细胞靶向结合并进入细胞,抑制肿瘤细胞或肿瘤血管的生成。
目前大部分纳米载药系统的专利仅单方面涉及药物传递或者肿瘤成像。例如中国发明专利“一种阿霉素共载药系统、其制备方法及应用”公开了一种表面具有靶向配体的阿霉素载药系统的制备方法;中国发明专利“一种rgd标记的荧光金纳米簇的制备方法”公开了一种以rgd做靶向配体的荧光纳米探针方法。而本发明制备的工艺还未见报道,尤其是一种具有靶向特异性的阿霉素金纳米簇载药系统。
因此,如何研制出一种既能高效靶向杀死肿瘤又对治疗进行实时监控的载药系统是本领域技术人员亟需解决的问题。
技术实现要素:
有鉴于此,本发明提供了一种纳米载药系统(dox-rgd-bsa@auncs)药物传递和生物成像,不仅可以传递阿霉素化疗药物并将它们释放在肿瘤区,使健康组织免于毒副作用,而且应用金纳米簇载体的荧光特性,可以帮助医生通过显微镜扫描看到肿瘤,能够对治疗进行实时监控。
为了突破纳米载药系统仅单方面涉及药物传递或者生物成像的局限性,本发明提供如下技术方案:
一种纳米载药系统(dox-rgd-bsa@auncs)的药物传递,其特征在于,包括如下步骤:
步骤1,金纳米簇(auncs@bsa)的制备方法:
步骤1.1,量取质量分数为1%的氯金酸溶液1.7ml,加入3.3ml去离子水,得到5ml、10mm氯金酸溶液;
步骤1.2,称取250mlbsa,溶解在5ml去离子水中,得到5ml、50mg/mlbsa溶液;
步骤1.3,称取20mgnaoh,溶解在0.5ml去离子水中,得到1mnaoh溶液;
步骤1.4,将配制好的5ml(10mm)的氯金酸溶液加入到5ml(50mg/ml)的bsa溶液,控温37℃,剧烈搅拌5min;
步骤1.5,将1mnaoh水溶液加入到上述混合溶液中,并且持续剧烈搅拌上述反应物,控温37℃,持续时间12~24h;
步骤1.6,将得到的产物冷却至室温,装进mwco100000透析袋中,透析外液用水,维持外界温度4℃,透析12~24h,并用葡萄糖凝胶过柱,以除去多余的bsa,从而得到金纳米簇;
步骤2,rgd-bsa@auncs的制备方法:
步骤2.1,取2ml金纳米簇加入到8mlpbs缓冲溶液(ph=7.4,20mm)中,得到金纳米簇溶液;
步骤2.2,取4ml金纳米簇溶液,在其中加入15~30mg的edc,避光条件室温下反应20min;
步骤2.3,加入15~20mg的nhs,在避光条件下剧烈搅拌1h,得到混合液;
步骤2.4,向上述混合液中加入c(rgd)fk溶液(100ul,10mg/ml),室温下搅拌反应12~24h;
步骤2.5,反应后,将反应溶液装进mwco100000透析袋中,透析外液用水,维持外界温度4℃,透析12~24h,并且反应产物用截留量为10kda的超滤离心管中离心(3000xg,20min),去除过量反应物,得到的产物溶于2mlpbs缓冲溶液中,且放置在4℃的冰箱内部保存,得到rgd-bsa@auncs;
步骤3,dox-rgd-bsa@auncs的制备方法:
步骤3.1,将制得的rgd-bsa-auncs和1.5mg的spdp加入到含有1mmedta的pbs缓冲溶液中,室温下反应4h,得到的反应产物装进mwco100000透析袋中,透析外液用水,维持外界温度4℃,透析12~24h,得到rgd-bsa@auncs;
步骤3.2,将盐酸阿霉素(1.5mg,2.6×10-6mol)和2-亚氨基硫烷盐酸盐(0.36mg,0.36×10-6mol)的混合物加入到含有1mmedta的psb缓冲液中,室温下反应4h,得到dox-sh(巯基dox修饰的盐酸阿霉素);
步骤3.3,过量的dox-sh和rgd-bsa@auncs反应,得到dox-rgd-bsa@auncs溶液;
步骤3.4,将步骤3.3中的dox-rgd-bsa@auncs溶液加入到pbs缓冲溶液中,然后装进mwco100000透析袋中,透析外液用水,维持外界温度4℃,透析12~24h,得到dox-rgd-bsa@auncs;
步骤4,谷胱甘肽(gsh)的检测:
步骤4.1,分别配制2mm、4mm、6mm、8mm、10mm的gsh;
步骤4.2,分别取步骤4.1中的gsh100ul,将其加入到纳米载药系统(dox-rgd-bsa@auncs)中,并加入pbs缓冲溶液使得反应体系的总体积为1ml,维持37℃反应4小时;
步骤4.3,将反应产物置于截留量为10kda的超滤离心管进行离心(3000xg,20min),并且将分离后的上、下溶液进行荧光检测。
优选的,步骤1.5中,反应溶液的ph为12,并且37℃下反应24h。
优选的,步骤2.4中,c(rgd)fk溶液的浓度为10mg/ml,并且室温下搅拌反应24h。
优选的,步骤3.2中,盐酸阿霉素和2-亚氨基硫烷盐酸盐等摩尔反应4小时。
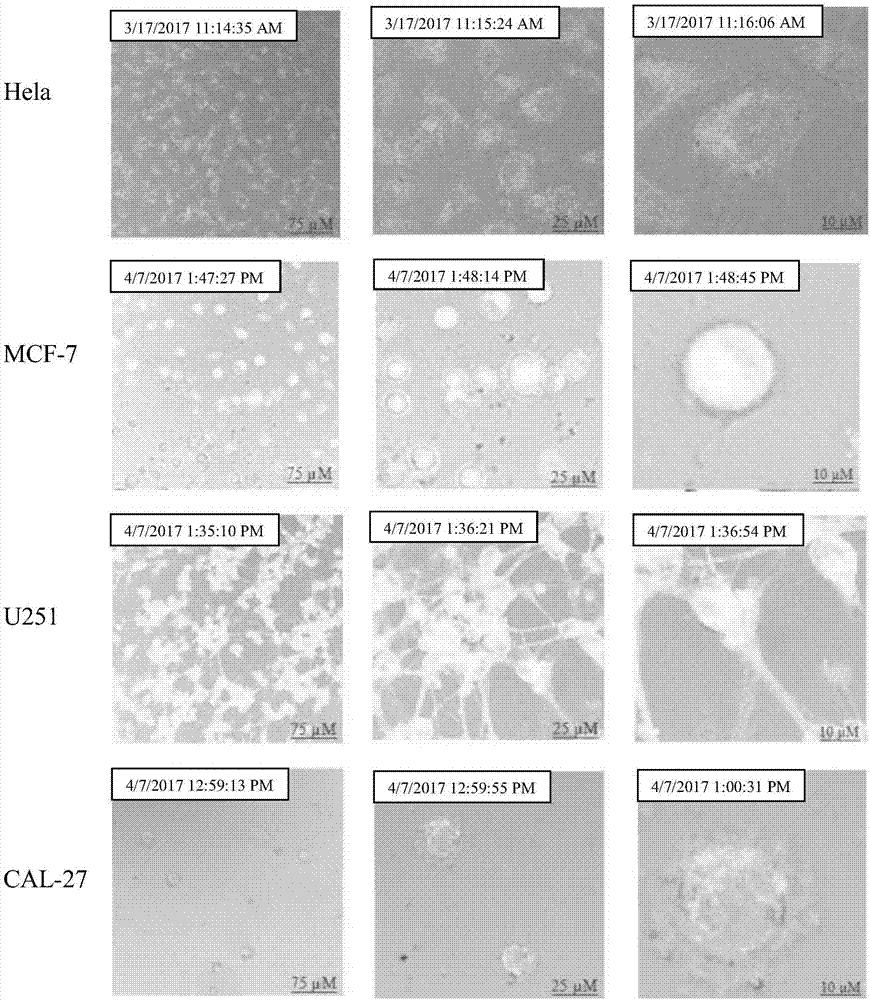
一种纳米载药系统(dox-rgd-bsa@auncs)的生物成像,其特征在于,包括如下步骤:在无菌环境下,将hela、mcf-7、u251、cal-27四种癌细胞细胞分别在培养基中生长,待细胞进入快速生长时期时,取0.5ml的dox-rgd-bsa@auncs溶液加入到细胞培养液中,孵化0、3、6小时在激光共聚焦显微镜观察细胞形态,为了更好的观察细胞成像以及细胞形态的变化,将培养皿在激光共聚焦显微镜下连续观察6小时,每5分钟拍一次照片。
优选的,在上述一种纳米载药系统(dox-rgd-bsa@auncs)的生物成像中,所述四种癌细胞加入dox-rgd-bsa@auncs溶液后,在激光共聚焦下观察细胞形态。
本发明以牛血清蛋白(bsa)为还原剂合成的金纳米簇(bsa@aunc)为载体,利用通过bsa氨基酸中的羧基和rgd的氨基通过酰胺化反应连接在一起,又利用双管能团连接剂spdp将巯基化的dox的巯基与bsa的氨基进行交联,制备出具有靶向特异性的纳米载药系统(dox-rgd-bsa@auncs)。进入细胞后,由于肿瘤细胞中含有大量的谷胱甘肽(gsh),能够将连接阿霉素和纳米簇的双硫键剪切,从而成功地将药物在肿瘤细胞中进行释放。通过透射电镜(tem)以及微粒粒度及表面电位分析仪分别对纳米载药系统进行了形貌、粒径与表面电位的表征。以宫颈癌细胞(hela)、乳腺癌细胞(mcf-7)、口腔癌细胞(cal-27)和胶质瘤细胞(u251)为研究对象,通过激光共聚焦(clsm)及流式细胞仪对纳米载药系统进入细胞以及药物治疗的情况进行检测,并且与正常细胞进行对比。
经由上述的技术方案可知,与现有技术相比,本发明公开提供了一种纳米载药系统(dox-rgd-bsa@auncs)的药物传递和生物成像,一方面能在高效靶向杀死肿瘤的同时对治疗进行实时监控;另一方面合成的以金纳米簇(bsa@aunc)为载体的纳米载药系统(dox-rgd-bsa@auncs)不仅可以针对多种类型的肿瘤细胞发挥作用,能够快速靶向识别癌细胞,而且通过谷胱甘肽(gsh)对连接阿霉素和纳米簇的双硫键的剪切作用将药物释放,能够快速、准确的杀死癌细胞,达到治疗的目的;并且在体内外呈现出良好的抗肿瘤作用,根据荧光成像的荧光分布情况和其荧光强度进行定性和定量分析,实现肿瘤早期诊断治疗以及治疗的实时监控。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
图1附图为本发明的纳米载药系统的过程原理图。
图2附图为本发明的纳米载药系统的紫外吸收图谱及激发、发射光谱。
图3附图为本发明的gsh的荧光检测(a图中从低到高分别为浓度为0、1mm、2mm、4mm、6mm、8mm、10mm的商品化gsh与纳米载药系统室温反应4小时后,经过超滤离心管离心后,取下清液测得的荧光光谱)。
图4附图为本发明的纳米载药系统的细胞成像。
图5附图为本发明的癌细胞(hela、mcf-7、u251、cal-27)的细胞成像。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供了一种纳米载药系统(dox-rgd-bsa@auncs)药物传递和生物成像,能在高效靶向杀死肿瘤的同时对治疗进行实时监控。
实施例1
金纳米簇(auncs@bsa)的制备方法:
步骤1.1,量取质量分数为1%的氯金酸溶液1.7ml,加入3.3ml去离子水,得到5ml、10mm氯金酸溶液;
步骤1.2,称取250mlbsa,溶解在5ml去离子水中,得到5ml、50mg/mlbsa溶液;
步骤1.3,称取20mgnaoh,溶解在0.5ml去离子水中,得到1mnaoh溶液;
步骤1.4,将配制好的5ml(10mm)的氯金酸溶液加入到5ml(50mg/ml)的bsa溶液,控温37℃,剧烈搅拌5min;
步骤1.5,将1mnaoh水溶液加入到上述混合溶液中,并且持续剧烈搅拌上述反应物,控温37℃,持续时间24h;
步骤1.6,将得到的产物冷却至室温,装进mwco100000透析袋中,透析外液用水,维持外界温度4℃,透析12h,并用葡萄糖凝胶过柱,以除去多余的bsa,从而得到金纳米簇。
实施例2
金纳米簇(auncs@bsa)的制备方法:
步骤1.1,量取质量分数为1%的氯金酸溶液1.7ml,加入3.3ml去离子水,得到5ml、10mm氯金酸溶液;
步骤1.2,称取250mlbsa,溶解在5ml去离子水中,得到5ml、50mg/mlbsa溶液;
步骤1.3,称取20mgnaoh,溶解在0.5ml去离子水中,得到1mnaoh溶液;
步骤1.4,将配制好的5ml(10mm)的氯金酸溶液加入到5ml(50mg/ml)的bsa溶液,控温37℃,剧烈搅拌5min;
步骤1.5,将1mnaoh水溶液加入到上述混合溶液中,并且持续剧烈搅拌上述反应物,控温37℃,持续时间24h;
步骤1.6,将得到的产物冷却至室温,装进mwco100000透析袋中,透析外液用水,维持外界温度4℃,透析24h,并用葡萄糖凝胶过柱,以除去多余的bsa,从而得到金纳米簇。
实施例3
rgd-bsa@auncs的制备方法:
步骤2.1,取2ml金纳米簇加入到8mlpbs缓冲溶液(ph=7.4,20mm)中,得到金纳米簇溶液;
步骤2.2,取4ml金纳米簇溶液,在其中加入20mg的edc,避光条件室温下反应20min;
步骤2.3,加入16mg的nhs,在避光条件下剧烈搅拌1h,得到混合液;
步骤2.4,向上述混合液中加入c(rgd)fk溶液(100ul,10mg/ml),室温下搅拌反应24h;
步骤2.5,反应后,将反应溶液装进mwco100000透析袋中,透析外液用水,维持外界温度4℃,透析12h,并且反应产物用截留量为10kda的超滤离心管中离心(3000xg,20min),去除过量反应物,得到的产物溶于2mlpbs缓冲溶液中,且放置在4℃的冰箱内部保存,得到rgd-bsa@auncs。
实施例4
rgd-bsa@auncs的制备方法:
步骤2.1,取2ml金纳米簇加入到8mlpbs缓冲溶液(ph=7.4,20mm)中,得到金纳米簇溶液;
步骤2.2,取4ml金纳米簇溶液,在其中加入15mg的edc,避光条件室温下反应20min;
步骤2.3,加入15mg的nhs,在避光条件下剧烈搅拌1h,得到混合液;
步骤2.4,向上述混合液中加入c(rgd)fk溶液(100ul,10mg/ml),室温下搅拌反应24h;
步骤2.5,反应后,将反应溶液装进mwco100000透析袋中,透析外液用水,维持外界温度4℃,透析24h,并且反应产物用截留量为10kda的超滤离心管中离心(3000xg,20min),去除过量反应物,得到的产物溶于2mlpbs缓冲溶液中,且放置在4℃的冰箱内部保存,得到rgd-bsa@auncs。
实施例5
dox-rgd-bsa@auncs的制备方法:
步骤3.1,将制得的rgd-bsa-auncs和1.5mg的spdp加入到含有1mmedta的pbs缓冲溶液中,室温下反应4h,得到的反应产物装进mwco100000透析袋中,透析外液用水,维持外界温度4℃,透析12h,得到rgd-bsa@auncs;
步骤3.2,将盐酸阿霉素(1.5mg,2.6×10-6mol)和2-亚氨基硫烷盐酸盐(0.36mg,0.36×10-6mol)的混合物加入到含有1mmedta的psb缓冲液中,室温下反应4h,得到dox-sh(巯基dox修饰的盐酸阿霉素);
步骤3.3,过量的dox-sh和rgd-bsa@auncs反应,得到dox-rgd-bsa@auncs溶液;
步骤3.4,将步骤3.3中的dox-rgd-bsa@auncs溶液加入到pbs缓冲溶液中,然后装进mwco100000透析袋中,透析外液用水,维持外界温度4℃,透析12h,得到dox-rgd-bsa@auncs。
实施例6
dox-rgd-bsa@auncs的制备方法:
步骤3.1,将制得的rgd-bsa-auncs和1.5mg的spdp加入到含有1mmedta的pbs缓冲溶液中,室温下反应4h,得到的反应产物装进mwco100000透析袋中,透析外液用水,维持外界温度4℃,透析24h,得到rgd-bsa@auncs;
步骤3.2,将盐酸阿霉素(1.5mg,2.6×10-6mol)和2-亚氨基硫烷盐酸盐(0.36mg,0.36×10-6mol)的混合物加入到含有1mmedta的psb缓冲液中,室温下反应4h,得到dox-sh(巯基dox修饰的盐酸阿霉素);
步骤3.3,过量的dox-sh和rgd-bsa@auncs反应,得到dox-rgd-bsa@auncs溶液;
步骤3.4,将步骤3.3中的dox-rgd-bsa@auncs溶液加入到pbs缓冲溶液中,然后装进mwco100000透析袋中,透析外液用水,维持外界温度4℃,透析24h,得到dox-rgd-bsa@auncs。
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。对于实施例公开的装置而言,由于其与实施例公开的方法相对应,所以描述的比较简单,相关之处参见方法部分说明即可。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!