一种肽修饰的多壁碳纳米管载体及其制备方法和应用与流程
本发明涉及医药技术领域,具体地说,是一种肽修饰的多壁碳纳米管载体及其制备方法和应用。
背景技术:
前列腺癌是严重威胁全球男性健康的常见恶性肿瘤之一。美国癌症协会2016年最新数据表明,前列腺癌在预计新发人数上位居第一,预计死亡人数上排名第二(仅次于肺癌)。目前晚期、复发、转移前列腺癌的治疗面临着很多问题,如何增加机体抗肿瘤的免疫效应已成为相关研究的热点问题。
肿瘤是严重危害人类健康的重大疾病之一,寻找可行且高效的肿瘤治疗方法,彻底攻克肿瘤是医学界的重要研究课题。继外科手术、放疗、化疗之后,肿瘤免疫治疗成为第4类已被证明具有显著临床疗效及优势的抗肿瘤治疗方法。它通过调动或激发机体自身的免疫功能,增强肿瘤周围微环境中各种抗肿瘤能力,从而抑制和杀伤肿瘤细胞。机体免疫功能的改变对肿瘤的生物学行为有直接影响,例如可引起某些肿瘤自发缓解或消退的现象。另外,长期免疫治疗可以阻止患者肿瘤的发病率增高等。抗pd1/pd-l1和抗ctla4抗体已被fda批准应用临床,取得了较好的抗肿瘤效果。与手术切除、放疗及化疗这些传统手段相比,肿瘤免疫治疗的优势主要有:1)利用生物细胞因子增强机体自身的免疫作用,以达到抗肿瘤作用,与放化疗相比,毒副作用明显降低;2)利用分子靶向药物治疗,目标明确,可选择性、特异性地杀伤肿瘤细胞,而不影响正常细胞;3)通过主动免疫激发全身性的抗肿瘤效应,作用范围广泛,尤其适用于多发病灶或有广泛转移的恶性肿瘤;4)对不适合进行手术的中晚期肿瘤患者,可以明显抑制其病情的发展,从而延长患者的生命;5)能够清除手术后不能彻底清除的残留病灶,防止复发和转移,同时能够修复放化疗所导致的相关组织和脏器的损伤,恢复正常免疫功能。
富含未甲基化胞嘧啶-鸟嘌呤二核苷酸的dna(cpgdna)是一种可以刺激多种免疫细胞活化或增殖、具有强烈的免疫激活功能的核酸。早在1984年,tokunaga等人在牛分枝结核杆菌卡介苗(bcg)提取液中发现了一种具有刺激作用的短单链dna,可增强nk细胞的杀伤活。hemmi等人于2000年发表的研究工作表明,toll样受体9(tolllikereceptor9,tlr9)是cpgdna发挥免疫激活性所必需的,可能是cpgdna的细胞内受体。tlr9属于模式识别受体(patternrecognitionreceptor,prr)家族,存在于人类等哺乳动物的b淋巴细胞、树突状细胞(dendriticcells)、单核细胞和自然杀伤细胞(nks)等免疫细胞的内吞小体膜上。受到cpg刺激后,激活细胞内mapk和核因子-κb(nf-κb)等信号通路,促使细胞分泌各种细胞因子,包括白介素6(il-6)、白介素10(il-10)、白介素12(il-12)、i型干扰素(typeiifns)和肿瘤坏死因子α(tnf-α)等。这些细胞因子可引发b细胞分化为分泌抗体的浆细胞、激活自然杀伤细胞(nk)、促进cd8+细胞毒性t淋巴细胞应答等,从而完成一系列先天的或适应性的免疫应答过程。cpgodn发挥药效的关键在于其能够有效地被体内免疫细胞摄取并与受体tlr9发生相互作用。然而,与其他核酸类药物一样,未经修饰的cpgdna同样面临易被核酸酶降解、细胞摄取率低等问题,因此需要剂量重复给药,这极大地限制了其在医学领域的应用。近年来,在递送cpgodn等寡核苷酸药物的应用中,研究者将注意力集中在了非病毒类的纳米材料载体上。
碳纳米管作为一维纳米碳材料,被认为是一种极有吸引力、应用前景广泛的新型药物载体。近年来,碳纳米管也被尝试用于输送药物分子等的载体。通过透射电镜、共聚焦显微镜、荧光显微镜等,人们已经在细胞质和成纤维细胞中观察到碳纳米管。kam等研究了多种人体癌细胞与功能化碳纳米管间相互作用,结果表明:功能化碳纳米管不仅可进入人体非黏性癌细胞还可进入黏性癌细胞株(adherentcelllines,choand3t3)。碳纳米管已有研究显示可作为靶向超声诊断纳米载体,碳纳米管子还可以和肿瘤细胞的微管蛋白结合,有效阻制肿瘤细胞增殖功效。但由于cnt的在水中的溶解性、分散性、和机体的生物相容性都很差,限制了在药物载体方面的使用。通过对碳纳米管和纯化和表面羧基化修饰可增强其分散性和溶解性,减轻对机体的毒性。
细胞穿膜肽(cellpenetratingpeptides,cpps)是一类具有较强的细胞膜穿透能力的小分子短肽,可携带多种大分子进入细胞。这类肽很快用到药物的靶向和导入的研究中,可以有效地将包括亲水性蛋白质和多肽、核苷酸、小分子药物、量子点和显像剂等在内的多种货物分子导入各种细胞中,开辟了药物进入细胞的新介导途径。其在基因治疗方面因其高效传递基因物质的能力及低毒性,容易制备而在过去20多年中成为研究热点。研究发现,多肽类载体中的精氨酸因其表面富集的正电荷可有效地吸附带负电荷的基因物质而形成粒径小,结构稳定的载体/基因复合物。组氨酸由于有咪唑基团,可有“质子海绵效应”,实现溶酶体的逃逸。从而可以构建一个以组氨酸和精氨酸组成的短肽,与羧基化多壁纳米管通过酰胺键连接,精氨酸带正电可以吸附带负电的cpg。
基于上述理论,本课题构建了一种由3个精氨酸(arginine)、6个组氨酸(histidine)组成的短肽(hr)修饰的多壁碳纳米管(multiwalledcarbonnanotubes)的纳米载体mhr,可以增强碳纳米管的水溶液中的溶解性、分散性,降低多壁碳纳米管的生物机体毒性。穿膜短肽hr中的精氨酸带正电,通过静电吸附富含未甲基化胞嘧啶-鸟嘌呤二核苷酸的dna(cpgdna)等免疫激活剂,形成mhr-cpg纳米免疫激活剂,保护cpg免受核酸酶的降解,增强其细胞摄取率,组氨酸的质子海绵效应可实现溶酶体逃逸。
目前尚无一种肽修饰的多壁碳纳米管,并且能够结合未甲基化胞嘧啶-鸟嘌呤二核苷酸的dna(cpgdna)等免疫激活剂激发机体的抗肿瘤免疫效应,为前列腺癌患者的治疗开辟一个新的治疗策略,同时也为碳纳米管应用于药物载体提供新的理论依据和思路。
技术实现要素:
本发明的目的在于提供一种可以增强碳纳米管的水溶液中的溶解性、分散性,降低多壁碳纳米管的生物机体毒性的肽修饰碳纳米管载体。本发明的另一个目的是提供该肽修饰碳纳米管载体的制备方法;本发明的第三目的是提供该多肽载体结合未甲基化胞嘧啶-鸟嘌呤二核苷酸的dna(cpgdna)等免疫激活剂在前列腺癌治疗中的应用。
本发明所要解决的主要技术问题是:如何提高增强碳纳米管的水溶液中的溶解性、分散性,降低多壁碳纳米管的生物机体毒性,以及如何提高肽修饰碳纳米管载体进入细胞的能力且可以实现溶酶体逃逸,同时保证材料具有生物可降解特性。
本发明设计了一种肽修饰的多壁碳纳米管载体,由精氨酸、组氨酸组成的多肽hr,hr中精氨酸带正电荷可与带负电未甲基化胞嘧啶-鸟嘌呤二核苷酸的dna(cpgdna)等免疫激活剂结合并具有穿膜作用,其中组氨酸因其质子海绵效应而促进内涵体逃逸。
本发明的第一方面,提供一种肽修饰的多壁碳纳米管载体,所述的多壁碳纳米管是表面羧基化的多壁碳纳米管;所述的肽修饰,是指多壁碳纳米管上的羧基和组氨酸上的氨基通过酰胺键连接。是根据序列进行肽固相合成,再将羧基化的碳纳米管上的羧基和组氨酸上的氨基通过酰胺键连接得到所述的肽修饰的多壁碳纳米管载体。
所述的羧基化的多壁碳纳米管,是将2g多壁碳纳米管加入98%浓硫酸和98%浓硝酸混合溶液中(3:1,v/v,80ml),在超声波水溶锅(40khz,40℃)超声8小时,然后磁力搅拌24小时,通过离心分离出羧基化的多壁碳纳米管,并冷冻干燥以备使用。
所述的肽修饰的多壁碳纳米管载体可通过将多壁碳纳米管(mwcnt)和多肽hr按照一定的比例搅拌一定的时间而成。优选的,所述的多壁碳纳米管(mwcnt)和多肽hr的质量比为1:30-1:20。更优选1:30。
所述的多肽的氨基酸序列如下所示:
hhhrrrrrr(seqidno:1);氨基酸之间以肽键相连,多肽可简写为h3r6,缩写为hr。可通过固相合成法合成。
所述的肽修饰,是指羧基化的多壁碳纳米管上的羧基和组氨酸上的氨基通过酰胺键连接。
所述的肽修饰的多壁碳纳米管载体可以简写为:mhr,其中m为多壁碳纳米管,h为组氨酸,r为精氨酸。
所述的肽修饰的多壁碳纳米管载体的化学结构式如式(i)所示:
本发明的h组氨酸,r精氨酸组成9肽,氨基酸之间以肽键连接,英文缩写为hr;在9肽的n端,碳纳米管上的羧基与氨基以酰胺键连接,肽修饰的多壁碳纳米管英文缩写为mhr;与未甲基化胞嘧啶-鸟嘌呤二核苷酸的dna(cpgdna)等免疫激活剂结合后结合缩写为mhr-cpg。
本发明的第二个方面,提供上述的肽修饰的多壁碳纳米管载体的制备方法,所述的制备方法包括如下步骤:
(a)hhhrrrrrr多肽的合成:合成hr;
(b)肽修饰的多壁碳纳米管载体制备:将步骤(a)合成的多肽hr与羧基化的多壁碳纳米管(mwcnt),按质量比mwcnt/hr=1:30-1:20(优选1:30)搅拌反应24小时。
在本发明的一个优选实施例中,步骤(b)具体为:取30mgmwcnt加入到200mgedc和nhs200mg的蒸馏水溶液中,磁力搅拌反应3小时,将多壁碳纳米管进行羧基化之后,按1:30的比例加入多肽hr反应,磁力搅拌24小时,然后离心去除未反应的多肽。
在本发明的一个优选实施例中,所述的步骤(b)中羧基化的多壁碳纳米管,是将2g多壁碳纳米管加入98%浓硫酸和98%浓硝酸混合溶液中(3:1,v/v,80ml),在超声波水溶锅(40khz,40℃)超声8小时,然后磁力搅拌24小时,通过离心分离出羧基化的多壁碳纳米管,并冷冻干燥以备使用。
优选的,步骤(b)反应后的溶液,2000rpm离心5min弃掉上清液,除去未反应肽。
优选的,步骤(b)所制得的样品在-20℃保存。
为维持纳米载体材料较高的活性,将制备的溶液冷冻干燥,并保存于-20℃,纳米材料在复溶后可在4℃长期保存。
本发明的第三个方面,是提供了上述的肽修饰的多壁碳纳米管载体在制备联合免疫激活剂药物中的应用。
优选的,所述的免疫激活剂,为未甲基化胞嘧啶-鸟嘌呤核苷酸的dna(cpgdna)。
所述的药物中,肽修饰的多壁碳纳米管载体中的精氨酸带正电可以与带负电免疫激活剂进行结合。
进一步地,本发明还提供了上述的肽修饰的多壁碳纳米管载体在制备前列腺癌治疗药物中的应用。
进一步的,本发明还提供了上述的肽修饰的多壁碳纳米管载体联合未甲基化胞嘧啶-鸟嘌呤二核苷酸的dna(cpgdna)等免疫激活剂在制备前列腺癌治疗药物中的应用。
所述的应用具体为:
将此肽修饰的多壁碳纳米管载体与cpgdna混合,制得mhr-cpg纳米免疫激活剂。
所述的肽修饰的多壁碳纳米管与cpgdna混合的n/p比为5:1-40:1(优选6:1),在此比例范围内,所述纳米载体材料能够引导cpgdna进入细胞内。
本发明提供的纳米载体适用于实验所需的免疫激活。
本发明的优点在于:
本发明构建了一种由3个精氨酸(arginine)、6个组氨酸(histidine)组成的短肽(hr)修饰的多壁碳纳米管(multiwalledcarbonnanotubes)的纳米载体mhr,可以增强碳纳米管的水溶液中的溶解性、分散性,降低多壁碳纳米管的生物机体毒性。穿膜短肽hr中的精氨酸带正电,通过静电吸附富含未甲基化胞嘧啶-鸟嘌呤二核苷酸的dna(cpgdna)免疫激活剂,形成mhr-cpg纳米免疫激活剂,保护cpg免受核酸酶的降解,增强其细胞摄取率,组氨酸的质子海绵效应可实现溶酶体逃逸。
本发明的纳米载体可以利用mhr-cpg激发机体的抗肿瘤免疫效应,为前列腺癌患者的治疗开辟一个新的治疗策略,同时也为碳纳米管应用于药物载体提供新的理论依据和思路。
本发明的制备方法操作简单,反应试剂和得到的产物无毒性,不会对环境产生污染,反应条件温和,反应后得到的纳米载体纯化简单,成分低廉,利于大规模推广于研究和应用领域。
附图说明
图1.mhr的核磁共振氢谱图;
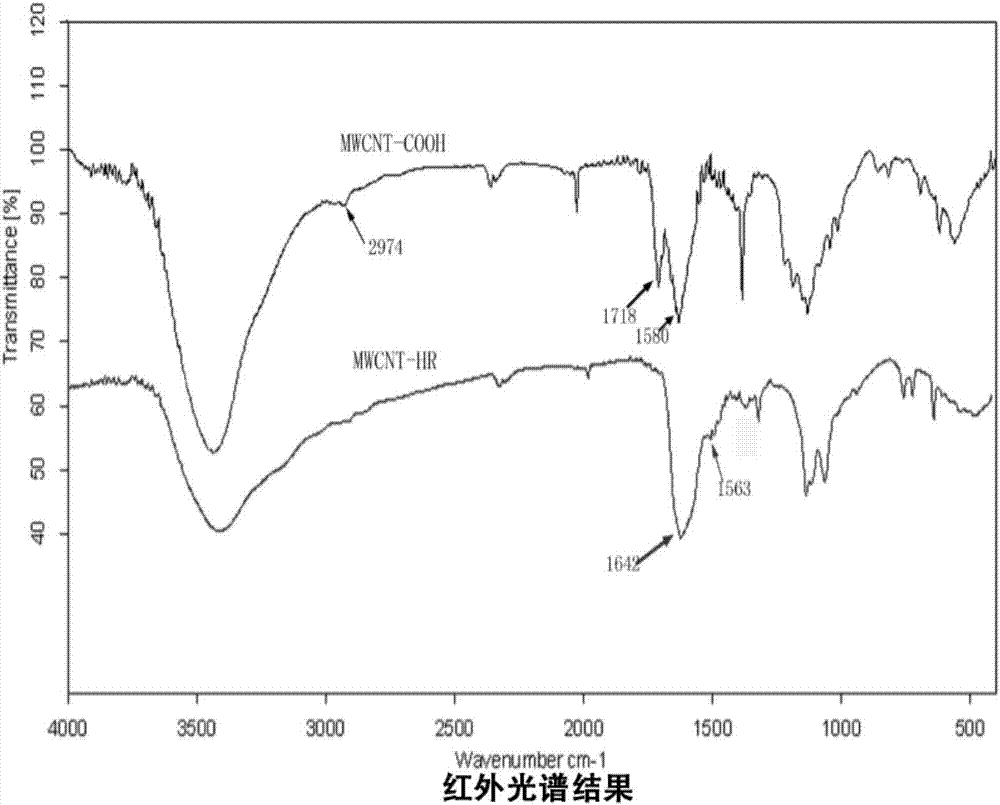
图2.mhr红外光谱图;
图3.其中a为羧基化的多壁碳纳米管mwcnt-cooh,b为肽修饰的多壁碳纳米管mhr透射电镜图;
图4.mhr的zeta电位图;
图5.不同氮磷比mhr/pegfp体外转染图;
图6.琼脂糖凝胶电泳图(考察mhr载基因的能力);
图7.cpg、mhr-cpg的细胞摄取图;
图8.激光共聚焦结果图;
图9.mhr和mwcnt-cooh的细胞毒性考察;
图10.免疫活性因子elisa考察。
具体实施方式
下面结合实施例对本发明提供的具体实施方式作详细说明。
实施例1:hr的合成
9肽hr氨基酸序列:hishishisargargargargargarg(his,组氨酸;arg,精氨酸)(seqidno:1),hr,由上海吉尔生化有限公司采用多肽固相合成法合成并命名为hr,利用制备高效液相色谱纯化合成的hr,使其纯度达到95%以上。r为精氨酸,h为组氨酸,氨基酸之间以肽键连接形成9肽。
实施例2:肽修饰的多壁碳纳米管载体mhr的制备
对多壁碳纳米管表面进行羧基化修饰,再对表面羧基进行活化,根据hhhrrrrrr序列进行肽固相合成(按质量比mwcnt/hr,1:30),搅拌反应24小时,碳纳米管上的羧基和组氨酸上的氨基能过酰胺键连接得到mhr,然后高速离心,对mhr测定电径,再用透视电镜对肽修饰的mhr进行形态考察,并利用核磁共振氢谱和红外光谱鉴定所得聚合物的结构特征。核磁共振氢谱结果见图1,红外光谱结果见图2,羧基化后的碳纳米管和肽修饰多壁碳纳米管的透射电镜如图3a和b(a为羧基化的多壁碳纳米管,b为肽修饰多壁碳纳米管),mhr的电位图结果见图4,电位+30mv左右。
实施例3:mhr/pegfp体外转染效率考察
选取鼠巨噬细胞细胞株raw-264(购自中国科学院上海生物科学研究所细胞培养中心),加入不同氮磷比(5、10、20、40)的mhr负载egfp质粒,配置纳米复合物涡旋10s后静置30min,加入孔板中,培养4小时后,更换为新鲜培养基,继续培养24小时。荧光显微镜观察细胞转染情况,如图5所示。图5显示在n/p=10时mhr的转染效率最佳。
实施例4:mhr载基因的能力的考察
配制不同n/p的mhr-cpg,进行琼脂糖凝胶电泳,测定mhr的负载cpg的功效。琼脂糖凝胶电泳结果见图6,mhr在n/p=6时即可将cpg完全载上。
实施例5:cpg、mhr-cpg的细胞摄取情况
用mhr和标记fitc的cpg进行涡漩,静止30min,选择raw-264细胞,按照30w/孔分别接种于12孔板上,加入1ml含10%fbs(gibco公司,美国)的dmem培养基(gibco公司,美国)培养24小时,使细胞汇合度达70-80%,加入cpg、mhr-cpg复合物,无血清培基37℃培养4h,利用流失细胞仪、激光共聚焦考察其摄取。
流失细胞术结果见图7(图7a表示的是流失细胞术结果,图7b结果是cpg-fitc阳性细胞数),可以看出mhr-cpg的摄取情况明显多于单纯的cpg。共聚焦结果见图8,可见mhr可以成功的将fitc标记的cpg携带进入细胞。
实施例6:mhr和mwcnt-cooh的细胞毒性研究
将raw264细胞按照8×103/孔接种于96孔板中,培养24h,使细胞汇合度达到50%。吸去培养基,每孔加入100μl含不同浓度mhr和羧基化的多壁碳纳米管mwcnt-cooh,继续培养24、48h,cck-8法检测细胞毒性,统计细胞存活率。结果见图9,可以看出mhr在24h和48h对细胞几乎没有毒性,毒性明显小于mwcnt-cooh。
实施例7:免疫活性因子elisa考察
给药分组如下mhr-cpg、mhr、cpg、mhr-noncpg、lps、空白组对raw-264细胞培养24小时,收集培养基,离心收集上清,elisa方法测定细胞免疫因子(tnf-α、il-12)的浓度。结果见图10。可以看出,mhr-cpg的免疫刺激活性和lps的免疫刺激活性相当,明显高于单体cpg。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种高度石墨化碳纳米线团材料及其制备方法
- 多壁碳纳米管/ Ce<sup>3+</sup>掺杂TiO<sub>2</sub>纳米纤维在对苯酚催化降解中的应用
- 一种石墨材料表面原位自生碳纳米管的方法
- 一种碳纳米管-石墨协同增强的电子烟导油绳制备方法
- 一种功能化多壁碳纳米管共混超滤膜的制备方法
- 一种在膨胀石墨孔隙内生长纳米碳管的方法
- 碳纳米管/膨胀石墨组合填料及其制备方法和含有组合填料的导热高分子材料及其制备方法
- 一种表面可控氧化的石墨化中间相碳微球负极材料及其制备方法
- 一种含改性氟化石墨纤维-碳纳米管的pc-pet基led散热材料及其制备方法
- 一种led用碳纳米管-石墨填充改性的pa6/abs复合导热塑料及其制备方法
- 一种掺杂多壁碳纳米管的壳聚糖生物凝胶膜的制备工艺方法与流程
- 一种金属掺杂的光热碳纳米材料及其制备方法和应用与流程
- 一种单质铜包覆多壁碳纳米管/铝基复合材料半固态坯料的制备方法与流程
- 一种基于多壁碳纳米管修饰超滤膜深度处理饮用水中抗生素的方法与流程
- 基于分等级结构的Ce掺杂In2O3纳米敏感材料的丙酮传感器、制备方法及其应用与流程
- 一种生物基氮硫共掺杂碳纳米片的制备方法与流程
- 一种多壁碳纳米管增强传热密封材料及其制备方法与流程
- 金属/碳纳米管复合掺杂的磷酸锰铁材料及其制备方法与流程
- 具有核壳结构的硫化钼/多壁碳纳米管杂化材料及其制备方法和应用与流程
- 碳纳米管掺杂芬布芬分子印迹聚合物控缓释材料的制备的制作方法与工艺