5Z‑7‑oxozeaenol在制备治疗自身免疫性脑脊髓炎药物中的应用的制作方法
本发明具体涉及一种小分子化合物5z-7-oxozeaenol在制备治疗自身免疫性脑脊髓炎药物中的应用。
背景技术:
多发性硬化(multiplesclerosis,ms)是中枢神经系统(centralnervesystem,cns)最常见的脱髓鞘疾病,它以脑和脊髓多处出现炎性灶,髓鞘破坏,胶质细胞增生,神经元丢失为特征,可导致永久性的神经功能损伤。根据病变累及部位的不同,临床可表现为:肢体瘫痪、麻木、肌肉痉挛、视力障碍、球麻痹、共济失调、自主神经功能紊乱等。全世界范围内大约有250万患者,且发病率仍在增加(koch-henriksenandsrensen,2010)。患者在30岁左右出现症状,大约50岁左右达到疾病高峰期。一旦罹患ms,致残率高,大大降低了患者的生活质量,给家庭和社会造成了沉重的负担。
多发性硬化的发病机理以及相关药物已经研发超过10年,然后并没有副作用少、疗效好的新药问世,目前的治疗还是以传统的血浆置换、激素和免疫抑制剂的治疗为主。包括急性发作期治疗和缓解期调节治疗。急性发作期治疗主要包括激素、丙种球蛋白应用及血浆置换等。缓解期调节治疗药物包括β-干扰素(interferon-β)、醋酸格拉默、米托蒽醌、芬戈莫德、特立氟胺等,其目的主要是调节炎症反应、减少复发。现有治疗方法是在疾病早期减少复发和降低致残率,但在疾病的进展阶段却无明显疗效。而且大多数药物价格昂贵,副作用严重,存在长期应用疗效减退等缺点。如长期使用皮质类固醇激素会出现严重的不良反应,包括骨质疏松、骨折、无菌性血管坏死、肝脂肪变性、感染等。β-干扰素长期使用后患者机体能产生中和抗体,通常用药3年后临床疗效下降。醋酸格拉默只能采用皮下注射给药,因此限制了其使用,长期局部注射可引起注射部位红肿、硬结、压痛、发热、瘙痒等。米托蒽醌可导致心脏功能降低及白血病等严重副作用(minagar,2013;stroetetal.,2011)。芬戈莫德可引起头痛、转氨酶增高。
目前多发性硬化病因不明,其发病机制中涉及多种炎性信号通路的激活,包括nf-κβ、p38mapk、jnk、erk等,而干预中某一条炎症信号通路的治疗效果不尽人意。比如p38mapk抑制剂sb203580可抑制lps刺激下巨噬细胞分泌tnf-α和il-1的水平(leeetal.,1994)。p38mapk抑制剂sb203580可有效改善类风湿性关节炎(rheumatoidarthritis,ra)、炎症性疼痛、牛皮癣、炎症性肠病、阿尔茨海默病等相关疾病症状(goldsteinandgabriel,2005)。p38抑制剂可以改善ra动物模型的病情,已经进入治疗ra和牛皮癣的临床试验阶段(cohen,2009)。然而,这些抑制剂在第三临床阶段的试验中因为药物毒性的原因被终止。
实验性自身免疫性脑脊髓炎(experimentalautoimmuneencephalomyelitis,eae)从最初建立至今大概50年(kabatetal.,1947)。eae通过激活自身反应性t细胞对cns髓鞘产生的免疫应答,它可以有效研究免疫系统在cns炎症性脱髓鞘病变中所起的作用。其典型的病理特征表现为:(1)血管周围的炎性细胞(主要是淋巴细胞、巨噬细胞、激活的小胶质细胞)浸润;(2)病灶区域的脱髓鞘,特点是髓鞘破坏、轴突保存(raoandsegal,2004)。它的免疫炎症反应、临床特征和组织病理学改变与人类ms疾病有惊人的相似(sosaandforsthuber,2011)。因此,它是目前ms研究中应用最广泛的动物模型(kippetal.,2012)。ms和eae两者的cns白质均出现t细胞、巨噬细胞和b细胞浸润的脱髓鞘病灶。其中,病灶内出现吞噬了疏水的髓磷脂形成的泡沫样巨噬细胞被认为是活动病灶。寡克隆igg在eae和ms患者脑脊液(cerebrospinalfluid,csf)中均可见到。两者的差异之处在于后者发病机制中还有基因、表观遗传和环境因素(包括感染和免疫系统之间的相互作用)的参与(becheretal.,2016)。
虽然多种抗原可诱导eae模型,最常用的有髓鞘碱性蛋白(myelinbasicprotein,mbp)、髓鞘少突细胞糖蛋白(myelinoligodendrocyteglycoprotein,mog)、髓鞘相关糖蛋白(myelin-associatedglycoprotein,mag)和蛋白质脂蛋白(proteolipidprotein,plp)等。但通过检测ms患者体内的自身抗体发现,与抗mbp抗体、抗plp抗体相比,ms患者体内存在更多的抗mog抗体,因此,现在更多的是使用mog作为抗原来诱导eae模型(costaetal.,2003)。
通常来说,在研发多发性硬化的药物时,首先要使用实验性自身免疫性脑脊髓炎的动物模型,在动物模型上使用显示有效而且无明显副作用的情况下,再申请进行临床试验。
转化生长因子-β激活激酶抑制剂5z-7-oxozeaenol(oz)是真菌来源的二羟基苯甲酸内酯。5z-7-oxozeaenol化学名为(3s,5z,8s,9s,11e)-3,4,9,10-tetrahydro-8,9,16-trihydroxy-14-methoxy-3-methyl-1h-2-benzoxacyclotetradecin-1,7(8h)-dione,cas号为66018-38-0;其结构式为
有研究表明5z-7-oxozeaenol可缓解非肥胖性糖尿病小鼠自身免疫性糖尿病的病情(caoetal.,2015)。余波等人的文章(余波,王金林,刘晶,等.转化生长因子-β激活激酶抑制剂5z-7-oxozeaenol对大鼠脑外伤海马ca1区的神经保护作用[j].中华实验外科杂志,2016,33(9):2110-2113.)公开了转化生长因子-β激活激酶抑制剂5z-7-oxozeaenol对大鼠脑外伤海马ca1区的神经保护作用。而脑外伤和中枢神经系统自身免疫性疾病--多发性硬化的不同之处在于,脑外伤属于外伤性疾病。ms病因不明,目前的研究支持它是一种cd4+t细胞介导的自身免疫性疾病,发病机制涉及免疫系统功能紊乱。脑外伤治疗以手术为主。ms治疗以激素和免疫抑制剂治疗为主。
因此,研发针对eae以及ms的更加有效、副作用少的药物,对于延长患者生存时间,提高患者的生活质量,具有重要的临床意义和社会效益。
技术实现要素:
本发明的目的在于5z-7-oxozeaenol在制备治疗自身免疫性脑脊髓炎药物中的应用。
本发明所采取的技术方案是:
5z-7-oxozeaenol及其药用衍生物在制备治疗脱髓鞘疾病的药物中的应用。
优选的,脱髓鞘疾病为自身免疫性脑脊髓炎。
优选的,脱髓鞘疾病为实验性自身免疫性脑脊髓炎
一种制备治疗脱髓鞘疾病的药剂,其活性成分为5z-7-oxozeaenol。
优选的,该药剂含有活性成分5z-7-oxozeaenol和药物上可接受的载体和/或稀释剂。
优选的,脱髓鞘疾病为自身免疫性脑脊髓炎。
优选的,脱髓鞘疾病为实验性自身免疫性脑脊髓炎。
本发明的有益效果是:
申请人所在研究团队经过两年的动物实验发现转化生长因子-β激活激酶抑制剂5z-7-oxozeaenol能有效改善实验性自身免疫性脑脊髓炎小鼠的症状,通过抑制p38mapk、jnk、erk通路,而不是nf-κb通路,减轻中枢神经系统炎症反应,减少免疫细胞分泌炎症细胞因子,抑制脊髓小胶质细胞活化。将5z-7-oxozeaenol能有效治疗eae,为临床治疗多发性硬化提供新的药物选择。
本发明中5z-7-oxozeaenol能有效治疗eae,预示着5z-7-oxozeaenol在治疗自身免疫性脑脊髓炎中的应用,下一步的临床实验正在开展中。
附图说明
图1.5z-7-oxozeaenol对eae小鼠具有明显的神经保护效应;
图2.5z-7-oxozeaenol能减轻eae小鼠脊髓炎症反应;
图3.5z-7-oxozeaenol能减轻eae小鼠脊髓脱髓鞘程度;
图4.5z-7-oxozeaenol能抑制eae小鼠脊髓小胶质细胞的激活;
图5.5z-7-oxozeaenol能降低eae小鼠外周免疫细胞经mog35-55肽刺激48h后细胞上清中炎性细胞因子的分泌;
图6.5z-7-oxozeaenol能抑制eae小鼠脊髓小胶质细胞iba-1表达;
图7.5z-7-oxozeaenol能抑制eae小鼠脊髓tak1通路的激活;
图8.5z-7-oxozeaenol能抑制eae小鼠脊髓mapks通路的激活。
具体实施方式
5z-7-oxozeaenol(oz)为真菌来源的二羟基苯甲酸内酯,购自英国tocris公司。
下面结合具体实验对本发明作进一步的说明,但并不局限于此。
1.侧脑室置管
以前囟点为0点定位穿刺点。穿刺点坐标依georgepaxinos小鼠脑立体定位图谱确定:前囟后0.6mm,矢状缝右侧1.5mm,硬膜下2.0mm的标准,等比例计算小鼠实际的前囟后距离0.5-0.55mm,矢状缝右侧1.25-1.4mm,硬膜下2.0mm,将带内芯的穿刺套管从进针点垂直插入,缓慢旋出导管内芯,见脑脊液溢出确定进入脑室,置回内芯。以牙托粉为粘和剂将穿刺套管、螺钉、颅骨紧密粘合,固定好导管。术后一周开始造模、给药。
2.eae小鼠模型的建立
每只小鼠皮下注射200μl的抗原乳剂,包含:100μl含0.2mg的髓鞘少突细胞糖蛋白(myelinoligodendrocyteglycoprotein,简写为mog)mog35-55肽以及1000及含50055结核分枝杆菌毒素的完全弗氏佐剂。但准备比实际需要多25%的乳剂用量,因为在乳化过程中可导致乳剂丢失。免疫当天和48h后经腹腔注射200μl含400ng的百日咳毒素。阴性对照组小鼠用pbs替代mog35-55肽与等体积cfa制备乳剂皮下注射。
3.实验分组
雌性c57bl/6小鼠,根据诱导剂和5z-7-oxozeaenol给药方式的不同,随机分成五组:(1)dmso-cfa组:用pbs替代mog35-55免疫小鼠,自免疫当天开始至取材之日每隔三天给予dmso2μl;(2)dmso-eae组:用mog35-55免疫小鼠进行eae造模,给药方法同dmso-cfa组;(3)5z-7-oxozeaenol1.6μg(0→12d)-eae组:用mog35-55免疫小鼠,自免疫当天开始至免疫后第12天,每隔三天侧脑室给予5z-7-oxozeaenol1.6μg;(4)5z-7-oxozeaenol1.6μg(12→21d)-eae组:用mog35-55免疫小鼠,自免疫第12天开始每隔三天侧脑室给予5z-7-oxozeaenol1.6μg至第21天终止;(5)5z-7-oxozeaenol1.6μg(0→21d)-eae组:用mog35-55免疫小鼠,自免疫当天开始每隔三天侧脑室给予5z-7-oxozeaenol1.6μg至免疫后第21天终止。各组分别为9只小鼠,免疫第21天进行取材。
4.神经功能评分
免疫当日为第0天,免疫当日及免疫后每日对所有动物进行体重测量,观察行为改变,并进行神经功能评分。eae模型评分采用国际较为通用的五分评分法,见表1。
表1五分评分法
结果见图1。
应用mog35-55肽皮下注射制备eae小鼠模型,在注射mog35-55肽的第1天开始,每天进行神经功能评分,至第21天结束。结果见图1,图1a为每日平均神经功能评分结果,图1b为最大神经功能评分结果。每组9只小鼠。数据以均数±标准误表示。采用mann-whitneyu-test进行统计分析。用*表示校正p<0.017;用**表示p<0.01,***表示p<0.001与dmso-eae组进行比较。
结果显示,与dmso-eae组相比,5z-7-oxozeaenol1.6μg(12→21d)-eae组小鼠在第19天、第20天、第21天神经功能评分有降低(p分别<0.017,<0.01,<0.001),说明从第19天开始,小鼠病情有明显改善。与dmso-eae组相比,5z-7-oxozeaenol1.6μg(0→21d)-eae组在第18天开始至第21天小鼠神经功能缺损评分均有下降(p<0.017,第21天p<0.001),差异有统计学意义,说明这组小鼠从第18天开始,病情开始好转,见图1a。并且,与dmso-eae组相比,5z-7-oxozeaenol1.6μg(12→21d)-eae组和5z-7-oxozeaenol1.6μg(0→21d)-eae组小鼠最大神经功能评分均降低(p<0.017),说明这两组小鼠虽然有神经系统缺损症状即瘫痪,但整个病程中,疾病的严重程度即瘫痪程度比dmso-eae组明显减轻,见图1b。实验结果表明,采用5z-7-oxozeaenol1.6μg0→12天以及0→21天两种给药模式,均能有效缓解eae小鼠病情,减轻eae小鼠瘫痪程度,对eae小鼠发挥神经保护作用。
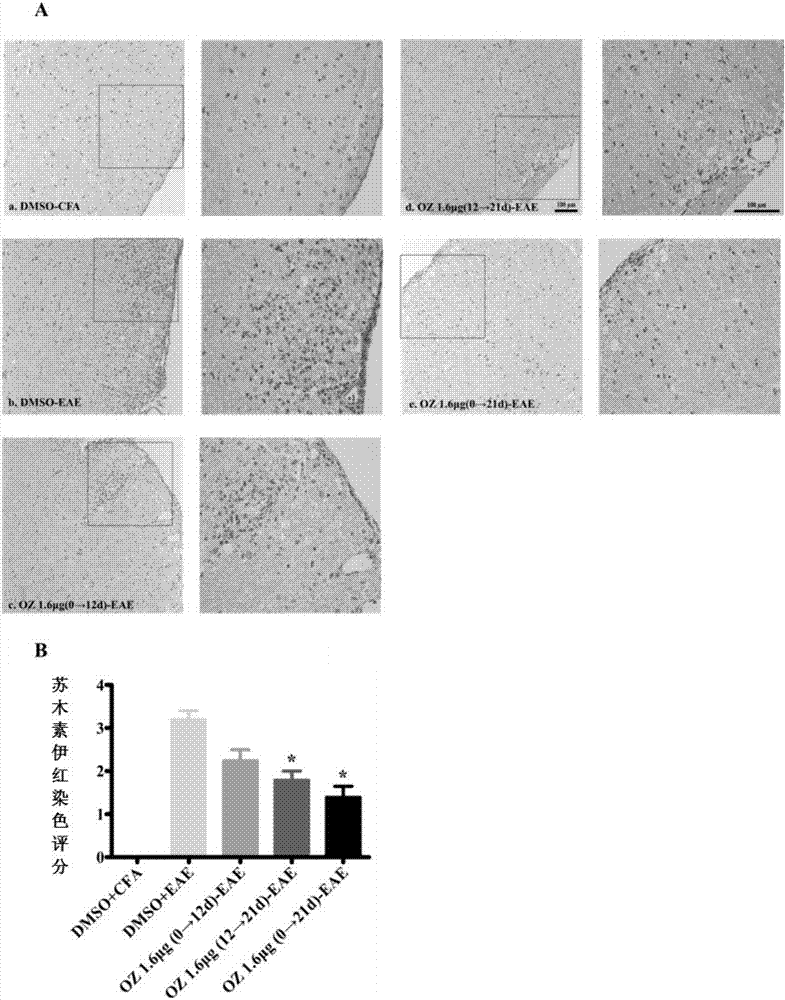
5.苏木素-伊红染色
切片入苏木素染3min,自来水洗;1%的盐酸酒精分化数秒,自来水冲洗;0.6%氨水返蓝,流水冲洗;切片入伊红染液中染色1-3min;脱水封片;显微镜镜检,图像采集。根据表2标准半定量分析炎性细胞浸润程度。
表2炎性细胞浸润程度分析标准
应用mog35-55肽皮下注射制备eae小鼠模型,在注射mog35-55肽后的第21天,各组均取五只小鼠,通过he染色(苏木素-伊红染色)检测各组小鼠脊髓淋巴细胞浸润情况,应用半定量方法进行评分。结果见图2,图2a为各组he染色代表图,其中各组的he染色图右图为左图方框的放大图;图2b为各组脊髓炎性细胞浸润情况半定量分析图。图2b采用mann-whitneyu-test进行统计分析,并进行p值校正。*表示校正p<0.017与dmso-eae组进行比较,数据以均数±标准误表示。
dmso-cfa组无明显淋巴细胞浸润;dmso-eae组和5z-7-oxozeaenol1.6μg(0→12d)-eae组可见明显的淋巴细胞浸润于脊髓实质;与dmso-eae组相比,5z-7-oxozeaenol1.6μg(12→21d)-eae组和5z-7-oxozeaenol1.6μg(0→21d)-eae组脊髓淋巴细胞浸润显著降低,主要集中在硬脊膜下(图2a);进一步统计分析发现,5z-7-oxozeaenol1.6μg(12→21d)-eae组和5z-7-oxozeaenol1.6μg(0→21d)-eae组与dmso-eae组相比,采用he染色半定量分析,脊髓炎症反应减轻,差异具有统计学意义(校正p<0.017)(图2b)。实验结果表明,5z-7-oxozeaenol1.6μg(12→21d)-eae组和5z-7-oxozeaenol1.6μg(0→21d)-eae组能有效减少eae小鼠脊髓淋巴细胞的浸润,抑制eae小鼠cns炎症反应。
6.luxolfastblue染色检测
切片置于0.1%lfb染液60℃孵育过夜;切片浸入0.05%碳酸锂中分化;0.1%伊红复染1min;封片;显微镜镜检,图像采集分析。根据表3标准半定量分析脱髓鞘程度。
表3脱髓鞘程度分析标准
应用mog35-55肽皮下注射制备eae小鼠模型,在注射mog35-55肽后的第21天,各组均取五只小鼠,通过lfb染色检测各组小鼠腰膨大脊髓的脱髓鞘情况,应用半定量方法进行评分。结果见图3,其中图3a为各组lfb染色代表图,其中各组的染色图右图为左图方框的放大图;图3b为各组脊髓脱髓鞘情况半定量分析图。图3b采用mann-whitneyu-test进行两两比较,并进行p值校正。*表示p<0.017与dmso-eae组进行比较,数据以均数±标准误表示。
dmso-cfa组无脱髓鞘样改变。dmso-eae组和5z-7-oxozeaenol1.6μg(0→12d)-eae组可见明显的脱髓鞘改变,表现为神经纤维周围空泡样环绕。与dmso-eae组相比,5z-7-oxozeaenol1.6μg(12→21d)-eae组和5z-7-oxozeaenol1.6μg(0→21d)-eae组脱髓鞘病变减轻(图3a);进一步对lfb染色(罗克沙尔固蓝染色)半定量统计分析发现,5z-7-oxozeaenol1.6μg(12→21d)-eae组和5z-7-oxozeaenol1.6μg(0→21d)-eae组与dmso-eae组相比,脱髓鞘病变程度减轻达到统计学差异p<0.017(图3b)。实验结果表明,5z-7-oxozeaenol对eae小鼠包裹在神经纤维外的髓鞘具有保护作用。
7.免疫组织化学染色
检测小胶质细胞表面标志物iba-1的表达。
应用mog35-55肽皮下注射制备eae小鼠模型,在注射mog35-55肽后的第21天,各组均取五只小鼠,通过免疫组化检测各组小胶质细胞表面标志物iba-1表达情况,应用定量方法进行统计,每只小鼠分析5个视野。结果见图4,图4a为各组iba-1免疫组化代表图,其中各组中的右图为左图方框的放大图;图4b为各组iba-1表达定量分析图。图4b采用one-wayanova进行统计,lsd进行多重比较。***表示p<0.001与dmso-eae组比较,###表示p<0.001与dmso-cfa组比较。数据以均数±标准误表示。
dmso-cfa组只见少量iba-1阳性的小胶质细胞,说明小胶质细胞处于静息状态,无明显激活。dmso-eae组和5z-7-oxozeaenol1.6μg(0→12d)-eae组可见大量iba-1阳性的小胶质细胞,表现为虫样改变,体积变大,呈现激活的状态。与dmso-eae组相比,5z-7-oxozeaenol1.6μg(12→21d)-eae组和5z-7-oxozeaenol1.6μg(0→21d)-eae组iba-1阳性的小胶质细胞数量减少,小胶质细胞体积相对较小,可见分枝,说明激活小胶质细胞数量减少(图4a)。进一步对免疫组化染色的小胶质细胞iba-1定量分析并统计发现,与dmso-eae组相比,5z-7-oxozeaenol1.6μg(12→21d)-eae组和5z-7-oxozeaenol1.6μg(0→21d)-eae组iba-1阳性细胞数明显下降达到统计学差异,p<0.001(图4b)。实验说明,5z-7-oxozeaenol12→21d和0→21d给药可抑制eae小鼠脊髓小胶质细胞iba-1的表达和细胞的激活。
8.酶联免疫吸附测定(elisa)检测eae
小鼠的外周免疫细胞经抗原mog35-55肽刺激48h后检测细胞上清中炎性细胞因子的表达,实验方法如下:
(1)原代制备小鼠脾细胞体外培养;
(2)细胞分脾细胞组(加入1640全培)、脾细胞+mog35-55肽刺激组(加含mog35-5520μg/ml的1640全培);
(3)培养48h后取细胞培养上清,分装保存于-80℃冰箱,进一步进行elisa检测炎性细胞因子的表达。
结果见图5,图5a为il-17a定量分析统计图;图5b为ifn-γ定量分析统计图;图5c为tnf-α定量分析统计图;图5d为il-6定量分析统计图。数据以均数±标准误表示(每组小鼠n=4),*p<0.05,**p<0.01,***p<0.001与dmso-eae组相比,###p<0.001与dmso-cfa组相比(采用单因素方差分析法)。
dmso-cfa组四种炎性因子表达水平低下,而dmso-eae组四种细胞因子水平表达均显著增高,两者相比有统计学差异(p<0.001)。说明,eae小鼠外周免疫细胞释放炎性细胞因子水平较阴性对照组显著增多。与dmso-eae组相比,5z-7-oxozeaenol1.6μg(0→12d)-eae组、5z-7-oxozeaenol1.6μg(12→21d)-eae组和5z-7-oxozeaenol1.6μg(0→21d)-eae组ifn-γ、tnf-α以及il-6炎性细胞因子水平表达均显著下降,差异有统计学意义(p<0.01或0.001)。而5z-7-oxozeaenol1.6μg(0→12d)-eae组与dmso-eae组相比,il-17表达水平接近,两者无统计学差异。但5z-7-oxozeaenol1.6μg(12→21d)-eae组和5z-7-oxozeaenol1.6μg(0→21d)-eaeil-17a的表达水平比dmso-eae组明显下降(p<0.05)(图5)。实验结果表明,5z-7-oxozeaenol各处理组均能显著降低eae小鼠外周免疫细胞经mog35-55肽体外刺激培养48h,培养上清中炎性细胞因子ifn-γ、tnf-α以及il-6的表达。但对于细胞因子il-17a而言,只有5z-7-oxozeaenol1.6μg(12→21d)-eae组和5z-7-oxozeaenol1.6μg(0→21d)-eae组外周免疫细胞上清中该细胞因子表达降低。
9.westernblot检测脊髓总蛋白iba-1、tak1、nf--1、mapks通路相关分子的表达水平
制备eae小鼠模型第21天取材,提取腰段脊髓总蛋白,westernblot检测脊髓总蛋白iba-1、tak1、nf-κβ、mapks通路相关分子的表达水平。实验方法如下:
(1)eae小鼠脊髓总蛋白的提取
小鼠腰段脊髓从-80℃取出后迅速于研磨器中加入裂解混合液(每20mg组织加100-200μl),继续研磨至无明显组织块,使其充分裂解。将研磨器中充分裂解后的悬液转移至干净的ep管中,冰上静置30min,在4℃条件下13000rpm,离心5min。收集上清至新的ep管中,即所要组织的总蛋白;吸取2μl用bca法测定蛋白浓度,其余分装保存于-80℃备用。
(2)westernblot检测。
脊髓总蛋白加入上样缓冲液进行热变性,然后sds-page电泳,然后转膜,4℃孵育一抗过夜,常温孵育二抗1小时,ecl发光液进行化学曝光。
实验结果如下:
制备eae小鼠模型第21天取材,提取脊髓总蛋白,westernblot检测小胶质细胞表面标志物iba-1含量,结果见图6,其中,图6a为iba-1的免疫印迹图;图6b为iba-1定量分析统计图。数据以均数±标准误表示(每组小鼠n=4),*p<0.05与dmso-eae组相比,##p<0.01,###p<0.001与dmso-cfa组相比(采用单因素方差分析法)。
dmso-cfa组iba-1表达水平低下。而dmso-eae组及5z-7-oxozeaenol1.6μg(0→12d)-eae组两组iba-1表达均显著增高,两者相比无统计学差异(p>0.05)。与dmso-eae组相比,5z-7-oxozeaenol1.6μg(12→21d)-eae组和5z-7-oxozeaenol1.6μg(0→21d)-eae组iba-1表达均显著下降,有统计学差异(p<0.05)(图6)。根据上述实验结果,我们发现5z-7-oxozeaenol1.6μg12→21天和0→21天给药均能有效抑制eae小鼠小胶质细胞iba-1的表达。结合实验6的免疫组化的小胶质细胞的形态分析,两者能有效抑制ifn-γ、tnf-α、il-17等诱导的小胶质细胞激活。
制备eae小鼠模型第21天取材,提取腰段脊髓总蛋白,westernblot检测p-tak1、tak1含量。结果见图7,其中图7a为p-tak1、tak1的免疫印迹图;图7b为p-tak1/tak1定量分析统计图。数据以均数±标准误表示(每组小鼠n=4),*p<0.05,**p<0.01与dmso-eae组相比,#p<0.05与dmso-cfa组相比(采用单因素方差分析法)。
与dmso-cfa组相比,dmso-eae组p-tak1表达升高(p<0.05)。说明eae小鼠脊髓存在p-tak1的激活。5z-7-oxozeaenol1.6μg(0→12d)-eae组与dmso-eae组相比,p-tak1表达无明显差异(p>0.05)。与dmso-eae组比,5z-7-oxozeaenol1.6μg(12→21d)-eae组和5z-7-oxozeaenol1.6μg(0→21d)-eae组两组p-tak1表达均显著下降(p<0.01和p<0.05)。这部分实验结果进一步证实5z-7-oxozeaenol通过抑制cns内tak1通路而发挥神经保护作用(图7)。
制备eae小鼠模型第21天取材,提取腰段脊髓总蛋白,westernblot检测nf-te和p38mapk、jnk、erk信号通路相应信号分子表达量。结果见图8,图8a为nf-相应、inf-、p-p38、p38、p-c-jun、c-jun、p-jnk、jnk、p-erk、erk的免疫印迹图;图8b为nf-κβ比肌动蛋白(内参)相对表达量;图8c为ik-βα比肌动蛋白的相对表达量;图8d为磷酸化p38比总p38的相对表达量;图8e为磷酸化c-jun比总c-jun的相对表达量;图8f为磷酸化jnk比总jnk的相对表达量;图8g为磷酸化erk1/2比总erk1/2的相对表达量。数据以均数±标准误表示(每组小鼠n=4),*p<0.05,**p<0.01与dmso-eae组相比,#p<0.05,##p<0.01与dmso-cfa组相比(采用单因素方差分析法)。
实验发现,与dmso-cfa组相比,dmso-eae组nf-κb、iκ-βα、p-p38和p-cjun表达明显增高,两组相比,差异有统计学意义。而5z-7-oxozeaenol1.6μg(12→21d)-eae组和5z-7-oxozeaenol1.6μg(0→21d)-eae组与dmso-eae处理组相比,nf-相比、if-相比表达无明显差异(p>0.05),说明5z-7-oxozeaenol不是通过作用于nf-κβ作用通路来发挥神经保护作用的。
进一步检测5z-7-oxozeaenol对mapks通路的影响,我们发现,与dmso-eae处理组相比,5z-7-oxozeaenol1.6μg(12→21d)-eae组和5z-7-oxozeaenol1.6μg(0→21d)-eae组的p-p38mapk、p-jnk、p-c-jun和p-erk1/2均表达下降(p<0.05或0.01)。因此,得出结论,5z-7-oxozeaenol对eae小鼠的神经保护作用,主要是通过抑制p38mapk、jnk和erk1/2通路来实现,而不能抑制nf-κb通路(图8)。
综上,申请人所在研究团队通过两年的动物实验发现转化生长因子-β激活激酶抑制剂5z-7-oxozeaenol能有效改善实验性自身免疫性脑脊髓炎小鼠的症状,通过抑制p38mapk、jnk、erk通路,而不是nf-κb通路,减轻中枢神经系统炎症反应,减少免疫细胞分泌炎症细胞因子,抑制脊髓小胶质细胞活化。将5z-7-oxozeaenol能有效治疗eae,为临床治疗多发性硬化提供新的药物选择。
由于实验性自身免疫性脑脊髓炎(experimentalautoimmuneencephalomyelitis,eae)从最初建立至今大概50年。它是目前ms研究中应用最广泛的动物模型。通常来说,在研发多发性硬化的药物时,首先要使用实验性自身免疫性脑脊髓炎的动物模型,在动物模型上使用显示有效而且无明显副作用的情况下,再申请进行临床试验。因此,本发明中5z-7-oxozeaenol能有效治疗eae,预示着5z-7-oxozeaenol可以应用于制备治疗自身免疫性脑脊髓炎药物。
- 还没有人留言评论。精彩留言会获得点赞!