一种骨形态发生蛋白微球的制备方法与流程
本发明涉及一种骨形态发生蛋白微球的制备方法特别是使用一种新型的载体材料甲氧基聚乙二醇-聚己内酯(mpeg-pcl),用来包载骨形态发生蛋白(bmp-2),制备微球的方法。
背景技术:
随着现代社会的发展,我国每年因创伤、感染和肿瘤等原因造成的骨缺损患者越来越多。骨缺损修复研究是骨科的研究热点,也是骨科医生致力解决的难题之一。骨缺损修复在骨的形成、吸收和重建过程需要骨形态发生蛋白、血管内皮细胞生长因子、血小板衍化生长因子等一系列细胞因子的共同调控,其中骨形态发生蛋白(bmp-2)为促进骨修复首选的重要因子。
bmp-2是骨折修复时的启动因子,可以诱导骨髓间充质干细胞向成软骨、成骨细胞定向增殖分化,从而促进软骨及骨的形成。然而bmp-2在体内的半衰期短,全身和局部应用很快被稀释代谢,达不到所期望的生物效应,需反复大量给药,使用剂量远高于生理水平,易引发诸如局部软组织水肿,脊髓脊神经根炎,异位骨化,种植体周围骨吸收及引发癌症等一系列的并发症,反复给药也增加了病人身体上的痛苦和经济上的负担。为了克服传统的bmp-2制剂的缺陷,通过制备药物缓释载体来持续缓释出药物以维持局部药物的浓度,从而提高药物的疗效,是解决的途径之一。
微球作为一种药物载体,在缓控释药物方面取得了很大的研究进展。具有以下几个优点:
(1)控制药物释放速度;
(2)增加药物对细胞膜的通透性;
(3)保护蛋白质药物,避免被蛋白酶降解而失活;
(4)提高药物的稳定性;
(5)延长药物疗效以及靶向给药。
就制作方法来看,当前制备药物微球的方法已经有了很多,3d打印法、乳化溶剂挥发法、相分离法、乳化溶剂萃取法、喷雾干燥法、熔融法等。但都各有缺点,例如在有
机溶剂挥发阶段,采用超声制得的微球会出现粒径差异性大而药物承载少的缺点。超声乳化制得初乳的方法也会对骨形态发生蛋白造成过热变性的影响,例如中国专利申请“bmp-2/plla/nha缓释微球及其制备方法”(cn201710009319.4)制备出了具有生物相容性好、吸收性好、力学强度高、可降解性好、稳定性好的药物微球,但是由于超声导致的局部过热可能会对骨形态发生蛋白产生过热变性失活等问题,从而影响药物微球的使用效果。
就所选择的药物载体材料来说,目前制备微球常用的载体材料有聚乙酸(pla),聚乳酸羟基乙酸共聚物(plga),因其具有良好的生物相容性和可生物降解性,在体内最终代谢产物为水和二氧化碳,因而被广泛用作药物载体。但是,上述载体材料在体内环境会产生酸性降解副产物,易引发炎症,影响bmp-2的稳定性和整体的治疗效果。
因此有必要提供一种新的载体材料与制作方法,以解决上述问题,改善给药方法。
技术实现要素:
针对上述现有技术,本发明提供了一种骨形态发生蛋白(bmp-2)微球的制备方法,本发明所选用的载体材料为甲氧基聚乙二醇-聚己内酯(mpeg-pcl)共聚物,其作为制备bmp-2微球的新型载体材料目前未见报道,因其无毒性、无致热性、无致敏性、无致畸致癌作用,具有良好的组织相容性,来源丰富,其不同于其他载体材料的优点是,在体内环境几乎不产生酸性降解副产物,这就避免了现有大部分载体材料的缺陷,减少了炎症反应的发生,所得微球粒径分布均匀、稳定性高,可局部注射给药,bmp-2/mpeg-pcl微球可以达到缓释、减少全身毒副作用,提高治疗效果的目的。
本发明是通过以下技术方案实现的:
(1)将mpeg-pcl溶于有机溶剂二氯甲烷中制成mpeg-pcl溶液;
(2)将bmp-2溶液分散于mpeg-pcl溶液中;
(3)将溶有bmp-2的mpeg-pcl溶液置于匀浆机搅拌进行第一次乳化得到初乳;
(4)将初乳缓慢加入到分散介质(聚乙烯醇溶液)中,继续剪切,进行第二次乳化,得到复乳;
(5)将此复乳置于磁力搅拌器上搅拌,挥发有机溶剂,冻干,即得bmp-2微球。
上述方法中,有机溶剂二氯甲烷易挥发,需现用现配。
上述方法中,分散到mpeg-pcl溶液中的bmp-2溶液的浓度优选为550μg/ml。
上述方法中,bmp-2溶液/mpeg-pcl溶液的体积比:1:(4~10),优选的,bmp-2溶液/mpeg-pcl溶液的体积比:1:5。
上述方法中,分散介质聚乙烯醇溶液的浓度范围2%~4%,优选的,浓度为2%。
上述方法中,mpeg-pcl溶液/聚乙烯醇溶液体积比:1:(10~15),优选的,mpeg-pcl溶液/聚乙烯醇溶液体积比:1:12。
上述方法中,bmp-2/mpeg-pcl微球,是由以下重量份的原料药和辅料制成的:优选的,甲氧基聚乙二醇-聚己内酯(mpeg-pcl)浓度:100mg/ml,聚乙烯醇(pva)浓度:2%,bmp-2溶液/mpeg-pcl溶液的体积比:1:5,mpeg-pcl溶液/聚乙烯醇溶液体积比:1:12。
上述方法中,使用匀浆机在冰浴的环境下进行第一次乳化,剪切转速为5000~15000r/min。时间为:30~90秒,制备得到初乳;优选的,剪切转速为10000r/min,剪切时间0.5min。
上述方法中,将初乳加到pva溶液中,用匀浆机在冰浴条件下,将初乳加到pva溶液中进行第二次乳化,使用转速5000~15000r/min,搅拌时间:30~120s,得到复乳。优选的,匀浆机剪切速度5000r/min,剪切1min。
上述方法中,将复乳置于磁力搅拌器上,300~700r/min搅拌3~6h挥发有机溶剂,优选的,400r/min搅拌4h,除去有机溶剂。
上述方法中,将挥发复乳的有机溶剂后,再离心水洗三次,冻干,即得bmp-2/mpeg-pcl微球。
通过本发明制备得到的bmp-2/mpeg-pcl微球,微球的平均粒径为6.17μm。
本发明的有益效果:
(1)载体材料是微球的重要部分,良好的蛋白载体材料应该具有以下特点,首先要具有良好的生物相容性,在体内不可以发生排异反应;其次,良好的蛋白载体材料还应该在体内可降解,降解后产物不应对人体产生危害,之前的微球载体材料在人体内降解后会产生酸性物质引发炎症对患处治疗效果不良影响;最后,良好的蛋白载体材料还应有适宜的缓释时间和降解速度,过快或者过慢都会影响治疗效果;
(2)本发明制备微球时采用了复乳溶剂挥发法进行制备,该方法所制得的微球粒径分布均匀,品质高;
(3)剪切转速与时间对微球的粒径也会有很大影响,本发明在制备微球过程中,对初乳和复乳的剪切速度与时间均做了大量实验,经过优选,得出初乳最优剪切时间为0.5min,剪切速度为10000r/min,复乳最优剪切时间为1min,剪切速度5000r/min,采用此剪切速度与时间可获得粒径分布更加均匀的微球;
(4)本发明所制备出的微球粒径分布均匀,表面不粗糙,稳定性高,制备方法简单易操作,可局部注射给药,使bmp-2长效稳定的作用于应用部位,促进骨生长,能够延长药物的作用时间,提高治疗效果并且缓释、减少毒副作用,提高治疗效果的目的,大大减少给药次数,提高患者顺应性。
附图说明
图1为bmp-2/mpeg-pcl微球的粒径分布图。
图2为bmp-2/mpeg-pcl微球的扫描电镜图。
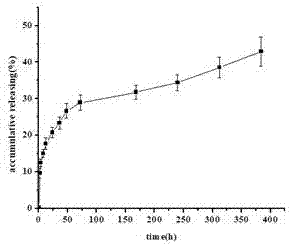
图3为bmp-2/mpeg-pcl微球利用动态膜透析法,在ph4醋酸盐缓冲液中的释放曲线。
具体实施方式
下面通过实施例对本发明进行具体描述,有必要指出的是下述实施例只用于对本发明做进一步说明,不能理解为对本发明保护范围的限制,该领域的技术人员根据下述说明的内容做出的一些非本质的改进和调整都在本发明的保护范围内。
实施例1bmp-2/mpeg-pcl微球的制取:称取100mgmpeg-pcl置于1ml有机溶剂二氯甲烷中,涡旋加速其溶解,二氯甲烷易挥发,应现配现用。称取0.24mg聚乙烯醇(pva),溶于12ml超纯水中,得到浓度为2%的pva溶液。取0.2mlbmp-2溶液加到mpeg-pcl溶液中,用匀浆机在冰浴条件下,10000r/min,剪切0.5min,得到初乳。将初乳加到pva溶液中,用匀浆机在冰浴条件下,5000r/min,剪切1min,得到复乳。将该复乳置于磁力搅拌器上以400r/min搅拌4h,挥发有机溶剂,离心水洗三次,冻干,即得bmp-2/mpeg-pcl微球。所制得的微球平均粒径为6.17μm,如图1所示,扫描电镜照片如图2所示。
实施例2bmp-2/mpeg-pcl微球在ph4醋酸盐缓冲液中的释放曲线:按实施例1制得bmp-2/mpeg-pcl微球。利用动态膜透析法,考察其在ph4醋酸盐缓冲液中的释放规律,所得释放曲线如图3所示。
由图3可知,在约前50h,bmp-2的释放速率相对较快,但随着时间的延长,微球释放药物的速率逐渐减慢,在第16天释放了约42%的药物,微球制剂可以延长药物的作用时间,提高治疗效果,大大减少给药次数,提高患者顺应性。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!