稳定的药物组合物的制作方法
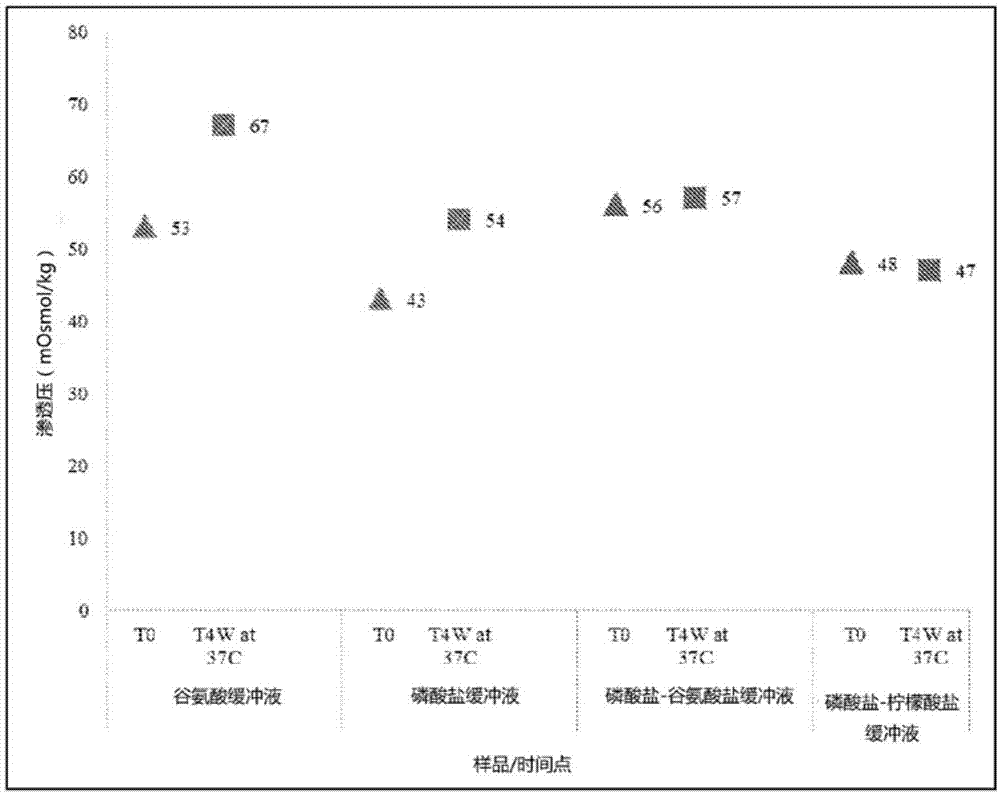
本申请与2016年1月12日提交的印度临时申请201641001111相关且要求其优先权,所述临时申请通过引用方式全文合并入本文。发明背景生物技术的进步为可能生产用于制药应用的各种蛋白质铺平了道路。然而,蛋白质是比传统药物更大且更复杂的包含多个官能团的三维结构。通常已知蛋白质在溶液中不稳定并且对ph、温度和氧化敏感,因此会在溶液中经历各种共价和非共价反应、修饰或降解。更常见的蛋白质降解途径包括聚集、脱酰胺和氧化。这些途径导致溶液中蛋白质的物理不稳定性和化学不稳定性。化学不稳定性可能是脱酰胺、水解、氧化或二硫化物交换的结果,而物理不稳定性可能是变性、聚集、吸附或沉淀的结果。蛋白质聚集是在蛋白质制剂中特别感兴趣的一点,因为其通常导致影响药物效力的蛋白质生物活性的降低,并还可能在患者中引起严重的免疫反应。蛋白质治疗剂的化学降解也涉及增加其抗原性潜力。因此,对于治疗用途的制剂,蛋白质具有固有挑战。因此,蛋白质制剂的稳定性是确保安全性和一致和有效的施用的最重要标准之一。组合物中蛋白质生物活性的任何损失都会降低其有效浓度。类似地,任何不期望的蛋白质修饰都可能导致功效的丧失,并增加不良事件的风险。因此,稳定的组合物需要将蛋白质配制在合适的缓冲剂中,以确保面对蛋白质降解途径时的稳定性。现有技术记载了在制剂中使用赋形剂从而防止聚集、变性或类似的其他降解。糖类如蔗糖、葡萄糖、棉子糖和海藻糖,以及多元醇如甘油、山梨糖醇和甘露糖醇已被用作蛋白质稳定剂。任何蛋白质组合物中糖和多元醇的浓度与蛋白质的稳定性成正比。(foster等,int.j.pharm。(1996)134(1,2):193-201)。蛋白质制剂中使用的其他赋形剂包括氨基酸、氨基糖、盐和polaxamer等。在配制蛋白质时,赋形剂的选择取决于多种因素,包括其与蛋白质以及制剂中其他组分的相容性、给药方式、剂量、治疗适应症等。因此,制剂开发背后的考虑包括筛选和选择合适的缓冲剂条件和赋形剂及它们的浓度。本发明通过开发保持活性成分中的蛋白质溶解度、稳定性和生物活性的稳定药物制剂来解决本领域中的挑战。发明简述本发明公开了包含双缓冲剂体系的用于抗体的稳定水性制剂,其中各缓冲剂选自磷酸盐、天冬氨酸盐、谷氨酸盐和琥珀酸盐。即使在加速稳定条件下,所公开的抗体制剂也提供在延长的时间段的改善的稳定性。所述稳定制剂抑制不期望的抗体变体的形成,从而保持抗体组合物的物理、化学或生物学特性。此外,所公开的制剂可用于许多不同的治疗性抗体。附图简述图1:如实施例1公开,示出37℃,t0和t4w下a-mab制剂的渗透压迁移(shift)。图2:说明a-mab组合物于受压条件下(50℃,2周)sec中高分子量物质(hmws)随时间推移的百分比趋势。图3:说明a-mab组合物于受压条件下(50℃,2周)sec中单体损失随时间推移的百分比趋势。图4:说明a-mab组合物于受压条件下(50℃,2周)iex碱性变体随时间推移的百分比趋势。图5:说明于受压条件下(50℃,2周)随时间推移,使用nanodrop的光散射趋势。这里,t0代表a-mab组合物第“0”天的数据,而t1w代表a-mab组合物于50℃的一周数据。发明详述本发明公开了用于抗体的稳定水性药物制剂,其中所述抗体被配制在双缓冲剂体系中。在本发明的一个实施方案中,双缓冲剂体系包含选自磷酸盐、天冬氨酸盐、琥珀酸盐和谷氨酸盐的两种缓冲剂中的任何组合。在本发明的另一个实施方案中,双缓冲剂体系由磷酸盐缓冲剂和谷氨酸盐缓冲剂组成。本发明的一个实施方案公开了用于抗体的稳定水性药物制剂,其中所述抗体被配制在双缓冲剂体系中,并且其还包含药学上可接受的赋形剂。在任何上述实施方案中,配制在双缓冲剂体系中的抗体于2-8℃下稳定至少2年。在本发明的任何上述实施方案中,配制在双缓冲剂体系中的抗体于25℃稳定至少3个月。在本发明的任何上述实施方案中,配制在双缓冲剂体系中的抗体于约40℃稳定至少2周,更优选至少4周。在本发明的任何上述实施方案中,配制在双缓冲剂体系中的抗体于约50℃稳定至少1周,更优选至少2周。在本发明的任何上述实施方案中,配制在双缓冲剂体系中的抗体于三次冻融循环后稳定,优选于五次冻融循环后稳定。在另一个实施方案中,本发明公开了包含赋形剂的抗体制剂,其中赋形剂包含氨基酸,优选所述氨基酸为精氨酸和/或甘氨酸或衍生物及它们的组合。在又一个实施方案中,本发明公开了包含赋形剂的抗体制剂,其中赋形剂包含糖或糖醇,优选所述糖为甘露糖醇、山梨糖醇、蔗糖和海藻糖或衍生物及它们的组合。在另一个实施方案中,本发明公开了包含赋形剂的抗体制剂,其中赋形剂包含表面活性剂,优选所述表面活性剂为聚山梨醇酯80。在另一个实施方案中,本发明公开了包含赋形剂的抗体制剂,其中赋形剂包含盐,更优选所述盐是氯化钠。任何上述本发明实施方案中,双缓冲剂体系的ph为约5至约7,更优选双缓冲剂体系的ph为约5.2至约6.0。任何上述本发明实施方案中,抗体在制剂中以至少20mg/ml的浓度存在,更优选至少50mg/ml并且进一步更优选至少100mg/ml。任何上述本发明实施方案中,制剂中的抗体是治疗性抗体。任何上述实施方案中,制剂中的抗体选自抗-tnfα抗体、抗-il-6r抗体、抗-her2抗体,更优选选自阿达木单抗、托珠单抗或曲妥珠单抗。在一个实施方案中,本发明公开了治疗性抗体的水性药物制剂,其包含双缓冲剂体系,其中双缓冲剂体系中的各缓冲剂选自磷酸盐、谷氨酸盐、天冬氨酸盐和琥珀酸盐,并且其中所述制剂是稳定的并保持其生物活性。在另一个实施方案中,本发明公开了用于治疗性抗体的水性药物制剂,其包含双缓冲剂体系,其中双缓冲剂体系中的各缓冲剂选自磷酸盐、谷氨酸盐、天冬氨酸盐和琥珀酸盐,并且其中制剂于2-8℃稳定至少2年、或于25℃下稳定至少3个月、或于约40℃下稳定至少2周、或于约50℃下稳定至少1周,并且所述制剂抑制抗体组合物单体含量的减少。本发明的另一个实施方案公开了包含治疗性抗体和双缓冲剂体系的水性药物制剂,其中双缓冲剂体系中的各缓冲剂选自磷酸盐、谷氨酸盐、天冬氨酸盐和琥珀酸盐,并且其中制剂于2-8℃稳定至少2年、或于25℃下稳定至少3个月、或于约40℃下稳定至少2周、或于约50℃下稳定至少1周,并且所述制剂抑制抗体组合物主峰含量的减少。在一个实施方案中,本发明公开了包含治疗性抗体和双缓冲剂体系的水性药物制剂,其中双缓冲剂体系中的各缓冲剂选自磷酸盐、谷氨酸盐、天冬氨酸盐和琥珀酸盐,并且与单缓冲剂体系相比,所述双缓冲剂体系中治疗性抗体的百分比回收率增加。在又一个实施方案中,本发明公开了包含磷酸盐-谷氨酸盐双缓冲剂体系的阿达木单抗(adalimumab)的水性药物制剂,其中所述制剂于25℃下稳定3个月并保持其生物学活性。在一个实施方案中,本发明公开了阿达木单抗的水性药物制剂,其包含选自磷酸盐-谷氨酸盐缓冲剂或琥珀酸盐-谷氨酸盐缓冲剂的双缓冲剂体系,其中所述制剂于25℃下稳定3个月、或于37℃下稳定4周、或于40℃下稳定4周、或于50℃下稳定2周,并且其中单体含量百分比不小于90%,更优选不小于98%。在另一个实施方案中,本发明公开了包含双缓冲剂体系的阿达木单抗的水性药物制剂,所述双缓冲剂体系选自磷酸盐-谷氨酸盐缓冲剂或琥珀酸盐-谷氨酸盐缓冲剂,其中所述制剂于25℃下稳定3个月、或于37℃下稳定4周、或于40℃下稳定4周、或于50℃下稳定2周,并且其中抗体组合物单体含量的减少小于7.5%,更优选小于2.5%。在另一个实施方案中,本发明公开了包含双缓冲剂体系的阿达木单抗的水性药物制剂,所述双缓冲剂体系选自磷酸盐-谷氨酸盐缓冲剂或琥珀酸盐-谷氨酸盐缓冲剂,其中所述制剂于25℃下稳定3个月、或于37℃下稳定4周、或于40℃下稳定4周、或于50℃下稳定2周,并且其中抗体组合物单体含量减少的百分比不大于10%,更优选不大于2.5%。在另一个实施方案中,本发明公开了包含磷酸盐-谷氨酸双缓冲剂体系的阿达木单抗的水性药物制剂,其中所述制剂甚至经历多次冻融循环后也是稳定的。所述制剂在三次冻融循环和/或五次冻融循环后也是稳定的。本文中阿达木单抗的浓度为约50mg/ml至约100mg/ml。本发明的一个实施方案公开了包含双缓冲剂体系的阿达木单抗的水性药物制剂,所述双缓冲剂体系选自磷酸盐-谷氨酸盐缓冲剂或琥珀酸盐-谷氨酸盐缓冲剂,其中所述制剂于25℃下稳定3个月、或于37℃下稳定4周、或于40℃下稳定4周、或于50℃下稳定2周,并且其中抗体组合物主峰的百分比大于35%,且优选大于65%。本发明的另一个实施方案公开了包含双缓冲剂体系的阿达木单抗的水性药物制剂,所述双缓冲剂体系选自磷酸盐-谷氨酸盐缓冲剂或琥珀酸盐-谷氨酸盐缓冲剂,其中所述制剂于25℃下稳定3个月、或于37℃下稳定4周、或于40℃下稳定4周、或于50℃下稳定2周,并且其中抗体组合物主峰的减少约在10-40%的范围内。本发明的一个实施方案公开了包含双缓冲剂体系的阿达木单抗的水性药物制剂,所述双缓冲剂体系选自磷酸盐-谷氨酸盐缓冲剂或琥珀酸盐-谷氨酸盐缓冲剂,其中所述制剂于25℃下稳定3个月、或于37℃下稳定4周、或于40℃下稳定4周、或于50℃下稳定2周,并且其中抗体组合物主峰减少的百分比在约15-55%的范围内。另一个实施方案公开了包含琥珀酸盐-天冬氨酸盐双缓冲剂体系的托珠单抗(tocilizumab)的水性药物制剂,其中制剂于40℃下稳定2周,并且其中抗体组合物的单体含量不小于95%。本发明另一个实施方案公开了包含琥珀酸盐-天冬氨酸盐双缓冲剂体系的托珠单抗的水性药物制剂,其中所述制剂于40℃下稳定2周,并且其中所述抗体组合物单体含量的减少不超过2.5%。本发明另一个实施方案公开了包含琥珀酸盐-天冬氨酸盐双缓冲剂体系的托珠单抗的水性药物制剂,其中所述制剂于40℃下稳定2周,并且其中所述抗体组合物单体含量减少的百分比不超过2.5%。本发明另一个实施方案公开了包含琥珀酸盐-天冬氨酸盐双缓冲剂体系的托珠单抗的水性药物制剂,其中所述制剂于40℃下稳定2周,并且其中抗体组合物的主峰含量不小于60%。本发明另一个实施方案公开了包含琥珀酸盐-天冬氨酸盐双缓冲剂体系的托珠单抗的水性药物制剂,其中所述制剂于40℃下稳定2周,并且其中主峰含量的减少不超过5%。本发明另一个实施方案公开了包含琥珀酸盐-天冬氨酸盐双缓冲剂体系的托珠单抗的水性药物制剂,其中所述制剂于40℃下稳定2周,并且其中抗体组合物主峰含量减少的百分比不超过10%。本发明另一个实施方案公开了包含双缓冲剂体系的曲妥珠单抗(trastuzumab)的水性药物制剂,所述双缓冲剂体系选自磷酸盐-谷氨酸盐缓冲剂或琥珀酸盐-谷氨酸盐缓冲剂,并且所述制剂于37℃下稳定2周或于50℃稳定1周,并且其中抗体组合物的单体含量不小于95%。本发明另一个实施方案公开了包含双缓冲剂体系的曲妥珠单抗的水性药物制剂,所述双缓冲剂体系选自磷酸盐-谷氨酸盐缓冲剂或琥珀酸盐-谷氨酸盐缓冲剂,并且所述制剂于37℃下稳定2周或于50℃稳定1周,并且其中抗体组合物单体含量的减少不超过5.0%。本发明另一个实施方案公开了包含双缓冲剂体系的曲妥珠单抗的水性药物制剂,所述双缓冲剂体系选自磷酸盐-谷氨酸盐缓冲剂或琥珀酸盐-谷氨酸盐缓冲剂,其中所述制剂于37℃下稳定2周或于50℃稳定1周,并能抑制抗体组合物单体含量的减少,其中单体含量减少的百分比不超过5.0%。本发明另一个实施方案公开了包含双缓冲剂体系的曲妥珠单抗的水性药物制剂,所述双缓冲剂体系选自磷酸盐-谷氨酸盐缓冲剂或琥珀酸盐-谷氨酸盐缓冲剂,其中最终双缓冲剂制剂中百分比回收率大于50%。定义本文所用的术语“抗体”涵盖完整抗体和其任何抗原结合片段(即“抗原结合部分”)或单链或融合蛋白。“抗体”是指包含通过二硫键相互连接的至少两条重链(h)和两条轻链(l)的糖蛋白,或其抗原结合部分。术语“稳定”制剂是指制剂,其中在所述制剂中的抗体在储存后保持其物理稳定性和/或化学稳定性和/或生物活性。稳定性研究提供了在不同环境因素影响下抗体质量的证据。ich的“q1a:stabilitytestingofnewdrugsubstancesandproducts”指出,来自加速稳定性研究的数据可用于评估高于或低于标签储存条件的短期偏移的影响,所述短期偏移可能发生在抗体运送期间。本文所用的术语“冻融循环”描述了将药物物质或药物产品冷冻至较低的温度如-50℃或甚至更低的温度如-80℃,并随后在室温下融化的过程。各种分析方法可用于测量药物制剂中抗体的物理和化学降解。如果抗体在颜色和/或透明度的视觉检查、或者在紫外光散射下、或通过尺寸排阻色谱测量,基本没有显示出聚集、沉淀和/或变性的迹象,则抗体在药物制剂中“保持其物理稳定性”。当抗体显示出没有或最少产物变体形成时,则抗体在药物制剂中“保持其化学稳定性”,所述产物变体可能包括由于目标抗体的化学修饰(例如脱氨基、氧化等)而导致的变体。可使用如离子交换色谱和疏水离子色谱的分析方法研究化学产品变体。本文所用的术语“单体”描述了由两条轻链和两条重链组成的抗体。通常通过大小排阻色谱法(sec)分析抗体组合物的单体含量。根据sec的分离原理,大分子或具有高分子量(hmw)的分子首先洗脱,接着是较小或重量较低的分子。在抗体组合物的典型sec谱中,可能包括二聚体、多聚体等的聚集体首先洗脱,接着是单体,而截短的抗体变体或降解物可能最后洗脱。在某些情况下,聚集峰或降解峰可能不会以基线分离峰形式洗脱,而是以肩峰或异常宽峰出现。为了维持抗体的适当活性,特别是治疗性抗体的适当活性,最好能减少聚集体或降解产物的形成从而将单体含量控制至目标值。在稳定性研究期间的不同时间点测量的抑制聚集体和降解物含量形成的能力,可以表明候选制剂对目标抗体的适合性。来自tosch的tsk-gelg3000swxl(7.8mmx30cm)色谱柱可用于水性hplc从而完成sec。这里使用的术语“主峰”是指在阳离子交换色谱过程中大量洗脱的峰(主要峰)。在阳离子交换色谱过程中,比主峰更早洗脱的峰,因其相比主峰的电荷更为酸性被称为酸性变体峰。在阳离子交换色谱过程中,比主峰更晚洗脱的峰,因其相比主峰的电荷更为碱性被称为碱性变体峰。主峰的产物可以通过离子交换色谱(iec)测定。iec包含两种模式,阳离子交换色谱和阴离子交换色谱。带正电的分子结合阴离子交换树脂,带负电的分子结合阳离子交换树脂。在典型的抗体组合物阳离子交换层析谱中,首先洗脱酸性变体,然后洗脱主峰,最后洗脱碱性变体。酸性变体是抗体修饰的结果,例如天冬酰胺残基的脱酰胺。碱性变体是c-末端赖氨酸残基不完全去除的结果。通常,在抗体中,重链和轻链的c末端都存在赖氨酸残基。在重链和轻链中都含有赖氨酸的抗体分子被称为k2变体,在重链和轻链中任一个含有赖氨酸残基的抗体分子被称为k1变体,而都没有的抗体分子被称为k0变体。羧肽酶b(cp-b酶)作用于位于k2和k1变体上的c-末端赖氨酸残基,从而将它们转化为k0分子。根据情况,可以对羧肽酶b(cp-b)酶消化的样品进行iec分析。在典型的稳定性研究中,稳定的制剂在研究期间预期会减少电荷变体(酸性和碱性变体)的形成,从而使任何主峰含量的减少达到最小化。如果抗体具有可实现其预期目的的生物学功能,则抗体在药物制剂中“保持其生物活性”。例如,抗体的生物活性可通过基于细胞的测定来确定,例如抗原结合/中和测定;如果是抗-tnf抗体,可通过tnfα细胞毒性中和测定来确定抗体的生物活性。术语“百分比回收率”是指在最终制剂缓冲剂中获得的抗体浓度与制剂步骤之前的过程缓冲剂中抗体浓度的比例,所述制剂步骤之前的过程缓冲剂例如最后下游过程的洗脱缓冲剂。抗体的高浓度制剂是指制剂,其使得能够使用等于或低于标准治疗制剂的体积,将较高剂量施用于受试者。药学上可接受的赋形剂是指可能有助于制剂中抗体稳定性的添加剂或载体。赋形剂可包括稳定剂和张力调节剂。稳定剂和张力调节剂的实例包括但不限于糖、氨基酸、多元醇、盐或表面活性剂,以及它们的衍生物和组合。糖和多元醇可指单糖、二糖和多糖。糖的实例包括但不限于蔗糖、葡萄糖、右旋糖等。另外,多元醇是指含有多个羟基基团的醇。多元醇的实例包括但不限于甘露糖醇、山梨糖醇等。表面活性剂是指用于保护蛋白质制剂免受各种胁迫条件如搅拌、剪切、暴露于高温等的药学上可接受的赋形剂。合适的表面活性剂包括但不限于聚氧乙烯山梨糖醇酐脂肪酸酯类如吐温20tm或吐温80tm、聚氧乙烯-聚氧丙烯共聚物(例如泊洛沙姆、pluronic)、十二烷基硫酸钠(sds)等或其组合。盐用作张力调节剂,盐的实例包括但不限于氯化钠、氯化钾、氯化镁、精氨酸盐酸盐、硫氰酸钠、硫氰酸铵、硫酸铵、氯化铵、氯化钙、氯化锌和/或乙酸钠。一种或多种氨基酸也可以是抗体制剂的一部分,并可选自碱性氨基酸或疏水性氨基酸或其组合。碱性氨基酸可以选自精氨酸、赖氨酸、组氨酸及其盐或其衍生物,而疏水性氨基酸可以选自甘氨酸、丙氨酸、缬氨酸、亮氨酸、苯丙氨酸、甲硫氨酸、色氨酸和其盐或衍生物。参考以下实施例更全面地描述本发明的某些具体方面和实施方案。然而,这些实例不应以任何方式被解释为限制本发明的范围。实施例为了获得用于抗体的稳定水性制剂,作为实验设计的一部分,评估了本发明公开的各种双缓冲剂。为一系列治疗性抗体评估了不同的双缓冲剂。稳定的制剂可以进一步包含药学上可接受的赋形剂。实时和加速条件下评估双缓冲剂体系中抗体制剂的稳定性。通过分析测定任何形式的化学降解和物理降解来研究抗体在双缓冲剂制剂中的稳定性。这种双缓冲剂体系中的抗体制剂特别有利于高浓度抗体。实施例1:单缓冲剂体系vs.双缓冲剂体系在单缓冲剂体系和双缓冲剂体系中配制50mg/ml的阿达木单抗(a-mab)。单缓冲剂体系和双缓冲剂体系的细节如表1所示。表1制剂组分最终ph值20mm谷氨酸5.2019.20mm磷酸盐缓冲液5.2323mm磷酸盐-谷氨酸盐缓冲液5.2520mm磷酸盐-柠檬酸盐缓冲液5.21上述所有制剂还包含终浓度0.1%的聚山梨醇酯80。上述阿达木单抗制剂的稳定性于37℃进行4周评估,然后通过大小排阻色谱法分析单体含量,并使用离子交换色谱法测定主峰含量,结果见表2和表3。在表中t0表示起始时间点的单体/主峰含量。另外,如图1所示观察了制剂的渗透压变化。表2nd-未检测到表3从表2和表3中可注意到,与在单缓冲剂体系中的a-mab(即磷酸盐缓冲剂或谷氨酸缓冲剂)以及其他双缓冲剂体系(即柠檬酸盐和磷酸盐双缓冲剂体系)中的a-mab相比,在磷酸盐谷氨酸盐缓冲剂中配制的a-mab中单体含量以及主峰含量的降低是最小的。图1表示在表1中公开的制剂中a-mab在37℃和t0和t4周的渗透压迁移。实施例2:阿达木单抗在不同双缓冲剂和赋形剂中的制剂如表4所示,将50mg/ml阿达木单抗配制成两种不同双缓冲剂组合的制剂,含有不同浓度和不同组合的赋形剂。此外,将相同浓度的阿达木单抗配制在柠檬酸盐-磷酸盐双缓冲剂中作为对照。表4上述阿达木单抗制剂的稳定性于50℃下评估2周,f2和f4的稳定性于25℃下评估3个月。此外,f2的稳定性于37℃下评估4周。此后通过大小排阻色谱法分析该制剂中的单体含量,并使用离子交换色谱法分析主峰含量,结果在表5-11示出。表中的t0表示在起始时间点的单体/主峰含量。图2显示了于50℃储存制剂f1-f5,在t0、t1(第1周)和t2(第2周)的高分子量物质(hmws)/聚集物含量的百分比(%)。图3显示了于50℃储存制剂f1-f5,在1周和2周时的单体损失百分比(%)。图4显示了于50℃储存制剂f1-f5,在0w和2w(2周)时的碱性变体百分比(%)。图5显示了于50℃储存制剂f1-f5,在t0和t1w(1周)时的光散射数据。表5表6表7表8表9表10表11此外,通过使用深入冷冻器将所述样品冷冻至-80℃并在室温下解冻,将样品f1-f5进行多次冻融循环。将冻融循环重复五次,然后使样品经sec和iec分别检查冻融循环对50mg/ml阿达木单抗的单体含量和主峰的影响,结果示于表12和表13。表12x表示冻融循环次数表13x表示冻融循环次数将50mg/ml阿达木单抗配制在f6和f7缓冲剂中,其组成列于表14。表14上述f6和f7中的阿达木单抗制剂的稳定性于40℃下评估4周。于25℃下储存3个月的f1、f6和f7样品也使用tnf-α细胞毒性中和测定的标准测定程序进行其生物活性评估,所述测定使用表达tnf受体的l929细胞。样品平均相对效力的计算结果见表15。表15此后通过大小排阻色谱法分析该制剂的单体含量,并使用离子交换色谱法分析该制剂主峰含量。结果分别在表16和17示出。表14中为尚未用羧肽酶-b处理过的样品的数据。表16表17从上述结果可以明显看出,即使在加速稳定条件下,配制在双缓冲剂体系的50mg/ml阿达木单抗也表现出稳定性,所述双缓冲剂体系如磷酸盐-谷氨酸盐缓冲剂和琥珀酸盐-谷氨酸盐缓冲剂。实施例3:高浓度抗体制剂将100mg/ml阿达木单抗配制在20mm磷酸盐-谷氨酸盐缓冲剂体系中,并进一步包含表18中所示的其他药学上可接受的赋形剂。此外,药学上可接受的赋形剂以如下浓度/浓度范围添加,如精氨酸的浓度范围约为40至120mm;甘氨酸浓度约为50mm,多元醇浓度为5-10mg/ml,氯化钠浓度为5-10mm。在该实验中使用100mg/ml阿达木单抗的批准制剂作为对照。表18上述阿达木单抗制剂的稳定性于40℃下评估4周。此后通过大小排阻色谱法分析制剂中的单体含量,并使用离子交换色谱法分析主峰含量,结果如表17和18所示。表中t0表示起始时间点处的单体/主峰含量。表17为尚未用羧肽酶-b处理的样品的数据。通过使用深入冷冻器将f8、f9和f11样品冷冻至-80℃并在室温下解冻,将所述样品进一步进行多次冻融循环。重复冻融循环五次,然后通过目测检查样品的颗粒物质,结果如表19所示。此外,将样品进行sec以检查冻融循环对100mg/ml阿达木单抗单体含量的影响,结果如表20所示。表19x表示冻融循环次数表20x表示冻融循环次数表21表22从上述结果可以明显看出,与100mg/ml阿达木单抗的经批准制剂相比,配制在双缓冲剂体系例如磷酸盐-谷氨酸盐缓冲剂中的100mg/ml阿达木单抗在加速条件下表现出更好的稳定性。实施例4:在双缓冲剂体系中配制的其他抗体将180mg/ml托珠单抗(tocilizumab,toc-mab)配制在如下表23所示的包含琥珀酸盐-天冬氨酸盐缓冲剂体系的双缓冲剂体系中。在该实验中使用180mg/ml托珠单抗的经批准制剂作为对照,所述180mg/ml托珠单抗的经批准制剂在组氨酸缓冲液中配制。表23制剂id制剂成分toc-(对照)180mg/mltoc-mab,20mml-组氨酸l-组氨酸单氢化物一水合物toc-1180mg/mltoc-mab,20mm琥珀酸盐-天冬氨酸盐缓冲液上述托珠单抗制剂于40℃下储存2周。此后通过大小排阻色谱法分析制剂中的单体含量,并使用离子交换色谱法分析主峰含量,结果如表24和25所示。表中的t0代表起始时间点处的单体/主峰含量。表24表25从以上结果可以明显看出,与在组氨酸缓冲剂中配制的托珠单抗相比,配制在双缓冲剂体系如琥珀酸盐-天冬氨酸盐中的180mg/ml托珠单抗在加速条件下与其稳定性相当。此外,作为评估不同治疗性抗体的双缓冲剂体系的一部分,将21mg/ml曲妥珠单抗(t-mab)配制在包含双缓冲剂体系中,所述双缓冲剂体系如磷酸盐-谷氨酸盐缓冲剂和琥珀酸盐-谷氨酸盐缓冲剂,其进一步包含如下表26所示的药学上可接受的赋形剂。此外,药学上可接受的赋形剂以下述浓度范围添加在曲妥珠单抗中,所述赋形剂为浓度约150mm、更具体为200mm的海藻糖;浓度为5mm的甲硫氨酸;浓度约为25mm的精氨酸;浓度范围为1.2-2%的蔗糖和山梨糖醇和浓度0.04mg/ml聚山梨醇酯20。在双缓冲剂体系中配制曲妥珠单抗之前,已经进行了缓冲剂交换步骤,从而将下游过程获得的不同缓冲剂中的曲妥珠单抗药物转移至所述双缓冲剂,并计算并于表27示出其回收率。表26表27制剂id回收率t-mab对照49.6t-mab-159.9t-mab-273.9t-mab-362.8t-mab-451.1t-mab-565.8通过将上述曲妥珠单抗制剂于37℃保持2周和于50℃保持1周,对所述样品进行加速稳定性研究。随后通过大小排阻法分析制剂中的单体含量,结果如表28所示。表中的t0代表起始时间点处的单体/主峰含量。表28当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1