自然铜浸出液在培养成骨细胞增殖与成熟矿化治疗中的用途的制作方法
本发明涉及一种自然铜thiobacillusferrooxidansby3-1浸出液在培养成骨细胞增殖与成熟矿化治疗中的用途,属于中医药领域。
背景技术:
骨质疏松症是一种全身性和系统性的骨骼疾病,由于骨骼代谢动态平衡受到破坏,骨形成小于骨吸收而引起。骨骼代谢过程需要许多功能细胞的维持,以保持骨骼的动态平衡,其中破骨细胞和成骨细胞是这个过程中主要的功能细胞。成骨细胞在骨骼形成过程中分泌钙盐和骨基质,以形成新的骨骼,破骨细胞则在骨骼形成过程中分泌酸性物质,扮演骨骼吸收的角色。
在长期临床应用过程中发现,中医骨科用药自然铜促进骨折愈合功效显著,然而目前使用的用经典方法炮制的自然铜在水中溶解度小,生物利用度低,给临床药用带来了很大问题,本专利采用了thiobacillusferrooxidansby3-1对自然铜进行了浸出,增加了自然铜中有效元素的浸出。本专利通过自然铜生物浸出的方法制得的自然铜生物浸出液在促进成骨细胞增殖与成熟矿化治方面功效显著,其效果远高于用经典方法炮制的自然铜。
技术实现要素:
本发明的目的在于提供一种自然铜浸出液的新用途,具体涉及自然铜浸出液在制备促进成骨细胞增殖与成熟矿化药物中的应用,所述自然铜浸出液是自然铜thiobacillusferrooxidansby3-1浸出液。
本专利采用了thiobacillusferrooxidansby3-1对自然铜进行了浸出,增加了自然铜中有效元素的浸出。碱性磷酸酶作为成骨细胞成熟与矿化的标志指标(杨霞etal.2018),是普遍存在于细胞膜上的一种糖蛋白,存在四种异构体,含有2个zn+和1个mg2+结合位点,能水解磷脂,为骨骼细胞矿化形成骨骼提供物质基础。实验以alp活性作为检测指标,测定了自然铜thiobacillusferrooxidansby3-1浸出液对成骨细胞alp活性的影响。实验结果表明自然铜thiobacillusferrooxidansby3-1浸出液处理后alp活性显著提高。
[1]杨霞,张超,王桂荣,李宝玲.绝经后2型糖尿病患者钙调激素、骨转换标志物与骨密度的相关性分析[j].宁夏医学杂志,2018(09):772-775.
附图说明
下面结合附图对本发明的具体实施方式作进一步详细描述。
图1为自然铜thiobacillusferrooxidansby3-1浸出液对成骨细胞alp活性影响。
中英文对照说明
1、生物材料
氧化亚铁硫杆菌(thiobacillusferrooxidansby3-1)于2004年7月23日保藏于中国典型培养物保藏中心,保藏编号:cctccno:m204057,保藏名称:氧化亚铁硫杆菌(thiobacillusferrooxidansby3-1)。
具体实施方式
以下提供具体实施例以实现本发明所述的自然铜thiobacillusferrooxidansby3-1浸出液在制备成骨细胞增殖与成熟矿化治疗药物中的应用,但不限于这些实施例。
实施例一:自然铜thiobacillusferrooxidansby3-1浸出液制备
称取0.5g自然铜,磨碎过200目筛,得粉末。于干净的250ml锥形瓶中,加入灭菌后的9k无铁液体培养基100ml,5m硫酸调ph至1.60,待ph稳定后,接种体积分数为10%氧化亚铁硫杆菌,空白对照不接种菌液。称取质量后,在25℃、130r/min浸出15天。实验过程中采用5m硫酸调节ph值,用蒸馏水补充所蒸发的水分。摇瓶浸出15天后停止,静置过夜,收集上清液,调节溶液ph至7左右,过0.22m滤膜除菌后,备用。
实施例二:对成骨细胞增殖的影响
①大鼠原代颅骨成骨细胞培养
取出生48h以内sd大鼠乳鼠10只,处死后75%酒精浸泡消毒10min,取颅骨,0.25%胰蛋白酶和0.1%ⅱ型胶原酶消化分离大鼠颅骨成骨细胞,大鼠原代颅骨成骨细胞(成骨细胞)生长融合至70%-80%以上时,0.25%胰蛋白酶消化传代,传代培养至第三代时进行后续实验。
②自然铜thiobacillusferrooxidansby3-1浸出液的梯度稀释
实验对煅烧自然铜和天然自然铜这两种类型自然铜生物浸出进行分组,设置了如下组:
0k培养液+thiobacillusferrooxidansby3-1+煅烧自然铜(0k+a.f+a-pyrite);
0k培养液+煅烧自然铜(0k+a-pyrite);
0k培养液+thiobacillusferrooxidansby3-1+天然自然铜(0k+a.f+n-pyrite);
0k培养液+天然自然铜(0k+n-pyrite)。
分别按照上述分组进行浸出:
0k+a.f+a-pyrite:培养液中含有0k培养液、10%thiobacillusferrooxidansby3-1菌液接种量和5g/l煅烧自然铜;
0k+a-pyrite:培养液中含有0k培养液和5g/l的煅烧自然铜;
0k+a.f+n-pyrite:培养液中含有0k培养液、10%thiobacillusferrooxidansby3-1菌液接种量和5g/l的天然自然铜;
0k+n-pyrite处理组:培养液中含有0k培养基和5g/l的天然自然铜;
恒温摇床250c150rpm培养20d后,收集各组浸出液,300rpm离心10min后,取上清液弃掉沉淀,8000rpm离心10min,保存上清液,原子吸收法测定浸出液中fe、cu、ca、zn、se元素含量。将8000rpm离心获得各组自然铜thiobacillusferrooxidansby3-1浸出液,用1molnaoh和2mol的乙二胺四乙酸二钠(ethylenediaminetetraaceticacid,na2edta)调节各组自然铜thiobacillusferrooxidansby3-1浸出液ph为7.0,然后用0.22m的滤膜过滤后40℃保存。
表1自然铜thiobacillusferrooxidansby3-1浸出的分组处理
不同分组的自然铜thiobacillusferrooxidansby3-1生物浸出液使用α-mem分别按照以下梯度稀释,即1:1、1:10、1:100、1:1000、1:10000、1:100000、1:1000000。作为阴性对照(9k、9k+a.f和0k)的培养液也应用α-mem按照同样的梯度稀释。
③成骨性诱导培养
由于实验筛选出的最佳的自然铜thiobacillusferrooxidansby3-1浸出液类别和浓度分别为:0k+a.f+n-pyrite(1:100)和0k+a.f+a-pyrite(1:10000),所以下面的实验研究采用这2种浓度和类型的自然铜thiobacillusferrooxidansby3-1浸出液进行。
在第三代成骨细胞培养至70-80%融合时进行成骨性诱导培养,即按分组分别换含有0k+a.f+n-pyrite(1:100)、0k+a.f+a-pyrite(1:10000)自然铜thiobacillusferrooxidansby3-1浸出液和雌二醇(1.0×10-8mol/l,作为阳性对照药物)的成骨性诱导液(含50mg/l磷酸化抗坏血酸、10mmol/lβ-甘油磷酸钠和1×10-8的地塞米松的α-mem培养液)进行成骨细胞的成熟矿化分析。
④对成骨细胞alp活性的影响
第3代成骨细胞接种到24孔细胞培养板中,成骨性诱导培养至9d测定alp活性,成骨细胞培养至第3代时接种到96孔板中,细胞浓度为4000cell/ml,待成骨细胞生长达到70-80%融合时,换用含有不同类型、不同梯度稀释的自然铜thiobacillusferrooxidansby3-1浸出液对成骨细胞进行成骨性的诱导培养(培养液中含有50mg/l磷酸化抗坏血酸、10mmol/lβ-甘油磷酸钠和1×10-8的地塞米松),培养至第3、6、9、12d时应用南京建成生物工程公司的碱性磷酸酶活性测定试剂盒测定碱性磷酸酶(alkalinephosphatase,alp)的活性,详细测定方法按照说明书进行操作,即每孔分别加入等体积缓冲液和基质液后充分摇匀,37℃水浴15min,再加入3倍于基质液体积的显色液,避光摇床震荡5min使其充分混匀显色后,紫外分光光度计507nm处测定od值,依据换算公式计算酶活力,表示方法为每克蛋白/15min。
第3代成骨细胞接种于60mm细胞培养皿中,成骨性诱导培养至8d时进行偶氮偶合法alp组织化学染色。成骨性诱导培养至8d时弃培养液,福尔马林固定30s后,弃掉固定液,pbs轻轻冲洗3次后,加入碱性磷酸酶组织化学染色液,室温静止30min左右,开始出现紫色斑点,显微镜下观察紫色斑点不再增多时,停止染色,弃掉染液,轻轻冲洗。显微镜下照相记录结果,同时使用相机全皿拍照。数据结果分析:照相后采用ipp(image-proplus6.0)灰度分析软件扫描碱性磷酸酶(alkalinephosphatase,alp)染色区域面积,应用公式:培养皿面积×(alp染色区域扫描面积/照片中皿的扫描面积)换算alp染色面积。
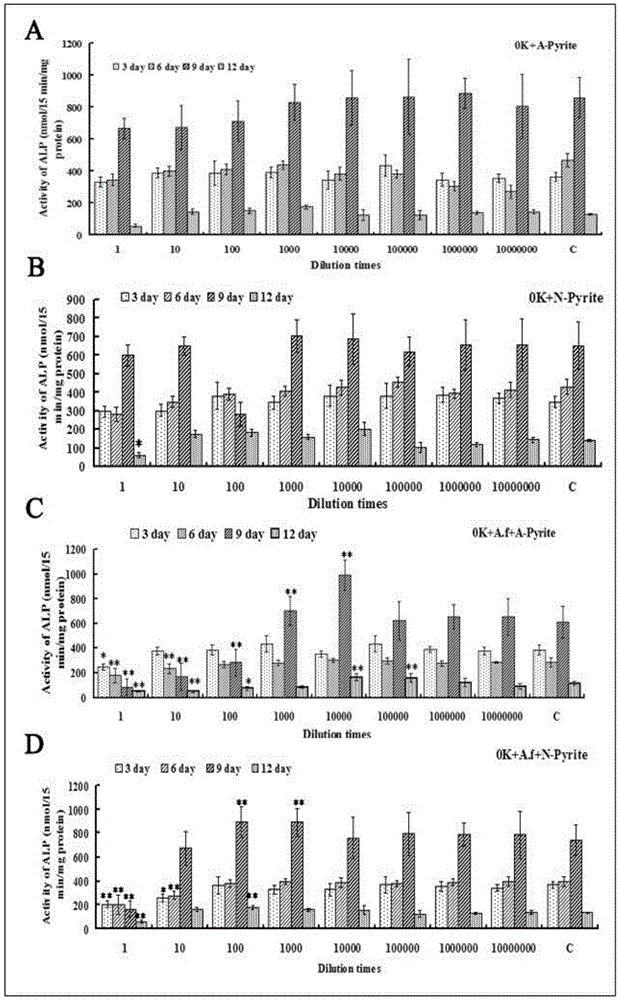
不同处理的自然铜thiobacillusferrooxidansby3-1浸出液对成骨细胞alp活性影响结果显示:
①自然铜thiobacillusferrooxidansby3-1浸出液对成骨细胞alp活性存在种类和浓度的依赖性,高浓度抑制alp活性,中浓度提高alp活性,如图1。
②图1a所示与对照组比较,0k+a-pyrite浸出液各稀释组对成骨细胞alp活性无显著性影响(p>0.05)。
③如图1b所示,与对照组比较,0k+n-pyrite1:1稀释组处理成骨细胞12d时显著抑制alp活性(p<0.05),其余各稀释倍数对成骨细胞alp活性无显著的影响(p>0.05)。
④如图1c所示,与对照组比较,0k+a.f+a-pyrite组的1:1稀释组成骨细胞alp活性在3、6、9和12d均显著被抑制(p<0.01或者p<0.05),0k+a.f+a-pyrite组的1:10稀释组成骨细胞alp活性在6、9和12d均显著被抑制(p<0.01或者p<0.05),0k+a.f+a-pyrite组的1:100稀释组成骨细胞alp活性在9和12d均显著被抑制(p<0.01或者p<0.05),1:1000和1:10000稀释组在处理成骨细胞第9d时显著提高成骨细胞的alp活性(p<0.01),同样,1:10000和1:100000稀释组在第12d显著提高成骨细胞alp活性(p<0.01)。
⑤如图1d所示0k+a.f+n-pyrite组1:1稀释组成骨细胞alp活性在3、6、9和12d均受到抑制(p<0.01),1:10稀释倍数组成骨细胞在第3和6d时alp活性显著提高(p<0.01),1:100和1:1000稀释组成骨细胞9d时alp活性显著提高(p<0.01),与对照组比较,0k+a.f+n-pyrite浸出液其余稀释倍数对成骨细胞alp活性无显著的影响(p>0.05)。说明自然铜thiobacillusferrooxidansby3-1浸出液对成骨细胞alp活性的影响存在一定种类差异,自然铜经过thiobacillusferrooxidansby3-1浸出处理后促成骨活性显著提高。
⑥图1e为thiobacillusferrooxidansby3-1培养液(9k+a.f)对成骨细胞alp活性的影响:与对照组比较,1:1和1:10稀释倍数组成骨细胞的alp活性在处理3、6、9和12d后均受到抑制(p<0.01),1:100稀释组成骨细胞第9d时极显著抑制成骨细胞alp活性(p<0.01),1:1000稀释组成骨细胞alp活性9d时显著提高(p<0.05),与对照组比较,9k+a.f培养液其余稀释倍数对成骨细胞alp活性无显著的影响(p>0.05)。
⑦图1f为9k培养液对成骨细胞alp活性的影响结果:与对照组比较,1:1和1:10稀释倍数组处理成骨细胞3、6、9和12d后均抑制alp活性(p<0.01),1:100稀释倍数组成骨细胞alp活性在第6和9d时受到极显著抑制(p<0.01),其余稀释倍数组对成骨细胞alp活性无显著的影响(p>0.05)。
⑧图1g为0k培养液对成骨细胞alp活性的影响结果:与对照组比较,1:1稀释倍数组成骨细胞alp活性在第3和9d时受到抑制(p<0.01或p<0.05),其余稀释倍数对成骨细胞alp活性无显著的影响(p>0.05)。实验结果显示,自然铜thiobacillusferrooxidansby3-1浸出液对成骨细胞alp活性影响存在一定种类差异和浓度的依赖性。
实验将两种不同类型自然铜分别使用thiobacillusferrooxidansby3-1进行浸出,应用0k、9k和9k+a.f三种类型的培养基作为空白对照,通过mtt法筛选自然铜thiobacillusferrooxidansby3-1浸出液作用于成骨细胞最佳浓度,实验结果表明自然铜的thiobacillusferrooxidansby3-1浸出液对成骨细胞增殖存在浓度的依赖性,高浓度thiobacillusferrooxidansby3-1浸出液抑制成骨细胞增殖,中浓度thiobacillusferrooxidansby3-1浸出液促进成骨细胞增殖,低浓度thiobacillusferrooxidansby3-1浸出液对成骨细胞的增殖无显著作用。其次实验分别对各类型自然铜thiobacillusferrooxidansby3-1生物浸出液:0k+a.f+a-pyrite、0k+a-pyrite、0k+a.f+n-pyrite和0k+n-pyrite促进骨形成活性进行了分析,发现thiobacillusferrooxidansby3-1能提高自然铜浸出的生物活性,说明浸出液作用与成骨细胞增殖存在种类差异。
实验进一步对比分析9k培养液组和9k的thiobacillusferrooxidansby3-1培养液组(9k+a.f),发现两种类型均只有高浓度抑制成骨细胞增殖,而其余各稀释倍数组对成骨细胞增殖均无显著影响。同时实验结果对比分析表明thiobacillusferrooxidansby3-1代谢产生物不会影响成骨细胞增殖活性。0k培养液各稀释组对成骨细胞增殖结果分析未发现显著的生物学活性,各组自然铜thiobacillusferrooxidansby3-1浸出促成骨细胞增殖作用,是浸出液的本身生物活性而不是0k培养液的作用。实验以alp活性强弱作为评价自然铜thiobacillusferrooxidansby3-1浸出液调节成骨细胞成熟与矿化的一个标志,检测不同浓度自然铜thiobacillusferrooxidansby3-1浸出液对成骨细胞碱性磷酸酶活性的影响,结果显示thiobacillusferrooxidansby3-1浸出液对成骨细胞alp活性的影响存在浸出种类和浓度的依赖性。实验用9k+a.f、9k和0k对比分析发现只有高浓度抑制成骨细胞alp活性,而其余对alp活性无显著的影响,实验结果说明thiobacillusferrooxidansby3-1代谢产物和0k培养液对提高成骨细胞alp活性无显著影响。其中0k+a.f+a-pyrite(1:10000)和0k+a.f+n-pyrite(1:100)为最佳稀释倍数。同时,为保证系统的准确与可靠性,实验应用了1.010-8mol的雌二醇作为阳性对照药物。
实验进一步验证了自然铜thiobacillusferrooxidansby3-1浸出液最佳药理活性浓度0k+a.f+a-pyrite(1:10000),0k+a.f+n-pyrite(1:100)和雌二醇对成骨细胞矿化能力的影响,结果显示自然铜thiobacillusferrooxidansby3-1浸出液和雌二醇均能增加碱性磷酸酶活性和组织化学染色的克隆面积。钙盐沉积对于骨骼形成极其重要,研究表明低钙饮食会导致钙盐的吸收平衡失调从而导致严重骨量丢失,最终导致骨质疏松症的发生,因此钙盐沉积是检测药物能否促进骨形成的一个重要指标,实验研究发现自然铜thiobacillusferrooxidansby3-1浸出液和雌二醇均能提高体外培养成骨细胞钙化结节的染色面积以及骨钙素的分泌。
综上所述,自然铜thiobacillusferrooxidansby3-1浸出液对体外培养成骨细胞分化成熟具有调控作用。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于治疗与有害细胞增殖相关的疾病的治疗剂的制作方法
- 用于诱导肝细胞增殖的方法以及其应用的制作方法
- 一种天然人体细胞增殖活性促进剂的制备的制作方法
- 淫羊藿黄酮及其有效成分在制备促进神经细胞增殖和分化作用药物中的用途的制作方法
- 治疗具有细胞增殖和血管生成特点的皮肤病的组合物和方法
- 用于治疗特征在于过度增殖皮肤细胞的疾病的人类甲状旁腺激素环状类似物的制作方法
- 用于治疗或预防以异常细胞增殖为特征之疾病的经取代的二苯基茚满酮、茚满和吲哚化 ...的制作方法
- 用于治疗或预防以异常细胞增殖为特征之疾病的经取代的11-苯基-二苯并吖庚因化合物的制作方法
- 一种高纯度、高增殖力、高细胞毒活性的cik细胞的制备方法
- 用于治疗特征在于过度或异常细胞增殖的疾病的2