可降解柔性药物控释装置的制作方法
本公开涉及电子技术领域,尤其涉及一种可降解柔性药物控释装置。
背景技术:
随着科技的不断进步,电子器件不断发展,对电子器件在稳定性能、寿命和功能状态等方面的要求不断提高。因此,在电子器件的设计和制造中,在追求性能的同时,更是追求器件的物理稳定性,这也是现阶段电子垃圾污染严重的原因之一。在某种意义上来说,电子器件越稳定越好,如手机等电子设备中所使用的电子器件。但是对于一些需要植入生物体体内的一些电子器件,如果在电子器件失效后,其物理形态还很稳定,那么对于植入该电子器件的生物体就需要进行二次手术取出,给生物体(尤其是人类)带来了二次伤害。尤其一些不需要长期植入的电子器件,比如神经修复过程电刺激器件、术后治疗的一些药物缓释器件等,如何保证其在使用阶段与人体内部组织贴合好,在失效后可在体内自行降解就显得尤为重要,是当前亟待解决的技术问题。
技术实现要素:
有鉴于此,本公开提出了一种可降解柔性药物控释装置。
根据本公开的一方面,提供了一种可降解柔性药物控释装置,所述装置安装于生物体体表和/或体内,所述装置包括:载药基底、多个承载基片、多个电路控释单元和封盖,
所述载药基底和所述封盖构成多个载药腔,每个载药腔中承载有药物溶液,所述药物溶液中包含有目标药物;
每个承载基片用于承载对应的电路控释单元,悬浮于所述载药腔内的药物溶液中,形成浮岛结构;
每个电路控释单元,用于根据接收到的电磁波控制所在载药腔中目标药物的释放,每个电路控释单元包括能量接收线圈、发热电阻,
所述能量接收线圈,用于在接收到对应于自身共振频率的电磁波时,通过电磁共振产生感应电流,并利用所述感应电流为所在的电路控释单元供电;
所述发热电阻,用于接收所述感应电流,并在所述感应电流的作用下发热,将产生的热量作用于所述药物溶液,以促进所述药物溶液中目标药物的释放。
对于上述装置,在一种可能的实现方式中,每个电路控释单元还包括寄生电容器,
所述寄生电容器与所在电路控释单元中的能量接收线圈连接,用于控制能量接收线圈进行电磁共振的共振频率。
对于上述装置,在一种可能的实现方式中,每个电路控释单元包括第一导线部、第二导线部和绝缘部,所述第一导线部与所述第二导线部连接,
所述第一导线部为环状,构成所述能量接收线圈;
所述第二导线部为可延展形状,构成所述发热电阻;
所述第二导线部中设置有导线分支,所述导线分支位于所述第一导线部的上方或下方、且与所述第一导线部存在重叠部分;
所述绝缘部,位于所述导线分支与所述第一导线部中与所述导线分支重叠的重叠导线之间,实现所述导线分支与所述重叠导线之间的电绝缘;
所述导线分支、所述重叠导线和所述绝缘部,构成所述寄生电容器。
对于上述装置,在一种可能的实现方式中,所述第一导线部和/或所述第二导线部中导线的形状为可延展形状,
其中,所述可延展形状包括:蛇形、s形中的任一种。
对于上述装置,在一种可能的实现方式中,每个载药腔中的承载基片还用于携带所述目标药物。
对于上述装置,在一种可能的实现方式中,所述药物溶液包括多种,不同药物溶液设置于不同的载药腔中,不同药物溶液所在的载药腔中的能量接收线圈的共振频率不同。
对于上述装置,在一种可能的实现方式中,所述能量接收线圈的共振频率处于目标肿瘤细胞的抑制频率范围内,
所述能量接收线圈,还用于在接收到对应于自身共振频率的电磁波时,通过电磁共振抑制所述目标肿瘤细胞的增殖。
对于上述装置,在一种可能的实现方式中,在所述装置被植入所述生物体内时,所述装置能够在所述生物体内降解。
对于上述装置,在一种可能的实现方式中,所述装置的材料包括可降解材料,
其中,所述载药基底、所述承载基片、所述封盖的材料包括柔性可降解材料,所述柔性可降解材料包括聚乳酸、聚乳酸-羟基乙酸共聚、聚乳酸-聚三亚甲基碳酸酯共聚、聚乙烯醇和蚕丝蛋白中至少一种,
所述多个电路控释单元的材料包括铁、镁、锌、钼中至少一种,
绝缘部的材料包括二氧化硅、氧化镁中至少一种。
对于上述装置,在一种可能的实现方式中,承载基片包括基片上部和基片下部,所述基片上部和所述基片下部用于夹持所述电路控释单元。
本公开实施例所提供的可降解柔性药物控释装置包括:载药基底、多个承载基片、多个电路控释单元和封盖,载药基底和封盖构成多个载药腔,每个载药腔中承载有药物溶液,药物溶液中包含有目标药物;每个承载基片用于承载对应的电路控释单元,悬浮于载药腔内的药物溶液中,形成浮岛结构;每个电路控释单元,用于根据接收到的电磁波控制所在载药腔中目标药物的释放,每个电路控释单元包括能量接收线圈、发热电阻,能量接收线圈用于在接收到对应于自身共振频率的电磁波时,通过电磁共振产生感应电流,并利用感应电流为所在的电路控释单元供电;发热电阻用于接收感应电流,并在感应电流的作用下发热,将产生的热量作用于药物溶液,以促进药物溶液中目标药物的释放。可以外部发射不同频率的电磁波控制药物的分阶段释放,以在不同的阶段释放不同的药物,且通过加热促进药物的释放使得药物的扩散范围更广,对生物体的作用效果更好。装置在使用过程中在生物体中的稳定性和可靠性高,装置中药物释放完毕后可以在生物体内降解成对生物体无害的小分子,并随着生物体的新陈代谢排除体外,无需进行取出装置的二次手术,不会为生物体带来额外的创伤。装置的适用范围广,可以根据实际需要在承载不同的药物。且装置的结构简单,有利于实现大规模、批量制造。
根据下面参考附图对示例性实施例的详细说明,本公开的其它特征及方面将变得清楚。
附图说明
包含在说明书中并且构成说明书的一部分的附图与说明书一起示出了本公开的示例性实施例、特征和方面,并且用于解释本公开的原理。
图1、图2示出根据本公开一实施例的可降解柔性药物控释装置的结构示意图。
图3示出根据本公开一实施例的可降解柔性药物控释装置的封盖的结构示意图。
图4示出根据本公开一实施例的可降解柔性药物控释装置的载药基底的结构示意图。
图5示出根据本公开一实施例的可降解柔性药物控释装置的药物控释示意图。
图6示出根据本公开一实施例的可降解柔性药物控释装置的电路控释单元的结构示意图。
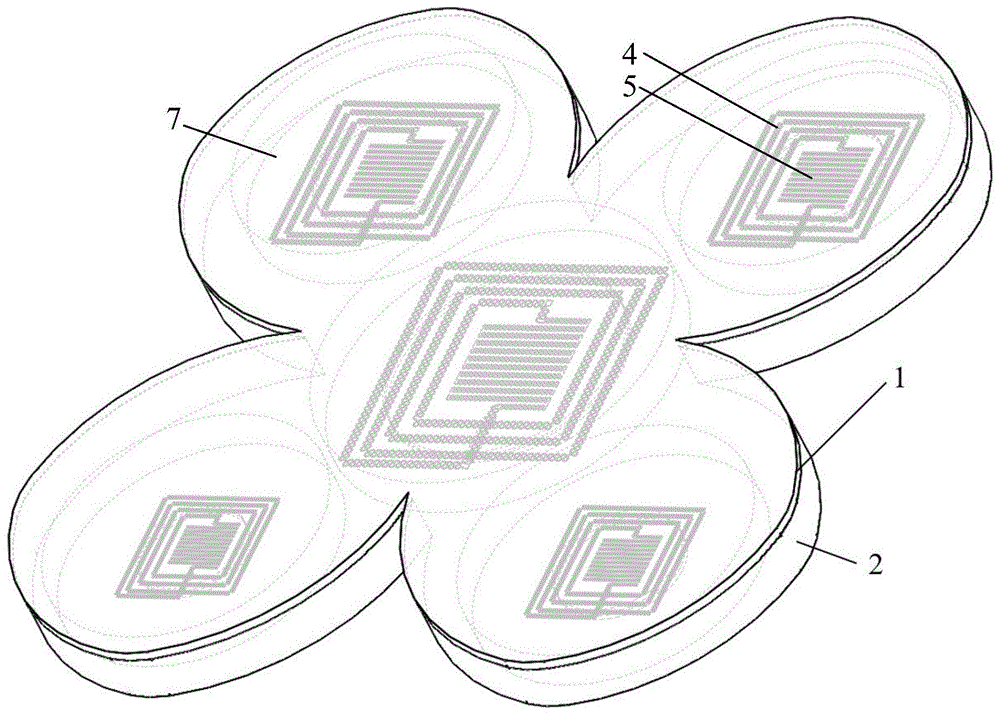
图7示出根据本公开一实施例的可降解柔性药物控释装置的结构示意图。
具体实施方式
以下将参考附图详细说明本公开的各种示例性实施例、特征和方面。附图中相同的附图标记表示功能相同或相似的元件。尽管在附图中示出了实施例的各种方面,但是除非特别指出,不必按比例绘制附图。
在这里专用的词“示例性”意为“用作例子、实施例或说明性”。这里作为“示例性”所说明的任何实施例不必解释为优于或好于其它实施例。
另外,为了更好的说明本公开,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本公开同样可以实施。在一些实例中,对于本领域技术人员熟知的方法、手段、元件和电路未作详细描述,以便于凸显本公开的主旨。
图1、图2示出根据本公开一实施例的可降解柔性药物控释装置的结构示意图。图3示出根据本公开一实施例的可降解柔性药物控释装置的封盖的结构示意图。图4示出根据本公开一实施例的可降解柔性药物控释装置的载药基底的结构示意图。图5示出根据本公开一实施例的可降解柔性药物控释装置的药物控释示意图。如图1-图5所示,装置安装于生物体体表和/或体内,该装置包括:载药基底2、多个承载基片3、多个电路控释单元和封盖1。
载药基底2和封盖1构成多个载药腔7,每个载药腔7中承载有药物溶液,药物溶液中包含有目标药物。每个承载基片3用于承载对应的电路控释单元,悬浮于载药腔7内的药物溶液中,形成浮岛结构。每个电路控释单元,用于根据接收到的电磁波控制所在载药腔中目标药物的释放,每个电路控释单元包括能量接收线圈4、发热电阻5。如图5所示,能量接收线圈4用于在接收到对应于自身共振频率的电磁波(外界能量发射线圈等发射装置发射的)时,通过电磁共振产生感应电流,并利用感应电流为所在的电路控释单元供电。发热电阻5用于接收感应电流,并在感应电流的作用下发热,将产生的热量作用于药物溶液,以促进药物溶液中目标药物的释放。
在本实施例中,可以根据需要对药物溶液中目标药物的含量、成分进行设置。该装置可以应用于人体、动物等生物体中。例如,对于患有脑胶质瘤的患者,可以将该装置植入患者脑部,目标药物可以是莫司汀、洛莫司汀、替莫唑胺、尼莫司汀、紫杉醇等,以对患者进行治疗。本领域技术人员可以根据实际需要对目标药物进行设置,本公开对此不作限制。
在一种可能的实现方式中,药物溶液可以包括多种,不同药物溶液设置于不同的载药腔7中,不同药物溶液所在的载药腔7中的能量接收线圈4的共振频率不同。
在本实施例中,假定装置包含5个载药腔(如图1所示),可以在载药腔中放置五种不同的药物溶液,每个载药腔中能量接收线圈设置不同的共振频率,如将中心位置的能量接收线圈的共振频率设置为60khz、将左上角的能量接收线圈的共振频率设置为120khz、将右上角的能量接收线圈的共振频率设置为180khz、将左下角的能量接收线圈的共振频率设置为240khz、将右下角的能量接收线圈的共振频率设置为300khz。在不同的时间段根据药物释放需求向装置发射不同频率的电磁波,如在植入的第一天发射频率为60khz的电磁波,使得中心位置载药腔中的能量接收线圈共振产生感应电流,并使得中心位置载药腔中的发热电阻发热,产生的热量作用于中心位置载药腔中的药物溶液,促进其中药物的释放。在之后的时间分别发射对应的频率的电磁波,实现其余药物的释放。
在本实施例中,承载基片和其上的电路控释单元悬浮于药物溶液中,形成一个“浮岛”,在装置受外力时,承载基片和电路控释单元在药物溶液的保护下,会极大程度的与外力隔离实现应变隔离,即便装置受外力较大,电路控释单元还可以保持原有形状和功能,保证了装置的稳定性和可靠性。
在本实施例中,发热电阻在发热的过程中不但可以促进药物释放,还能作用于病患的患处,对病患进行治疗。
在本实施例中,发热电阻5发热的功率p和电阻的阻值以及能量接收线圈4的感应电流大小有关,p=i2r。其中,p为发热电阻5发热功率,i为能量接收线圈4所产生的感应电流,r为发热电阻5的阻值。其中,r=ρl/s,其中,ρ为制备发热电阻5的材料的电导率,l为发热电阻5电阻丝的长度,s为对应电阻丝的横截面积。通过调整电阻丝的长度和横截面积可以实现阻值的改变,从而根据需要调节发热电阻的发热功率。
在一种可能的实现方式中,每个电路控释单元还包括寄生电容器8,寄生电容器8与所在电路控释单元中的能量接收线圈4连接,用于控制能量接收线圈4进行电磁共振的共振频率。
本公开实施例所提供的可降解柔性药物控释装置包括:载药基底、多个承载基片、多个电路控释单元和封盖,载药基底和封盖构成多个载药腔,每个载药腔中承载有药物溶液,药物溶液中包含有目标药物;每个承载基片用于承载对应的电路控释单元,悬浮于载药腔内的药物溶液中;每个电路控释单元,用于根据接收到的电磁波控制所在载药腔中目标药物的释放,每个电路控释单元包括能量接收线圈、发热电阻,能量接收线圈用于在接收到对应于自身共振频率的电磁波时,通过电磁共振产生感应电流,并利用感应电流为所在的电路控释单元供电;发热电阻用于接收感应电流,并在感应电流的作用下发热,将产生的热量作用于药物溶液,以促进药物溶液中目标药物的释放。可以外部发射不同频率的电磁波控制药物的分阶段释放,以在不同的阶段释放不同的药物,且通过加热促进药物的释放使得药物的扩散范围更广,对生物体的作用效果更好。装置在使用过程中在生物体中的稳定性和可靠性高,装置中药物释放完毕后可以在生物体内降解成对生物体无害的小分子,并随着生物体的新陈代谢排除体外,无需进行取出装置的二次手术,不会为生物体带来额外的创伤。装置的适用范围广,可以根据实际需要在承载不同的药物。且装置的结构简单,有利于实现大规模、批量制造。
图6示出根据本公开一实施例的可降解柔性药物控释装置的电路控释单元的结构示意图。图7示出根据本公开一实施例的可降解柔性药物控释装置的结构示意图。在一种可能的实现方式中,如图6、图7所示,每个电路控释单元包括第一导线部s1、第二导线部s2和绝缘部6,第一导线部s1与第二导线部s2连接。第一导线部s1为环状,构成能量接收线圈4。第二导线部s2为可延展形状,构成发热电阻5。第二导线部s2中设置有导线分支s2’,导线分支s2’位于第一导线部s1的上方或下方、且与第一导线部s1存在重叠部分。绝缘部6位于导线分支s2’与第一导线部s1中与导线分支s2’重叠的重叠导线s1’之间,实现导线分支s2’与重叠导线s1’之间的电绝缘。导线分支s2’、重叠导线s1’和绝缘部6,构成寄生电容器8。
通过上述方式,可以直接通过刻蚀技术制备出电路控释单元,无需单独制备所需的寄生电容器,简化装置的加工过程,降低装置的制造难度。
在该实现方式中,第二导线部s2的可延展形状可以包括蛇形、s形等可延展的形状,这样可以提高发热电阻的拉伸性能,提高发热电阻的可靠性和稳定性。构成能量接收线圈的第一导线部的环形形状可以是“回”字形、圆环形状等形状。本领域技术人员可以根据实际需要对发热电阻和能量接收线圈的形状进行设置,本公开对此不作限制。
在本实施例中,在能量接收线圈4的作用下电路的共振频率为
在一种可能的实现方式中,还可以在电路控释单元中单独设置寄生电容器,本公开对此不作限制。
在一种可能的实现方式中,如图6所示,第一导线部s1和/或第二导线部s2中导线的形状为可延展形状。其中,可延展形状可以包括:蛇形、s形中的任一种。
在该实现方式中,第一导线部和第二导线部中导线的形状可以是单独的一根导线的形状,将第一导线部和第二导线部的导线设置为可延展形状,在其受力时,为导线通过转动等变化来抵消应变提供了强有力的保证,以达到保护导线的目的,提高了整个装置在使用过程中的稳定性和可靠性。本领域技术人员可以根据实际需要对导线的形状进行设置,本公开对此不作限制。
在一种可能的实现方式中,每个载药腔7中的承载基片3还用于携带目标药物。
在该实现方式中,承载基片可以携带药物。承载基片也可以吸收载药腔内的药物溶液,在吸收载药腔内的药物溶液后,由于发热电阻发热促进承载基片上的药物释放,同时承载基片由于药物扩散使其上的药物浓度降低,由于周围载药腔内的药物浓度较高,形成一定的药物浓度梯度,促进承载基片进一步吸收载药腔的药物,从而形成一个正向的药物释放循环,促进药物释放。
在一种可能的实现方式中,能量接收线圈4的共振频率处于目标肿瘤细胞的抑制频率范围内。能量接收线圈4,还用于在接收到对应于自身共振频率的电磁波时,通过电磁共振抑制目标肿瘤细胞的增殖。
在该实现方式中,不同类的肿瘤细胞在特定频率的电磁波作用下,其生长繁殖会在一定程度上被抑制,可以根据需要调整能量接收线圈4的共振频率,使其在共振时能一定程度上抑制肿瘤细胞的增殖。例如,将共振频率设置在100khz-1mhz范围内。本领域技术人员可以根据肿瘤细胞的实际抑制需要对共振频率进行设置,本公开对此不作限制。
在一种可能的实现方式中,如图2、图7所示,承载基片3可以包括基片上部和基片下部,基片上部和基片下部用于夹持电路控释单元。
在该实现方式中,承载基片可以通过夹持的方式承载电路控释单元,也可以通过包裹等方式实现电路控释单元的承载,本公开对此不作限制。
在一种可能的实现方式中,在装置被植入生物体内时,装置能够在生物体内降解。
在一种可能的实现方式中,装置的材料可以包括可降解材料。其中,载药基底、承载基片、封盖的材料可以包括柔性可降解材料,柔性可降解材料包括聚乳酸(polylacticacid,简称pla)、聚乳酸-羟基乙酸共聚(polylactic-co-glycolicacid,简称plga)、聚乳酸-聚三亚甲基碳酸酯共聚(pla-ptmc)、聚乙烯醇(polyvinylalcohol,vinylalcoholpolymer,简称pva)和蚕丝蛋白中至少一种。多个电路控释单元的材料可以包括铁、镁、锌、钼中至少一种。绝缘部的材料可以包括二氧化硅、氧化镁中至少一种。
在该实现方式中,可以根据装置在生物体中需要保持稳定工作状态的时长,对装置各部件的材料以及尺寸进行选择,本公开对此不作限制。例如,假定装置需在人体中植入放置3个月,以保证药物的正常释放,可以选取pla-ptmc为载药基底、承载基片、封盖的材料,金属锌为电路控释单元的材料,氧化镁为绝缘部的材料,设置相应的尺寸。
在一种可能的实现方式中,装置的厚度可以为1mm-2mm,长度可以为10mm-30mm,宽度可以为10mm-30mm。可以根据降解时间需要、药物溶液的量、生物体植入的部位等具体使用场景的信息对装置的尺寸进行设置,本公开对此不作限制。
在一种可能的实现方式中,装置可以设置为花瓣状等任意形状,本公开对此不作限制。
本公开还提供一种制备上述装置中部分部件的方法,可以先在硬质基底上采用多次沉积薄膜和光刻的工艺,制备完成能量接收线圈4、绝缘部6、发热电阻5,得到电路控释单元,然后通过转印技术转移到承载基片3上。其中,承载基片在制备的过程中,可以先将pla-ptmc(承载基片的制备材料)固化前的溶液与对应的目标药物进行混溶,再对混合后的液体进固化,从而形成带有目标药物的承载基片。
需要说明的是,尽管以上述实施例作为示例介绍了可降解柔性药物控释装置如上,但本领域技术人员能够理解,本公开应不限于此。事实上,用户完全可根据个人喜好和/或实际应用场景灵活设定各部件,只要符合本公开的技术方案即可。
以上已经描述了本公开的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的。本文中所用术语的选择,旨在最好地解释各实施例的原理、实际应用或对市场中的技术的技术改进,或者使本技术领域的其它普通技术人员能理解本文披露的各实施例。
- 还没有人留言评论。精彩留言会获得点赞!