一种研究蛋白质及药物-蛋白质复合体构象多态性的方法与流程
本发明属于生物物理领域,涉及一种研究蛋白质及药物-蛋白质复合体构象多态性的方法。
背景技术:
在药物设计和开发研究中,解析蛋白质与药物分子形成的复合物结构,有助于实现面向靶点的新型药物分子的结构优化与功能设计。目前常用的研究蛋白质-药物结构的研究手段包括x-射线单晶衍射、核磁共振波谱、冷冻电子显微镜。上述传统表征手段要求蛋白质-药物复合物必须通过苛刻的样品制备过程,在特定的环境下形成均一的构象,才能实现高分辨的空间结构解析。比如x-射线单晶结构解析,需要摸索出特定的蛋白质浓度、溶剂环境、培养温度等条件才能够获得蛋白质-药物分子的共组装单晶,且单晶中蛋白质、药物分子仅能以一种构象存在,才能实现该复合体的空间结构解析。类似地,核磁共振波谱技术与冷冻电镜技术要求蛋白质样品的单一构象形成周期性,需要对大量样品信号做统计平均化处理。如果蛋白质本身同时存在着多种折叠结构,或者像固有无序蛋白这类分子不存在明确的三维空间结构,则很难使用现有的表征手段用以研究蛋白质-药物分子的作用机制。所以,发展新技术新方法用以解析具有多重构象的蛋白质-药物分子的结构具有重要的研究意义。
技术实现要素:
为了弥补现有技术的不足,本发明的目的在于提供一种研究蛋白质及药物-蛋白质复合体构象多态性的单分子成像方法。
本发明的目的在于提供一种研究蛋白质及药物-蛋白质复合体构象多态性的装置,所述装置可以通过分析样品获得蛋白质及药物-蛋白质复合体构象。
为了实现上述目的,本发明采用如下技术方案:
本发明的第一方面提供了一种测定待测分子与蛋白/多肽结合构象的方法,包括步骤:
1)制备蛋白/多肽溶液;
2)加入待测分子,充分混合;
3)将混合液加到导电性基底表面;
4)使用扫描探针显微镜进行扫描获得stm图像;
5)统计分析待测分子在肽链上的结合结构、位点和数量,获得能量分布差。
进一步,5)中能量分布差的计算公式为:
其中,ei、ej分别为状态i、j的能量,pi、pj分别为状态i、j的分布概率,kb为玻尔兹曼常数,t为绝对温度。
进一步,1)中蛋白/多肽溶液与伴侣分子共混,制备混合液。
进一步,所述伴侣分子与肽链c-末端羧基形成氢键。
进一步,所述伴侣分子为4bpy。
进一步,步骤1)中的溶液或混合液进行超声处理。
进一步,3)中所述导电性基底包括石墨基底、金属基底、氧化物基底、半导体基底。其中,所述金属基底包括(但不限于)金、银、铜、铂基底;氧化物基底包括(但不限于)zno、cu2o、caco3;半导体基底包括(但不限于)cds、zns、gaas。
进一步,所述导电性基底为石墨基底。
进一步,所述石墨基底为高定向热解石墨基底(hopg)。hopg是一种新型高纯度碳材料,是热解石墨经高温高压处理后制得的一种新型石墨材料,其性能接近单晶石墨。它具有高密度(2.20g/cm)、高纯度(杂质含量(0.0002%)和热、电、磁、力学性能各向异性,其具有原子级平整的表面,而且在很多环境中很稳定,适于扫描隧道显微镜的研究。
进一步,3)还包括除去基底表面残留液,除去基底表面残留液的方式包括(但不限于)吹惰性气体、加热烘干、自然干燥。
进一步,除去基底表面残留液的方式为吹惰性气体。
进一步,惰性气体为氮气。
进一步,所述待测分子为药物、染料、抗体或药物前体。所述染料包括(但不限于)酞菁、卟啉类分子及其衍生物,硫黄素、刚果红、姜黄素及其衍生物;所述抗体包括(但不限于)淀粉质多肽分子抗体;药物包括(但不限于)吡啶、嘧啶、吡嗪、咪唑、吡咯等氮杂环类分子及其衍生物。
本发明的第二方面提供了一种测定待测分子与蛋白/多肽结合构象的设备,包括:
1)液体混合装置;
2)上样装置;
3)组装体形成装置;
4)显微扫描装置;
5)计算输出装置。
进一步,所述计算输出装置输出待测分子在肽链上的结合结构、位点和数量,获得能量分布差。
进一步,所述能量分布差通过公式进行计算,公式如下:
其中,ei、ej分别为状态i、j的能量,pi、pj分别为状态i、j的分布概率,kb为玻尔兹曼常数,t为绝对温度。
进一步,所述液体混合装置包括超声装置,所述超声装置对液体混合装置的液体进行超声混合。
进一步,组装体形成装置中包括导电性基底,上样装置将混合均匀的液体加到导电性基底表面。所述导电性基底包括(但不限于)石墨基底、金属基底、半导体基底;所述金属基底包括(但不限于)金、银、铜、铂基底;所述氧化物基底包括(但不限于)zno、cu2o、caco3;半导体基底包括(但不限于)cds、zns、gaas。
进一步,所述导电性基底为石墨基底。
进一步,所述石墨基底优选为高定向热解石墨基底(hopg)。hopg是一种新型高纯度碳材料,是热解石墨经高温高压处理后制得的一种新型石墨材料,其性能接近单晶石墨。它具有高密度(2.20g/cm)、高纯度(杂质含量(0.0002%)和热、电、磁、力学性能各向异性。
进一步,组装体形成装置中还包括干燥装置,所述干燥装置用于去除残留于导电性基底表面的液体。
进一步,显微扫描装置进行扫描,用于获得组装体的stm图像。
进一步,计算输出装置对显微扫描装置扫描的图像进行计算分析,输出待测分子在肽链上的结合结构、位点和数量,获得能量分布差,以及优势构象。
本发明的第二方面提供的设备,采用本发明第一方面所述的方法进行蛋白以及蛋白和药物的相互作用的结构或构象研究。
本发明的第三方面提供了本发明的第一方面所述的方法、本发明第二方面所述的设备在靶向蛋白药物开发中的应用。
在本发明中,术语“分子伴侣”和“伴侣分子”可以互换使用,指的是包括一种蛋白质、肽、核酸、碳水化合物等的任何分子,这些分子特定地与蛋白质的一个活性位点相互作用并且增强了一种稳定的分子构象的形成,具有优异的物理化学特性。
在本发明中,除了扫描探针显微镜之外,液/固界面成像模式也适用于本发明的方法。
本发明的优点及有益效果:
本发明首次公开了一种获得测定待测分子与蛋白/多肽结合结构或构象的方法,通过获得多肽(蛋白)的自组装结构或与伴侣分子的共组装结构的stm图像之后,加入染料、抗体、药物或药物前体等待测分子,得到待测分子在肽链上的结合结构、位点和数量,并在分子水平上研究多肽和待测分子的相互作用,测定待测分子在多肽上的优势构象。
本发明利用扫描隧道显微技术是在单分子水平上研究药物分子与蛋白质分子的相互作用,药物分子在蛋白分子上的作用位点和吸附能力,不受限于蛋白质-药物样品的结晶过程,可以观察复合物微小的结构改变。本发明对于解析靶标蛋白与药物相互作用的模式和结合本质具有重要的意义。
本发明可以用于在新药早期研究阶段中标靶的确定,不同序列蛋白对于药物分子的相互作用等的测试。利用分子水平的证据来寻找可能的药物靶点,从而对寻找和设计有效的调节剂分子、药物分子等提供指导。
附图说明
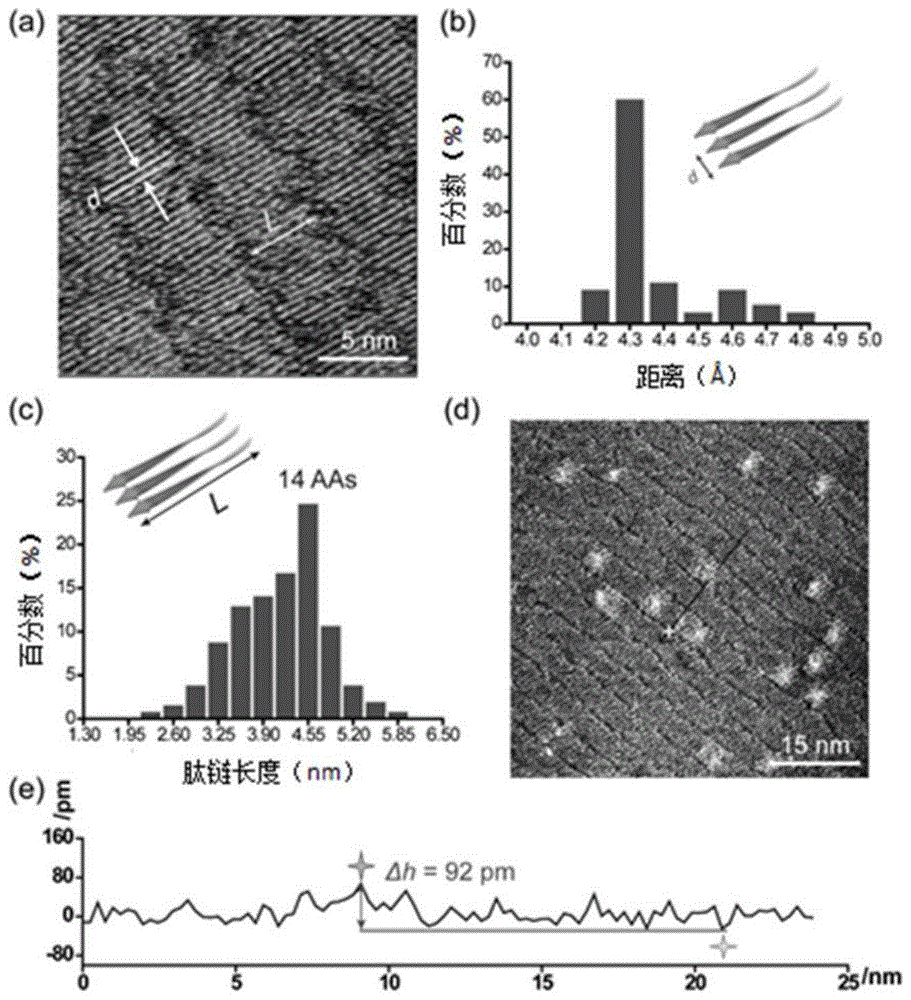
图1是tht在hiapp8-37组装体上的吸附情况图,其中,图a是hiapp8-37的自组装体的stm图;图b是两个相邻肽链之间的距离分布统计图;图c是hiapp8-37的自组装体肽链的长度分布统计图;图d是tht与hiapp8-37的共组装体的stm图;图e是对应于图d中的黑线的横截面轮廓图。
图2是tht在hiapp8-37/4bpy共组装体中的吸附情况图,其中,图a是hiapp8-37/4bpy共组装体的stm图;图b是hiapp8-37/4bpy共组装体的肽链长度分布统计图;图c是tht与hiapp8-37、4bpy共组装体的stm图;图d是对应于图c中的黑线的横截面轮廓图;图e是tht/hiapp8-37/4bpy共组装体的高分辨率stm图;图f是在stm尖端操作之前(左)和之后(右),tht低聚物的尺寸变化图,虚线圆圈突出显示了受针尖操作影响后的消失部分。
图3是tht结合靶点蛋白的结构图,其中图a是tht低聚物在hiapp8-37/4bpy共组装体中的不同结合状态图;图b是不同低聚物分布情况图;图c是不同低聚物类型中的tht数量分布情况图;图d是不同结合状态的低聚物的能量差异图。
具体的实施方式
下面结合具体的实施例进一步说明本发明,本发明的实施例仅用于解释本发明,并不意味着限制本发明的保护范围。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
1、材料与试剂
靶点蛋白分子:固有无序蛋白hiapp8-37;伴侣分子:4,4’-联吡啶(4bpy);药物分子(待测分子):硫黄素-t(tht),结构如下所示:
其中,tht结构式的长为1.3nm,宽为0.4nm,4bpy的长度为0.75nm。
2、实验方法
1)先将靶点蛋白hiapp8-37和伴侣分子4bpy混合于水溶液中,超声1分钟,充分混合之后,取出10微升溶液,滴到新揭离的石墨表面,静置10分钟,使混合分子体系在石墨上形成组装体并沉积在表面上之后,再用高纯度氮气吹干。
2)利用商品化的多模式扫描探针显微镜(spm,nanoscopeiiia型,veeco公司,美国),实验条件为大气下恒流模式,对hiapp8-37单组分、hiapp8-37与药物分子tht双组分,hiapp8-37与伴侣分子4bpy双组分、,hiapp8-37/4bpy/tht三组分体系分别进行扫描,得到高分辨stm图像。
3)统计分析药物分子tht在hiapp8-37/4bpy/tht三组分共组装stm图像中每一种结合影像的长度、宽度,判断tht的结合结构;统计每一种结合模式的分布数量,计算药物分子不同构象之间的能量之差,确定最优结合构象,计算药物分子不同构象之间的能量之差的公式如下:
其中,ei、ej分别为状态i、j的能量,pi、pj分别为状态i、j的分布概率,kb为玻尔兹曼常数,t为绝对温度。
4、结果
靶点蛋白以及靶点蛋白与药物分子的不同组装体的stm图像如图1所示,靶点蛋白hiapp8-37的stm图像具有条陇型特征,条陇中每条亮线对应于hiapp8-37肽链(图1a),相邻的两条肽链间距为
靶点蛋白与伴侣分子、靶点蛋白与伴侣分子和药物三组分共组装体的stm图像如图2所示,伴侣分子4bpy与hiapp8-37的c-末端羧基形成氢键,稳定靶点蛋白(图2a),hiapp8-37的c-端结构域长度分布为3.8-5.0nm(图2b)。β-片层结构中同一条肽链上相邻的两个氨基酸残基距离为0.325nm,hiapp8-37的c-末端β-片层结构的主要折叠位点在gly24附近,hiapp8-37以asn22(0.4%),phe23(28.5%),和ala25(16.6%)作为c-末端结构域的关键折叠位点。多折叠位点的存在表明hiapp8-37具有多重折叠构象。在靶点蛋白与伴侣分子和药物分子的三元共组装体系中,伴侣分子4bpy增强了药物分子tht在靶点蛋白上的stm衬度,可以清楚地分辨每个tht分子的吸附结构(图2c,2e),与最低点处的高度差为186pm(图2d)。依据每个tht分子的尺寸,判断该药物分子以低聚物形式结合于靶点蛋白上。同时,在stm成像过程中,观测到药物低聚物的解离过程(图2f),由于stm针尖的扰动,使得tht低聚物的尺寸变小,图中的虚线标识出了变小的部分。
根据统计计算分析,tht结合靶点蛋白的结构如图3所示,其通过4种形式结合于靶点蛋白:二聚体头/尾构象、二聚体肩并肩构象、四聚体、六聚体(图3a)。分别按低聚物数目(图3b)、tht数目(图3c)统计不同构象的药物分子在靶点上的吸附分布,最终根据能量差计算公式,计算获得不同构象间的能量差异,发现四聚体为最优能量构象(图3d)。
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!