一种基于三七皂苷-水凝胶盖髓剂材料及其制备方法与流程
本发明属于牙髓封闭材料技术领域,尤其涉及一种基于三七皂苷-水凝胶盖髓剂材料及其制备方法。
背景技术:
牙髓是高度血管化和神经支配的结缔组织,为牙齿提供营养、保护和防御。牙髓也高度敏感,容易受到例如细菌等病原体的刺激,也容易受到细菌产品的伤害。在深龋和外伤的刺激下,牙髓可能产生不可逆的牙髓炎,导致牙髓坏死、根尖周炎和潜在的全身并发症,例如骨髓炎和菌血症。
为了保持牙髓组织的活力,临床上采用牙髓封闭材料来覆盖暴露在外或发生感染的牙髓。牙髓封闭材料应满足一系列基本要求,例如:凝固时间短、对牙齿基质具有粘合性、无致癌性和具有生物相容性。此外,理想的牙髓封闭材料还应该具有生物活性,以缓解牙髓的炎症并刺激修复性牙本质的形成,使牙髓与病原体完全隔离从而保持其生命力。长期以来,氢氧化钙一直被用作纸浆封盖材料,并曾在金标准疗法中使用,氢氧化钙也经常用作测试新材料的阳性对照。但是使用氢氧化钙会产生一系列临床问题,例如:高溶解度、较差的机械性能和隧道缺陷。作为替代方案,三氧化二矿骨料(mta)在临床上比氢氧化钙显示出更有利的结果,并且被认为是目前金标准治疗方案。但是,三氧化二矿骨料(mta)的使用也涉及一些问题,例如:变色,设置时间长和操作困难。因此,人们一直在努力开发新型的纸浆封盖材料。
在纸浆封盖材料的尝试中,可光交联的水凝胶显示出的性能令人鼓舞,如易处理和良好的生物相容性。与基于磷酸钙的材料相比,水凝胶的一个主要优点是水凝胶可以充当各种生物活性剂的受控药物输送系统,从而赋予水凝胶多种有效功能。甲基丙烯酸明胶(gel-ma)是胶原的水解形式,具有与胶原相同的化学组成;胶原是牙髓细胞外基质中的主要成分,因此水凝胶具有良好的生物相容性但却不会像胶原一样传播病原体。明胶包含许多粘附配体,例如精氨酸-甘氨酸-天冬氨酸序列,它们可促进细胞粘附和迁移。还可以通过gel-ma支持人牙髓干细胞和人脐带血管内皮细胞再生牙髓组织的能力证明了gel-ma的良好细胞相容性。gel-ma通过非共价键合机制,例如分子相互作用,对矿化组织具有良好的键合能力。氨基分解可以进一步增强粘合强度,而刺激性牙髓中的弱酸性环境可以促进氨基分解。gel-ma的流动性可以完全覆盖裸露的牙髓。在短时间的光交联时间之后,gel-ma可以从液体过渡到水凝胶,并达到50-60kpa的硬度,这有利于细胞外基质矿化和硬组织形成。为了满足纸浆包装材料的其他要求,可以通过相应的修改轻松地调节gel-ma的理化特性,例如填充无机纳米粒子以提高机械性能和不透射线。虽然如此,gel-ma仍缺乏缓解炎症和诱导牙本质生成的内在能力。可以通过携带生物活性剂来功能化gel-ma来解决此问题。
ngr1(线型人参皂苷r1),一种从三七提取的生物活性单体,已被广泛用于心血管疾病和骨质疏松症的临床治疗。众所周知,ngr1可通过减少雌激素受体依赖的akt/nrf2活化,通过减少nadph(甘油三磷酸脱氢酶)氧化酶和线粒体衍生的超氧化物来保护细胞免于炎症和凋亡。
技术实现要素:
本发明的目的是克服现有技术中的不足,提供一种基于三七皂苷-水凝胶盖髓剂材料及其制备方法。
这种基于三七皂苷-水凝胶盖髓剂材料,所述盖髓剂为甲基丙烯酸明胶和线型人参皂苷r1复合水凝胶(gel-ma/ngr1复合水凝胶)。
这种基于三七皂苷-水凝胶盖髓剂材料的制备方法,包括以下步骤:
步骤1、合成甲基丙烯酸明胶(gel-ma);
步骤1.1、将明胶在磷酸盐缓冲盐水(pbs)中溶解,形成5%~20%质量体积比(w/v)的明胶溶液;
步骤1.2、在搅拌条件下,以0.1~0.5ml·min-1的速率将甲基丙烯酸酐(ma)添加到步骤1.1制得的明胶溶液中,直到甲基丙烯酸酐(ma)的最终浓度达到设定值;
步骤1.3、用naoh调节步骤1.2所得反应混合物的ph值至7.4~8;调节ph值后的反应混合物继续反应3~6小时;使用截止透析袋在37~50℃下将样品在去离子水中透析,去除未反应的甲基丙烯酸酐(ma)和其他副产物;
步骤1.4、将透析后的样品冷冻干燥至少48h,并在室温下避光保存;
步骤2、制备负载线型人参皂苷r1(ngr1)的甲基丙烯酸明胶和线型人参皂苷r1复合水凝胶(gel-ma/ngr1复合水凝胶):
步骤2.1、将制备的甲基丙烯酸明胶(gel-ma)溶解在磷酸盐缓冲盐水(pbs)中获得10%、15%和20%质量体积比(w/v)的前驱体溶液;
步骤2.2、分别取一定量10%、15%和20%质量体积比(w/v)甲基丙烯酸明胶(gel-ma)的前驱体溶液和0.1wt%~0.5wt%的光引发剂涡旋混合30s~3min,然后将涡旋混合的产物完全暴露于紫外线中进行紫外辐照30s~5min;甲基丙烯酸明胶取用的量视应用而定,测流变时取50~100ul,体内实验取100ul,观察成胶的形貌时取200ul。
步骤2.3、在步骤2.2处理后得到的(w/v)甲基丙烯酸明胶(gel-ma)的前驱体溶液中添加线型人参皂苷r1(ngr1)的二甲亚砜溶液,分别制得对应的负载线型人参皂苷r1(ngr1)的复合水凝胶。
作为优选,步骤1.1中磷酸盐缓冲盐水的温度为50℃;步骤1.1和步骤2.1中磷酸盐缓冲盐水的浓度均为0.01m~0.1m,磷酸盐缓冲盐水的ph为7.2~7.4。
作为优选,步骤1.2中搅拌速率为800rpm。
作为优选,步骤1.2中甲基丙烯酸酐(ma)的最终浓度的设定值为1%体积比(v/v)。
作为优选,步骤1.3中naoh的浓度为5m;调节ph值后的反应混合物继续反应的温度为50℃;截止透析袋的截留分子量为3.5kda或10kda;样品在去离子水中透析的时长为5天。
作为优选,步骤1.4中透析后的样品在-80℃下冷冻。
作为优选,步骤2.2中光引发剂溶于75%的乙醇中,浓度为50mg/ml;光引发剂为i2959。
作为优选,步骤2.3中线型人参皂苷r1的二甲亚砜溶液浓度为1000mg/ml;线型人参皂苷r1(ngr1)的二甲亚砜溶液的添加量分为高载药量(hd)、低载药量(nd)和无载药量(nd)。
本发明的有益效果是:本发明提出一种可光交联的gel-ma/ngr1复合水凝胶,作为盖髓剂的替代材料;该复合水凝胶具有强大的抗炎能力和诱导修复性牙本质生成的能力。本发明还研究了可光交联的gel-ma/ngr1复合水凝胶的理化性质及其在诱导体外牙本质生成和体内修复性牙本质形成中的功效。
附图说明
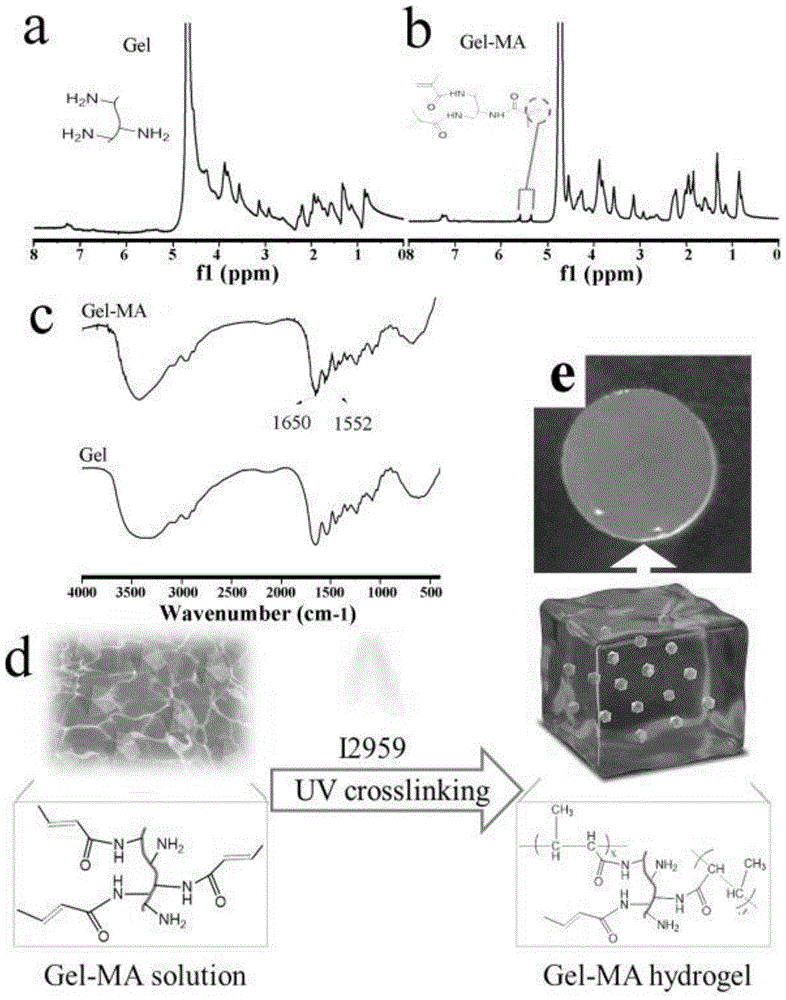
图1为甲基丙烯酸明胶(gel-ma)的制备及其化学结构分析流程图;
图2为线型人参皂苷r1(ngr1)体外矿化、gel-ma/ngr1的体外生物相容性及诱导矿化结果图;图2(a)和图2(b)为50和500μg/ml的ngr1促进细胞外基质矿化结果图;图2(c)、图2(d)和图2(e)分别为固含量为100mg/ml、150mg/ml和200mg/ml的水凝胶的细胞存活率结果图;图2(f)至图2(k)分别为固含量为100mg/ml、150mg/ml和200mg/ml水凝胶的mdpc6t成牙本质细胞样的细胞外基质矿化结果图;
图3(a)为nd、ld和hd水凝胶的频率扫描结果图;图3(b)为添加ngr1后的储能模量(g′)图;
图4(a)为通过cck-8测定gel-ma/ngr1的生物相容性结果图;图4(b)为观察水凝胶组中的红色荧光结果图;图4(c)为gel-ma组(nd、ld和hd)的alp基因表达情况结果图;图4(d)为dm组、nd组、ld组和hd组中alp基因的mrna表达水平结果图;图4(e)为dm组、nd组、ld组和hd组中mrna的表达水平结果图;图4(f)为dm组、nd组、ld组和hd组中ocn蛋白的表达水平结果图;
图5(a)为bc组、dc组、nd组、ld组和hd组的micro-ct结果图;图5(b)为bc组、dc组、nd组、ld组和hd组的钙化相对体积示意图;图5(c)为bc组、dc组、nd组、ld组和hd组的he和masson染色结果图;
图6(a)为dmp-1、ocn、dspp和runx2的免疫组织化学染色光学显微照片;图6(b)至图6(e)为dmp-1、ocn、dspp和runx2的免疫组织化学染色定量分析结果图。
具体实施方式
下面结合实施例对本发明做进一步描述。下述实施例的说明只是用于帮助理解本发明。应当指出,对于本技术领域的普通人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
ngr1可以显着促进骨钙素(ocn)(牙本质生成分化标记物)的表达和细胞外基质矿化。初步研究表明,ngr1还可以有效诱导成牙本质细胞样细胞和人类原牙髓干细胞的细胞外基质矿化(最终牙本质分化标记)。ngr1在盖髓治疗中具有广阔的应用前景。
一、制备的gel-ma/ngr1复合水凝胶的表征
用brukeravanceiiihd600光谱仪(bruker,德国)在600mhz下记录明胶和gel-ma的1h-nmr谱。在brukertensorii(bruker,德国)上以2cm-1的分辨率在400-4000cm-1的范围内记录了衰减全反射flourier变换红外光谱(atr-ftir)。使用扫描电子显微镜(novananosem200,fei,美国)观察水凝胶的扫描电子显微镜(sem)图像。将制得的水凝胶(φ8mm,制造sem样品时使用蒸馏水作为溶剂)冻干48小时,并在观察前用金喷镀60秒。使用axisultradldx射线光电子能谱(xps)(日本岛津市)和标准镁x射线源(1253.6ev)分析了ngr1负载的gel-ma水凝胶(nd,ld和hd)的表面化学元素。
二、gel-ma/ngr1复合水凝胶的体外生物相容性
通过将小鼠牙乳头细胞(mdpc6t)直接嵌入到水凝胶中来评估水凝胶的生物相容性。将水凝胶(gel-ma用环氧乙烷灭菌,并溶解在灭菌的pbs中)在96孔板中进行uv交联,然后以每孔1000个细胞的密度接种mdpc6t。在第1天、第4天和第7天,用pbs冲洗样品,然后加入10%cellcountingkit-8(cck-8,beyotimebiotechnology,上海,中国)溶液,避光于37℃孵育3小时。使用elisa酶标仪(varioskanlux,thermofisher,usa)测量od值。此外,采用live/dead分析(美国生命技术公司)评估水凝胶上细胞的活力。将mdpc6t以每孔1000个细胞的密度接种到预先形成的水凝胶上。在特定时间点,用live/dead试剂盒对细胞染色,该试剂盒会被代谢活性细胞裂解,产生绿色荧光,而死细胞产生红色荧光。用75%乙醇处理10分钟的样品用作阳性对照,并使用tcp中的正常培养基(90%dmem+10%fbs+1%青霉素-链霉素)作为阴性对照。将所有样品在live/dead染料溶液(0.5mlpbs中的0.25μl钙黄绿素-am染料和1.0μl乙二胺homodimer-1染料)中孵育30分钟。孵育后,将样品用pbs洗涤3次,并在dmi8显微镜(德国leica)上观察。所有实验均重复三次。
三、gel-ma/ngr1复合水凝胶的流变学研究
使用discoveryhr-2流变仪(tainstruments,usa)进行流变学测量,使用直径为8mm平板和1mm的间隙。进行振荡扫描实验以确定水凝胶的机械性能。记录了g'和g"作为37℃频率的函数。频率扫描实验在0.4%的固定应变下进行,角频率从0.01到100rads-1。
四、体外矿化诱导
将前驱体在48孔板中进行uv交联,接种3×104mdpc6t到水凝胶上。17天后评估牙本质生成标记,例如碱性磷酸酶(早期牙本质生成分化标记)和骨钙素(ocn,晚期牙本质分化标记)的表达水平。将细胞固定在4%多聚甲醛中,然后与alp染色液反应20分钟。将alp阳性细胞染成蓝色,并在显微镜下观察。收集上清液,并使用ocnelisa试剂盒(南京建成)进行评估。细胞外基质矿化结节-最终的牙本质发生分化标志物,使用茜素红染色(ars)试剂盒(cyagen,中国广州)进行了染色。在孵育17天后,用pbs漂洗3次,用95%乙醇固定15分钟,用蒸馏水洗涤3次,最后在37℃下用茜素红染色溶液染色1小时。染色的样品用蒸馏水洗涤3次;每次洗涤持续一分钟。使用光学显微镜(日本尼康)拍摄顶面图片。拍摄钙化区域,然后使用image-proplus6.0软件进行量化。对于这些实验,使用不存在ngr1或gel-ma的牙本质诱导培养基(dm)作为对照。
五、pcr测定mrna水平
mdpc6t以3×104细胞/孔的密度接种在48孔板中。通过pcr(bio-radcfx96,bio-radlaboratories,inc.,美国)评估牙本质基因碱性磷酸酶(alp)和骨钙素(ocn)的mrna表达水平。使用trizol试剂(invitrogen,thermofisherscientific,inc.)从样品和对照组中提取rna。使用superscriptii试剂盒(invitrogen,molecularprobes,eugene,or),用1μg总rna和oligo-dt引物合成互补(c)dna。用gdnaeraser(takara,otsu,japan)消化dna。pcr用sybrpremixextaqtmii试剂盒(日本大津市takarabio,inc.)进行。整个反应系统为25μl,rt-qpcr使用40个循环进行,其中在95℃变性10分钟,在95℃退火15s,在60℃延伸1min。将每个基因的相对表达水平标准化至actin,并使用2-δδcq方法进行基因表达的相对定量。
六、gel-ma/ngr1复合水凝胶的体内研究
为了进一步验证体内诱导水凝胶的牙本质发生和生物相容性的能力,使用体重为200~300g的4周龄sprague-dawley大鼠创建牙本质修复动物模型。在当前的修改模型中,将植入位置扩展到牙髓腔的底部,以扩大接触面积,从而使后续评估变得更加容易。选择上颌第一和第二磨牙进行手术。每组设置6只动物。研究方案已由温州医科大学动物研究中心伦理委员会批准(wydw2017-0503)。在实验性手术前三十分钟用三氯乙醛水合物(10%,3ml/kg)(solarbio,北京,中国)给大鼠麻醉。
手术步骤如下:
1)在上颌第一磨牙和第二磨牙的中央窝上用1/4圆形碳化物钻针(直径为0.5毫米,美国sswhitebursinc.)钻孔,以形成碗形深度约1mm的空腔,然后用生理盐水冷却。
2)用牙科用铰刀(瑞士梅勒费尔登特普利市20#)获得咬合腔,并用钻孔除去原本牙本质。首先用2%的次氯酸钠(中国上海)对腔进行冲洗,然后用2%的氯己定(中国德州)进行冲洗,并用灭菌的棉球进行止血。同时制备100mg/mlgel-ma/ngr1水凝胶(nd,ld,hd)前驱体溶液。
3)用1ml注射器抽吸前驱体溶液,并用26号注射器针头将100μl注射到空腔中,并立即于紫外线(365nm,90mw/cm2)进一步交联3分钟。
以上步骤1)至步骤3)在黑暗中进行。dycal(dentsply,德国)用作对照。所有组的咬合腔均用玻璃离子水门汀(gc,fujiii,日本)密封。在移植后四个星期取回了样本。四周是评估盖髓剂材料诱导效果的最常用时间点之一。在这个时间点,新形成的修复性牙本质将很容易被检测到,因为牙髓形成治疗早在3天后就开始了牙本质的形成。因此本发明选择该时间点来说明与其他材料相比,gel-ma/ngr1的牙本质生成功效。在全麻下通过心内灌注4%多聚甲醛杀死大鼠,提取牙齿样品,固定在4%多聚甲醛中进行进一步分析。为了充分固定组织,去除修复材料以确保固定溶液完全渗入牙髓。
术后表征:
micro-ct:手术后第28天,用x射线计算机断层扫描(micro-ct)装置(skyscan1176;bruker,德国)进行离体扫描。micro-ct参数如下:20×10mm视场,9μm体素尺寸,al1mm,65kv,381μa,46分钟暴露时间。所有数据集均使用nrecon软件(版本1.6.10.4)进行了3维重构,并以bmp格式导出。使用vgstudiomax(1.2.1版)软件从周围的组织(牙齿结构)中提取新形成的硬组织(牙本质桥),其中使用魔术棒自动跟踪牙髓腔中不规则矿化的边缘,然后由两名经验丰富的医生进行进一步的边缘矫正。上面的计算重复了三遍。使用ctanalyzer软件(版本1.15.4)分析定量的形态特征和硬组织的密度。这些测量重复五次。
免疫组化:经过微ct扫描后,样品在10%的乙二胺四乙酸(edta)中脱钙,每周更换两次,持续3周,然后在一系列梯度浓度的乙醇中脱水,浓度从70%降至100%。随后进行石蜡包埋,使长轴平行于基本平面。切下4mm厚的纵向连续切片并将其安装在涂有聚赖氨酸的显微镜载玻片上,然后进行苏木伊红染色(he),masson染色和免疫组化(ihc)染色。dentin唾液磷酸蛋白(dspp),1:200稀释度,sc-73632;牙本质基质蛋白1(dmp-1),1:200稀释度,sc-73633;骨钙蛋白(ocn),1:200稀释度,sc-390877和runt相关转录因子2(runx2),1:200稀释度,sc-101145,santacrutbiotechnology。根据厂商提供的实验方案进行染色。最后,使用olympusdp71显微镜(日本olympusco.)在显微镜下进行检查。ihc染色的平均选项密度通过imagej软件(版本1.51j8)进行计算。
七、结果
1、gel-ma水凝胶的制备及其化学结构分析
如图1(a)和图1(b)所示,h-nmr谱图中5.34ppm和5.60ppm处的两个新峰代表了丙烯酸双键,证明了gel-ma的成功合成,通过进一步计算,得到其甲基丙烯酸化接枝率为25.10%。如图1(c)所示,在ftir光谱中,在1650cm-1和1552cm-1处的尖锐吸收峰分别对应于c=o和cnh的拉伸振动,这表明在gel-ma中存在双键。此外,在gel-ma红外光谱中,在3400cm-1附近的羟基的吸收峰变得尖锐,这表示由于与丙烯酸甲酯的反应中明胶中氨基的消耗,氢键减少。成胶过程如图1(d)所示。如图1(e)所示,在成胶过程中没有发生明显的收缩。
2、ngr1诱导mdpc6t矿化
如图2(a)和图2(b)所示,与对照组相比,50和500μg/ml的ngr1均可促进细胞外基质矿化(分别为3.6和2.8倍)相关。
3、如图2(c)和2(d)所示,固含量为100mg/ml,150mg/ml和200mg/ml的水凝胶的细胞活力均高于80%。此后进一步检查了掺入不同量ngr1的gel-ma的体外生物相容性(如下表s1所示)。ld和hd组的细胞存活率也均高于80%(图2c,d和e)。
表s1掺入不同量ngr1的gel-ma的体外生物相容性表
4、筛选ngr1和gel-ma的最佳组合
为了筛选ngr1(nd,ld和hd)和gel-ma(固体含量分别为100、150和200mg/ml)诱导体外牙本质生成的最佳组合,定性(图2(f)至图2(h))和定量(图2(i)-图2(k))评估了mdpc6t成牙本质细胞样的细胞外基质矿化。结果表明,如果没有ngr1,不同固含量的gel-ma对矿化诱导结果没有显著影响(图2(i)-图2(k))。对于固含量为100mg/ml的gel-ma,与nd相比,ngr1(ld和hd两者)的存在可以显着促进mdpc6t细胞的细胞外基质矿化图2(i)。相反,对于固含量为150和200mg/ml的gel-ma水凝胶,ngr1无法做到(图2(j)-图2(k),p>0.05)。因此在实验中选择了100mg/mlgel-ma加载ngr1(ld,hd)。
5、流变性能
进一步探讨了ngr1对gel-ma的理化性质的潜在影响。图3(a)显示了nd,ld和hd水凝胶的频率扫描。ngr1的添加将储能模量(g')显着提高了一个数量级,从nd的811±21pa到ld的52±2kpa和hd的56±2kpa(图3(b))。
6、体外促牙本质形成
通过cck-8测定gel-ma/ngr1的生物相容性(图4(a))。所有组的od值随培养时间的增加而显着增加(p<0.01),从0.14±0.00增加到0.53±0.02。此外,live/dead分析表明,与对照组相比,在48小时培养后,mdpc6t附着在水凝胶上或水凝胶中的形态广泛,并且细胞密度在培养5天后明显增加。在水凝胶组中仅观察到非常少的红色荧光,这表明在nd,ld或hd上没有明显的死细胞(图4(b))。
无论ngr1剂量如何,所有gel-ma组(nd,ld和hd)的alp基因表达均显着高于dm组(图4(c))。ld显示alp的mrna表达水平与nd组相似,而hd与alp的mrna表达水平显着低于ld和nd组。在alp染色中也发现了类似的模式(图4(d))。ld和hd组中ocn的mrna表达水平比dm高3.3±0.3倍和2.5±1.2倍(图4(e))。同样地,ld组的ocn蛋白表达水平与hd组相似,显着高于nd和dm组(图4(f))。
7、体内促修复性牙本质再生
micro-ct:结果如图5(a)所示,空白对照组(bc,没有任何盖髓剂材料)几乎没有发现新形成的矿化区域。相反,在其他组中,例如在注射组中,在注射材料的位置周围检测到钙化阴影(图5(a)中的白色箭头)。nd组的钙化相对体积是bc组的25±6倍(图5(b))。如图5(b)所示,ld组(155±7倍)和hd组(175±22倍)的钙化相对体积显着高于dc组(896±8倍)。其中dc组是dycal对照组;dc组的其它实验条件与ld组、hd组和nd组相同;区别在于植入的材料不一样:体内用的是10%gelma的hd,ld,nd三个剂型。bc(blankcontrol)组只造缺损,不填入任何材料。
8、免疫组化
图5(c)显示了he和masson染色的结果。masson染色显示ld和hd组的致密凝胶网络结构要少得多,这可能是由于植入的水凝胶的生物降解所致。在三个不含ngr1的组(bc,dc和nd)中,种植牙周围的牙髓组织的边界向侧面移动,这可能是由于牙髓组织坏死引起的。相反,在ld和hd组中未检测到这种现象。在植入的水凝胶附近的牙髓组织中检测到亮蓝色染色(图5(c)中的浅色箭头),这表明形成了矿化的组织。与bc组和nd组相比,dc,ld和hd组的he染色显示更多新形成的修复性牙本质样组织(图5(c)中的深色箭头)。dmp-1,ocn,dspp和runx2的免疫组织化学染色及定量分析如图6所示。光学显微照片显示,在dc组中植入部位周围的牙髓组织中发现了更大的区域,染色更深,ld和hd高于bc和nd。如图6所示,ld和hd中四种标记物的平均选择密度均高于dc组,而bc和nd组中表达的蛋白质很少。ld组的平均光密度值最高。
- 还没有人留言评论。精彩留言会获得点赞!