一种利用废弃玻璃水热合成介孔材料的方法及其应用与流程
本发明涉及一种吸附材料,尤其是涉及一种利用废弃玻璃水热合成介孔材料的方法及其应用。
背景技术:
随着我国经济的快速发展和城镇化进程的加速,玻璃作为一种重要的材料被广泛应用在各行各业,也使得废弃玻璃的数量大量增加。我国每年城市废弃的玻璃总量约为450~750万t,占城市生活垃圾总量的3~5%,因此处理如此庞大数量的废玻璃逐渐成为一个重要的经济和社会问题。
在我国,废玻璃回收手段通常是将处理加工后的碎玻璃作为原料直接掺入配合料中用来熔化玻璃。但这种处理方式带来的不良后果,一是彩色玻璃的成分差异较大,它们在用于回炉再生制造玻璃产品时对玻璃的纯度和颜色等会有一定影响,限制了其应用。二是这种回收方式制成的产品经济价值较低,回收成本远远高于产品本身价值,导致回收处理经营往往处于亏损状态。此外,有学者利用废玻璃在950~1050℃下烧结,制备成了抗折强度与物理化学稳定性性能较好的建筑面砖;也有一些将废玻璃和粉煤灰制备呈高强复合陶粒以及钙铝硅微晶玻璃的研究。但这些研究都是使用烧结法对废玻璃进行处理,温度均在1000℃左右,能耗较高,不符合节能环保的理念。
因此,为废弃玻璃的回收及应用提供一条新途径或新思路具有显著的现实意义。
技术实现要素:
本发明是为了解决现有技术的废弃玻璃回收利用能耗高的问题,提供了一种工艺步骤简单,易于实现,能耗低的利用废弃玻璃水热合成介孔材料的方法,制得的介孔材料可用于污水处理或是重金属的吸附,为废弃玻璃的回收及应用提供了一条新途径。
为了实现上述目的,本发明采用以下技术方案:
本发明的一种利用废弃玻璃水热合成介孔材料的方法,具体步骤为:
(1)将废弃玻璃经机械破碎、研磨后过筛,烘干,待用;
(2)在研磨后的废弃玻璃中加入废弃玻璃质量30~40%的Ca(OH)2,混合均匀后于200~220℃下水热处理12~14h,过滤,干燥后即得介孔材料。通过对反应条件的严格控制,以生成雪硅钙石并提高材料的多孔性,为使反应样品中Ca/Si接近雪硅钙石中的Ca/Si的值,本发明中限定Ca(OH)2的加入量为废弃玻璃质量30~40%。
作为优选,所述废弃玻璃为Na-Ca-Si系玻璃。
作为优选,所述废弃玻璃由以下质量百分含量的组分组成:70~71%SiO2,13~14%Na2O,6~7%CaO,3~4%Al2O3,1~2%K2O,余量为不可避免的杂质。废弃玻璃的组成非常重要,以保证生成材料的种类和材料的多孔性。
作为优选,步骤(1)中,研磨后过筛控制废弃玻璃粒径≤65μm。
作为优选,步骤(2)中,干燥温度为80~100℃,干燥时间≥24h。
一种利用废弃玻璃水热合成介孔材料的方法制得的介孔材料在处理污水或吸附重金属时的应用。
因此,本发明具有如下有益效果:
(1)本发明利用废弃玻璃通过水热合成介孔材料,工艺步骤简单,易于实现,能耗低,具有重大的环保意义;
(2)制得的介孔材料可用于污水处理或是重金属的吸附,为废弃玻璃的回收及应用提供了一条新途径。
附图说明
图1是本发明制得的介孔材料的XRD图谱。
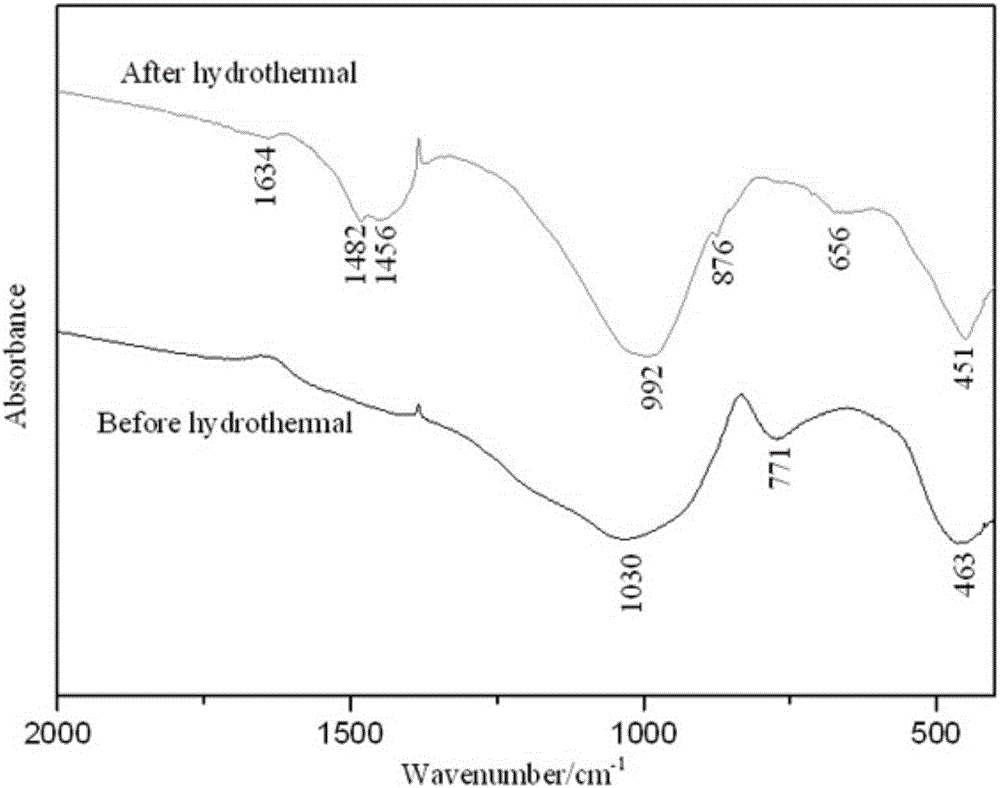
图2是本发明制得的介孔材料的红外图谱。
图3是本发明制得的介孔材料的SEM图。
图4是本发明制得的介孔材料的EDS能谱。
图5是废弃玻璃及本发明制得的介孔材料BJH孔径分布图。
图6是本发明制得的介孔材料进行镍离子吸附实验时吸附时间对吸附量的影响。
具体实施方式
下面结合附图和具体实施方式对本发明做进一步的描述。
实施例1
(1)将废弃玻璃(Na-Ca-Si系玻璃)经机械破碎、研磨后过筛控制废弃玻璃粒径≤65μm,烘干,待用,废弃玻璃由以下质量百分含量的组分组成:70%SiO2,14%Na2O,7%CaO,4%Al2O3,2%K2O,余量为不可避免的杂质;
(2)在研磨后的废弃玻璃中加入废弃玻璃质量30%的Ca(OH)2,混合均匀后于200℃下水热处理14h,过滤,以80℃温度干燥≥24h后即得介孔材料。
实施例2
(1)将废弃玻璃(Na-Ca-Si系玻璃)经机械破碎、研磨后过筛控制废弃玻璃粒径≤65μm,烘干,待用,废弃玻璃由以下质量百分含量的组分组成:71%SiO2,13%Na2O,6%CaO,3%Al2O3,1%K2O,余量为不可避免的杂质;
(2)在研磨后的废弃玻璃中加入废弃玻璃质量40%的Ca(OH)2,混合均匀后于220℃下水热处理12h,过滤,以100℃温度干燥≥24h后即得介孔材料。
实施例3
(1)将废弃玻璃(Na-Ca-Si系玻璃)经机械破碎、研磨后过筛控制废弃玻璃粒径≤65μm,烘干,待用,废弃玻璃由以下质量百分含量的组分组成:70.5%SiO2,13.5%Na2O,6.8%CaO,3.6%Al2O3,1.2%K2O,余量为不可避免的杂质;
(2)在研磨后的废弃玻璃中加入废弃玻璃质量30~40%的Ca(OH)2,混合均匀后于210℃下水热处理13h,过滤,以90℃温度干燥≥24h后即得介孔材料。
通过本发明制得的介孔材料的XRD图谱如图1所示。
从图1可以看出,反应前为一个明显的非晶态馒头峰,而加入了Ca(OH)2水热处理后,XRD图谱中出现了雪硅钙石,方沸石和方解石相。雪硅钙石的化学式为Ca5Si6O18H2·4H2O,在200℃水热条件下,玻璃中的SiO2的溶解度大大提高,水分子在水热条件下更加活跃,水通过扩散至SiO2表面,破坏玻璃的网格结构,添加的Ca(OH)2使得介质溶液呈一定的碱性,并提高了SiO2的溶解度,随着硅氧键的破坏,并与Ca离子结合,逐步生成了雪硅钙石晶体。
通过本发明制得的介孔材料的红外图谱如图2所示。
从图2可以看出,废弃玻璃的红外吸收谱带由三部分组成:第一部分在900-1200cm-1波数范围内,最强吸收峰位于1030cm-1,为Si-O-Si的伸缩振动吸收峰[10];第二部分在400-500cm-1波数范围内,为O-Si-O的弯曲振动吸收带;第三部分是从820cm-1开始,到640cm-1结束,以771cm-1为最强吸收峰,此吸收峰为Al3+以四配位体作为玻璃网络形成体进入玻璃网络结构时的Si-O-Al的伸缩振动。水热处理后,样品在1030cm-1的Si-O-Si的伸缩振动吸收峰和463cm-1处的O-Si-O的弯曲振动吸收峰都明显变尖变窄,说明离子排列的无序度减小,有晶相物质生成,结合XRD图谱,对应的晶相应该的是雪硅钙石。771cm-1处吸收峰消失是由于玻璃中【AlO4】四面体参与了反应,新出现的876cm-1和1456cm-1吸收峰对应的是方解石中CO32-的振动峰,1634cm-1处吸收峰对应的是新生成的晶体中结晶水的弯曲振动峰。
通过本发明制得的介孔材料的SEM图和EDS能谱分别如图3、图4所示。
从图3中可以看出,样品中出现了大量针状的晶体,这些晶体的元素组成主要是Ca和Si,而Na的含量很少,结合XRD分析可知这些晶体为针状的雪硅钙石,说明经水热反应后样品中生成的晶体主要为雪硅钙石,由EDS计算出的Ca/Si大约在0.6,接近雪硅钙石中的钙硅比。
废弃玻璃及本发明制得的介孔材料BJH孔径分布图如图5所示。
从图4可以看出,针状雪硅钙石的生成大大提高了样品的比表面积,由氮吸附法测得废弃玻璃粉末的比表面积仅为0.312m2/g,而水热反应后达到了12.707m2/g,从图4的BJH孔径分布图也可看出未经过水热处理的废玻璃的孔径在介孔范围内几乎没有分布,而经过水热反应后样品在介孔范围内的孔隙大量增加,其中孔径分布主要集中在3-15nm之间,比表面积和孔隙率的增加有利于吸附性能的提高。
用本发明制得的介孔材料进行镍离子吸附实验,具体步骤为:
Ni2+标准溶液的配制:用可见分光光度计在394nm处测定不同浓度样品吸光度值,并绘制Ni2+的标准曲线。
吸附实验中取50mL一定浓度的Ni2+溶液置于150mL锥形瓶中,加入0.5g合成的样品,在25℃下以120r/min的速度振荡一定时间后静置,取上层清液测定溶液中残余的Ni2+的浓度,按吸附容量式计算样品对Ni2+的吸附量:
式中,Q(t)为每克样品吸附Ni2+离子的质量(mg/g),C0为吸附前溶液中Ni2+浓度,C1为吸附平衡后溶液中Ni2+浓度(mol/L),V为溶液体积(L),m为样品的质量(g)。
得到的结果如图6所示,其中Ni2+的初始浓度为80mmol/L,吸附时间分别为5、10、30、60、180、360、720、1 440min,随着时间延长,样品对Ni2+的吸附量逐渐增大。在起初的360min内吸附量增长很快,之后趋于平缓,720min后吸附量达到了平衡,为278.53mg/g。
由上述结果可知,本发明运用水热技术,通过添加Ca(OH)2将废弃玻璃合成为介孔吸附材料,合成的介孔吸附材料主晶相为雪硅钙石,SEM下可见大量针状雪硅钙石结晶,比表面积为12.707m2/g,吸附机理为单分子化学吸附,可用于污水处理或是重金属的吸附,为废弃玻璃的回收及应用提供一条新途径或新思路,具有重大的环保意义。
以上所述的实施例只是本发明的一种较佳的方案,并非对本发明作任何形式上的限制,在不超出权利要求所记载的技术方案的前提下还有其它的变体及改型。
- 还没有人留言评论。精彩留言会获得点赞!