干细胞小球诱导培养液及干细胞小球培养方法与流程
本发明涉及细胞培养液,具体是一种在体外环境下培养细胞(包括肿瘤细胞系、永生化细胞系和正常细胞系等),可诱导细胞连续不断产生大量干细胞小球(spheroids)的干细胞小球诱导培养液。
背景技术:
干细胞—尤其是肿瘤干细胞的研究已成为全球肿瘤研究的热点。目前,干细胞的分选基本上均利用流式细胞仪结合干细胞相关表面标志物来进行的,但干细胞在体外培养环境下极容易分化。在体外培养环境下,干细胞比较明确的特点是表达干细胞标志物,并能形成干细胞小球。干细胞小球是由一个异质化的细胞群组成:包括原始干细胞、祖细胞及部分已经分化的细胞。干细胞小球是具有干细胞特性的细胞在体外培养时展现的一种表型。迄今为止,尚未见文献报道使用培养液在体外培养环境下诱导细胞产生干细胞小球。缺氧与干细胞的关系非常密切。缺氧微环境可促进细胞表达干细胞表型,维持干细胞于一定数目并抑制干细胞的分化。
技术实现要素:
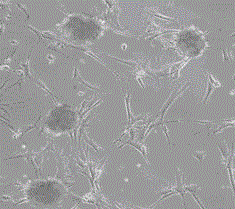
本发明就是为了解决使用培养液在体外培养环境下,诱导细胞产生干细胞小球的题,而提供一种干细胞小球诱导培养液及干细胞小球培养方法。本发明是按照以下技术方案实现的。一种干细胞小球诱导培养液,所述诱导培养液是将氯化钴(Cobaltchloride,CoCl2)142.758-285.516mg,紫杉醇2.135-4.27μg,胎牛血清100-200ml,双抗生素10ml,室温下混合于EMEM培养基中至1000ml,经0.2μ的过滤器过滤、灭菌制成。所述干细胞小球诱导培养液,所述诱导培养液是将氯化钴氯化钴214.137mg,紫杉醇2.989μg,胎牛血清100ml,双抗生素10ml,室温下混合于EMEM培养基中至1000ml,经0.2μ的过滤器过滤、灭菌制成。一种干细胞小球培养方法,其是按以下步骤进行的:a.体外原培养液培养的细胞生长至融合度达到90%,改用混合培养液培养,并在二氧化碳培养箱中第一次缺氧培养12-96小时,直至90%的细胞发生死亡;所述混合培养液是按原培养液:干细胞小球诱导培养液为2:1的混合而成;b.待贴壁的培养细胞约只剩下10%时,去除含有死亡细胞的培养液,贴壁细胞经1×PBS洗涤2次,加入原培养液继续培养3-10天,使剩下的贴壁细胞重新增殖,待增殖的细胞密度达到90%后,重新更换混合培养液,并进行第二次缺氧培养,贴壁细胞洗涤后,原培养液中再次增殖,细胞密度达到90%,收集悬浮的干细胞小球。所述干细胞小球培养方法,其第二次缺氧培养后,贴壁细胞洗涤,原培养液中再次增殖,待细胞密度达到90%后,移去培养瓶中的原培养液,经磷酸盐缓冲溶液洗涤后,用0.5%-2.5%胰酶消化细胞,然后再加入不含血清的原培养液继续培养细胞12小时,在培养瓶中收集悬浮的干细胞小球。这样设计的本发明,在体外环境下诱导细胞连续不断产生大量干细胞小球,这些干细胞小球能表达明确的干细胞标志物:CD44,CD133,OCT3/4,Nanog,SOX-2和ABCG2等正常或者肿瘤干细胞标志物。附图说明图1是永生化细胞系NOF151hT细胞干细胞小球结构图;图2是永生化细胞系NOF151p53ihT干细胞小球结构图;图3是成纤维细胞系WI-38干细胞小球结构图;图4是成纤维细胞系BJ干细胞小球结构图;图5是乳腺癌细胞系MDA-MB-231细胞干细胞小球结构图;图6是乳腺癌细胞系BT-549细胞干细胞小球结构图;图7是卵巢癌细胞系HEY细胞干细胞小球结构图;图8是悬浮生长的卵巢癌细胞系HEY干细胞小球结构图;图9是卵巢癌细胞SKOv3细胞干细胞小球结构图;图10是人造肿瘤细胞细胞系FTE187SV40hTHras细胞干细胞小球结构图;图11是NOF151hT细胞干细胞小球染色图;图12是NOF151p53ihT细胞干细胞小球染色图;图13是BT-549干细胞小球干细胞CD44免疫组化染色图;图14是BT-549干细胞小球干细胞CD133免疫组化染色图;图15是BT-549干细胞小球干细胞SOX-2免疫组化染色图;图16是MDA-MB-231干细胞小球OCT3/4免疫荧光染色阳性图;图17是MDA-MB-231干细胞小球Nanog免疫荧光染色阳性图;图18是MDA-MB-231干细胞小球SOX-2免疫荧光染色阳性图;图19是MDA-MB-231干细胞小球ABCG2免疫荧光染色阳性图;图20是SKOv3干细胞小球OCT3/4免疫荧光染色阳性图;图21是SKOv3干细胞小球Nanog免疫荧光染色阳性图;图22是SKOv3干细胞小球SOX-2免疫荧光染色阳性图;图23是SKOv3干细胞小球ABCG2免疫荧光染色阳性图;图24是HEY干细胞小球干细胞CD44免疫组化染色图;图25是HEY干细胞小球干细胞CD133免疫组化染色图;图26是HEY干细胞小球干细胞OCT3/4免疫荧光染图色;图27是HEY干细胞小球干细胞Nanog免疫荧光染图色;图28是HEY干细胞小球干细胞.SOX-2免疫荧光染色图;图29是HEY干细胞小球干细胞ABCG2免疫荧光染色图。具体实施方式下面结合附图及实施例对本发明进行详细的说明。一.一种干细胞小球诱导培养液,其是按以下配比的原料制成的,将氯化钴(Cobaltchloride,CoCl2)142.758-285.516mg,紫杉醇2.135-4.27μg,胎牛血清100-200ml,双抗生素10ml,室温下混合于EMEM培养基中至1000ml,经0.2μ的过滤器过滤、灭菌制成。所述干细胞小球诱导培养液,其是按以下配比的原料制成的,将氯化钴氯化钴214.137mg,紫杉醇2.989μg,胎牛血清100ml,双抗生素10ml,室温下混合于EMEM培养基中至1000ml,经0.2μ的过滤器过滤、灭菌制成。二.干细胞小球的培养方法1.乳腺癌细胞系MDA-MB-231细胞干细胞小球或BT-549细胞干细胞小球的培养:体外正常培养环境下DMEM培养液培养MDA-MB-231细胞,或BT-549细胞干细胞小球,待细胞生长至融合度达到90%;更换混合培养液,混合培养液是按照DMEM培养液:诱导培养液为2:1的比例配制,即DMEM培养液3.34ml,诱导培养液1.67ml;在二氧化碳培养箱中培养12-96小时,直至90%左右的细胞发生死亡。每隔6-12小时显微镜下观察一次,待MDA-MB-231细胞培养的细胞出现明显的形态改变时,利用移液管小心去除混合培养液,使用磷酸盐缓冲溶液(1×PBS)洗涤2次,然后加入适量的DMEM培养液继续培养,随后的1-2天内将出现大量死亡而漂浮在培养液中;大约3-10天,剩下贴壁细胞重新增殖,待增殖的细胞密度达到90%后重新更换成混合培养液,按照上述方法重复处理一次。待第二次处理后的细胞密度达到90%后,此时MDA-MB-231细胞中即可见到数量不等的干细胞小球。如果培养瓶中未见干细胞小球,按照上述方法重复处理1-2次。如果难以见到明确的干细胞小球,则在第二次处理细胞后待细胞密度达到90%后,移去培养瓶中的混合培养液,1×PBS洗涤后使用2.5%胰酶1ml消化细胞,然后,再加入不含血清的DMEM培养液继续培养细胞,12小时后可在培养瓶中见到大量悬浮的乳腺癌细胞系MDA-MB-231细胞干细胞小球,或BT-549细胞干细胞小球。如图5、6、13-19所示。2.卵巢癌细胞系HEY细胞干细胞小球、SKOv3细胞干细胞小球或人造肿瘤细胞细胞系FTE187SV40hTHras细胞干细胞小球的培养:体外正常培养环境下RPMI-16培养液培养HEY细胞,或SKOv3细胞,或FTE187SV40hTHras细胞,待细胞生长至融合度达到90%;更换混合培养液,混合培养液是按照RPMI-16培养液:诱导培养液为2:1的比例配制,即RPMI-16培养液3.34ml,诱导培养液1.67ml;在二氧化碳培养箱中培养12-96小时,直至90%左右的细胞发生死亡。每隔6-12小时显微镜下观察一次,待培养的HEY细胞,或SKOv3细胞出现明显的形态改变时,利用移液管小心去除混合培养液,使用磷酸盐缓冲溶液(1×PBS)洗涤2次,然后加入适量的RPMI-16培养液继续培养,随后的1-2天内将出现大量死亡而漂浮在培养液中;大约3-10天,剩下贴壁细胞重新增殖,待增殖的细胞密度达到90%后重新更换成混合培养液,按照上述方法重复处理一次。待第二次处理后的细胞密度达到90%后,此时HEY细胞中即可见到数量不等的干细胞小球。如果培养瓶中未见干细胞小球,按照上述方法重复处理1-2次。如果难以见到明确的干细胞小球,则在第二次处理细胞后待细胞密度达到90%后,移去培养瓶中的混合培养液,1×PBS洗涤后使用2%胰酶2ml消化细胞,然后,再加入不含血清的RPMI-16培养液继续培养细胞,12小时后可在培养瓶中见到大量悬浮的卵巢癌细胞系HEY细胞干细胞小球,或SKOv3细胞干细胞小球,或FTE187SV40hTHras细胞干细胞小球。如图7-10,20-29所示。3.永生化细胞系NOF151hT细胞干细胞小球和NOF151p53ihT细胞干细胞小球的培养:体外正常培养环境下Media199/MCDB205培养液培养的MDA-MB-231细胞,待细胞生长至融合度达到90%;更换混合培养液,混合培养液按照Media199/MCDB205培养液:诱导培养液为2:1的比例配制,即Media199/MCDB205培养液3.34ml,诱导培养液1.67ml;在二氧化碳培养箱中培养12-96小时,直至90%左右的细胞发生死亡。培养时间长短取决于不同细胞系的耐受程度程度。培养的时间长短需要预实验判定,此外,通过增加诱导培养液的浓度可适当缩短培养时间。每隔6-12小时显微镜下观察一次,待培养的细胞出现明显的形态改变时,利用移液管小心去除混合培养液,使用1×PBS洗涤2次,然后加入适量的Media199/MCDB205培养液继续培养,随后的1-2天内某些类型的细胞系将出现大量死亡而漂浮在培养液中;大约3-10天,剩下贴壁细胞重新增殖,待增殖的细胞密度达到90%后重新更换成混合培养液,按照上述方法重复处理一次。待第二次处理后的细胞密度达到90%后,此时可见到数量不等的NOF151hT细胞干细胞小球或NOF151p53ihT细胞干细胞小球。如果培养瓶中未见干细胞小球,按照上述方法重复处理1-2次。如果仍难以见到明确的干细胞小球,则在第二次处理细胞后待细胞密度达到90%后移去培养瓶中的混合培养基,1×PBS洗涤后使用2.5%胰酶1ml消化细胞,然后,再加入不含血清的Media199/MCDB205培养液继续培养细胞,12小时后可在培养瓶中见到大量悬浮的NOF151hT细胞干细胞小球,或NOF151p53ihT细胞干细胞小球。如图1、2、11、12所示。4.成纤维细胞系WI-38干细胞小球或BJ干细胞小球的培养:体外正常培养环境下DMEM/F12培养液培养的成纤维细胞系WI-38细胞,或成纤维细胞系BJ细胞,待细胞生长至融合度达到90%;更换混合培养液,混合培养液按照DMEM/F12培养液:诱导培养液为2:1的比例配制,即DMEM/F12培养液3.34ml,诱导培养液1.67ml;在二氧化碳培养箱中培养12-96小时,直至90%左右的细胞发生死亡。每隔6-12小时显微镜下观察一次,待培养的细胞出现明显的形态改变时,利用移液管小心去除混合培养液,使用1×PBS洗涤2次,然后加入适量的DMEM/F12培养液继续培养,随后的1-2天内某些类型的细胞系将出现大量死亡而漂浮在培养液中;大约3-10天,剩下贴壁细胞重新增殖,待增殖的细胞密度达到90%后重新更换成混合培养液,按照上述方法重复处理一次。待第二次处理后的细胞密度达到90%后,此时可见到数量不等的WI-38细胞干细胞小球,或BJ细胞干细胞小球。如果培养瓶中未见干细胞小球,按照上述方法重复处理1-2次。如果仍难以见到明确的干细胞小球,则在第二次处理细胞后待细胞密度达到90%后移去培养瓶中的混合培养基,1×PBS洗涤后使用2.5%胰酶1ml消化细胞,然后,再加入不含血清的DMEM/F12培养液继续培养细胞,12小时后可在培养瓶中见到大量悬浮的WI-38细胞干细胞小球,或BJ细胞干细胞小球。如图3、4所示。上述实施例中这些干细胞小球能表达明确的干细胞标志物:CD44,CD133,OCT3/4,Nanog,SOX-2和ABCG2等正常或者肿瘤干细胞标志物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1